Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo de quimiotaxis mejorado para la identificación rápida de quimioatrayentes rizobacterianos en exudados radiculares
En este artículo
Resumen
Aquí, presentamos un protocolo mejorado de ensayo de quimiotaxis. El objetivo de este protocolo es reducir los pasos y los costos de los métodos tradicionales de quimiotaxis bacteriana y servir como un recurso valioso para comprender las interacciones planta-microbio.
Resumen
La identificación de quimiotaxis es muy importante para la investigación y aplicación de bacterias promotoras del crecimiento de la rizosfera. Establecimos un método sencillo para identificar rápidamente los quimioatrayentes que podrían inducir el movimiento quimiotáctico de las bacterias promotoras del crecimiento de la rizosfera en portaobjetos de vidrio estériles a través de pasos simples. La solución bacteriana (OD600 = 0,5) y la solución acuosa quimioatrayente estéril se agregaron gota a gota en el portaobjetos de vidrio a un intervalo de 1 cm. Se utilizó un asa inoculante para conectar la solución acuosa quimioatrayente a la solución bacteriana. El tobogán se mantuvo a temperatura ambiente durante 20 minutos en el banco limpio. Finalmente, se recogió la solución acuosa quimioatrayente para el recuento bacteriano y la observación microscópica. En este estudio, a través de múltiples comparaciones de resultados experimentales, el método superó múltiples deficiencias de los métodos tradicionales de quimiotaxis bacteriana. El método redujo el error de conteo de placas y acortó el ciclo experimental. Para la identificación de sustancias quimioatrayentes, este nuevo método puede ahorrar 2-3 días en comparación con el método tradicional. Además, este método permite a cualquier investigador completar sistemáticamente un experimento de quimiotaxis bacteriana en 1-2 días. El protocolo puede considerarse un recurso valioso para comprender las interacciones planta-microbio.
Introducción
La quimiotaxis es importante para la colonización de las rizobacterias promotoras del crecimiento de las plantas (PGPR) en las raíces y para comprender las interacciones planta-microbio1. Una clase de compuestos de bajo peso molecular (quimioatrayentes) en los exudados de la raíz de las plantas inducen el movimiento quimiotáctico de PGPR a la rizosfera2. El ácido málico, el ácido cítrico y otros componentes de los exudados radiculares estimulan la quimiotaxis de las cepas de Bacillus3. Por ejemplo, la glucosa, el ácido cítrico y el ácido fumárico en los exudados de la raíz del maíz reclutan bacterias a la superficie de la raíz4. La D-galactosa, que se deriva de los exudados radiculares, induce la quimiotaxis de Bacillus velezensis SQR95. Los ácidos orgánicos, incluyendo fumarato, ácido málico y succinato, influyen en la quimiotaxis y la colonización de varios PGPR en el sistema de cultivo intercalado Cajanus cajan - Zea mays6. El ácido oleanólico en los exudados de la raíz de arroz, actúa como quimioatrayente para la cepa FP357. Otros exudados vegetales (incluyendo histidina, arginina y aspartato) pueden desempeñar un papel crucial en la respuesta quimiotáctica de las bacterias8. Los exudados de las plantas funcionan como una señal para dirigir el movimiento de las bacterias, que es el primer paso durante la colonización de la rizosfera. La colonización de plantas por PGPR es un proceso de enorme relevancia, ya que los PGPR son beneficiosos para el huésped de la planta.
Se han utilizado muchos métodos para analizar la quimiotaxis bacteriana. El método de la placa de natación es uno de los métodos descritos anteriormente9. En este método, las placas se hicieron con un medio semisólido. Se agregó un tampón quimiotáctico que contenía agar (1.0%, p/v) a la placa. El tampón se calienta y luego se mezcla con el quimioatrayente. Luego, se agregaron 8 μL de suspensión de bacterias gota a gota a la mitad de la placa y la placa se colocó en una incubadora a 28 ° C. La placa fue observada y fotografiada regularmente. Sin embargo, el ciclo experimental del método de la placa de natación fue muy largo. En el método capilar10, una punta de pipeta sirve como cámara para contener 100 μL de suspensión bacteriana. Se utilizó una aguja de jeringa de 1 ml como capilar. Se insertó una aguja de jeringa que contenía quimioatrayentes con diferentes gradientes de concentración en la punta de la pipeta de 100 μL. Después de la incubación a temperatura ambiente durante 3 h, se retiró la aguja de la jeringa, el contenido se diluyó y se enchapó en el medio. La acumulación bacteriana en la jeringa estaba representada por unidades formadoras de colonias (UFC) en las placas. Sin embargo, el error experimental dentro de las réplicas para el método capilar fue grande. Otro método utilizó un dispositivo Microfluídico SlipChip11. Brevemente, la solución de albúmina sérica bovina (BSA) se inyectó en todos los canales y se retiró al vacío. Las soluciones que contenían diferentes quimioatrayentes (concentración de 1 mM solo para detección cualitativa), células bacterianas suspendidas en solución salina tamponada con fosfato y tampón salino tamponado con fosfato (control negativo) se agregaron a los micropocillos superior, medio e inferior, respectivamente. La incubación se realizó en un ambiente oscuro a temperatura ambiente durante 30 minutos. Las células bacterianas se detectaron en los micropocillos. El dispositivo microfluídico SlipChip, sin embargo, era caro. Por lo tanto, cada uno de los métodos descritos anteriormente tenía ventajas y desventajas.
Se estableció un ensayo de quimiotaxis mejorado para la identificación rápida de quimioatrayentes rizobacterianos en exudados radiculares utilizando portaobjetos de vidrio estériles sin pasos complicados. En este estudio, a través de múltiples comparaciones de resultados experimentales, el método superó múltiples deficiencias de los métodos tradicionales de quimiotaxis bacteriana. El método redujo el error de conteo de placas y acortó el ciclo experimental. Por lo tanto, si se utiliza para identificar una sustancia quimioatrayente, este nuevo método puede ahorrar 2-3 días y reducir el costo de los materiales experimentales.
Protocolo
1. Materiales y equipos
NOTA: Bacillus altitudinis LZP02 (CP075052) fue aislado de la rizosfera del arroz en el noreste de China12,13 para este estudio.
- Cultura B. altitudinis LZP02 en luria-bertani (LB) medio (peptona, 10 g L-1; NaCl, 8 g de L-1 y extracto de levadura, 5 g de L-1) durante 10 h. Recoger las células por centrifugación a 9.569 x g durante 2 min a 4 °C. y almacenar con glicerol al 15% a -80 °C.
NOTA: Para este experimento, las semillas de arroz (Oryza sativa Longgeng 46) fueron proporcionadas por el Instituto de Investigación del Arroz de la Academia de Ciencias Agrícolas de Heilongjiang.
2. Colección de exudados radiculares
- Distribuya aleatoriamente las semillas de arroz en una cámara de crecimiento.
NOTA: Las semillas de arroz se esterilizaron con 30% de H2O2 durante 30 minutos y se remojaron en agua durante la noche. Las condiciones fueron las siguientes: la luz controlada (ciclo luz/oscuridad de 16/8 h), la temperatura (22 ± 2 °C) y la humedad relativa (͂70%). - Cultive semillas de arroz durante una semana y agregue agua estéril dos veces.
- Seleccione plántulas de arroz de tamaño similar y plante en 50 ml de murashige y Skoog (MS) medio líquido. Incubar durante 48 h a 22 °C en condiciones asépticas.
NOTA: Los exudados de raíz de arroz se liberarán en el medio MS14,15,16.
3. Cromatografía líquida-análisis espectrometría de masas de exudados radiculares
- Recoger 100 μL de la muestra (medio MS que contiene exudados radiculares) en un tubo centrífugo de 1,5 ml. Añadir 20 μL del disolvente de extracción (acetonitrilo-metanol-agua, 2:2:1, incluida la norma interna). Homogeneizar la muestra a 45 Hz durante 4 min, seguido de ultrasonidos en hielo durante 5 min en un baño de agua.
- Repita el ciclo de homogeneización y ultrasonido tres veces. Incubar la muestra a -20 °C durante 1 h, seguida de centrifugación a 133.778 x g y 4 °C durante 15 min.
- Transfiera el sobrenadante resultante a viales de LC-MS y guárdelo a -80 °C hasta el análisis UHPLC-QE. Prepare las muestras de control de calidad (QC) mezclando porciones iguales del sobrenadante de todas las muestras.
NOTA: Cada volumen de muestra fue de 600 μL (seis réplicas por experimento) en el experimento presentado. - Realizar análisis LC-MS/MS utilizando sistema UHPLC, columna UPLC HSS T3 (2,1 mm x 100 mm, 1,8 μm) y Q Exactive12.
- Use una solución acuosa de ácido fórmico al 0,1% y una solución acuosa de acetato de amonio de 5 mmol/L como fase móvil A y acetonitrilo como fase B móvil. Use ácido fórmico y acetato de amonio como modos de iones positivos y negativos, respectivamente.
- Establezca el gradiente de elución de la siguiente manera: 0 min, 1% B; 1 min, 1% B; 8 min, 99% B. 10 min, 99% B. 10.1 min, 1% B; 12 min, 1% B. Ajuste el caudal y el volumen de inyección a 0,5 mL/min y 2 μL, respectivamente.
NOTA: La macromolécula (>1.000 Daltons) no se puede detectar.
4. Ensayo de quimiotaxis
- Prepare la solución acuosa quimioatrayente. Asegúrese de que sea estéril. Filtre la solución quimioatrayente con un filtro de bacterias de 0,22 μm.
NOTA: La solución acuosa quimioatrayente fue la única sustancia obtenida de los estudios LC-MS disuelta en agua. La concentración y el volumen se pueden ajustar adecuadamente de acuerdo con diferentes estudios. Se utilizó la solución de ácido cítrico como ejemplo. Todas las acciones deben realizarse por el lado de una lámpara. - Marque la posición central de la diapositiva de vidrio en un intervalo de 1 cm. Asegúrese de que el portaobjetos de vidrio esté esterilizado varias veces en la llama.
- Añadir los 30 μL de solución quimioatrayente a la izquierda del portaobjetos de vidrio. Asegúrese de que las bacterias se cultivaron hasta la etapa logarítmica (2 x 108 UFC/ml) en medio LB. Agregue 30 μL de la solución bacteriana a la derecha del portaobjetos de vidrio.
NOTA: Prepare un grupo de control negativo con un volumen igual de agua estéril. Se utilizó la solución salina (NaCI al 0,9%) como control positivo para eliminar los cambios causados por la fuerza intermolecular en el experimento. - Esterilizar un bucle de inoculación varias veces en la llama. Use el bucle de inoculación para conectar la solución acuosa quimioatrayente a la solución bacteriana y manténgala a temperatura ambiente durante 20 minutos en un banco limpio.
NOTA: El experimento debe llevarse a cabo en un entorno sin viento. Ajuste el tiempo antes de desconectar la línea de conexión para detectar tensiones de diferentes habilidades atléticas de manera adecuada. - Después de 20 minutos, desconecte la línea de conexión con papel de filtro.
- Asegúrese de que el tubo centrífugo de 1,5 ml sea estéril. Recoja la solución acuosa quimioatrayente a la izquierda del portaobjetos de vidrio. Transfiera la solución al tubo de centrífuga estéril de 1,5 ml.
- Agregue el volumen apropiado de safranina al tubo de la centrífuga. Después de 2 min, recoja los líquidos miscibles para contar las bacterias y la observación microscópica con una cámara de conteo de sangre.
5. Análisis de resultados
- Determine el número de microorganismos viables atraídos utilizando la siguiente ecuación:
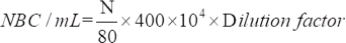
donde NBC: Número total de células bacterianas; N: Número de bacterias en 80 cuadrículas.
NOTA: Se utilizó software de análisis estadístico para el análisis de datos. El error se basó en tres valores experimentales replicados diferentes y se calculó utilizando ANOVA unidireccional seguido del análisis post-hoc de Turquía. P ≤ 0,05 se consideró significativo.
Resultados
Se detectaron un total de 584 y 937 metabolitos conocidos en los índices de iones positivos y negativos, respectivamente. Estudios previos han demostrado que los quimioatrayentes son típicamente ácidos orgánicos, aminoácidos y carbohidratos17,18.
En este estudio, se seleccionaron 16 tipos de quimioatrayentes de los estudios LC-MS en los exudados de la rizosfera de arroz para experimentos posteriores (Tabla 1). Uti...
Discusión
El aumento de la investigación indica que las interacciones planta-bacteria ocurren principalmente en la rizosfera y están influenciadas por los exudados de la raíz20,21,22,23,24. Los exudados de las raíces de las plantas incluyen una amplia gama de metabolitos primarios, incluidos ácidos fenólicos, ácidos orgánicos y aminoácidos, así como compuestos...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (Nos. 31870493), los Proyectos Clave de Investigación y Desarrollo en Heilongjiang, China (GA21B007) y las Tarifas de Investigación Básica de las Universidades en la Provincia de Heilongjiang, China (No. 135409103).
Materiales
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid | Beijing InnoChem Science & Technology C.,Ltd. | 490-79-9 | |
| Acetonitrile | CNW Technologies | 75-05-8 | |
| Ammonium acetate | CNW Technologies | 631-61-8 | |
| Caffeic acid | Beijing InnoChem Science & Technology C.,Ltd. | 331-39-5 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Fresco17 | |
| Citric acid | Beijing InnoChem Science & Technology C.,Ltd. | 77-92-9 | |
| Clean bench | Shanghai Boxun Industrial Co., Ltd. | BJ-CD | |
| Ferulic acid | Beijing InnoChem Science & Technology C.,Ltd. | 1135-24-6 | |
| Formic acid | CNW Technologies | 64-18-6 | |
| Fructose | Beijing InnoChem Science & Technology C.,Ltd. | 57-48-7 | |
| Galactose | Beijing InnoChem Science & Technology C.,Ltd. | 59-23-4 | |
| Glycine | Beijing InnoChem Science & Technology C.,Ltd. | 56-40-6 | |
| Grinding Mill | Shanghai Jingxin Industrial Development Co., Ltd. | JXFSTPRP-24 | |
| Histidine | Beijing InnoChem Science & Technology C.,Ltd. | 71-00-1 | |
| Internal standard: 2-Chloro-L-phenylalanine | Shanghai Hengbai Biotech C.,Ltd. | 103616-89-3 | |
| Leucine | Beijing InnoChem Science & Technology C.,Ltd. | 61-90-5 | |
| Malic acid | Beijing InnoChem Science & Technology C.,Ltd. | 6915-15-7 | |
| Mannose | Beijing InnoChem Science & Technology C.,Ltd. | 3458-28-4 | |
| Mass Spectrometer | Thermo Fisher Scientific | Q Exactive Focus | |
| Methanol | CNW Technologies | 67-56-1 | |
| Optical Microscope | Olympus | BX43 | |
| Phenylalanine | Beijing InnoChem Science & Technology C.,Ltd. | 63-91-2 | |
| Proline | Beijing InnoChem Science & Technology C.,Ltd. | 147-85-3 | |
| Scales | Sartorius | BSA124S-CW | |
| Serine | Beijing InnoChem Science & Technology C.,Ltd. | 56-45-1 | |
| Threonine | Beijing InnoChem Science & Technology C.,Ltd. | 72-19-5 | |
| UHPLC | Agilent | 1290 UHPLC | |
| Ultrasound Instrument | Shenzhen Leidebang Electronics Co., Ltd. | PS-60AL | |
| Valine | Beijing InnoChem Science & Technology C.,Ltd. | 7004-03-7 |
Referencias
- Belas, R. Biofilms, flagella, and mechanosensing of surfaces by bacteria. Trends in Microbiology. 22 (9), 517-527 (2014).
- Haichar, Z., Santaella, C., Heulin, T., Achouak, W. Root exudates mediated interactions belowground. Soil Biology and Biochemistry. 77 (7), 69-80 (2014).
- Zhang, N., et al. Effects of different plant root exudates and their organic acid components on chemotaxis, biofilm formation and colonization by beneficial rhizosphere-associated bacterial strains. Plant and Soil. 374 (1-2), 689-700 (2014).
- Zhang, N., et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates. BMC Genomics. 16 (1), 685 (2015).
- Lui, Y., et al. Induced root-secreted D-galactose functions as a chemoattractant and enhances the biofilm formation of Bacillus velezensis SQR9 in an mcpa-dependent manner. Applied Microbiology and Biotechnology. 104 (17), 785-797 (2020).
- Vora, S. M., Joshi, P., Belwalkar, M., Archana, G. Root exudates influence chemotaxis and colonization of diverse plant growth-promoting rhizobacteria in the Cajanus cajan - Zea mays intercropping system. Rhizosphere. 18 (12), 100331 (2021).
- Sampedro, I., et al. Effects of halophyte root exudates and their components on chemotaxis, biofilm formation and colonization of the halophilic bacterium halomonas anticariensis FP35T. Microorganisms. 8 (4), 575 (2020).
- Liu, X. L., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. A dual role amino acid from sesbania rostrata seed exudates in the chemotaxis response of Azorhizobium caulinodans ORS571. Molecular Plant-Microbe Interactions. 32 (9), 1134-1147 (2019).
- Ling, N., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere. European Journal of Soil Biology. 47 (6), 374-379 (2011).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiology. 148 (3), 1547-1556 (2008).
- Shen, C., et al. Bacterial chemotaxis on Slipchip. Lab on a Chip. 14 (16), 3074-3080 (2014).
- Liu, H., et al. Bacillus pumilus LZP02 promotes rice root growth by improving carbohydrate metabolism and phenylpropanoid biosynthesis. Molecular Plant-Microbe Interactions. 33 (10), 1222-1231 (2020).
- Goswami, M., Deka, S. Isolation of a novel rhizobacteria having multiple plant growth promoting traits and antifungal activity against certain phytopathogens. Microbiological Research. 240, 126516 (2020).
- Kaiira, M., Chemining'Wa, G., Ayuke, F., Baguma, Y., Nganga, F. Profiles of compounds in root exudates of rice, cymbopogon, desmodium, mucuna and maize. Journal of Agricultural Sciences Belgrade. 64 (4), 399-412 (2019).
- Shi, Y., et al. Effect of rice root exudates and strain combination on biofilm formation of Paenibacillus polymyxa and Paenibacillus macerans. African Journal of Microbiology Research. 6 (13), 3343-3347 (2012).
- Lee, H. W., Ghimire, S. R., Shin, D. H., Lee, I. J., Kim, K. U. Allelopathic effect of the root exudates of K21, a potent allelopathic rice. Weed Biology and Management. 8 (2), 85-90 (2008).
- Belimov, A. A., et al. Rhizobacteria that produce auxins and contain 1-amino-cyclopropane-1-carboxylic acid deaminase decrease amino acid concentrations in the rhizosphere and improve growth and yield of well-watered and water-limited potato (Solanum tuberosum). Annals of Applied Biology. 167 (1), 11-25 (2015).
- Ankati, S., Podile, A. R. Metabolites in the root exudates of groundnut change during interaction with plant growth promoting rhizobacteria in a strain-specific manner. Journal of Plant Physiology. 243, 153057 (2019).
- Gordillo, F., Chavez, F., Jerez, C. A. Motility and chemotaxis of Pseudomonas sp. B4 towards polychlorobiphenyls and chlorobenzoates. FEMS Microbiology Ecology. 60 (2), 322-328 (2007).
- Bais, H. P., Weir, T. L., Perry, L. G., Gilroy, S., Vivanco, J. M. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology. 57, 233-266 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Badri, D. V., Weir, T. L., Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: plant-microbe interactions. Curr Opin Biotech. Current Opinion in Biotechnology. 20 (6), 642-650 (2009).
- Kamilova, F., Kravchenko, L. V., Shaposhnikov, A. I., Makarova, N., Lugtenberg, B. Effects of the tomato pathogen Fusarium oxysporum f. sp. radicis-lycopersici and of the biocontrol bacterium Pseudomonas fluorescens WCS365. Molecular Plant-Microbe Interactions. 19 (10), 1121-1126 (2006).
- Kamilova, F., et al. Organic acids, sugars, and L-tryptophane in exudates of vegetables growing on stonewool and their effects on activities of rhizosphere bacteria. Molecular Plant-Microbe Interactions. 19 (3), 250-256 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Hao, W. Y., Ren, L. X., Ran, W., Shen, Q. R. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp. Niveum. Plant and Soil. 336 (1-2), 485-497 (2010).
- Hao, Z. P., Wang, Q., Christie, P., Li, X. L. Allelopathic potential of watermelon tissues and root exudates. Scientia Horticulturae. 112 (3), 315-320 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados