JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
루트 엑수데이트에서 뿌리 균 화학 물질의 신속 한 식별에 대 한 향상 된 화학 분석
요약
여기에서, 우리는 향상된 화학탁증 분석 프로토콜을 제시합니다. 이 프로토콜의 목표는 전통적인 세균 화학 요법 방법의 단계와 비용을 줄이고 식물 미생물 상호 작용을 이해하는 데 중요한 자원역할을하는 것입니다.
초록
화학 요법 식별은 뿌리 권 성장 촉진 박테리아의 연구 및 응용 프로그램에 매우 중요합니다. 간단한 단계를 통해 멸균 유리 슬라이드에서 뿌리 부속성 성장 촉진 박테리아의 화학적 움직임을 유도할 수 있는 화학 물질을 신속하게 식별하는 간단한 방법을 확립했습니다. 박테리아 용액(OD600 = 0.5) 및 멸균 화학 요법 수성 용액은 1cm 간격으로 유리 슬라이드에 드롭와이즈를 첨가하였다. 항분 루프는 화학 요법 수성 용액을 세균 용액에 연결하는 데 사용되었습니다. 슬라이드는 깨끗한 벤치에서 20 분 동안 실온에서 보관되었습니다. 마지막으로, 항암제 수성 용액은 세균계 수분 및 현미경 관찰을 위해 수집되었다. 이 연구에서는 실험 결과의 여러 비교를 통해, 방법은 전통적인 세균성 화학 요법 방법의 여러 단점을 극복. 이 방법은 플레이트 계수의 오류를 줄이고 실험 주기를 단축시켰다. 화학 물질의 식별을 위해,이 새로운 방법은 기존의 방법에 비해 2-3 일을 절약 할 수 있습니다. 추가적으로, 이 방법은 어떤 연구원든지 체계적으로 1-2 일 안에 세균성 화학 요법 실험을 완료하는 것을 허용합니다. 프로토콜은 식물 세균 상호 작용을 이해하기 위한 귀중한 자원으로 간주될 수 있습니다.
서문
화학 요법은 뿌리에 식물 성장 촉진 뿌리 균 (PGPR)의 식민지화에 중요 하고 식물-미생물 상호 작용을 이해 1. 식물 뿌리 에서 저분자 화합물 (화학 요법제)의 클래스는 뿌리 부각에 PGPR의 화학 운동을 유도2. 말산, 구연산 및 뿌리 의 다른 성분은 바실러스 균주의 화학 을 자극3. 예를 들어, 옥수수 뿌리에서 포도당, 구연산 및 fumaric 산은 뿌리 표면에 박테리아를 모집4. D-갈라콘토제는 뿌리 에서 유래되어 바실러스 벨레젠시스 SQR95의 화학요법을 유도한다. 유기 산, fumarate를 포함 하 여, 기이 한 산, 그리고 간결, 화학 요법및 카자누스 카잔에서 다양 한 PGPR의 식민지에 영향을 - 제아는 교차 크롭 시스템 6 수 있습니다. 쌀 뿌리에서 올레아놀산은 변속, 변형 FP357에 대한 화학 작용의 역할을 한다. 다른 식물 이출 (히스티딘 포함, 아르기닌, 및 아스파르타트) 박테리아의 화학 반응에 중요 한 역할을 할 수 있습니다8. 식물은 뿌리 권 식민지 동안 첫 번째 단계인 박테리아의 움직임을 지시하는 신호로서의 기능을 추방한다. PGPR에 의한 식물 식민지는 엄청난 관련성의 과정입니다, PGPR은 식물 호스트에 도움이 되기 때문에.
세균 성 화학 요법을 분석하는 데 많은 방법이 사용되었습니다. 상기 수영플레이트 방법은 이전에 설명된 방법 중 하나입니다9. 이 방법에서 플레이트는 반고체 배지로 만들어졌습니다. 한천(1.0%, w/v)을 함유한 화학완충제가 플레이트에 첨가되었다. 버퍼는 가열된 다음 화학 요법자와 혼합됩니다. 이어서, 8μL의 박테리아 현탁액은 플레이트의 중간에 드롭와이즈로 첨가되었고 플레이트는 28°C에서 인큐베이터에 배치되었다. 접시는 정기적으로 관찰되고 촬영되었습니다. 그러나, 수영 플레이트 방법의 실험 주기는 매우 길다. 모세관과 같은 방법10에서, 파이펫 팁은 세균 현탁액의 100 μL을 보유하기위한 챔버 역할을한다. 1 mL 주사기 바늘은 모세관으로 사용되었다. 다른 농도 그라데이션을 가진 화학 물질을 포함하는 주사기 바늘을 100 μL 파이펫 팁에 삽입했습니다. 3시간 동안 실온에서 배양한 후, 주사기 바늘을 제거하고, 함량을 희석시키고 배지상에 도금하였다. 주사기의 세균 축적은 플레이트내의 식민지 형성 단위(CfU)로 표현되었다. 그러나 모세관과 같은 방법에 대한 복제 내의 실험 오차는 컸다. 또 다른 방법은 미세 유체 슬립 칩 장치를 사용했다11. 간략하게, 소 혈청 알부민 (BSA) 용액은 모든 채널에 주입하고 진공을 사용하여 제거되었다. 상이한 화학요법제(질적 검출을 위한 1mM 농도),인산완충식염 및 인산염 완충식식염 버퍼링식 염선 버퍼(음성 대조군)에서 중단된 세균세포(음의 대조군)를 각각 상부, 중간 및 하부 마이크로웰에 첨가하였다. 인큐베이션은 30분 동안 실온에서 어두운 환경에서 수행되었다. 세균성 세포는 마이크로웰에서 그 때 검출되었습니다. 그러나 미세유체 슬립칩 장치는 비용이 많이 들었습니다. 따라서, 상술한 각 방법은 장점과 단점이 있었다.
복잡한 단계 없이 멸균 유리 슬라이드를 사용하여 뿌리 에서 뿌리 줄기균 화학 요법의 신속한 식별을 위한 개선된 화학요법 분석법을 확립했습니다. 이 연구에서는 실험 결과의 여러 비교를 통해, 방법은 전통적인 세균성 화학 요법 방법의 여러 단점을 극복. 이 방법은 플레이트 계수의 오류를 줄이고 실험 주기를 단축시켰다. 따라서, 화학 물질을 식별하는 데 사용되는 경우, 이 새로운 방법은 2-3 일을 절약하고 실험 재료의 비용을 줄일 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 재료 및 장비
참고: 바실러스 알티투디니스 LZP02 (CP075052)는 이 연구를 위해 중국 북동부의 쌀 의 뿌리부로부터 분리되었다12,13.
- 문화 B. 알티투디니스 LZP02 에서 루리아-베르타니 (LB) 매체 (펩톤, 10 g L-1; NaCl, L-1 및 효모 추출물 8g, L-1 5g) 10시간. 4°C에서 2분 동안 9,569 x g 에서 원심분리로 세포를 수집하고 -80°C에서 15% 글리세롤로 보관합니다.
참고: 이 실험을 위해, 쌀 씨앗 (Oryza sativa Longgeng 46) 농업 과학의 헤이룽장 아카데미의 쌀 연구소에 의해 제공 되었다.
2. 루트 이출의 컬렉션
- 성장 챔버에 쌀 씨를 무작위로 분배합니다.
참고: 쌀 씨앗은 30분 동안 30% H2O2로 살균되었고 하룻밤 사이에 물에 담그었습니다. 조건은 다음과 같습니다 : 제어 된 빛 (16/8 h 빛 / 어두운 주기), 온도 (22 ± 2 ° C) 및 상대 습도 (͂ 70 %). - 일주일 동안 쌀 씨를 배양하고 멸균 물을 두 번 추가합니다.
- 무라시게와 스쿠그(MS) 액체 매체의 50mL에 비슷한 크기의 쌀 묘목을 선택합니다. 무균 조건하에서 22 °C에서 48 h에 대한 배양.
참고: 쌀 뿌리 는 MS 매체14,15,16에 출시 될 예정이다.
3. 액체 크로마토그래피 질량 분광법 분석
- 1.5mL 원심분리기 튜브에서 샘플(심미지 함유 루트 이출)의 100 μL을 수집합니다. 추출 용매의 20 μL을 추가합니다(아세토닐-메탄올-물, 내부 표준을 포함하여 2:2:1). 45Hz에서 4분 동안 샘플을 균질화한 다음 수조에서 5분 동안 얼음 초음파를 초음파처리합니다.
- 균질화 및 초음파 주기를 세 번 반복합니다. 샘플을 -20°C에서 1시간 동안 배양한 다음 133,778xg, 4°C에서 15분 동안 원심분리를 한다.
- 생성된 상체를 LC-MS 바이알로 전송하고 UHPLC-QE 분석전까지 -80°C에 저장합니다. 모든 샘플의 상부체의 동일한 부분을 혼합하여 품질 관리(QC) 샘플을 준비합니다.
참고: 각 샘플 부피는 제시된 실험에서 600 μL(실험당 6회 복제)이었다. - UHPLC 시스템, UPLC HSS T3 컬럼(2.1mm x 100mm, 1.8 μm) 및 Q Exactive12를 사용하여 LC-MS/MS 분석을 수행합니다.
- 0.1% 포름산 수성 용액과 5mmol/L 암모늄 아세테이트 수성 용액을 모바일 상 A및 아세토닐릴로 이동상 B. 포믹산과 암모늄 아세테이트를 각각 양성 및 음의 이온 모드로 사용한다.
- 용출 그라데이션을 다음과 같이 설정합니다: 0 분, 1% B; 1 분, 1 % B; 8 분, 99% B. 10 분, 99% B. 10.1 분, 1% B; 12분, 1% B. 유량 및 사출 부피를 각각 0.5mL/min 및 2 μL로 설정합니다.
참고: 거대 분자(>1,000 달튼)는 검출할 수 없습니다.
4. 화학 요법 분석
- 화학 요법 수성 용액을 준비하십시오. 멸균되었는지 확인하십시오. 0.22 μm 박테리아 필터로 화학 요법 용액을 필터링합니다.
참고: 화학요법 수성 용액은 물에 용해된 LC-MS 연구에서 얻은 단일 물질이었습니다. 농도 및 부피는 다른 연구에 따라 적절하게 조정할 수 있습니다. 구연산 용액을 예로 들 수 있었다. 모든 작업은 램프 의 측면에 의해 수행되어야합니다. - 유리 슬라이드의 중간 위치를 1cm 간격으로 표시합니다. 유리 슬라이드가 화염에 여러 번 살균되었는지 확인합니다.
- 유리 슬라이드 왼쪽에 30 μL의 화학 용액을 추가합니다. 박테리아가 LB 배지에서 로그산학 단계(2 x 108 CFU/mL)로 배양되었는지 확인합니다. 유리 슬라이드 오른쪽에 세균 용액의 30 μL을 추가합니다.
참고: 동일한 양의 멸균 수로 음수 대조군을 준비합니다. 식염수 용액(0.9% NaCI)은 실험에서 분자 간 힘에 의한 변화를 제거하기 위해 양성 대조군으로 사용되었다. - 화염에 여러 번 접종 루프를 살균. 접종 루프를 사용하여 화학 요법 수성 용액을 박테리아 용액에 연결하고 깨끗한 벤치에서 20 분 동안 실온에서 유지하십시오.
참고: 실험은 바람이 없는 환경에서 수행해야 합니다. 다른 운동 능력의 긴장에 대 한 연결 라인을 분리 하기 전에 시간을 조정. - 20분 후 연결 선을 필터 용지로 분리합니다.
- 1.5mL 원심분리기 튜브가 멸균되었는지 확인하십시오. 유리 슬라이드의 왼쪽에 있는 화학 요법 수성 용액을 수집합니다. 용액을 1.5mL 멸균 원심분리기 튜브로 이송한다.
- 원심분리기 튜브에 적절한 양의 사프란린을 추가합니다. 2 분 후, 혈액 계수 챔버와 박테리아와 현미경 관찰을 계산하기위한 잘못된 액체를 수집합니다.
5. 결과 분석
- 다음 방정식을 사용하여 유치된 실행 가능한 미생물의 수를 결정합니다.
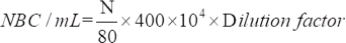
어디 NBC: 박테리아 세포의 총 수; N: 80개의 그리드에 있는 박테리아의 수.
참고: 통계 분석 소프트웨어가 데이터 분석에 사용되었습니다. 이 오류는 세 가지 복제된 실험 값을 기반으로 하며 단방향 ANOVA를 사용하여 계산되었으며 터키의 사후 분석이 뒤따랐습니다. P ≤ 0.05는 중요한 것으로 간주되었다.
Access restricted. Please log in or start a trial to view this content.
결과
총 584 및 937 알려진 대사 산물은 각각 양성 및 음의 이온 지수에서 검출되었다. 이전 연구에 따르면 화학 요법은 일반적으로 유기산, 아미노산 및 탄수화물17,18입니다.
본 연구에서는, 쌀 뿌리줄기에서 LC-MS 연구에서 16종류의 화학요법제가 후속 실험(표 1)을 위해 선택되었다. 수영 플레이트 방법을 사용하여, 우리는 rhizo...
Access restricted. Please log in or start a trial to view this content.
토론
증가 연구는 식물 박테리아 상호 작용이 주로 뿌리 에서 발생 하 고 루트 exudates20,21,22,23,24에 의해 영향을 나타냅니다. 식물 뿌리 이출은 페놀산, 유기산 및 아미노산뿐만 아니라 더 복잡한 이차 화합물25,26,27을 포함한 다?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 중국 국립자연과학재단(31870493, 중국 헤이룽장의 주요 연구개발 프로젝트(GA21B007), 중국 헤이룽장성 대학의 기초연구료(제1호 135409103)가 지원했다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid | Beijing InnoChem Science & Technology C.,Ltd. | 490-79-9 | |
| Acetonitrile | CNW Technologies | 75-05-8 | |
| Ammonium acetate | CNW Technologies | 631-61-8 | |
| Caffeic acid | Beijing InnoChem Science & Technology C.,Ltd. | 331-39-5 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Fresco17 | |
| Citric acid | Beijing InnoChem Science & Technology C.,Ltd. | 77-92-9 | |
| Clean bench | Shanghai Boxun Industrial Co., Ltd. | BJ-CD | |
| Ferulic acid | Beijing InnoChem Science & Technology C.,Ltd. | 1135-24-6 | |
| Formic acid | CNW Technologies | 64-18-6 | |
| Fructose | Beijing InnoChem Science & Technology C.,Ltd. | 57-48-7 | |
| Galactose | Beijing InnoChem Science & Technology C.,Ltd. | 59-23-4 | |
| Glycine | Beijing InnoChem Science & Technology C.,Ltd. | 56-40-6 | |
| Grinding Mill | Shanghai Jingxin Industrial Development Co., Ltd. | JXFSTPRP-24 | |
| Histidine | Beijing InnoChem Science & Technology C.,Ltd. | 71-00-1 | |
| Internal standard: 2-Chloro-L-phenylalanine | Shanghai Hengbai Biotech C.,Ltd. | 103616-89-3 | |
| Leucine | Beijing InnoChem Science & Technology C.,Ltd. | 61-90-5 | |
| Malic acid | Beijing InnoChem Science & Technology C.,Ltd. | 6915-15-7 | |
| Mannose | Beijing InnoChem Science & Technology C.,Ltd. | 3458-28-4 | |
| Mass Spectrometer | Thermo Fisher Scientific | Q Exactive Focus | |
| Methanol | CNW Technologies | 67-56-1 | |
| Optical Microscope | Olympus | BX43 | |
| Phenylalanine | Beijing InnoChem Science & Technology C.,Ltd. | 63-91-2 | |
| Proline | Beijing InnoChem Science & Technology C.,Ltd. | 147-85-3 | |
| Scales | Sartorius | BSA124S-CW | |
| Serine | Beijing InnoChem Science & Technology C.,Ltd. | 56-45-1 | |
| Threonine | Beijing InnoChem Science & Technology C.,Ltd. | 72-19-5 | |
| UHPLC | Agilent | 1290 UHPLC | |
| Ultrasound Instrument | Shenzhen Leidebang Electronics Co., Ltd. | PS-60AL | |
| Valine | Beijing InnoChem Science & Technology C.,Ltd. | 7004-03-7 |
참고문헌
- Belas, R. Biofilms, flagella, and mechanosensing of surfaces by bacteria. Trends in Microbiology. 22 (9), 517-527 (2014).
- Haichar, Z., Santaella, C., Heulin, T., Achouak, W. Root exudates mediated interactions belowground. Soil Biology and Biochemistry. 77 (7), 69-80 (2014).
- Zhang, N., et al. Effects of different plant root exudates and their organic acid components on chemotaxis, biofilm formation and colonization by beneficial rhizosphere-associated bacterial strains. Plant and Soil. 374 (1-2), 689-700 (2014).
- Zhang, N., et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates. BMC Genomics. 16 (1), 685(2015).
- Lui, Y., et al. Induced root-secreted D-galactose functions as a chemoattractant and enhances the biofilm formation of Bacillus velezensis SQR9 in an mcpa-dependent manner. Applied Microbiology and Biotechnology. 104 (17), 785-797 (2020).
- Vora, S. M., Joshi, P., Belwalkar, M., Archana, G. Root exudates influence chemotaxis and colonization of diverse plant growth-promoting rhizobacteria in the Cajanus cajan - Zea mays intercropping system. Rhizosphere. 18 (12), 100331(2021).
- Sampedro, I., et al. Effects of halophyte root exudates and their components on chemotaxis, biofilm formation and colonization of the halophilic bacterium halomonas anticariensis FP35T. Microorganisms. 8 (4), 575(2020).
- Liu, X. L., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. A dual role amino acid from sesbania rostrata seed exudates in the chemotaxis response of Azorhizobium caulinodans ORS571. Molecular Plant-Microbe Interactions. 32 (9), 1134-1147 (2019).
- Ling, N., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere. European Journal of Soil Biology. 47 (6), 374-379 (2011).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiology. 148 (3), 1547-1556 (2008).
- Shen, C., et al. Bacterial chemotaxis on Slipchip. Lab on a Chip. 14 (16), 3074-3080 (2014).
- Liu, H., et al. Bacillus pumilus LZP02 promotes rice root growth by improving carbohydrate metabolism and phenylpropanoid biosynthesis. Molecular Plant-Microbe Interactions. 33 (10), 1222-1231 (2020).
- Goswami, M., Deka, S. Isolation of a novel rhizobacteria having multiple plant growth promoting traits and antifungal activity against certain phytopathogens. Microbiological Research. 240, 126516(2020).
- Kaiira, M., Chemining'Wa, G., Ayuke, F., Baguma, Y., Nganga, F. Profiles of compounds in root exudates of rice, cymbopogon, desmodium, mucuna and maize. Journal of Agricultural Sciences Belgrade. 64 (4), 399-412 (2019).
- Shi, Y., et al. Effect of rice root exudates and strain combination on biofilm formation of Paenibacillus polymyxa and Paenibacillus macerans. African Journal of Microbiology Research. 6 (13), 3343-3347 (2012).
- Lee, H. W., Ghimire, S. R., Shin, D. H., Lee, I. J., Kim, K. U. Allelopathic effect of the root exudates of K21, a potent allelopathic rice. Weed Biology and Management. 8 (2), 85-90 (2008).
- Belimov, A. A., et al. Rhizobacteria that produce auxins and contain 1-amino-cyclopropane-1-carboxylic acid deaminase decrease amino acid concentrations in the rhizosphere and improve growth and yield of well-watered and water-limited potato (Solanum tuberosum). Annals of Applied Biology. 167 (1), 11-25 (2015).
- Ankati, S., Podile, A. R. Metabolites in the root exudates of groundnut change during interaction with plant growth promoting rhizobacteria in a strain-specific manner. Journal of Plant Physiology. 243, 153057(2019).
- Gordillo, F., Chavez, F., Jerez, C. A. Motility and chemotaxis of Pseudomonas sp. B4 towards polychlorobiphenyls and chlorobenzoates. FEMS Microbiology Ecology. 60 (2), 322-328 (2007).
- Bais, H. P., Weir, T. L., Perry, L. G., Gilroy, S., Vivanco, J. M. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology. 57, 233-266 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Badri, D. V., Weir, T. L., Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: plant-microbe interactions. Curr Opin Biotech. Current Opinion in Biotechnology. 20 (6), 642-650 (2009).
- Kamilova, F., Kravchenko, L. V., Shaposhnikov, A. I., Makarova, N., Lugtenberg, B. Effects of the tomato pathogen Fusarium oxysporum f. sp. radicis-lycopersici and of the biocontrol bacterium Pseudomonas fluorescens WCS365. Molecular Plant-Microbe Interactions. 19 (10), 1121-1126 (2006).
- Kamilova, F., et al. Organic acids, sugars, and L-tryptophane in exudates of vegetables growing on stonewool and their effects on activities of rhizosphere bacteria. Molecular Plant-Microbe Interactions. 19 (3), 250-256 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Hao, W. Y., Ren, L. X., Ran, W., Shen, Q. R. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp. Niveum. Plant and Soil. 336 (1-2), 485-497 (2010).
- Hao, Z. P., Wang, Q., Christie, P., Li, X. L. Allelopathic potential of watermelon tissues and root exudates. Scientia Horticulturae. 112 (3), 315-320 (2007).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유