Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Улучшенный анализ хемотаксиса для быстрой идентификации ризобактериальных хемоаттрактантантов в корневых экссудатах
В этой статье
Резюме
Здесь мы представляем улучшенный протокол анализа хемотаксиса. Целью этого протокола является снижение этапов и затрат традиционных методов бактериального хемотаксиса и использование в качестве ценного ресурса для понимания взаимодействия растений и микробов.
Аннотация
Идентификация хемотаксиса очень важна для исследования и применения бактерий, способствующих росту ризосферы. Мы разработали простой метод для быстрой идентификации химиоаттрактантантов, которые могут индуцировать хемотаксическое движение бактерий, способствующих росту ризосферы, на стерильных стеклянных слайдах с помощью простых шагов. Раствор бактерий (OD600 = 0,5) и стерильный водный раствор химиоаттрактанта добавляли по каплям на стеклянную горку с интервалом 1 см. Для соединения водного раствора хемоаттрактанта с бактериальным раствором использовалась инокуляционная петля. Горку держали при комнатной температуре в течение 20 минут на чистой скамейке. Наконец, водный раствор химиоаттрактанта собирали для подсчета бактерий и микроскопического наблюдения. В этом исследовании, благодаря многократным сравнениям экспериментальных результатов, метод преодолел многочисленные недостатки традиционных методов бактериального хемотаксиса. Метод уменьшил погрешность подсчета пластин и сократил экспериментальный цикл. Для идентификации хемоаттрактантных веществ этот новый метод позволяет сэкономить 2-3 дня по сравнению с традиционным методом. Кроме того, этот метод позволяет любому исследователю систематически завершить эксперимент по бактериальному хемотаксису в течение 1-2 дней. Протокол можно считать ценным ресурсом для понимания взаимодействия растений и микробов.
Введение
Хемотаксис важен для колонизации ризобактерий, способствующих росту растений (PGPR) на корнях и для понимания взаимодействия растений и микробов1. Класс низкомолекулярных соединений (хемоаттрактанты) в экссудатах корней растений индуцирует хемотаксическое движение PGPR в ризосферу2. Яблочная кислота, лимонная кислота и другие компоненты в корневых экссудатах стимулируют хемотаксис штаммов Bacillus3. Например, глюкоза, лимонная кислота и фумаровая кислота в экссудатах корня кукурузы рекрутируют бактерии на поверхность корня4. D-галактоза, которая получена из корневых экссудатов, индуцирует хемотаксис Bacillus velezensis SQR95. Органические кислоты, в том числе фумарат, яблочная кислота и сукцинат, влияют на хемотаксис и колонизацию различных PGPR в системе cajanus cajan - Zea mays intercropping6. Олеаноловая кислота в экссудатах корня риса, действует как химиоаттрактант для штамма FP357. Другие растительные экссудаты (включая гистидин, аргинин и аспартат) могут играть решающую роль в хемотаксическом ответе бактерий8. Экссудаты растений функционируют как сигнал для направления движения бактерий, что является первым шагом во время колонизации ризосферы. Колонизация растений с помощью PGPR является процессом огромной важности, так как PGPR полезны для хозяина растения.
Многие методы были использованы для анализа бактериального хемотаксиса. Метод плавательной пластины является одним из методов, описанных ранее9. При этом способе пластины изготавливали из полутвердой среды. К пластине добавляли хемотаксический буфер, содержащий агар (1,0%, мас./об.). Буфер нагревают, а затем смешивают с химиоаттрактантом. Затем 8 мкл суспензии бактерий добавляли по каплям к середине пластины и пластину помещали в инкубатор при 28 °C. Пластину регулярно наблюдали и фотографировали. Однако экспериментальный цикл метода плавательной пластины был очень длинным. В капилляроподобном способе10 наконечник пипетки служит камерой для хранения 100 мкл бактериальной суспензии. В качестве капилляра использовалась игла шприца объемом 1 мл. Шприцевую иглу, содержащую химиоаттрактанты с различными градиентами концентрации, вставляли в наконечник пипетки объемом 100 мкл. После инкубации при комнатной температуре в течение 3 ч шприцевую иглу удаляли, содержимое разбавляли и наносили на среду. Бактериальное накопление в шприце было представлено колониеобразующими единицами (КОЕ) в пластинах. Тем не менее, экспериментальная ошибка в репликах для капилляроподобного метода была большой. Другим методом использовалось микрофлюидное устройство SlipChip11. Вкратце, раствор бычьего сывороточного альбумина (BSA) вводили во все каналы и удаляли с помощью вакуума. Растворы, содержащие различные хемоаттрактанты (концентрация 1 мМ только для качественного обнаружения), бактериальные клетки, взвешенные в фосфатно-буферном физиологическом растворе и фосфатно-буферном солевом буфере (отрицательный контроль), добавляли в верхнюю, среднюю и нижнюю микролунки соответственно. Затем инкубацию проводили в темной среде при комнатной температуре в течение 30 мин. Затем бактериальные клетки были обнаружены в микролунках. Микрофлюидное устройство SlipChip, однако, было дорогим. Поэтому каждый из описанных выше способов имел свои преимущества и недостатки.
Мы установили улучшенный анализ хемотаксиса для быстрой идентификации ризобактериальных химиоаттрактантантов в корневых экссудатах с использованием стерильных стеклянных слайдов без сложных этапов. В этом исследовании, благодаря многократным сравнениям экспериментальных результатов, метод преодолел многочисленные недостатки традиционных методов бактериального хемотаксиса. Метод уменьшил погрешность подсчета пластин и сократил экспериментальный цикл. Поэтому, если использовать для выявления химиоаттрактантного вещества, этот новый метод позволяет сэкономить 2-3 дня и удешевить экспериментальные материалы.
протокол
1. Материалы и оборудование
ПРИМЕЧАНИЕ: Bacillus altitudinis LZP02 (CP075052) был выделен из ризосферы риса на северо-востоке Китая12,13 для этого исследования.
- Культура Б. altitudinis LZP02 в среде Лурия-Бертани (LB) (пептон, 10 г L-1; NaCl, 8 г L-1 и дрожжевой экстракт, 5 г L-1) в течение 10 ч. Собирают клетки центрифугированием при 9,569 х г в течение 2 мин при 4 °C и хранят с 15% глицерином при -80 °C.
ПРИМЕЧАНИЕ: Для этого эксперимента семена риса (Oryza sativa Longgeng 46) были предоставлены Научно-исследовательским институтом риса Хэйлунцзянской академии сельскохозяйственных наук.
2. Сбор корневых экссудатов
- Случайным образом распределите семена риса в камере роста.
ПРИМЕЧАНИЕ: Семена риса стерилизовали 30% H2O2 в течение 30 мин и замачивали в воде на ночь. Условия были следующими: контролируемый свет (16/8 ч светло-темный цикл), температура (22 ± 2 °C) и относительная влажность (͂70%). - Культурируйте семена риса в течение недели и дважды добавляйте стерильную воду.
- Выбирайте саженцы риса аналогичного размера и сажайте в 50 мл жидкой среды Мурашиге и Скуг (МС). Инкубировать в течение 48 ч при 22 °C в асептических условиях.
ПРИМЕЧАНИЕ: Экссудаты корня риса будут высвобождаться в среду MS14,15,16.
3. Жидкостная хроматография-масс-спектрометрический анализ корневых экссудатов
- Соберите 100 мкл образца (MS-среда, содержащая корневые экссудаты) в центрифужной пробирке объемом 1,5 мл. Добавить 20 мкл экстракционного растворителя (ацетонитрил-метанол-вода, 2:2:1, включая внутренний стандарт). Гомогенизируют образец при 45 Гц в течение 4 мин с последующей ультразвуковой обработкой на льду в течение 5 мин на водяной бане.
- Повторите гомогенизацию и ультразвуковой цикл три раза. Инкубируют образец при -20°С в течение 1 ч с последующим центрифугированием при 133,778 х г и 4°С в течение 15 мин.
- Перенесите полученный супернатант во флаконы LC-MS и храните при -80 °C до анализа UHPLC-QE. Подготовьте образцы контроля качества (QC) путем смешивания равных частей супернатанта всех образцов.
ПРИМЕЧАНИЕ: Каждый объем образца составлял 600 мкл (шесть реплик в эксперименте) в представленном эксперименте. - Выполните анализ LC-MS/MS с использованием системы UHPLC, колонки UPLC HSS T3 (2,1 мм x 100 мм, 1,8 мкм) и Q Exactive12.
- Используйте 0,1% водный раствор муравьиной кислоты и водный раствор ацетата аммония 5 ммоль/л в качестве подвижной фазы А и ацетонитрил в качестве подвижной фазы В. Используйте муравьиную кислоту и ацетат аммония в качестве положительного и отрицательного ионных режимов соответственно.
- Установите градиент элюирования следующим образом: 0 мин, 1% В; 1 мин, 1% В; 8 мин, 99% B. 10 мин, 99% B. 10,1 мин, 1% B; 12 мин, 1% B. Установите скорость потока и объем впрыска на уровне 0,5 мл/мин и 2 мкл соответственно.
ПРИМЕЧАНИЕ: Макромолекула (>1000 Дальтон) не может быть обнаружена.
4. Анализ хемотаксиса
- Приготовьте химиоаттрактант водным раствором. Убедитесь, что он стерилен. Фильтруйте раствор химиоаттрактанта с помощью бактериального фильтра 0,22 мкм.
ПРИМЕЧАНИЕ: Водный раствор хемоаттрактанта представлял собой единственное вещество, полученное в результате исследований LC-MS, растворенное в воде. Концентрация и объем могут быть соответствующим образом скорректированы в соответствии с различными исследованиями. В качестве примера был использован раствор лимонной кислоты. Все действия должны выполняться сбоку от лампы. - Отметьте среднее положение стеклянной горки с интервалом 1 см. Убедитесь, что стеклянная горка стерилизована несколько раз на пламени.
- Добавьте 30 мкл раствора химиоаттрактанта слева от стеклянного предметного стекла. Убедитесь, что бактерии культивировались до логарифмической стадии (2 x 108 КОЕ/мл) в среде LB. Добавьте 30 мкл бактериального раствора справа от стеклянной горки.
ПРИМЕЧАНИЕ: Подготовьте отрицательную контрольную группу с равным объемом стерильной воды. Солевой раствор (0,9% NaCI) использовали в качестве положительного контроля с целью устранения изменений, вызванных межмолекулярной силой в эксперименте. - Стерилизуйте инокуляционную петлю несколько раз на пламени. Используйте инокуляционную петлю для соединения водного раствора химиоаттрактанта с раствором бактерий и держите его при комнатной температуре в течение 20 минут на чистой скамье.
ПРИМЕЧАНИЕ: Эксперимент должен проводиться в безветренной среде. Отрегулируйте время перед отключением соединительной линии для деформаций различных спортивных способностей соответствующим образом. - Через 20 мин отсоедините соединительную линию фильтровальной бумагой.
- Убедитесь, что трубка центрифуги объемом 1,5 мл стерильна. Соберите водный раствор химиоаттрактанта слева от стеклянной горки. Переложите раствор в стерильную центрифужную трубку объемом 1,5 мл.
- Добавьте соответствующий объем сафранина в трубку центрифуги. Через 2 мин соберите смешиваемые жидкости для подсчета бактерий и микроскопического наблюдения с помощью камеры для подсчета крови.
5. Анализ результатов
- Определите количество привлеченных жизнеспособных микроорганизмов с помощью следующего уравнения:
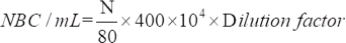
где NBC: Общее количество клеток бактерий; N: Количество бактерий в 80 сетках.
ПРИМЕЧАНИЕ: Для анализа данных использовалось программное обеспечение для статистического анализа. Ошибка была основана на трех различных реплицированных экспериментальных значениях и была рассчитана с использованием одностороннего ANOVA, за которым последовал пост-специальный анализ Турции. P ≤ 0,05 было сочтено значительным.
Результаты
Всего было обнаружено 584 и 937 известных метаболитов в положительных и отрицательных показателях ионов соответственно. Предыдущие исследования показали, что хемоаттрактанты обычно представляют собой органические кислоты, аминокислоты и углеводы17,18.
Обсуждение
Растущие исследования показывают, что взаимодействия растений и бактерий в основном происходят в ризосфере и находятся под влиянием корневых экссудатов20,21,22,23,24. Экссудаты корней растений включаю...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (No 31870493), Ключевыми научно-исследовательскими проектами в Хэйлунцзяне, Китай (GA21B007) и Сборами за фундаментальные исследования университетов в провинции Хэйлунцзян, Китай (No 135409103).
Материалы
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid | Beijing InnoChem Science & Technology C.,Ltd. | 490-79-9 | |
| Acetonitrile | CNW Technologies | 75-05-8 | |
| Ammonium acetate | CNW Technologies | 631-61-8 | |
| Caffeic acid | Beijing InnoChem Science & Technology C.,Ltd. | 331-39-5 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Fresco17 | |
| Citric acid | Beijing InnoChem Science & Technology C.,Ltd. | 77-92-9 | |
| Clean bench | Shanghai Boxun Industrial Co., Ltd. | BJ-CD | |
| Ferulic acid | Beijing InnoChem Science & Technology C.,Ltd. | 1135-24-6 | |
| Formic acid | CNW Technologies | 64-18-6 | |
| Fructose | Beijing InnoChem Science & Technology C.,Ltd. | 57-48-7 | |
| Galactose | Beijing InnoChem Science & Technology C.,Ltd. | 59-23-4 | |
| Glycine | Beijing InnoChem Science & Technology C.,Ltd. | 56-40-6 | |
| Grinding Mill | Shanghai Jingxin Industrial Development Co., Ltd. | JXFSTPRP-24 | |
| Histidine | Beijing InnoChem Science & Technology C.,Ltd. | 71-00-1 | |
| Internal standard: 2-Chloro-L-phenylalanine | Shanghai Hengbai Biotech C.,Ltd. | 103616-89-3 | |
| Leucine | Beijing InnoChem Science & Technology C.,Ltd. | 61-90-5 | |
| Malic acid | Beijing InnoChem Science & Technology C.,Ltd. | 6915-15-7 | |
| Mannose | Beijing InnoChem Science & Technology C.,Ltd. | 3458-28-4 | |
| Mass Spectrometer | Thermo Fisher Scientific | Q Exactive Focus | |
| Methanol | CNW Technologies | 67-56-1 | |
| Optical Microscope | Olympus | BX43 | |
| Phenylalanine | Beijing InnoChem Science & Technology C.,Ltd. | 63-91-2 | |
| Proline | Beijing InnoChem Science & Technology C.,Ltd. | 147-85-3 | |
| Scales | Sartorius | BSA124S-CW | |
| Serine | Beijing InnoChem Science & Technology C.,Ltd. | 56-45-1 | |
| Threonine | Beijing InnoChem Science & Technology C.,Ltd. | 72-19-5 | |
| UHPLC | Agilent | 1290 UHPLC | |
| Ultrasound Instrument | Shenzhen Leidebang Electronics Co., Ltd. | PS-60AL | |
| Valine | Beijing InnoChem Science & Technology C.,Ltd. | 7004-03-7 |
Ссылки
- Belas, R. Biofilms, flagella, and mechanosensing of surfaces by bacteria. Trends in Microbiology. 22 (9), 517-527 (2014).
- Haichar, Z., Santaella, C., Heulin, T., Achouak, W. Root exudates mediated interactions belowground. Soil Biology and Biochemistry. 77 (7), 69-80 (2014).
- Zhang, N., et al. Effects of different plant root exudates and their organic acid components on chemotaxis, biofilm formation and colonization by beneficial rhizosphere-associated bacterial strains. Plant and Soil. 374 (1-2), 689-700 (2014).
- Zhang, N., et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates. BMC Genomics. 16 (1), 685 (2015).
- Lui, Y., et al. Induced root-secreted D-galactose functions as a chemoattractant and enhances the biofilm formation of Bacillus velezensis SQR9 in an mcpa-dependent manner. Applied Microbiology and Biotechnology. 104 (17), 785-797 (2020).
- Vora, S. M., Joshi, P., Belwalkar, M., Archana, G. Root exudates influence chemotaxis and colonization of diverse plant growth-promoting rhizobacteria in the Cajanus cajan - Zea mays intercropping system. Rhizosphere. 18 (12), 100331 (2021).
- Sampedro, I., et al. Effects of halophyte root exudates and their components on chemotaxis, biofilm formation and colonization of the halophilic bacterium halomonas anticariensis FP35T. Microorganisms. 8 (4), 575 (2020).
- Liu, X. L., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. A dual role amino acid from sesbania rostrata seed exudates in the chemotaxis response of Azorhizobium caulinodans ORS571. Molecular Plant-Microbe Interactions. 32 (9), 1134-1147 (2019).
- Ling, N., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere. European Journal of Soil Biology. 47 (6), 374-379 (2011).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiology. 148 (3), 1547-1556 (2008).
- Shen, C., et al. Bacterial chemotaxis on Slipchip. Lab on a Chip. 14 (16), 3074-3080 (2014).
- Liu, H., et al. Bacillus pumilus LZP02 promotes rice root growth by improving carbohydrate metabolism and phenylpropanoid biosynthesis. Molecular Plant-Microbe Interactions. 33 (10), 1222-1231 (2020).
- Goswami, M., Deka, S. Isolation of a novel rhizobacteria having multiple plant growth promoting traits and antifungal activity against certain phytopathogens. Microbiological Research. 240, 126516 (2020).
- Kaiira, M., Chemining'Wa, G., Ayuke, F., Baguma, Y., Nganga, F. Profiles of compounds in root exudates of rice, cymbopogon, desmodium, mucuna and maize. Journal of Agricultural Sciences Belgrade. 64 (4), 399-412 (2019).
- Shi, Y., et al. Effect of rice root exudates and strain combination on biofilm formation of Paenibacillus polymyxa and Paenibacillus macerans. African Journal of Microbiology Research. 6 (13), 3343-3347 (2012).
- Lee, H. W., Ghimire, S. R., Shin, D. H., Lee, I. J., Kim, K. U. Allelopathic effect of the root exudates of K21, a potent allelopathic rice. Weed Biology and Management. 8 (2), 85-90 (2008).
- Belimov, A. A., et al. Rhizobacteria that produce auxins and contain 1-amino-cyclopropane-1-carboxylic acid deaminase decrease amino acid concentrations in the rhizosphere and improve growth and yield of well-watered and water-limited potato (Solanum tuberosum). Annals of Applied Biology. 167 (1), 11-25 (2015).
- Ankati, S., Podile, A. R. Metabolites in the root exudates of groundnut change during interaction with plant growth promoting rhizobacteria in a strain-specific manner. Journal of Plant Physiology. 243, 153057 (2019).
- Gordillo, F., Chavez, F., Jerez, C. A. Motility and chemotaxis of Pseudomonas sp. B4 towards polychlorobiphenyls and chlorobenzoates. FEMS Microbiology Ecology. 60 (2), 322-328 (2007).
- Bais, H. P., Weir, T. L., Perry, L. G., Gilroy, S., Vivanco, J. M. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology. 57, 233-266 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Badri, D. V., Weir, T. L., Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: plant-microbe interactions. Curr Opin Biotech. Current Opinion in Biotechnology. 20 (6), 642-650 (2009).
- Kamilova, F., Kravchenko, L. V., Shaposhnikov, A. I., Makarova, N., Lugtenberg, B. Effects of the tomato pathogen Fusarium oxysporum f. sp. radicis-lycopersici and of the biocontrol bacterium Pseudomonas fluorescens WCS365. Molecular Plant-Microbe Interactions. 19 (10), 1121-1126 (2006).
- Kamilova, F., et al. Organic acids, sugars, and L-tryptophane in exudates of vegetables growing on stonewool and their effects on activities of rhizosphere bacteria. Molecular Plant-Microbe Interactions. 19 (3), 250-256 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Hao, W. Y., Ren, L. X., Ran, W., Shen, Q. R. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp. Niveum. Plant and Soil. 336 (1-2), 485-497 (2010).
- Hao, Z. P., Wang, Q., Christie, P., Li, X. L. Allelopathic potential of watermelon tissues and root exudates. Scientia Horticulturae. 112 (3), 315-320 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены