A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير الفلوري الذاتي لتقييم التمثيل الغذائي الخلوي
In This Article
Summary
يصف هذا البروتوكول التصوير الفلوري وتحليل الإنزيمات المساعدة الأيضية الذاتية المنشأ، وانخفاض نيكوتيناميد الأدينين (الفوسفات) ثنائي النوكليوتيد (NAD(P)H)، وثنائي النوكليوتيد المؤكسد فلافين الأدينين (FAD). يوفر التصوير الفلوري الذاتي ل NAD (P) H و FAD طريقة خالية من الملصقات وغير مدمرة لتقييم التمثيل الغذائي الخلوي.
Abstract
الأيض الخلوي هو العملية التي تولد بها الخلايا الطاقة ، وتتميز العديد من الأمراض ، بما في ذلك السرطان ، بالتمثيل الغذائي غير الطبيعي. انخفاض نيكوتيناميد الأدينين (الفوسفات) ثنائي النوكليوتيد (NAD (P) H) و الفلافين المؤكسد الأدينين ثنائي النوكليوتيد (FAD) هي إنزيمات مساعدة للتفاعلات الأيضية. يظهر NAD (P) H و FAD تألقا ذاتيا ويمكن عزلهما طيفا عن طريق الإثارة والأطوال الموجية للانبعاثات. يمكن أن يوجد كل من الإنزيمات المساعدة ، NAD (P) H و FAD ، إما في تكوين حر أو مرتبط بالبروتين ، ولكل منهما عمر فلوري متميز - وهو الوقت الذي يبقى فيه الفلوروفور في حالة الحماس. يسمح التصوير الفلوري مدى الحياة (FLIM) بتحديد كمية كثافة التألق وعمر NAD (P) H و FAD لتحليل التمثيل الغذائي الخلوي بدون ملصقات. يمكن تحسين كثافة التألق والمجاهر مدى الحياة لتصوير NAD (P) H و FAD عن طريق اختيار الأطوال الموجية المناسبة للإثارة والانبعاثات. تتحقق الاضطرابات الأيضية بواسطة السيانيد من بروتوكولات التصوير الفلوري الذاتي للكشف عن التغيرات الأيضية داخل الخلايا. ستوضح هذه المقالة تقنية التصوير الفلوري الذاتي ل NAD (P) H و FAD لقياس التمثيل الغذائي الخلوي.
Introduction
الأيض هو العملية الخلوية لإنتاج الطاقة. يشمل التمثيل الغذائي الخلوي مسارات متعددة ، بما في ذلك تحلل السكر ، والفسفرة التأكسدية ، وتحلل الجلوتامين. تستخدم الخلايا السليمة هذه المسارات الأيضية لتوليد الطاقة من أجل الانتشار والوظيفة ، مثل إنتاج السيتوكينات بواسطة الخلايا المناعية. تتميز العديد من الأمراض، بما في ذلك الاضطرابات الأيضية والسرطان والتنكس العصبي، بتغيير التمثيل الغذائي الخلوي1. على سبيل المثال ، تحتوي بعض أنواع الخلايا السرطانية على معدلات مرتفعة من تحلل السكر ، حتى في وجود الأكسجين ، لتوليد جزيئات لتخليق الأحماض النووية والبروتينات والدهون2,3. هذه الظاهرة، المعروفة باسم تأثير واربورغ، هي السمة المميزة للعديد من أنواع السرطان، بما في ذلك سرطان الثدي وسرطان الرئة والأورام الأرومية الدبقية4. بسبب تغيرات التمثيل الغذائي الخلوي المرتبطة بتطور السرطان ، يمكن أن يكون التمثيل الغذائي الخلوي علامة حيوية بديلة للاستجابة للدواء5,6. علاوة على ذلك ، فإن فهم فعالية الدواء على المستوى الخلوي أمر بالغ الأهمية لأن عدم تجانس الخلايا يمكن أن يؤدي إلى استجابات دوائية مختلفة لدى الأفراد7,8.
تعد التقنيات التي تحدد التغيرات في التمثيل الغذائي الخلوي وتحدد كميتها ضرورية لدراسات السرطان والاستجابة للأدوية. تستخدم التحليلات الكيميائية والبروتينية لتقييم عملية التمثيل الغذائي للخلايا أو الأنسجة ولكنها تفتقر إلى دقة الخلية الواحدة والمعلومات المكانية. يمكن للمقايسات القائمة على قارئ لوحة الأيض قياس استهلاك الأس الهيدروجيني والأكسجين في العينة بمرور الوقت والاضطراب الأيضي اللاحق بواسطة المواد الكيميائية. يمكن استخدام الرقم الهيدروجيني لحساب معدل التحمض خارج الخلية (ECAR) ، والذي يوفر نظرة ثاقبة على النشاط المحلل للسكر للخلايا9. طرق التصوير لكامل الجسم ، بما في ذلك التصوير المقطعي بالإصدار البوزيتروني للفلورو-D-glucose 2-[fluorine-18] (FDG PET) والتحليل الطيفي بالرنين المغناطيسي (MRS) ، هي طرق تصوير غير جراحية تستخدم سريريا لتحديد تكرار الورم وفعالية الدواء من خلال القياسات الأيضية10،11،12،13،14.
يصور FDG-PET امتصاص الأنسجة من FDG ، وهو تناظري للجلوكوز المسمى إشعاعيا. زيادة امتصاص FDG-PET من قبل الأورام بالنسبة للأنسجة المحيطة يرجع إلى تأثير Warburg 12,13. صور MRS النوى الشائعة للجزيئات المستخدمة في التمثيل الغذائي ، مثل 13C و 31P ، ويمكنها الحصول على معلومات ديناميكية حول كيفية تغير التمثيل الغذائي استجابة للمحفزات ، مثل التمرين أو الأكل14. على الرغم من أنه يمكن استخدام FDG-PET و MRS سريريا ، إلا أن هذه التقنيات تفتقر إلى الدقة المكانية لحل عدم التجانس داخل الرحم. وبالمثل ، يتم إجراء قياسات استهلاك الأكسجين على مجموعة كبيرة من الخلايا. يتغلب التصوير الفلوري الذاتي على عقبة الدقة المكانية لهذه التقنيات ويوفر طريقة غير جراحية لقياس التمثيل الغذائي الخلوي.
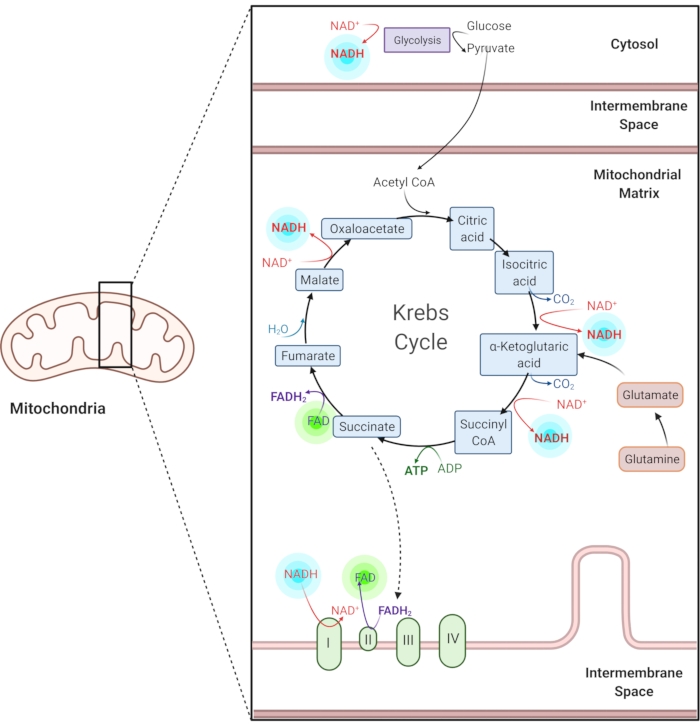
الشكل 1: NADH و FAD في المسارات الأيضية الشائعة. NADH و FAD هي إنزيمات مساعدة تستخدم في تحلل السكر ، ودورة كريبس ، وسلسلة نقل الإلكترون. يوفر التصوير الفلوري الذاتي لهذه الجزيئات معلومات حول التمثيل الغذائي الخلوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
انخفاض نيكوتيناميد الأدينين (الفوسفات) ثنائي النوكليوتيد (NAD (P) H) و flavin الأدينين ثنائي النوكليوتيد المؤكسد (FAD) هي إنزيمات مساعدة للتفاعلات الأيضية ، بما في ذلك تحلل السكر ، الفسفرة التأكسدية ، وانحلال الجلوتامينو (الشكل 1). كل من NAD (P) H و FAD هما من الفلورسنت الذاتي ويوفران تباينا داخليا للتصوير الفلوري 1,15. NADPH له خصائص فلورسنت مماثلة ل NADH. ولهذا السبب ، غالبا ما يستخدم NAD (P) H لتمثيل الإشارة المدمجة ل NADH و NADPH2,16.
يحدد التصوير الفلوري مدى الحياة (FLIM) عمر التألق أو الوقت الذي يكون فيه الفلوروفور في حالة الحماس. تستجيب الأعمار الفلورية للبيئة الدقيقة للفلوروفورات وتوفر معلومات حول التمثيل الغذائي الخلوي17. يمكن أن يوجد NAD (P) H و FAD داخل الخلايا إما في تشكيلات مرتبطة بالبروتين أو حرة ، ولكل منها عمر مختلف. NAD(P)H الحر له عمر أقصر من NAD(P)H المرتبط بالبروتين. على العكس من ذلك ، فإن FAD المجاني له عمر أطول من FAD18,19 المقيد. يمكن قياس أوزان مكونات العمر والعمر من بيانات الاضمحلال الفلوري مدى الحياة من خلال Eq. (1)20:
I(t) = α 1e-t/τ1 + α 2e-t/τ2 + C (1)
يمثل Eq (1) شدة التألق الطبيعية كدالة للوقت. يمثل α 1 و α 2 في هذه المعادلة المكونات المتناسبة للعمر القصير والطويل (α 1+ α 2 = 1) ، على التوالي ، τ1 و τ2 يمثلان العمر القصير والطويل ، على التوالي ، و C يمثل ضوء الخلفية7,20. يتم حساب العمر المرجح للسعة، والممثل هنا ك τm، باستخدام Eq. (2).
τm = α 1τ1+ α 2τ2 (2)
يمكن حساب متوسط العمر من خلال متوسط "t" على شدة اضمحلال الفلوروفور ، والذي يظهر للاضمحلال الأسي بواسطة Eq. (3) 17,21.
τ*m= (α 1τ12+ α 2τ22)/ (α 1τ1+ α 2τ2) (3)
يمكن حساب صورة شدة التألق من صورة العمر من خلال دمج اضمحلال التألق مدى الحياة. التصوير الفلوري الذاتي هو طريقة غير مدمرة وخالية من الملصقات يمكن استخدامها لتوصيف عملية التمثيل الغذائي للخلايا الحية بدقة دون الخلايا. توفر نسبة الأكسدة والاختزال البصرية مقياسا تناظريا بصريا لحالة الأكسدة والاختزال الكيميائي للخلية ويتم حسابها كنسبة كثافة NAD (P) H و FAD. على الرغم من أن صيغة حساب نسبة الأكسدة والاختزال البصرية ليست موحدة22،23،24،25 ، إلا أنها تعرف هنا بأنها شدة FAD على الشدة المشتركة ل NAD (P) H و FAD. يستخدم هذا التعريف لأن الكثافة المجمعة في المقام تطبيع المقياس بين 0 و 1 ، والنتيجة المتوقعة لتثبيط السيانيد هي انخفاض في نسبة الأكسدة والاختزال. توفر الأعمار الفلورية ل NAD (P) H و FAD الحر نظرة ثاقبة على التغيرات في البيئة الدقيقة للمذيبات الأيضية ، بما في ذلك درجة الحموضة ودرجة الحرارة والقرب من الأكسجين والأسمولية 17.
يمكن أن تشير التغيرات في عمر التألق للأجزاء المرتبطة من NAD (P) H و FAD إلى استخدام المسار الأيضي والتمثيل الغذائي الخاص بالركيزة26. يمكن تفسير أوزان المكونات للتغيرات في الجزء الحر إلى الجزء المرتبط من الإنزيمات المساعدة18,19. إجمالا، تسمح مقاييس عمر التألق الذاتي الكمي هذه بتحليل الأيض الخلوي، وقد تم استخدام التصوير الفلوري الذاتي لتحديد الأورام من الأنسجة الطبيعية27،28، وتوصيف الخلايا الجذعية29،30، وتقييم وظيفة الخلايا المناعية31،32،33،34،35، وقياس النشاط العصبي36، 37,38، وفهم فعالية الدواء في أنواع السرطان مثل سرطان الثدي وسرطان الرأس والرقبة21,39,40,41,42. يمكن الجمع بين التصوير الفلوري الذاتي عالي الدقة مع تجزئة الصور لتحليل الخلية الواحدة وتحديد كمية عدم التجانس داخل السكان43،44،45،46،47.
يمكن تصوير NAD (P) H و FAD على المجاهر الفلورية أحادية الفوتون أو متعددة الفوتونات التي تم تكوينها للتصوير المكثف أو مدى الحياة. بالنسبة للمجاهر أحادية الفوتون ، عادة ما يتم إثارة NAD (P) H و FAD بأطوال موجية تتراوح بين 375-405 نانومتر و 488 نانومتر ، على التوالي ، بسبب مصادر الليزر الشائعة عند هذه الأطوال الموجية 48. في الإثارة الفلورية ثنائية الفوتون ، سوف يثير NAD (P) H و FAD بأطوال موجية تتراوح من 700 إلى 750 نانومتر تقريبا و 700 إلى 900 نانومتر ، على التوالي 15,49. بمجرد إثارة الفلوروفورات ، ينبعث من NAD (P) H و FAD فوتونات بأطوال موجية تتراوح بين ~ 410 نانومتر إلى ~ 490 نانومتر و ~ 510 نانومتر إلى ~ 640 نانومتر ، على التوالي 15. يبلغ الطول الموجي الأقصى للانبعاثات NAD(P)H و FAD حوالي 450 نانومتر و 535 نانومتر على التوالي48.
بسبب اختلاف أطوال موجية الإثارة والانبعاثات ، يمكن عزل تألق الإنزيمين المساعدين الأيضيين طفيا. يعد فهم الخصائص الطيفية ل NAD (P) H و FAD ضروريا لتصميم وتحسين بروتوكولات التصوير بالموجات الفلورية الذاتية. السيانيد هو مثبط IV مركب لسلسلة نقل الإلكترون (ETC). تتميز آثار السيانيد على التمثيل الغذائي الخلوي وكثافة التألق الذاتي وعمر NAD (P) H و FAD داخل الخلايا بشكل جيد27,40. لذلك ، تعد تجربة اضطراب السيانيد وسيلة فعالة للتحقق من صحة بروتوكولات التصوير NAD (P) H و FAD. توفر تجربة السيانيد الناجحة الثقة في أنه يمكن استخدام بروتوكول التصوير NAD (P) H و FAD لتقييم عملية التمثيل الغذائي لمجموعات أو اضطرابات غير معروفة.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. طلاء الخلايا للتصوير
- استنشق الوسط من قارورة T-75 المتقاربة بنسبة 80-90٪ من خلايا MCF-7 ، واشطف الخلايا ب 10 مل من المياه المالحة المعقمة العازلة بالفوسفات (PBS) ، وأضف 2 مل من 0.25٪ من التربسين (1x) لفصل الخلايا عن قاع القارورة.
- احتضن القارورة عند 37 درجة مئوية لمدة 4 دقائق تقريبا. تحقق من الخلايا تحت المجهر لتأكيد الانفصال.
- أضف على الفور 8 مل من وسط الثقافة لإلغاء تنشيط التربسين.
- جمع الخلايا في أنبوب مخروطي (15 مل أو 50 مل). عد الخلايا باستخدام مقياس الدم.
- الطرد المركزي للخلايا 200 × غرام لمدة 5 دقائق.
- بمجرد الطرد المركزي ، استنشق السوبرناتان. أعد تعليق حبيبات الخلايا في 1 مل من وسط الاستزراع ، والبذور 4 × 105 خلية على طبق تصوير 35 مم من الزجاج السفلي (أو حامل العينة المناسب للمجهر المستخدم).
- أضف 2 مل من وسط المزرعة إلى طبق التصوير للحفاظ على استقلاب الخلايا.
- احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO2 لمدة 24-48 ساعة قبل التصوير للخلايا للالتصاق والوصول إلى مرحلة النمو اللوغاريتمية.
ملاحظة: تم تحديد مرحلة النمو من خلال الخبرة السابقة مع هذه الخلايا وتم تأكيدها باستخدام ورقة بيانات الخلية.
2. التصوير FLIM متعدد الفوتونات من NAD (P) H و FAD
- قم بتشغيل جميع مكونات المجهر الفلوري متعدد الفوتونات ، بما في ذلك المجهر ومصدر الليزر وأجهزة الكشف المستخدمة.
- موضع العينة
- قم بتشغيل مصباح brightfield. تأكد من أن الضوء يدخل إلى العين. اختر هدفا، عادة 20x أو 40x أو 100x لتصوير الخلايا. ضع 1 قطرة من وسط الغمر المناسب أعلى الهدف [تخطي إذا كنت تستخدم هدفا جويا].
- حرك الهدف لأسفل لوضع العينة بشكل صحيح دون لمس الهدف. ضع الطبق ذو القاع الزجاجي على حامل العينة على مرحلة المجهر. تأكد من أن العينة آمنة ولن تتحرك أثناء التصوير.
- قم بتوسيط العينة بهدف استخدام عنصر تحكم المرحلة X-Y. بمجرد الانتهاء من ذلك ، انظر إلى العدسة وحرك الهدف لأعلى للتركيز على الخلايا.
- إذا كان المجهر داخل حاوية ، فأغلق باب صندوق الإضاءة. افتح برنامج الحصول على الصور ، وانقر فوق علامة التبويب التصوير متعدد الفوتونات ، وقم بتعيين معلمات التصوير متعدد الفوتونات التالية: حجم الصورة = 256 × 256 بكسل ؛ بكسل يسكن الوقت = 4-25 ميكروثانية. إجمالي وقت الحصول على الصورة = ~ 60 ثانية ؛ كسب كاشف محسن لحساب الفوتون الواحد = 85٪ (خاص بالنظام المستخدم).
- تصوير وظيفة استجابة الأجهزة (IRF) ومعيار العمر الافتراضي للفلورسنت
- ضع بلورات اليوريا على طبق زجاجي القاع وقم بتأمين غطاء الطبق بشريط أو بارافيلم.
ملاحظة: تظل بلورات اليوريا مستقرة في درجة حرارة الغرفة لعدة أشهر. - صورة بلورات اليوريا.
- ضع طبق اليوريا على مسرح المجهر وركز على بلورة اليوريا.
- اضبط الطول الموجي ليزر الإثارة على 900 نانومتر.
- استخدم مرشح الانبعاثات الذي يلتقط أطوال موجية 450 نانومتر.
- احصل على صورة عمر فلوري لبلورة اليوريا مع طاقة ليزر عند العينة <1 ميجاوات واستخدم معلمات التصوير الموصى بها المذكورة في الخطوة 2.2.4.
- صور الخرز الأصفر والأخضر (YG) كمعيار عمر التألق.
- قم بإنشاء شريحة خرزة YG عن طريق تخفيف محلول حبة YG 1: 1000 في الماء المعقم. ضع حجما صغيرا (~ 30 ميكرولتر) على شريحة أو طبق من أسفل الزجاج. قم بتغطيتها بغطاء وأغلق حواف الغطاء بطلاء أظافر شفاف.
- ضع شريحة حبة YG على مرحلة المجهر مع جانب الغطاء من الشريحة نحو الهدف.
- اضبط الطول الموجي ليزر الإثارة على 890 نانومتر
- استخدم مرشح الانبعاثات الذي يلتقط ~ 500-600 نانومتر من الأطوال الموجية.
- احصل على صورة عمر فلوري لحبة YG باستخدام طاقة ليزر في العينة <1 ميجاوات ومعلمات الصورة الموصى بها [الخطوة 2.2.4].
- تحقق من عمر الخرزة باستخدام IRF من اليوريا. إذا لم يكن العمر الافتراضي ~ 2.1 ns، تحقق مما إذا كانت الخرزة على اتصال مع حبة أخرى تساهم في إخماد التألق، أو أن محلول الخرزة قد جف، أو أن الخرزة خارج نطاق التركيز، أو IRF غير دقيق، أو أن التحول بين IRF واضمحلال التألق غير محسن [انظر الخطوة 4.2.4].
ملاحظة: عمر ~ 2.1 نانو ثانية مستقر مع مرور الوقت.
- ضع بلورات اليوريا على طبق زجاجي القاع وقم بتأمين غطاء الطبق بشريط أو بارافيلم.
- NAD (P) H التصوير
- ضع الطبق ذو القاع الزجاجي مع الخلايا على مرحلة المجهر وركز على الخلايا.
ملاحظة: يوصى بوضع الخلايا في غرفة بيئية للحفاظ على مستويات الحرارة والرطوبة و CO2 أثناء اكتساب الصورة ، لأن هذه المعلمات يمكن أن تؤثر على التمثيل الغذائي الخلوي. - اضبط كسب الكاشف إلى القيمة المثلى ل FLIM. بالإضافة إلى ذلك ، قم بالتغيير إلى وقت الإقامة المطلوب - معلمة تشير إلى الوقت الذي يقضيه الليزر في كل بكسل من العينة.
ملاحظة: يجب أن تظل هذه المعلمات كما هي طوال الفترة المتبقية من الإجراء. وذلك لضمان الاتساق في إضاءة الليزر وإعدادات الكاشف لضمان صحة القياسات القائمة على الكثافة، والتي تعتمد على طاقة الليزر، ومعلمات المسح الضوئي، وكسب الكاشف. هناك مكاسب كاشف محسنة لتشغيل أجهزة الكشف في وضع عد الفوتون الواحد. القيمة هي 85٪ للنظام المشار إليه. - اضبط ليزر الفوتون المتعدد على 750 نانومتر. تأكد من ضبط التحكم في الطاقة لليزر عند الصفر في البداية حتى لا تتلف الخلايا عند فتح الغالق على الليزر.
ملاحظة: يوصى بالإثارة عند 750 نانومتر ل NAD(P)H ، على الرغم من أنه يحتوي على امتصاص واسع عند 700-750 نانومتر. يوصى بالإثارة عند 890 نانومتر ل FAD ، على الرغم من أنه يحتوي على امتصاص واسع عند 700-900 نانومتر. - قم بتعيين أو حدد مرشح انبعاثات لجمع الأطوال الموجية للانبعاثات عند ~ 400-500 نانومتر.
- ابدأ التصوير بطريقة التركيز البؤري أو العرض المباشر لتحسين إعدادات الصورة.
ملاحظة: الليزر يعمل الآن. لا تفتح حاوية المجهر في هذه المرحلة. ارتداء معدات الحماية الشخصية المناسبة. - قم بزيادة طاقة الليزر ببطء إلى ~ 3-8 ميجاوات في العينة مع ضمان تركيز الخلايا أيضا. بمجرد ضبطه ، سجل الحد الأقصى للطاقة المستخدمة. استخدم إعداد الطاقة هذا للتصوير على أجزاء أخرى من طبق بتري لتصوير NAD(P)H.
ملاحظة: من المهم قياس طاقة الليزر في العينة أو نافذة الالتقاط وعدم الاعتماد على جهد خلية pockels لأن خلايا pockels غير مستقرة. غالبا ما تتم مراقبة طاقة الليزر أثناء التصوير باستخدام نافذة التقاط بدلا من العينة. باستخدام مقياس طاقة ثان عند الهدف، يمكن استخدام العلاقة بين القدرة في نافذة الالتقاط والطاقة في العينة لتقدير القدرة التقريبية في العينة من قياسات نافذة الالتقاط. - اجمع صورة NAD(P)H FLIM مع وقت تكامل صورة يبلغ 60 ثانية.
- تحقق من أن الصورة تحتوي على فوتونات كافية (ذروة ~ 100 فوتون لبكسل السيتوبلازم) داخل منحنى الاضمحلال الفلوري مدى الحياة. إذا كان عدد الفوتونات منخفضا جدا ، فقم بزيادة طاقة الليزر أو مدة الحصول على الصورة.
ملاحظة: يعتمد الحد الأدنى لعدد الذروة للفوتونات داخل الاضمحلال الأسي الفلوري على معلمات النظام، بما في ذلك الدقة الزمنية وIRF وضوضاء الخلفية.
- ضع الطبق ذو القاع الزجاجي مع الخلايا على مرحلة المجهر وركز على الخلايا.
- تصوير بدعة
- اضبط ليزر الفوتون المتعدد على 890 نانومتر وانتظر حتى يتم قفله في وضع الطول الموجي الجديد. تأكد من ضبط التحكم في الطاقة لليزر عند الصفر في البداية حتى لا تتلف الخلايا عند فتح الغالق على الليزر.
ملاحظة: لا تحرك المرحلة أو التركيز الموضوعي عند إجراء هذه الخطوة. يجب أن يتطابق مجال رؤية FAD (FOV) مباشرة مع NAD(P)H FOV لهذه الصورة. - قم بتعيين أو تحديد مرشح انبعاثات لجمع الأطوال الموجية للانبعاثات عند ~ 500-600 نانومتر.
- ابدأ التصوير بطريقة التركيز البؤري أو العرض المباشر لتحسين إعدادات الصورة.
ملاحظة: الليزر يعمل الآن. لا تفتح حاوية المجهر في هذه المرحلة. - قم بزيادة طاقة الليزر ببطء إلى ~ 5-10 mW في العينة وسجل الحد الأقصى للطاقة المستخدمة. استخدم هذا كإعداد طاقة للتصوير على أجزاء أخرى من طبق بتري لتصوير FAD.
- اجمع صورة FAD FLIM مع وقت تكامل صورة يبلغ 60 ثانية.
- تحقق من أن الصورة تحتوي على فوتونات كافية (ذروة ~ 100 فوتون لبكسل السيتوبلازم) داخل منحنى الاضمحلال الفلوري مدى الحياة. إذا كان عدد الفوتونات منخفضا جدا ، فقم بزيادة طاقة الليزر أو مدة الحصول على الصورة.
ملاحظة: يعتمد الحد الأدنى لعدد الذروة للفوتونات داخل الاضمحلال الأسي الفلوري على معلمات النظام، بما في ذلك الدقة الزمنية وIRF وضوضاء الخلفية.
- اضبط ليزر الفوتون المتعدد على 890 نانومتر وانتظر حتى يتم قفله في وضع الطول الموجي الجديد. تأكد من ضبط التحكم في الطاقة لليزر عند الصفر في البداية حتى لا تتلف الخلايا عند فتح الغالق على الليزر.
- كرر الخطوات 2.4-2.5 عند أربعة إلى خمسة FOVs إضافية. تأكد من أن كل صورة متباعدة على الأقل 2 FOVs بعيدا عن المواقع المصورة.
3. إعداد تجربة السيانيد
- قم بإذابة 130.24 ملغ من سيانيد الصوديوم في 25 مل من PBS لصنع محلول سيانيد الصوديوم 80 mM (20x).
ملاحظة: السيانيد سام. ارتداء معدات الحماية الشخصية المناسبة. - استنشاق 100 ميكرولتر من وسط الثقافة من الطبق. استبدل هذا ب 100 ميكرولتر من محلول سيانيد الصوديوم للحصول على تركيز 4 mM من السيانيد في الطبق.
- ضع الخلايا في حاضنة لمدة 5 دقائق للسماح للخلايا بالتفاعل مع محلول السيانيد.
- كرر الخطوات 2.4-2.6 للحصول على صور NAD(P)H و FAD للخلايا بعد التعرض للسيانيد.
ملاحظة: التعرض لفترات طويلة للسيانيد سوف يقتل الخلايا. يتم الحصول على صور ما بعد السيانيد في غضون 30 دقيقة من إضافة السيانيد.
4. تحليل صورة FLIM
- افتح برنامج تحليل العمر الافتراضي FLIM.
- افتح صورة اليوريا للحصول على IRF المقاسة.
- استيراد صورة اليوريا. حدد نقطة على صورة بلورة اليوريا لاستخدامها في تحليل الصورة. قم بزيادة قيمة الحاوية المكانية لدمج بيانات FLIM من وحدات بكسل متعددة إلى 1 أو أعلى للحصول على ذروة اضمحلال > 100 فوتون عن طريق تغيير متغير سلة المهملات الموجود على واجهة البرنامج الرئيسية.
- احفظ البيانات كIRF.
- في البرنامج المشار إليه، انقر فوق القائمة المنسدلة بعنوان IRF، وحدد نسخ من بيانات الاضمحلال. بعد ذلك ، انقر فوق نسخ إلى الحافظة لاستخدامها في تحليل صورة الصورة التي تم التقاطها أثناء التجربة.
- تحليل الصور لصور NAD (P) H و FAD مدى الحياة
- استيراد ملف الصورة إلى برنامج تحليل العمر الفلوري.
- تحسين تصور الصورة لرؤية الخلايا والمقصورات تحت الخلوية عن طريق تغيير الشدة والتباين إذا لزم الأمر.
- انقر فوق القائمة المنسدلة خيارات وحدد كثافة. هنا ، قم بتغيير الكثافة والتباين حسب الرغبة وانقر فوق موافق.
- استيراد IRF من صورة اليوريا.
- انقر فوق القائمة المنسدلة IRF وحدد لصق من الحافظة.
- تعيين معلمات الاضمحلال متعدد الأس50.
- قم بتعيين قيمة عتبة لتقييم الاضمحلالات لبيكسلات السيتوبلازم.
ملاحظة: هنا، تم استخدام قيمة 50. تم اختيار القيمة من خلال مقارنة قيم ذروة التألق للعديد من بيكسلات الخلفية والنواة التمثيلية مع قيمة الذروة للعديد من بيكسلات السيتوبلازم. تم تحديد قيمة بين بيكسلات النواة وبيكسلات السيتوبلازم للعتبة.
- قم بتعيين قيمة عتبة لتقييم الاضمحلالات لبيكسلات السيتوبلازم.
- تحقق من أن قيمة Shift تقوم بمحاذاة IRF بالنسبة إلى الحافة الصاعدة للتألق. اضبط التحول إذا لزم الأمر على قيمة تقلل من قيمة Chi-squared.
- قم بزيادة الحاوية المكانية بحيث يكون لوحدات بكسل السيتوبلازم قيم ذروة التألق عند أو فوق 100.
ملاحظة: زيادة سلة المهملات المكانية ستؤدي إلى انخفاض الدقة المكانية. - حساب عمر التألق لجميع وحدات البكسل في الصورة.
- في البرنامج المشار إليه، انقر فوق القائمة المنسدلة حساب | مصفوفة الاضمحلال.
ملاحظة: يشار إلى النجاح بصورة ملونة بشكل خاطئ لعمر التألق المرجح بالسعة.
- في البرنامج المشار إليه، انقر فوق القائمة المنسدلة حساب | مصفوفة الاضمحلال.
- حفظ بيانات عمر التألق.
- انقر فوق القائمة المنسدلة ملف | التصدير. اختر المعلمات المطلوبة للتحليل وانقر فوق موافق. احفظ الصورة.
- حدد زر اللون من القائمة المنسدلة خيارات لضبط مقياس عمر التألق المعروض، وتكوين اللون إلى B-G-R، واضبط القيم الدنيا والقصوى لشريط الألوان المحدد لضبط مقياس اللون لصورة عمر التألق.
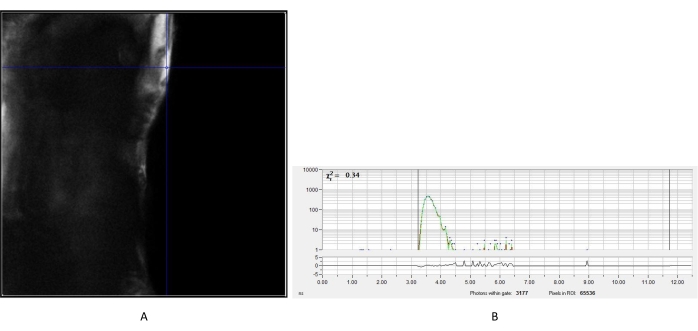
الشكل 2: قياس IRF من بلورة اليوريا. (أ) صورة الكثافة التي تم الحصول عليها من اليوريا. تم اختيار بكسل تمثيلي لإنشاء منحنى اضمحلال IRF (B) للتحليل اللاحق لصور عمر التألق للخلايا. اختصار: IRF = وظيفة استجابة الأداة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تجزئة الخلايا
ملاحظة: يستخدم البروتوكول الموضح هنا برنامج تحليل صور51. يتم توفير صور MCF-7 التمثيلية ورمز تحليل البيانات52.- تنزيل ملف MCF7_Segmentation_Final.cpproj52.
- قم باستيراد خط أنابيب MCF7_Segmentation بالنقر فوق ملف | | الاستيراد خط أنابيب من ملف، حدد الملف MCF7_Segmentation_Final.cpproj.
- انقر فوق وحدة الصور وأضف صور كثافة NAD(P)H المراد تقسيمها.
ملاحظة: يجب أن تكون الصور بتنسيق .tif أو .png أو .jpg. - اضغط على زر تحليل الصور في أسفل اليمين.
ملاحظة: قد يحتاج خط الأنابيب إلى تحسين الصور التي يتم الحصول عليها على أنظمة مختلفة. لاستكشاف الأخطاء وإصلاحها، جرب الخطوات الفرعية التالية- استخدام وضع الاختبار لاختبار معلمات مختلفة: انقر فوق بدء وضع الاختبار وقم بتشغيل كل وحدة نمطية بالنقر فوق زر التشغيل بجوار اسم الوحدة النمطية.
- انقر فوق الوحدة النمطية الأولى IdentifyPrimaryObjects واضبط القطر النموذجي للكائنات، بوحدات البكسل (الحد الأدنى، الحد الأقصى) لمطابقة قطر الخلايا.
ملاحظة: بالنسبة لخلايا MCF-7، تم استخدام 10 و40 بكسل للحد الأدنى والحد الأقصى، على التوالي. - انقر فوق الوحدة النمطية EnhanceOrSuppressFeatures واضبط حجم الميزة لتحسين تعريف نوع الميزة المحدد.
ملاحظة: تم استخدام حجم ميزة 10 بكسل لخلايا MCF-7. - انقر فوق الوحدة النمطية الثانية EnhanceOrSuppressFeatures واضبط نطاق أحجام الثقوب لتحسين تحسين المناطق النووية.
ملاحظة: تم استخدام نطاق من 5-20 لخلايا MCF-7. - انقر فوق الوحدة النمطية الثانية IdentifyPrimaryObjects واضبط المعلمات (استراتيجية العتبة، وطريقة العتبة، ومقياس تجانس العتبة، وعامل تصحيح العتبة) لتحسين تحديد النوى. انقر فوق ? حسب كل معلمة لتحديد الإعدادات المثلى وتطبيقها على وحدة IdentifySecondaryObjects.
- انقر فوق الوحدة النمطية FilterObjects واضبط شكل المنطقة. حدد الحد الأدنى والحد الأقصى للبيكسل لشكل المساحة المراد تحديده.
ملاحظة: بالنسبة لخلايا MCF-7 ، تم استخدام 100 و 500 للحد الأقصى والحد الأدنى ، على التوالي. يتم شرح عملية تجزئة الخلية من خلال تحديد النواة والانتشار إلى حدود الخلية بالتفصيل من قبل والش و Skala47.
- باستخدام أقنعة السيتوبلازم الخلوية ، متوسط متغيرات إخراج عمر التألق لكل خلية داخل الصورة.

الشكل 3: تحديد وتجزئة الخلايا الفردية. صورة كثافة NAD(P)H لخلايا MCF7 (A) التي تم الحصول عليها من خلال دمج صورة عمر التألق. تم تصوير الخلايا باستخدام إثارة 750 نانومتر عند 5 ميجاوات لمدة 60 ثانية. يمثل المحوران x وy موقع البكسل للصورة. (أ) تم تحديد الخلايا الفردية. تم إخفاء الخلايا (B) للقضاء على أي ضوضاء في الخلفية من مجموعة البيانات. ثم تم تحديد النواة (C) وإسقاطها على قناع الخلية (D). ثم تمت تصفية الخلايا (E) لإزالة المناطق المقنعة التي لا تتناسب مع حجم الخلايا النموذجية. شريط المقياس = 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. طريقة بديلة: التصوير شدة التألق
- قم بتشغيل المعدات التي سيتم استخدامها أثناء التجربة.
ملاحظة: يمكن الحصول على صور شدة التألق باستخدام المجاهر الفلورية واسعة المجال أو المجاهر الفلورية البؤرية أو المجاهر متعددة الفوتونات.- تأكد من أن المجهر المراد استخدامه يحتوي على مصدر إثارة مناسب ل NAD (P) H (الطول الموجي أحادي الفوتون ~ 370-405 نانومتر: الطول الموجي ثنائي الفوتون ~ 700-750 نانومتر) و FAD (الطول الموجي أحادي الفوتون ~ 488 نانومتر ، الطول الموجي ثنائي الفوتون ~ 890 نانومتر).
- تأكد من أن المجهر يحتوي على مرشح لعزل انبعاث NAD (P) H (~ 400-500 نانومتر).
ملاحظة: غالبا ما تعمل إعدادات 4',6-Diamidino-2-phenylindole (DAPI) مع NAD(P)H. - تأكد من أن المجهر يحتوي على مرشح لعزل انبعاثات FAD (~ 500-600 نانومتر).
ملاحظة: غالبا ما تعمل إعدادات بروتين الفلورسنت الأخضر (GFP) مع FAD.
- تحضير المجهر.
- قم بتشغيل مصباح brightfield. تأكد من أن الضوء يدخل إلى العين. ضع 1 قطرة من وسط الغمر المناسب فوق الهدف المقابل إذا لزم الأمر.
- حرك الهدف لأسفل لوضع العينات بشكل صحيح دون أي تدخل. ضع طبق بتري على المسرح بشكل صحيح. تأكد من أن العينة آمنة ولن تتحرك أثناء التصوير.
ملاحظة: يوصى بوضع الخلايا في غرفة بيئية للحفاظ على مستويات الحرارة والرطوبة و CO2 أثناء اكتساب الصورة ، لأن هذه المعلمات يمكن أن تؤثر على التمثيل الغذائي الخلوي. - توسيط العينة مع الهدف. بمجرد الانتهاء من ذلك ، انظر إلى العدسة وحرك الهدف حتى تبدو الخلايا في بؤرة التركيز.
- ابدأ التصوير بكثافة.
- افتح برنامج التصوير واضبط تكوين الإثارة والانبعاثات لالتقاط NAD (P) H بالنقر فوق علامة التبويب التقاط في برنامج الحصول على الصور ووضع مرشح الإثارة والانبعاثات NAD (P) H في برج المجهر.
ملاحظة: تم استخدام مرشح إثارة 357/44 ، و 409 ثنائي كروم طويل ، ومرشح انبعاثات 447/60 لتصوير NAD (P) H. - تحسين إضاءة الإثارة ومعلمات الكاشف. إذا كان التبييض يمثل مشكلة، فقم بتقليل شدة الإضاءة وزيادة وقت تكامل الصورة.
ملاحظة: NAD (P) H هي إشارة ضعيفة. كن على دراية بالتبييض إذا تم استخدام الكثير من الطاقة. - احصل على صورة NAD(P)H بحجم الصورة المطلوب. تأكد من حفظ الصورة.
- اضبط تكوين الإثارة والانبعاثات لالتقاط FAD. تحسين إضاءة الإثارة ومعلمات الكاشف.
ملاحظة: تم استخدام مرشح الإثارة 458/64 ، و 495 ثنائي اللون طويل الممر ، ومرشح الانبعاثات 550/88 لتصوير FAD. - احصل على صورة FAD. تأكد من حفظ الصورة.
ملاحظة: يجب أن تظل معلمات الحصول على صورة NAD (P) H و FAD (شدة الإضاءة وحجم الصورة وكسب الكاشف) كما هي طوال تجربة التصوير. - كرر العملية في خمسة مواقع إضافية ، متباعدة على الأقل 2 FOVs بعيدا عن المواقع المصورة.
- افتح برنامج التصوير واضبط تكوين الإثارة والانبعاثات لالتقاط NAD (P) H بالنقر فوق علامة التبويب التقاط في برنامج الحصول على الصور ووضع مرشح الإثارة والانبعاثات NAD (P) H في برج المجهر.
- تحليل بيانات نسبة الأكسدة والاختزال على مستوى الصورة
- افتح صور كثافة NAD(P)H وFAD في برنامج معالجة الصور.
- اضبط عتبة على NAD(P)H للاحتفاظ ببكسل السيتوبلازم وتعيين بيكسلات الخلفية والنواة إلى 0.
- احسب صورة نسبة الأكسدة والاختزال عن طريق تقييم المعادلة FAD/(NAD(P)H+FAD) عند كل بكسل باستخدام صورة NAD(P)H المتدرجة.
- احسب القيمة المتوسطة للبكسل غير 0.
ملاحظة: يمكن تنفيذ هذه الخطوات في برنامج تحليل الصور أو ترميزها مباشرة باستخدام البرامج النصية.
- تحليل نسبة الأكسدة والاختزال على مستوى الخلية
- اتبع الخطوات 4.3.1-4.3.5 للحصول على صورة قناع للخلايا داخل كل صورة NAD(P)H.
- احسب صورة نسبة الأكسدة والاختزال عن طريق تقييم المعادلة FAD/(NAD(P)H+FAD) عند كل بكسل.
- باستخدام قناع سيتوبلازم الخلية، متوسط نسبة الأكسدة والاختزال لجميع وحدات البكسل لكل خلية داخل الصورة.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم استزراع خط خلايا سرطان الثدي الظهاري ، MCF-7 ، في DMEM مع استكمال 10 ٪ مصل البقر الجنيني (FBS) و 1 ٪ البنسلين الستربتومايسين. بالنسبة للتصوير الفلوري ، تم زرع الخلايا بكثافة 4 × 105 خلية لكل طبق تصوير 35 مم من الزجاج السفلي قبل 48 ساعة من التصوير. تم تصوير الخلايا قبل وبعد العلاج بالسيانيد باستخ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
تم استخدام كثافة التألق الذاتي والتصوير مدى الحياة على نطاق واسع لتقييم التمثيل الغذائي في الخلايا21,55. FLIM عالي الدقة وبالتالي يحل الخلايا المفردة ، وهو أمر مهم لدراسات السرطان لأن عدم التجانس الخلوي يساهم في عدوان الورم ومقاومة الأدوية7,39,41,44,45,46,58.
Access restricted. Please log in or start a trial to view this content.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تشمل مصادر التمويل معهد الوقاية من السرطان وأبحاثه في تكساس (CPRIT RP200668) وجامعة تكساس إيه آند إم. تم إنشاء الشكل 1 مع BioRender.com.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 2-deoxy-d-glucose (2-DG) | Sigma | AC111980000; AC111980010; AC111980050; AC111980250 | |
| Antibiotic Antimicrobial (pen-strep) | Gibco | 15240096 | |
| Cell Samples | American Type Culture Collection | N/A | MCF-7 cancer line |
| CellProfiler | Broad Institute | N/A | Image analysis software |
| Conical Tube | VWR | 89039-664 | 15 mL conical tube |
| DMEM | ThermoFisher | 11965092 | Culture media |
| FAD dichroic mirror | Semrock | FF495-Di03-25x36 | 495 nm |
| FAD emission filter | Semrock | FF01-550/88-25 | 550/88 nm |
| FAD excitation filter | Semrock | FF01-458/64-25 | 458/64 nm |
| FBS | ThermoFisher | 16000036 | |
| Fluorescence Lifetime Microscope | 3i | N/A | |
| Glass bottom dish | MatTek Corp | P35G-1.0-14-C | |
| Multiphoton Laser | Coherent | N/A | 2P Coherent Laser, Tunable 680 nm-1080 nm |
| NAD(P)H dichroic mirror | Semrock | FF409-Di03-25x36 | 409 nm |
| NAD(P)H emission filter | Semrock | FF02-447/60-25 | 447/60 nm |
| NAD(P)H excitation filter | Semrock | FF01-357/44-25 | 357/44 nm |
| PBS | ThermoFisher | 70011044 | |
| Potassium Cyanide | Sigma-Aldrich | 380970 | |
| SlideBooks 6 | 3i | N/A | Image acquisition software |
| SPCImage | Becker & Hickl GmbH | N/A | Fluorescence lifetime analysis software |
| Stage Top Incubator | okoLab | N/A | |
| Trypsin | Biosciences | 786-262 | |
| Urea | Sigma-Aldrich | U5128 | |
| YG beads | Polysciences | 19096-2 | Yg microspheres (20.0 µm) |
References
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomarkers in Medicine. 4 (2), 241-263 (2010).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Zheng, J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation (Review). Oncology Letters. 4 (6), 1151-1157 (2012).
- Potter, M., Newport, E., Morten, K. J. The Warburg effect: 80 years on. Biochemical Society Transactions. 44 (5), 1499-1505 (2016).
- Zhao, Y., Butler, E. B., Tan, M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death and Disease. 4 (3), 532(2013).
- Patel, S., Ahmed, S. Emerging field of metabolomics: Big promise for cancer biomarker identification and drug discovery. Journal of Pharmaceutical and Biomedical Analysis. 107, 63-74 (2015).
- Walsh, A. J., Cook, R. S., Skala, M. C. Functional optical imaging of primary human tumor organoids: Development of a personalized drug screen. Journal of Nuclear Medicine. 58 (9), 1367-1372 (2017).
- Zaal, E. A., Berkers, C. R. The influence of metabolism on drug response in cancer. Frontiers in Oncology. 8, 500(2018).
- Little, A. C., et al. High-content fluorescence imaging with the metabolic flux assay reveals insights into mitochondrial properties and functions. Communications Biology. 3 (1), 271(2020).
- Wang, X., et al. Comparison of magnetic resonance spectroscopy and positron emission tomography in detection of tumor recurrence in posttreatment of glioma: A diagnostic meta-analysis. Asia-Pacific Journal of Clinical Oncology. 11 (2), 97-105 (2015).
- Nabi, H. A., Zubeldia, J. M. Clinical applications of 18F-FDG in oncology. Journal of Nuclear Medicine Technology. 30 (1), 3-9 (2002).
- Kostakoglu, L., Agress, H., Goldsmith, S. J. Clinical role of FDG PET in evaluation of cancer patients. Radiographics. 23 (2), 315-340 (2003).
- Hoh, C. K. Clinical use of FDG PET. Nuclear Medicine and Biology. 34 (7), 737-742 (2007).
- van de Weijer, T., Schrauwen-Hinderling, V. B. Application of magnetic resonance spectroscopy in metabolic research. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1865 (4), 741-748 (2019).
- Huang, S., Heikal, A. A., Webb, W. W. Two-photon fluorescence spectroscopy and microscopy of NAD(P)H and Flavoprotein. Biophysical Journal. 82, 2811-2825 (2002).
- Lagarto, J. L., et al. Characterization of NAD(P)H and FAD autofluorescence signatures in a Langendorff isolated-perfused rat heart model. Biomedical Optics Express. 9 (10), 4961-4978 (2018).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. , Springer. Boston, MA. (2013).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proceedings of the National Academy of the Sciences of the United States of America. 89 (4), 1271-1275 (1992).
- Nakashima, N., Yoshihara, K., Tanaka, F., Yagi, K. Picosecond fluorescence lifetime of the coenzyme of D-amino acid oxidase. Journal of Biological Chemistry. 255 (11), 5261-5263 (1980).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomedical Optics Express. 11 (10), 5674-5688 (2020).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (7), 1-43 (2020).
- Liu, Z., et al. Mapping metabolic changes by noninvasive, multiparametric, high-resolution imaging using endogenous contrast. Science Advances. 4 (3), (2018).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Cancer Research. 74 (11), 3067-3075 (2014).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. Journal of Biological Chemistry. 254 (11), 4764-4771 (1979).
- Sharick, J. T., et al. Protein-bound NAD(P)H lifetime is sensitive to multiple fates of glucose carbon. Scientific Reports. 8 (1), 5456(2018).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19494-19499 (2007).
- Skala, M. C., et al. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. Journal of Biomedical Optics. 12 (2), 024014(2007).
- Uchugonova, A. A., König, K. Two-photon autofluorescence and second-harmonic imaging of adult stem cells. Journal of Biomedical Optics. 13 (5), 054068(2008).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nature Methods. 11 (11), 1161-1169 (2014).
- Walsh, A. J., et al. Classification of T-cell activation via autofluorescence lifetime imaging. Nature Biomedical Engineering. 5 (1), 77-88 (2021).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Cancer Research. 80 (23), 5408-5423 (2020).
- Pavillon, N., Hobro, A. J., Akira, S., Smith, N. I. Noninvasive detection of macrophage activation with single-cell resolution through machine learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 2676-2685 (2018).
- Chang, C. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- Kaech, S. M., Cui, W. Transcriptional control of effector and memory CD8+ T cell differentiation. Nature Reviews. Immunology. 12 (11), 749-761 (2012).
- Gómez, C. A., Fu, B., Sakadžić, S., Yaseena, M. A. Cerebral metabolism in a mouse model of Alzheimer's disease characterized by two-photon fluorescence lifetime microscopy of intrinsic NADH. Neurophotonics. 5 (4), 045008(2018).
- Yaseen, M. A., et al. In vivo imaging of cerebral energy metabolism with two-photon fluorescence lifetime microscopy of NADH. Biomedical Optics Express. 4 (2), 307-321 (2013).
- Bower, A. J., et al. High-speed label-free two-photon fluorescence microscopy of metabolic transients during neuronal activity. Applied Physics Letters. 118 (8), 081104(2021).
- Walsh, A. J., et al. Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer. Cancer Research. 74 (18), 5184-5194 (2014).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Cancer Research. 73 (20), 6164-6174 (2013).
- Chowdary, M. V. P., et al. Autofluorescence of breast tissues: Evaluation of discriminating algorithms for diagnosis of normal, benign, and malignant conditions. Photomedicine and Laser Surgery. 27 (2), 241-252 (2009).
- Demos, S. G., Bold, R., White, R. D., Ramsamooj, R. Investigation of near-infrared autofluorescence imaging for the detection of breast cancer. IEEE Journal of Selected Topics in Quantum Electronics. 11 (4), 791-798 (2005).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Cancer Research. 80 (23), 5408-5423 (2020).
- Sharick, J. T., et al. Cellular metabolic heterogeneity in vivo is recapitulated in tumor organoids. Neoplasia. 21 (6), 615-626 (2019).
- Shah, A. T., Diggins, K. E., Walsh, A. J., Irish, J. M., Skala, M. C. In vivo autofluorescence imaging of tumor heterogeneity in response to treatment. Neoplasia. 17 (12), 862-870 (2015).
- Walsh, A. J., Skala, M. C. Optical metabolic imaging quantifies heterogeneous cell populations. Biomedical Optics Express. 6 (2), 559-573 (2015).
- Walsh, A. J., Skala, M. C. An automated image processing routine for segmentation of cell cytoplasms in high-resolution autofluorescence images. Multiphoton Microscopy in the Biomedical Sciences XIV. , (2014).
- Skala, M., Ramanujam, N. Methods in Molecular Biology. 594, 155-162 (2010).
- Stringari, C., et al. Multicolor two-photon imaging of endogenous fluorophores in living tissues by wavelength mixing. Scientific Reports. 7, 3792(2017).
- SPCImage 2.9: Data analysis software for fluorescence lifetime imaging microscopy. SPCImage. , Available from: https://biology.uiowa.edu/sites/biology.uiowa.edu/files/SPCIMAGE29.pdf (2007).
- CellProfiler. , Available from: https://cellprofiler.org/releases (2007).
- Autofluorescence Imaging. GitHub. , Available from: https://github.com/walshlab/Autofluorescence-Imaging (2021).
- Ramey, N. A., Park, C. Y., Gehlbach, P. L., Chuck, R. S. Imaging mitochondria in living corneal endothelial cells using autofluorescence microscopy. Photochemistry and Photobiology. 83 (6), 1325-1329 (2007).
- Walsh, A., Cook, R. S., Rexer, B., Arteaga, C. L., Skala, M. C. Optical imaging of metabolism in HER2 overexpressing breast cancer cells. Biomedical Optics Express. 3 (1), 75-85 (2012).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxidants & Redox Signaling. 30, 875-889 (2019).
- Bird, D. K., et al. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of the coenzyme NADH. Cancer Research. 65, 8766-8773 (2005).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Cancer Research. 73 (20), 6164-6174 (2013).
- Walsh, A. J., Castellanos, J. A., Nagathihalli, N. S., Merchant, N. B., Skala, M. C. Optical imaging of drug-induced metabolism changes in murine and human pancreatic cancer organoids reveals heterogeneous drug response. Pancreas. 45 (6), 863-869 (2016).
- Gubser, P. M., et al. Rapid effector function of memory CD8+ T cells requires an immediate-early glycolytic switch. Nature Immunology. 14 (10), 1064-1072 (2013).
- Papalexi, E., Satija, R. Single-cell RNA sequencing to explore immune cell heterogeneity. Nature Review. Immunology. 18 (1), 35-45 (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. The Journals of Gerontology: Series A. 67 (10), 1022-1035 (2012).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-protocol. 8 (10), 2850(2018).
- Becker, W. The bh TCSPC Handbook. , Available from: https://www.becker-hickl.com/wp-content/uploads/2021/10/SPC-handbook-9ed-05a.pdf (2021).
- Gadella, T. W. J. Fluorescent and Luminescent Probes for Biological Activity. Mason, W. T. 34, Ch. 34 467-479 (1999).
- Miller, D. R., Jarrett, J. W., Hassan, A. M., Dunna, A. K. Deep tissue iImaging with multiphoton fluorescence microscopy. Current Opinion in Biomedical Engineering. 4, 32-39 (2017).
- Berezin, M. Y., Achilefu, S. Fluorescence lifetime measurements and biological imaging. Chemical Reviews. 110 (5), 2641-2684 (2010).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved