JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포 대사를 평가하기 위한 자가형광 이미징
요약
이 프로토콜은 내인성 대사 조효소, 환원된 니코틴아미드 아데닌(인산염) 디뉴클레오타이드(NAD(P)H) 및 산화된 플라빈 아데닌 디뉴클레오타이드(FAD)의 형광 이미징 및 분석을 기술한다. NAD(P)H 및 FAD의 자가형광 이미징은 세포 대사를 평가하기 위한 라벨이 없는 비파괴적인 방법을 제공한다.
초록
세포 대사는 세포가 에너지를 생성하는 과정이며, 암을 포함한 많은 질병은 비정상적인 신진 대사를 특징으로합니다. 환원된 니코틴아미드 아데닌(포스페이트) 디뉴클레오타이드(NAD(P)H) 및 산화된 플라빈 아데닌 디뉴클레오타이드(FAD)는 대사 반응의 조효소이다. NAD(P)H 및 FAD는 자가형광을 나타내며 여기 및 방출 파장에 의해 분광적으로 분리될 수 있다. 조효소인 NAD(P)H 및 FAD는 모두 유리 또는 단백질 결합 구성으로 존재할 수 있으며, 이들 각각은 형광단이 여기된 상태로 유지되는 시간인 뚜렷한 형광 수명을 갖는다. 형광 수명 이미징 (FLIM)은 세포 대사의 라벨없는 분석을 위해 NAD (P) H 및 FAD의 형광 강도와 수명을 정량화 할 수 있습니다. 형광 강도 및 수명 현미경은 적절한 여기 및 방출 파장을 선택하여 NAD(P)H 및 FAD 이미징에 최적화할 수 있습니다. 시안화물에 의한 대사 교란은 세포 내의 대사 변화를 검출하기 위해 자기 형광 이미징 프로토콜을 검증합니다. 이 기사에서는 세포 신진 대사를 측정하기위한 NAD (P) H 및 FAD의 자기 형광 이미징 기술을 시연합니다.
서문
신진 대사는 에너지를 생산하는 세포 과정입니다. 세포 대사는 글리코 분해, 산화 인산화 및 글루타미노분해를 포함한 여러 경로를 포함합니다. 건강한 세포는 면역 세포에 의한 사이토카인의 생산과 같은 증식 및 기능을위한 에너지를 생성하기 위해 이러한 대사 경로를 사용합니다. 대사 장애, 암 및 신경 변성을 포함한 많은 질병은 변경된 세포 대사를 특징으로합니다1. 예를 들어, 일부 암 세포 유형은 산소의 존재 하에서도 핵산, 단백질 및 지질의 합성을 위한 분자를 생성하기 위해 상승된 당분해 속도를 갖는다2,3. 바르부르크 효과로 알려진 이 현상은 유방암, 폐암, 교모세포종4을 포함한 많은 암 유형의 특징이다. 암 진행과 관련된 세포 대사의 변화로 인해, 세포 대사는 약물 반응에 대한 대리 바이오마커가 될 수 있다5,6. 더욱이, 세포 수준에서 약물 효능을 이해하는 것은 세포 이질성이 개인에서 상이한 약물 반응을 초래할 수 있기 때문에 중요하다7,8.
세포 신진 대사의 변화를 확인하고 정량화하는 기술은 암 및 약물 반응 연구에 필수적입니다. 화학 및 단백질 분석은 세포 또는 조직의 신진 대사를 평가하는 데 사용되지만 단일 세포 해상도 및 공간 정보가 부족합니다. 대사 플레이트 리더 기반 분석은 시간에 따른 샘플의 pH 및 산소 소비와 화학 물질에 의한 후속 대사 교란을 측정 할 수 있습니다. pH는 세포외 산성화 속도(ECAR)를 계산하는데 사용될 수 있으며, 이는 세포의 글리콜 활성에 대한 통찰력을 제공한다9. 2-[불소-18] 플루오로-D-글루코스 양전자 방출 단층 촬영 (FDG PET) 및 자기 공명 분광법 (MRS)을 포함한 전신 영상 방법은 대사 측정을 통해 종양 재발 및 약물 효능을 확인하기 위해 임상적으로 사용되는 비침습적 영상 방식입니다10,11,12,13,14.
FDG-PET는 방사성 표지된 글루코스 유사체인 FDG의 조직 흡수를 이미지화한다. 주변 조직에 비해 종양에 의한 FDG-PET의 흡수 증가는 바르부르크 효과12,13에 기인한다. MRS 이미지는 13C 및 31P와 같은 신진 대사에 사용되는 분자의 일반적인 핵을 이미지화하고 운동이나 식사와 같은 자극에 반응하여 신진 대사가 어떻게 변하는지에 대한 동적 정보를 얻을 수 있습니다14. FDG-PET 및 MRS가 임상적으로 사용될 수 있지만, 이들 기술은 종양내 이질성을 해결하기 위한 공간 분해능이 부족하다. 마찬가지로, 산소 소비량 측정은 세포의 벌크 집단에 대해 이루어진다. 자가 형광 이미징은 이러한 기술의 공간 분해능 장애물을 극복하고 세포 대사를 정량화하는 비침습적 방법을 제공합니다.
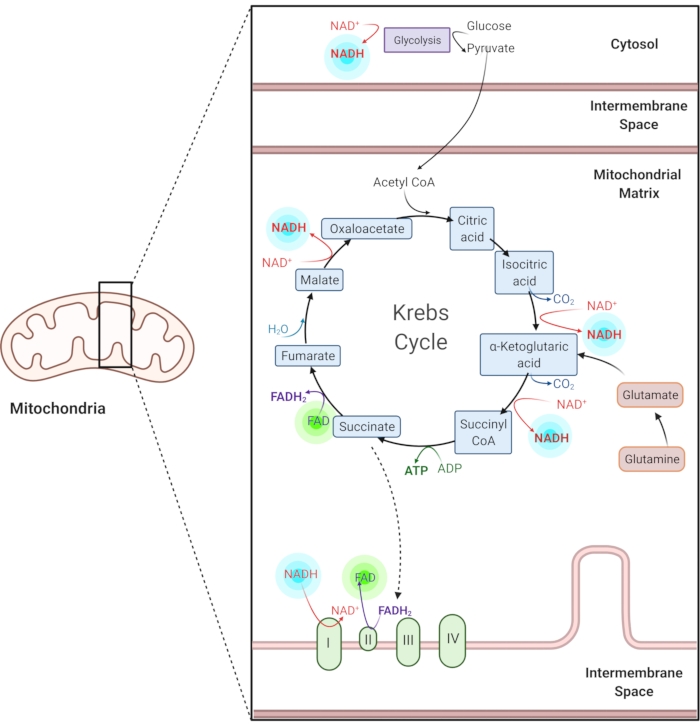
도 1: 일반적인 대사 경로에서의 NADH 및 FAD. NADH 및 FAD는 당분해, 크렙스 사이클 및 전자 수송 사슬에 사용되는 조효소이다. 이들 분자의 자가형광 이미징은 세포 대사에 대한 정보를 제공한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
환원된 니코틴아미드 아데닌(phosphate) 디뉴클레오타이드(NAD(P)H) 및 산화된 플라빈 아데닌 디뉴클레오타이드(FAD)는 당분해, 산화적 인산화 및 글루타미노분해를 포함하는 대사 반응의 조효소이다(도 1). NAD(P)H 및 FAD는 모두 자기형광성이며 형광 영상1,15에 내인성 대비를 제공합니다. NADPH는 NADH와 유사한 형광 특성을 갖는다. 이 때문에 NAD(P)H는 NADH와 NADPH2,16의 결합 신호를 나타내는 데 자주 사용됩니다.
형광 수명 이미징 (FLIM)은 형광 수명 또는 형광단이 여기된 상태에 있는 시간을 정량화합니다. 형광 수명은 형광단의 미세 환경에 반응하고 세포 대사에 대한 정보를 제공합니다17. NAD(P)H 및 FAD는 단백질 결합 또는 자유 형태에서 세포 내에 존재할 수 있으며, 이들 각각은 상이한 수명을 갖는다. 유리 NAD(P)H는 단백질 결합 NAD(P)H보다 짧은 수명을 갖는다; 반대로, 무료 FAD는 바운드 FAD18,19보다 수명이 길다. 수명 및 수명 성분 가중치는 Eq. (1)20을 통해 형광 수명 감쇠 데이터로부터 정량화될 수 있다:
I(t) = α 1e-t/τ1 + α 2e-t/τ2 + C (1)
Eq(1)은 시간의 함수로서 정규화된 형광 강도를 나타낸다. 이 방정식의 α 1과 α 2는 각각 짧은 수명과 긴 수명(α 1+ α 2=1)의 비례 성분을 나타내고, τ1과 τ2는 각각 짧은 수명과 긴 수명을 나타내며, C는 배경광7,20을 설명합니다. 여기서 τm으로 표현되는 진폭 가중 수명은 Eq. (2)를 사용하여 계산됩니다.
τm= α 1τ1+ α 2τ2 (2)
평균 수명은 형광단의 강도 붕괴에 대한 평균 "t"를 계산함으로써 계산될 수 있으며, 이는 2-지수 붕괴에 대해 Eq. (3)17,21에 의해 도시된다.
τ*m= (α 1τ12+ α 2τ22)/ (α 1τ1+ α 2τ2) (3)
형광 강도 이미지는 형광 수명 붕괴를 통합함으로써 수명 이미지로부터 계산될 수 있다. 자가 형광 이미징은 세포 내 해상도에서 살아있는 세포의 신진 대사를 특성화하는 데 사용할 수있는 비파괴적이고 라벨이없는 방법입니다. 광학 산화 환원 비율은 셀의 화학적 산화 환원 상태에 대한 광학 아날로그 메트릭을 제공하며 NAD (P) H 및 FAD 강도의 비율로 계산됩니다. 광학 산화 환원 비율을 계산하는 공식은 표준화되지 않았지만22,23,24,25, NAD (P) H 및 FAD의 결합 된 강도에 대한 FAD의 강도로 정의됩니다. 이 정의는 분모의 합산 강도가 0과 1 사이의 메트릭을 정규화하고 시안화물 억제의 예상 결과가 산화 환원 비율의 감소이기 때문에 사용됩니다. 유리 NAD(P)H 및 FAD의 형광 수명은 pH, 온도, 산소에 대한 근접성 및 삼투압을 포함한 대사 용매 미세환경의 변화에 대한 통찰력을 제공합니다17.
NAD(P)H 및 FAD의 결합된 분획의 형광 수명의 변화는 대사 경로 이용률 및 기질-특이적 대사26을 나타낼 수 있다. 성분 중량은 조효소18,19의 결합 분획에 대한 자유의 변화에 대해 해석될 수 있다. 전체적으로, 이러한 정량적 자가형광 수명 측정은 세포 대사의 분석을 허용하고, 자가형광 이미징은 정상 조직으로부터 신생물을 확인하는데 사용되어왔다.27,28, 줄기 세포의 특성화29,30, 면역 세포 기능 평가31,32,33,34,35, 신경 활성 측정36, 37,38, 유방암 및 두경부암과 같은 암 유형에서의 약물 효능 이해21,39,40,41,42. 고해상도 자가형광 이미징은 단일 세포 분석 및 집단내 이질성의 정량화를 위한 이미지 세분화와 결합될 수 있다43,44,45,46,47.
NAD(P)H 및 FAD는 강도 또는 수명 이미징을 위해 구성된 단일 광자 또는 다중 광자 형광 현미경으로 이미징할 수 있습니다. 단일 광자 현미경의 경우, NAD(P)H 및 FAD는 일반적으로 이러한 파장에서 일반적인 레이저 소스로 인해 각각 375-405nm 및 488nm의 파장에서 여기됩니다48. 이광자 형광 여기에서, NAD(P)H 및 FAD는 각각 대략 700 내지 750 nm 및 700 내지 900 nm의 파장에서 여기할 것이다(15,49). 일단 형광단이 여기되면, NAD(P)H 및 FAD는 각각 ~410nm에서 ~490nm, ~510nm에서 ~640nm 사이의 파장에서 광자를 방출한다15. NAD(P)H 및 FAD 최대 방출 파장은 각각 약 450nm 및 535nm(48)이다.
그들의 상이한 여기 및 방출 파장 때문에, 두 대사 조효소의 형광은 분광적으로 단리될 수 있다. NAD(P)H 및 FAD의 스펙트럼 특성에 대한 이해는 자가형광 이미징 프로토콜의 설계 및 최적화에 필요합니다. 시안화물은 전자 수송 사슬 (ETC) 착물 IV 억제제이다. 시안화물이 세포 대사에 미치는 영향과 세포 내 NAD(P)H 및 FAD의 자가형광 강도 및 수명은 잘 특성화되어 있습니다27,40. 따라서 시안화물 섭동 실험은 NAD(P)H 및 FAD 이미징 프로토콜을 검증하는 효과적인 수단입니다. 성공적인 시안화물 실험은 NAD(P)H 및 FAD 이미징 프로토콜이 알려지지 않은 그룹이나 교란의 신진대사를 평가하는 데 사용될 수 있다는 확신을 제공합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 이미징을위한 셀 도금
- MCF-7 세포의 80-90% 컨플루언트 T-75 플라스크로부터 배지를 흡인하고, 세포를 멸균 포스페이트 완충 식염수 (PBS) 10 mL로 헹구고, 0.25% 트립신(1x) 2 mL를 첨가하여 플라스크 바닥으로부터 세포를 분리한다.
- 플라스크를 ∼4분 동안 37°C에서 인큐베이션한다. 분리를 확인하기 위해 현미경으로 세포를 확인하십시오.
- 즉시 배지 8 mL를 첨가하여 트립신을 비활성화시킨다.
- 세포를 원뿔형 튜브 (15 mL 또는 50 mL)에 수집하십시오. 혈구계를 사용하여 세포를 계수하십시오.
- 세포 200 × g 을 5분 동안 원심분리한다.
- 일단 원심분리되면, 상청액을 흡인한다. 세포의 펠렛을 1 mL의 배지에 재현탁시키고, 시드 4 × 105 세포를 35 mm 유리 바닥 이미징 접시 (또는 사용되는 현미경에 적합한 샘플 홀더) 상에 상에.
- 세포 대사를 유지하기 위해 이미징 접시에 2 mL의 배지를 첨가하십시오.
- 세포를 37°C에서 24-48시간 동안 5% CO2 와 함께 인큐베이션한 후 세포가 부착하고 대수 성장 단계에 도달하도록 이미징한다.
참고: 성장 단계는 이들 세포에 대한 사전 경험에 의해 결정되고 세포 데이터시트로 확인되었다.
2. NAD (P) H 및 FAD의 다중 광자 FLIM 이미징
- 현미경, 레이저 소스 및 사용중인 검출기를 포함하여 다중 광자 형광 수명 현미경의 모든 구성 요소를 켭니다.
- 샘플 배치
- 브라이트필드 램프를 켭니다. 빛이 아이피스로 들어가고 있는지 확인하십시오. 세포 이미징을 위해 목표(일반적으로 20x, 40x 또는 100x)를 선택합니다. 목표 위에 적절한 침지 매체 1 방울을 바르십시오 [공기 목표를 사용하는 경우 건너 뛰기].
- 목표를 아래로 이동하여 목표를 건드리지 않고 표본을 올바르게 배치합니다. 유리 바닥 접시를 현미경 단계의 샘플 홀더 위에 놓습니다. 시편이 안전하며 이미징 중에 움직이지 않는지 확인하십시오.
- X-Y 스테이지 컨트롤을 사용하여 시편을 목표로 중앙에 맞춥니다. 이 작업이 완료되면 아이피스를 살펴보고 목표를 위로 움직여 세포에 초점을 맞춥니다.
- 현미경이 인클로저 내에 있으면 라이트 박스 도어를 닫으십시오. 이미지 획득 소프트웨어를 열고 Multiphoton Imaging 탭을 클릭하고 다음 multiphoton 이미징 매개 변수를 설정하십시오 : 이미지 크기 = 256 x 256 픽셀; 픽셀 체류 시간 = 4-25 μs; 총 이미지 획득 시간 = ~ 60 초; 단일 광자 계수에 최적화된 검출기 이득 = 85%(사용 중인 시스템에 따라 다름).
- 기기 반응 기능(IRF) 및 형광 수명 표준의 이미징
- 유리 바닥 접시에 요소 결정을 놓고 접시 뚜껑을 테이프 또는 파라 필름으로 고정하십시오.
참고 : 요소 결정은 실온에서 수개월 동안 안정적으로 유지됩니다. - 요소 결정을 이미지화하십시오.
- 요소 접시를 현미경 무대에 놓고 요소 결정에 초점을 맞 춥니 다.
- 여기 레이저의 파장을 900nm로 설정합니다.
- 450nm 파장을 캡처하는 방출 필터를 사용하십시오.
- 샘플 <1mW에서 레이저 파워로 요소 결정의 형광 수명 이미지를 얻고 단계 2.2.4에서 언급된 권장 이미징 파라미터를 사용합니다.
- 노란색 - 녹색 (YG) 비드를 형광 수명 표준으로 이미지화하십시오.
- YG 비드 용액을 멸균수에 1:1,000으로 희석하여 YG 비드 슬라이드를 만듭니다. 작은 부피 (~ 30 μL)를 슬라이드 또는 유리 바닥 접시에 놓습니다. 커버 슬립으로 덮고 커버 슬립의 가장자리를 명확한 매니큐어로 밀봉하십시오.
- YG 비드 슬라이드를 현미경 스테이지에 놓고 슬라이드의 커버슬립 면을 목표물 쪽으로 향하게 합니다.
- 여기 레이저의 파장을 890nm로 설정
- ~ 500-600 nm 파장을 캡처하는 방출 필터를 사용하십시오.
- 샘플 <1 mW에서 레이저 파워를 사용하여 YG 비드의 형광 수명 이미지를 획득하고 추천된 이미지 파라미터를 얻었다[단계 2.2.4].
- 우레아의 IRF를 이용하여 비드의 수명을 확인한다. 수명이 ~2.1ns가 아닌 경우, 비드가 형광 담금질에 기여하는 다른 비드와 접촉하는지, 비드 용액이 건조되었는지, 비드가 초점이 맞지 않거나, IRF가 정확하지 않거나, IRF와 형광 붕괴 사이의 이동이 최적화되지 않았는지 확인하십시오 [단계 4.2.4 참조].
참고: ~2.1ns의 수명은 시간이 지남에 따라 안정적입니다.
- 유리 바닥 접시에 요소 결정을 놓고 접시 뚜껑을 테이프 또는 파라 필름으로 고정하십시오.
- NAD (P) H 이미징
- 세포가있는 유리 바닥 접시를 현미경 단계에 놓고 세포에 집중하십시오.
참고: 이미지 획득 중에 열, 습도 및 CO2 수준을 유지하기 위해 세포를 환경 챔버에 배치하는 것이 좋습니다. 이러한 매개 변수는 세포 신진 대사에 영향을 줄 수 있습니다. - 검출기의 게인을 FLIM에 대한 최적 값으로 조정합니다. 추가적으로, 원하는 드웰 시간-레이저가 시편의 각 픽셀에서 소비하는 시간을 나타내는 파라미터로 변경한다.
참고: 이러한 매개 변수는 절차의 나머지 부분에서 동일하게 유지되어야 합니다. 이는 레이저 조명 및 검출기 설정의 일관성을 보장하여 레이저 전력, 스캔 파라미터 및 검출기 이득에 의존하는 강도 기반 측정의 유효성을 보장하기 위한 것입니다. 단일 광자 계수 모드에서 검출기를 작동시키기 위한 최적화된 검출기 이득이 있습니다. 이 값은 참조된 시스템의 85%입니다. - 다중 광자 레이저를 750nm로 설정합니다. 레이저의 셔터를 열 때 셀이 손상되지 않도록 레이저의 전원 제어가 초기에 0으로 설정되어 있는지 확인하십시오.
참고: 750nm에서의 여기는 NAD(P)H에 권장되지만, 700-750nm에서 광범위한 흡수를 가집니다. 890nm에서의 여기는 FAD에 권장되지만 700-900nm에서 광범위한 흡수가 있습니다. - ~ 400-500nm에서 방출 파장을 수집하기 위해 방출 필터를 설정하거나 선택하십시오.
- 초점 또는 라이브 뷰 방식으로 이미징을 시작하여 이미지 설정을 최적화합니다.
참고: 레이저가 현재 작동 중입니다. 이 시점에서 현미경 인클로저를 열지 마십시오. 적절한 개인 보호 장비를 착용하십시오. - 샘플에서 레이저 파워를 ~ 3-8 mW로 천천히 증가시키면서 셀에 초점을 맞춥니다. 조정이 완료되면 사용 된 최대 전력을 기록하십시오. NAD(P)H 이미징을 위해 페트리 접시의 다른 세그먼트에서 이미징하는 데 이 전원 설정을 사용합니다.
참고: 샘플 또는 픽오프 창에서 레이저 파워를 측정하고 포켈 셀이 안정적이지 않으므로 포켈 셀 전압에 의존하지 않는 것이 중요합니다. 종종 레이저 파워는 샘플 대신 픽오프 윈도우로 이미징하는 동안 모니터링됩니다. 목표에서 두 번째 전력계를 사용하면 픽업 윈도우에서의 전력과 샘플의 전력 사이의 관계를 사용하여 픽오프 윈도우 측정으로부터 샘플의 대략적인 전력을 추정할 수 있습니다. - 이미지 통합 시간이 60초인 NAD(P)H FLIM 이미지를 수집합니다.
- 이미지가 형광 수명 붕괴 곡선 내에 충분한 광자 (세포질 픽셀에 대해 ~ 100 광자의 피크)를 가지고 있는지 확인하십시오. 광자의 수가 너무 적으면 레이저 전력 또는 이미지 획득 기간을 늘리십시오.
참고: 형광 지수 감쇠 내의 광자의 최소 피크 수는 시간 분해능, IRF 및 배경 잡음을 포함한 시스템 매개변수에 따라 달라집니다.
- 세포가있는 유리 바닥 접시를 현미경 단계에 놓고 세포에 집중하십시오.
- FAD 이미징
- 다중 광자 레이저를 890nm로 설정하고 새로운 파장에서 모드 잠금이 될 때까지 기다립니다. 레이저의 셔터를 열 때 셀이 손상되지 않도록 레이저의 전원 제어가 초기에 0으로 설정되어 있는지 확인하십시오.
참고: 이 단계를 수행할 때 스테이지 또는 목표 포커스를 이동하지 마십시오. FAD 시야각(FOV)은 이 이미지의 NAD(P)H FOV와 직접 일치해야 합니다. - 방출 필터를 설정하거나 선택하여 ~500-600nm에서 방출 파장을 수집합니다.
- 초점 또는 라이브 뷰 방식으로 이미징을 시작하여 이미지 설정을 최적화합니다.
참고: 레이저가 현재 작동 중입니다. 이 시점에서 현미경 인클로저를 열지 마십시오. - 샘플에서 레이저 파워를 ~ 5-10 mW로 천천히 증가시키고 사용 된 최대 전력을 기록하십시오. 이것을 FAD 이미징을위한 Petri 접시의 다른 세그먼트에서 이미징을위한 전원 설정으로 사용하십시오.
- 이미지 통합 시간이 60초인 FAD FLIM 이미지를 수집합니다.
- 이미지가 형광 수명 붕괴 곡선 내에 충분한 광자 (세포질 픽셀에 대해 ~ 100 광자의 피크)를 가지고 있는지 확인하십시오. 광자의 수가 너무 적으면 레이저 전력 또는 이미지 획득 기간을 늘리십시오.
참고: 형광 지수 감쇠 내의 광자의 최소 피크 수는 시간 분해능, IRF 및 배경 잡음을 포함한 시스템 매개변수에 따라 달라집니다.
- 다중 광자 레이저를 890nm로 설정하고 새로운 파장에서 모드 잠금이 될 때까지 기다립니다. 레이저의 셔터를 열 때 셀이 손상되지 않도록 레이저의 전원 제어가 초기에 0으로 설정되어 있는지 확인하십시오.
- 추가 4~5개의 FOV에서 2.4-2.5단계를 반복합니다. 각 이미지가 이미지화된 위치에서 FOV 간격이 최소 2개 이상 떨어져 있는지 확인합니다.
3. 시안화물 실험 준비
- 130.24 mg의 시안화나트륨을 PBS 25 mL에 녹여 80 mM (20x) 시안화나트륨 용액을 만든다.
참고 : 시안화물은 독성이 있습니다. 적절한 개인 보호 장비를 착용하십시오. - 접시로부터 배양 배지 100 μL를 흡인한다. 이것을 100 μL의 시안화 나트륨 용액으로 교체하여 접시 중의 4 mM 농도의 시안화물을 얻었다.
- 세포를 5분 동안 인큐베이터에 넣어 세포가 시안화물 용액과 반응할 수 있도록 한다.
- 시안화물 노출 후 세포의 NAD(P)H 및 FAD 이미지를 획득하기 위해 단계 2.4-2.6을 반복한다.
참고 : 시안화물에 장기간 노출되면 세포가 죽습니다. Postcyanide 이미지는 시안화물 첨가 후 30 분 이내에 획득됩니다.
4. FLIM 이미지 분석
- FLIM 수명 분석 소프트웨어를 엽니다.
- 우레아 이미지를 열어 측정된 IRF를 획득한다.
- 요소 이미지를 가져옵니다. 이미지 분석에 사용할 요소 결정의 이미지에서 점을 선택합니다. 주 소프트웨어 인터페이스에 있는 Bin 변수를 변경하여 100광자의 감쇠 피크 에 대해 FLIM 데이터를 여러 픽셀> 1 이상으로 통합하도록 공간 빈 값을 늘립니다.
- 데이터를 IRF로 저장합니다.
- 참조된 소프트웨어에서 IRF라는 드롭다운 메뉴를 클릭하고 부패 데이터에서 복사를 선택합니다. 그런 다음 클립보드에 복사를 클릭하여 실험 중에 촬영한 이미지의 이미지 분석에 활용합니다.
- NAD(P)H 및 FAD 수명 이미지의 이미지 분석
- 이미지 파일을 형광 수명 분석 소프트웨어로 가져옵니다.
- 필요한 경우 강도와 대비를 변경하여 세포 및 하위 구획을 볼 수 있도록 이미지 시각화를 개선합니다.
- 옵션 드롭다운 메뉴를 클릭하고 강도를 선택합니다. 여기에서 강도와 대비를 원하는대로 변경하고 확인을 클릭하십시오.
- 요소 이미지에서 IRF를 가져옵니다.
- IRF 드롭다운 메뉴를 클릭하고 클립보드에서 붙여넣기를 선택합니다.
- 다중 지수 감쇠 매개 변수 설정50.
- 임계값을 설정하여 세포질 픽셀의 붕괴를 평가합니다.
참고: 여기서는 50 값이 사용되었습니다. 이 값은 몇몇 대표적인 배경 및 핵 픽셀의 형광 피크 값과 몇몇 세포질 픽셀의 피크 값을 비교함으로써 선택되었다. 핵 픽셀과 세포질 픽셀 사이의 값을 역치에 대해 선택하였다.
- 임계값을 설정하여 세포질 픽셀의 붕괴를 평가합니다.
- Shift 값이 형광의 상승 에지를 기준으로 IRF를 정렬하는지 확인합니다. 필요한 경우 시프트를 Chi-제곱 값을 최소화하는 값으로 조정합니다.
- 세포질 픽셀이 100 이상에서 형광 피크 값을 갖도록 공간 빈을 증가시킨다.
참고: 공간 빈을 늘리면 공간 해상도가 감소합니다. - 이미지의 모든 픽셀에 대한 형광 수명을 계산합니다.
- 참조된 프로그램에서 계산 드롭다운 메뉴를 | 붕괴 매트릭스.
참고: 성공은 진폭 가중 형광 수명에 대해 잘못된 색상의 이미지로 표시됩니다.
- 참조된 프로그램에서 계산 드롭다운 메뉴를 | 붕괴 매트릭스.
- 형광 수명 데이터를 저장합니다.
- 파일 드롭다운 메뉴를 | 내보내기. 분석할 매개변수를 선택하고 확인을 클릭합니다. 이미지를 저장합니다.
- 옵션 드롭다운 메뉴에서 색상 단추를 선택하여 표시되는 형광 수명 메트릭을 조정하고, 색상 구성을 B-G-R로 조정하고, 특정 색상 막대 최소값과 최대값을 설정하여 형광 수명 이미지의 색상 배율을 조정합니다.
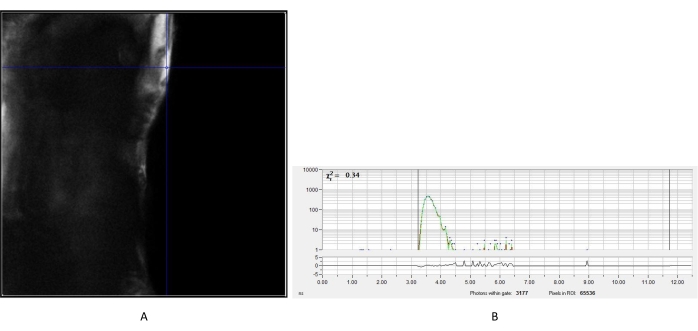
그림 2: 요소 결정의 IRF 측정. (a) 요소로부터 얻어진 강도 이미지. 세포의 형광 수명 이미지의 후속 분석을 위해 IRF 붕괴 곡선 (B)을 생성하기 위해 대표적인 픽셀을 선택하였다. 약어: IRF = 계측기 응답 기능. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 세포 분할
참고: 여기에 설명된 프로토콜은 이미지 분석 소프트웨어51을 사용합니다. 대표적인 MCF-7 이미지 및 데이터 분석 코드가 제공된다52.- MCF7_Segmentation_Final.cpproj 파일52를 다운로드합니다.
- 파일 MCF7_Segmentation를 클릭하여 | 파이프라인 가져오기 가져오기 | 파일에서 파이프라인을 선택하고 MCF7_Segmentation_Final.cpproj 파일을 선택합니다.
- 이미지 모듈을 클릭하고 분할할 NAD(P)H 강도 이미지를 추가합니다.
참고: 이미지는 .tif, .png 또는 .jpg 형식이어야 합니다. - 왼쪽 하단의 이미지 분석 버튼을 누릅니다.
참고: 파이프라인은 다른 시스템에서 획득한 이미지에 대한 최적화가 필요할 수 있습니다. 문제 해결을 위해 다음 하위 단계를 시도하십시오.- 다른 매개 변수를 테스트하기 위해 테스트 모드 사용: 테스트 모드 시작 을 클릭하고 모듈 이름 옆에 있는 재생 단추를 클릭하여 각 모듈을 실행합니다.
- 첫 번째 IdentifyPrimaryObjects 모듈을 클릭하고 개체의 일반 지름을 픽셀 단위(최소, 최대) 로 조정하여 셀 직경과 일치시킵니다.
참고: MCF-7 셀의 경우 최소 및 최대값에 각각 10 및 40픽셀이 사용되었습니다. - EnhhOrSuppressFeatures 모듈을 클릭하고 피쳐 크기를 조정하여 선택한 피쳐 유형의 식별을 개선합니다.
참고: MCF-7 셀에는 10픽셀의 피처 크기가 사용되었습니다. - 두 번째 EnhanceOrSuppressFeatures 모듈을 클릭하고 구멍 크기 범위를 조정하여 핵 영역의 향상을 최적화합니다.
참고: MCF-7 세포에 대해 5-20의 범위가 사용되었다. - 두 번째 IdentifyPrimaryObjects 모듈을 클릭하고 매개 변수(임계값 전략, 임계값 평활화 방법, 임계값 평활화 스케일 및 임계값 보정 계수)를 조정하여 핵 식별을 최적화합니다. 각 매개 변수의 ?를 클릭하여 최적의 설정을 식별하고 IdentifySecondaryObjects 모듈에 적용합니다.
- FilterObjects 모듈을 클릭하고 영역 모양을 조정합니다. 식별할 영역 형상의 최소 및 최대 픽셀을 선택합니다.
참고: MCF-7 셀의 경우, 각각 최대 및 최소값에 대해 100 및 500을 사용하였다. 핵을 확인하고 세포 경계로 증식하는 세포 세분화 과정은 Walsh 및 Skala47에 의해 상세히 설명된다.
- 세포질 마스크를 사용하여, 이미지 내의 각 세포에 대한 형광 수명 출력 변수를 평균화한다.

그림 3: 개별 세포의 식별 및 세분화. 상기 NAD(P)H MCF7 세포(A)의 강도 이미지를 적분하여 얻은 형광 수명 이미지. 세포를 60초 동안 5 mW에서 750 nm 여기로 사용하여 영상화하였다. x 축과 y 축은 이미지의 픽셀 위치를 나타냅니다. (a) 개별 세포를 동정하였다. 셀들을 마스킹(B)하여 데이터 세트로부터 임의의 배경 노이즈를 제거하였다. 이어서, 핵을 확인하고(C) 세포 마스크(D) 상에 투사하였다. 이어서, 세포를 여과(E)하여 전형적인 세포의 크기에 맞지 않는 마스킹된 영역을 제거하였다. 배율 막대 = 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 대체 방법 : 형광 강도 이미징
- 실험 중에 사용할 장비를 켭니다.
참고: 형광 강도 이미지는 광역 형광 현미경, 공초점 형광 현미경 또는 다중 광자 현미경으로 획득할 수 있습니다.- 사용할 현미경에 NAD(P)H (단일 광자 파장 ~ 370-405 nm : 이광자 파장 ~ 700-750 nm) 및 FAD (단일 광자 파장 ~ 488 nm, 이광자 파장 ~ 890 nm)에 적합한 여기 소스가 있는지 확인하십시오.
- 현미경에 NAD (P) H 방출 (~ 400-500nm)의 분리를위한 필터가 있는지 확인하십시오.
참고: 4',6-디아미디노-2-페닐인돌(DAPI) 설정은 종종 NAD(P)H에서 작동합니다. - 현미경에 FAD 방출 (~ 500-600 nm)의 분리를위한 필터가 있는지 확인하십시오.
참고: 녹색 형광 단백질(GFP) 설정은 종종 FAD에서 작동합니다.
- 현미경을 준비하십시오.
- 브라이트필드 램프를 켭니다. 빛이 아이피스로 들어가고 있는지 확인하십시오. 필요한 경우 해당 목표 위에 적절한 침지 매체 1 방울을 바르십시오.
- 목표물을 아래로 움직여 간섭 없이 샘플을 올바르게 배치합니다. 페트리 접시를 무대에 제대로 올려 놓으십시오. 시편이 안전하며 이미징 중에 움직이지 않는지 확인하십시오.
참고: 이미지 획득 중에 열, 습도 및 CO2 수준을 유지하기 위해 세포를 환경 챔버에 배치하는 것이 좋습니다. 이러한 매개 변수는 세포 신진 대사에 영향을 줄 수 있습니다. - 표본을 목표로 중심을 잡습니다. 이 작업이 완료되면 아이피스를 살펴보고 셀에 초점이 맞춰진 것처럼 보일 때까지 목표를 이동하십시오.
- 강도 이미징을 시작합니다.
- 이미징 소프트웨어를 열고 이미지 수집 소프트웨어에서 캡처 탭을 클릭하고 NAD(P)H 여기 및 방출 필터를 현미경 포탑에 배치하여 NAD(P)H를 캡처 하도록 여기 및 방출 구성을 설정합니다.
참고: NAD(P)H 이미징에 357/44 여기 필터, 409 롱패스 이색성 및 447/60 방출 필터가 사용되었습니다. - 여기 조명 및 검출기 파라미터를 최적화합니다. 표백이 문제인 경우 조명 강도를 줄이고 이미지 통합 시간을 늘리십시오.
참고: NAD(P)H는 약한 신호입니다. 너무 많은 전력을 사용하는 경우 표백에 유의하십시오. - 원하는 이미지 크기의 NAD(P)H 이미지를 획득합니다. 이미지가 저장되었는지 확인합니다.
- 여기 및 방출 구성을 설정하여 FAD를 캡처합니다. 여기 조명 및 검출기 파라미터를 최적화합니다.
참고: FAD 이미징에 458/64 여기 필터, 495 롱패스 이색성 및 550/88 방출 필터가 사용되었습니다. - FAD 이미지를 가져옵니다. 이미지가 저장되었는지 확인합니다.
참고: NAD(P)H 및 FAD 이미지 수집 파라미터(조명 강도, 이미지 크기, 검출기 이득)는 이미징 실험 전반에 걸쳐 동일하게 유지되어야 합니다. - 이미지화된 위치에서 최소 2개의 FOV를 이격된 추가 다섯 위치에서 이 프로세스를 반복합니다.
- 이미징 소프트웨어를 열고 이미지 수집 소프트웨어에서 캡처 탭을 클릭하고 NAD(P)H 여기 및 방출 필터를 현미경 포탑에 배치하여 NAD(P)H를 캡처 하도록 여기 및 방출 구성을 설정합니다.
- 이미지 레벨 산화 환원 비율 데이터 분석
- 이미지 처리 프로그램에서 NAD(P)H 및 FAD 강도 이미지를 엽니다.
- NAD(P)H에 임계값을 설정하여 세포질 픽셀을 유지하고 배경 및 핵 픽셀을 0으로 설정합니다.
- 임계값 NAD(P)H 이미지를 사용하여 각 픽셀에서 방정식 FAD/(NAD(P)H+FAD)를 평가하여 산화환원 비율 이미지를 계산합니다.
- 0이 아닌 픽셀의 평균값을 계산합니다.
참고: 이러한 단계는 이미지 분석 소프트웨어에서 수행하거나 스크립트로 직접 코딩할 수 있습니다.
- 세포 수준 산화 환원 비율 분석
- 단계 4.3.1-4.3.5에 따라 각 NAD(P)H 이미지 내의 셀의 마스크 이미지를 획득한다.
- 각 픽셀에서 방정식 FAD/(NAD(P)H+FAD)를 평가하여 산화환원 비율 이미지를 계산합니다.
- 세포질 마스크를 사용하여, 이미지 내의 각 세포에 대한 모든 픽셀에 대한 산화환원 비율을 평균화한다.
Access restricted. Please log in or start a trial to view this content.
결과
상피 유방암 세포주인 MCF-7을 10% 소 태아 혈청(FBS) 및 1% 페니실린-스트렙토마이신이 보충된 DMEM에서 배양하였다. 형광 이미징을 위해, 세포를 이미징 48 h 전에 35 mm 유리 바닥 이미징 디쉬 당 4 × 105 세포의 밀도로 시딩하였다. 세포를 상기 언급된 프로토콜을 사용하여 시안화물 처리 전후에 이미지화하였다. 시안화물 실험의 목표는 NAD(P)H 및 FAD 형광의 스펙트럼 분리를 확인하고 세포의 대?...
Access restricted. Please log in or start a trial to view this content.
토론
자가 형광 강도 및 평생 이미징은 세포의 신진 대사를 평가하기 위해 널리 사용되어 왔습니다.21,55. FLIM은 고분해능이므로 단일 세포를 해결하는데, 이는 세포 이질성이 종양 공격성 및 약물 내성에 기여하기 때문에 암 연구에 중요합니다.7,39,41,44,45,46,58.
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
자금 출처에는 텍사스 암 예방 및 연구소 (CPRIT RP200668)와 텍사스 A & M 대학이 포함됩니다. 그림 1은 BioRender.com 로 작성되었습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 2-deoxy-d-glucose (2-DG) | Sigma | AC111980000; AC111980010; AC111980050; AC111980250 | |
| Antibiotic Antimicrobial (pen-strep) | Gibco | 15240096 | |
| Cell Samples | American Type Culture Collection | N/A | MCF-7 cancer line |
| CellProfiler | Broad Institute | N/A | Image analysis software |
| Conical Tube | VWR | 89039-664 | 15 mL conical tube |
| DMEM | ThermoFisher | 11965092 | Culture media |
| FAD dichroic mirror | Semrock | FF495-Di03-25x36 | 495 nm |
| FAD emission filter | Semrock | FF01-550/88-25 | 550/88 nm |
| FAD excitation filter | Semrock | FF01-458/64-25 | 458/64 nm |
| FBS | ThermoFisher | 16000036 | |
| Fluorescence Lifetime Microscope | 3i | N/A | |
| Glass bottom dish | MatTek Corp | P35G-1.0-14-C | |
| Multiphoton Laser | Coherent | N/A | 2P Coherent Laser, Tunable 680 nm-1080 nm |
| NAD(P)H dichroic mirror | Semrock | FF409-Di03-25x36 | 409 nm |
| NAD(P)H emission filter | Semrock | FF02-447/60-25 | 447/60 nm |
| NAD(P)H excitation filter | Semrock | FF01-357/44-25 | 357/44 nm |
| PBS | ThermoFisher | 70011044 | |
| Potassium Cyanide | Sigma-Aldrich | 380970 | |
| SlideBooks 6 | 3i | N/A | Image acquisition software |
| SPCImage | Becker & Hickl GmbH | N/A | Fluorescence lifetime analysis software |
| Stage Top Incubator | okoLab | N/A | |
| Trypsin | Biosciences | 786-262 | |
| Urea | Sigma-Aldrich | U5128 | |
| YG beads | Polysciences | 19096-2 | Yg microspheres (20.0 µm) |
참고문헌
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomarkers in Medicine. 4 (2), 241-263 (2010).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Zheng, J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation (Review). Oncology Letters. 4 (6), 1151-1157 (2012).
- Potter, M., Newport, E., Morten, K. J. The Warburg effect: 80 years on. Biochemical Society Transactions. 44 (5), 1499-1505 (2016).
- Zhao, Y., Butler, E. B., Tan, M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death and Disease. 4 (3), 532(2013).
- Patel, S., Ahmed, S. Emerging field of metabolomics: Big promise for cancer biomarker identification and drug discovery. Journal of Pharmaceutical and Biomedical Analysis. 107, 63-74 (2015).
- Walsh, A. J., Cook, R. S., Skala, M. C. Functional optical imaging of primary human tumor organoids: Development of a personalized drug screen. Journal of Nuclear Medicine. 58 (9), 1367-1372 (2017).
- Zaal, E. A., Berkers, C. R. The influence of metabolism on drug response in cancer. Frontiers in Oncology. 8, 500(2018).
- Little, A. C., et al. High-content fluorescence imaging with the metabolic flux assay reveals insights into mitochondrial properties and functions. Communications Biology. 3 (1), 271(2020).
- Wang, X., et al. Comparison of magnetic resonance spectroscopy and positron emission tomography in detection of tumor recurrence in posttreatment of glioma: A diagnostic meta-analysis. Asia-Pacific Journal of Clinical Oncology. 11 (2), 97-105 (2015).
- Nabi, H. A., Zubeldia, J. M. Clinical applications of 18F-FDG in oncology. Journal of Nuclear Medicine Technology. 30 (1), 3-9 (2002).
- Kostakoglu, L., Agress, H., Goldsmith, S. J. Clinical role of FDG PET in evaluation of cancer patients. Radiographics. 23 (2), 315-340 (2003).
- Hoh, C. K. Clinical use of FDG PET. Nuclear Medicine and Biology. 34 (7), 737-742 (2007).
- van de Weijer, T., Schrauwen-Hinderling, V. B. Application of magnetic resonance spectroscopy in metabolic research. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1865 (4), 741-748 (2019).
- Huang, S., Heikal, A. A., Webb, W. W. Two-photon fluorescence spectroscopy and microscopy of NAD(P)H and Flavoprotein. Biophysical Journal. 82, 2811-2825 (2002).
- Lagarto, J. L., et al. Characterization of NAD(P)H and FAD autofluorescence signatures in a Langendorff isolated-perfused rat heart model. Biomedical Optics Express. 9 (10), 4961-4978 (2018).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. , Springer. Boston, MA. (2013).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proceedings of the National Academy of the Sciences of the United States of America. 89 (4), 1271-1275 (1992).
- Nakashima, N., Yoshihara, K., Tanaka, F., Yagi, K. Picosecond fluorescence lifetime of the coenzyme of D-amino acid oxidase. Journal of Biological Chemistry. 255 (11), 5261-5263 (1980).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomedical Optics Express. 11 (10), 5674-5688 (2020).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (7), 1-43 (2020).
- Liu, Z., et al. Mapping metabolic changes by noninvasive, multiparametric, high-resolution imaging using endogenous contrast. Science Advances. 4 (3), (2018).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Cancer Research. 74 (11), 3067-3075 (2014).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. Journal of Biological Chemistry. 254 (11), 4764-4771 (1979).
- Sharick, J. T., et al. Protein-bound NAD(P)H lifetime is sensitive to multiple fates of glucose carbon. Scientific Reports. 8 (1), 5456(2018).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19494-19499 (2007).
- Skala, M. C., et al. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. Journal of Biomedical Optics. 12 (2), 024014(2007).
- Uchugonova, A. A., König, K. Two-photon autofluorescence and second-harmonic imaging of adult stem cells. Journal of Biomedical Optics. 13 (5), 054068(2008).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nature Methods. 11 (11), 1161-1169 (2014).
- Walsh, A. J., et al. Classification of T-cell activation via autofluorescence lifetime imaging. Nature Biomedical Engineering. 5 (1), 77-88 (2021).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Cancer Research. 80 (23), 5408-5423 (2020).
- Pavillon, N., Hobro, A. J., Akira, S., Smith, N. I. Noninvasive detection of macrophage activation with single-cell resolution through machine learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 2676-2685 (2018).
- Chang, C. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- Kaech, S. M., Cui, W. Transcriptional control of effector and memory CD8+ T cell differentiation. Nature Reviews. Immunology. 12 (11), 749-761 (2012).
- Gómez, C. A., Fu, B., Sakadžić, S., Yaseena, M. A. Cerebral metabolism in a mouse model of Alzheimer's disease characterized by two-photon fluorescence lifetime microscopy of intrinsic NADH. Neurophotonics. 5 (4), 045008(2018).
- Yaseen, M. A., et al. In vivo imaging of cerebral energy metabolism with two-photon fluorescence lifetime microscopy of NADH. Biomedical Optics Express. 4 (2), 307-321 (2013).
- Bower, A. J., et al. High-speed label-free two-photon fluorescence microscopy of metabolic transients during neuronal activity. Applied Physics Letters. 118 (8), 081104(2021).
- Walsh, A. J., et al. Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer. Cancer Research. 74 (18), 5184-5194 (2014).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Cancer Research. 73 (20), 6164-6174 (2013).
- Chowdary, M. V. P., et al. Autofluorescence of breast tissues: Evaluation of discriminating algorithms for diagnosis of normal, benign, and malignant conditions. Photomedicine and Laser Surgery. 27 (2), 241-252 (2009).
- Demos, S. G., Bold, R., White, R. D., Ramsamooj, R. Investigation of near-infrared autofluorescence imaging for the detection of breast cancer. IEEE Journal of Selected Topics in Quantum Electronics. 11 (4), 791-798 (2005).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Cancer Research. 80 (23), 5408-5423 (2020).
- Sharick, J. T., et al. Cellular metabolic heterogeneity in vivo is recapitulated in tumor organoids. Neoplasia. 21 (6), 615-626 (2019).
- Shah, A. T., Diggins, K. E., Walsh, A. J., Irish, J. M., Skala, M. C. In vivo autofluorescence imaging of tumor heterogeneity in response to treatment. Neoplasia. 17 (12), 862-870 (2015).
- Walsh, A. J., Skala, M. C. Optical metabolic imaging quantifies heterogeneous cell populations. Biomedical Optics Express. 6 (2), 559-573 (2015).
- Walsh, A. J., Skala, M. C. An automated image processing routine for segmentation of cell cytoplasms in high-resolution autofluorescence images. Multiphoton Microscopy in the Biomedical Sciences XIV. , (2014).
- Skala, M., Ramanujam, N. Methods in Molecular Biology. 594, 155-162 (2010).
- Stringari, C., et al. Multicolor two-photon imaging of endogenous fluorophores in living tissues by wavelength mixing. Scientific Reports. 7, 3792(2017).
- SPCImage 2.9: Data analysis software for fluorescence lifetime imaging microscopy. SPCImage. , Available from: https://biology.uiowa.edu/sites/biology.uiowa.edu/files/SPCIMAGE29.pdf (2007).
- CellProfiler. , Available from: https://cellprofiler.org/releases (2007).
- Autofluorescence Imaging. GitHub. , Available from: https://github.com/walshlab/Autofluorescence-Imaging (2021).
- Ramey, N. A., Park, C. Y., Gehlbach, P. L., Chuck, R. S. Imaging mitochondria in living corneal endothelial cells using autofluorescence microscopy. Photochemistry and Photobiology. 83 (6), 1325-1329 (2007).
- Walsh, A., Cook, R. S., Rexer, B., Arteaga, C. L., Skala, M. C. Optical imaging of metabolism in HER2 overexpressing breast cancer cells. Biomedical Optics Express. 3 (1), 75-85 (2012).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxidants & Redox Signaling. 30, 875-889 (2019).
- Bird, D. K., et al. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of the coenzyme NADH. Cancer Research. 65, 8766-8773 (2005).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Cancer Research. 73 (20), 6164-6174 (2013).
- Walsh, A. J., Castellanos, J. A., Nagathihalli, N. S., Merchant, N. B., Skala, M. C. Optical imaging of drug-induced metabolism changes in murine and human pancreatic cancer organoids reveals heterogeneous drug response. Pancreas. 45 (6), 863-869 (2016).
- Gubser, P. M., et al. Rapid effector function of memory CD8+ T cells requires an immediate-early glycolytic switch. Nature Immunology. 14 (10), 1064-1072 (2013).
- Papalexi, E., Satija, R. Single-cell RNA sequencing to explore immune cell heterogeneity. Nature Review. Immunology. 18 (1), 35-45 (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. The Journals of Gerontology: Series A. 67 (10), 1022-1035 (2012).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-protocol. 8 (10), 2850(2018).
- Becker, W. The bh TCSPC Handbook. , Available from: https://www.becker-hickl.com/wp-content/uploads/2021/10/SPC-handbook-9ed-05a.pdf (2021).
- Gadella, T. W. J. Fluorescent and Luminescent Probes for Biological Activity. Mason, W. T. 34, Ch. 34 467-479 (1999).
- Miller, D. R., Jarrett, J. W., Hassan, A. M., Dunna, A. K. Deep tissue iImaging with multiphoton fluorescence microscopy. Current Opinion in Biomedical Engineering. 4, 32-39 (2017).
- Berezin, M. Y., Achilefu, S. Fluorescence lifetime measurements and biological imaging. Chemical Reviews. 110 (5), 2641-2684 (2010).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유