Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücresel Metabolizmayı Değerlendirmek için Otofloresan Görüntüleme
Bu Makalede
Özet
Bu protokol, endojen metabolik koenzimlerin, indirgenmiş nikotinamid adenin (fosfat) dinükleotid (NAD (P) H) ve oksitlenmiş flavin adenin dinükleotidin (FAD) floresan görüntülemesini ve analizini tanımlar. NAD(P)H ve FAD'ın otofloresan görüntülemesi, hücresel metabolizmayı değerlendirmek için etiketsiz, tahribatsız bir yöntem sağlar.
Özet
Hücresel metabolizma, hücrelerin enerji ürettiği süreçtir ve kanser de dahil olmak üzere birçok hastalık anormal metabolizma ile karakterizedir. İndirgenmiş nikotinamid adenin (fosfat) dinükleotid (NAD(P)H) ve oksitlenmiş flavin adenin dinükleotid (FAD) metabolik reaksiyonların koenzimleridir. NAD (P) H ve FAD otofloresan sergiler ve uyarma ve emisyon dalga boyları ile spektral olarak izole edilebilir. Her iki koenzim, NAD (P) H ve FAD, her biri ayrı bir floresan ömrüne sahip olan serbest veya proteine bağlı bir konfigürasyonda bulunabilir - floroforun uyarılmış durumda kaldığı süre. Floresan ömür boyu görüntüleme (FLIM), hücresel metabolizmanın etiketsiz analizi için NAD (P) H ve FAD'nin floresan yoğunluğunun ve ömürlerinin ölçülmesini sağlar. Floresan yoğunluğu ve ömür boyu mikroskoplar, uygun uyarma ve emisyon dalga boyları seçilerek NAD(P)H ve FAD'yi görüntülemek için optimize edilebilir. Siyanür ile metabolik pertürbasyonlar, hücrelerdeki metabolik değişiklikleri tespit etmek için otofloresan görüntüleme protokollerini doğrular. Bu makalede, hücresel metabolizmayı ölçmek için NAD (P) H ve FAD'nin otofloresan görüntüleme tekniği gösterilecektir.
Giriş
Metabolizma, enerji üretmenin hücresel sürecidir. Hücresel metabolizma, glikoliz, oksidatif fosforilasyon ve glutaminoliz dahil olmak üzere birçok yolu kapsar. Sağlıklı hücreler, bağışıklık hücreleri tarafından sitokinlerin üretimi gibi çoğalma ve işlev için enerji üretmek için bu metabolik yolları kullanır. Metabolik bozukluklar, kanser ve nörodejenerasyon dahil olmak üzere birçok hastalık, değişmiş hücresel metabolizma ile karakterizedir1. Örneğin, bazı kanser hücresi tipleri, nükleik asitlerin, proteinlerin ve lipitlerin sentezi için moleküller üretmek üzere oksijen varlığında bile glikoliz oranlarını yükseltmiştir2,3. Warburg etkisi olarak bilinen bu fenomen, meme kanseri, akciğer kanseri ve glioblastomlar dahil olmak üzere birçok kanser türünün ayırt edici özelliğidir4. Kanser progresyonu ile ilişkili hücresel metabolizmadaki değişiklikler nedeniyle, hücresel metabolizma ilaç yanıtı için vekil bir biyobelirteç olabilir5,6. Ayrıca, hücre heterojenliği bireylerde farklı ilaç yanıtlarına yol açabileceğinden, ilaç etkinliğini hücresel düzeyde anlamak çok önemlidir7,8.
Hücresel metabolizmadaki değişiklikleri tanımlayan ve ölçen teknolojiler, kanser ve ilaç yanıtı çalışmaları için gereklidir. Kimyasal ve protein analizleri, hücrelerin veya dokuların metabolizmasını değerlendirmek için kullanılır, ancak tek hücreli çözünürlük ve mekansal bilgiden yoksundur. Metabolik plaka okuyucu tabanlı testler, numunedeki pH ve oksijen tüketimini zaman içinde ve ardından kimyasallar tarafından metabolik bozulmayı ölçebilir. PH, hücrelerin glikolitik aktivitesi hakkında bir fikir veren hücre dışı asitleşme oranını (ECAR) hesaplamak için kullanılabilir9. 2-[flor-18] floro-D-glukoz pozitron emisyon tomografisi (FDG PET) ve manyetik rezonans spektroskopisi (MRS) dahil olmak üzere tüm vücut görüntüleme yöntemleri, metabolik ölçümler yoluyla tümör nüksünü ve ilaç etkinliğini tanımlamak için klinik olarak kullanılan noninvaziv görüntüleme yöntemleridir10,11,12,13,14.
FDG-PET, RADYO-etiketli bir glikoz analoğu olan FDG'nin doku alımını görüntüler. Tümörler tarafından çevre dokuya göre FDG-PET alımının artması, Warburg etkisinden kaynaklanmaktadır12,13. MRS, 13C ve 31P gibi metabolizma için kullanılan moleküllerin ortak çekirdeklerini görüntüler ve metabolizmanın egzersiz veya yemek yeme gibi uyaranlara yanıt olarak nasıl değiştiği hakkında dinamik bilgiler elde edebilir14. FDG-PET ve MRS klinik olarak kullanılabilse de, bu teknolojiler intratümöral heterojenliği çözmek için uzamsal çözünürlükten yoksundur. Aynı şekilde, oksijen tüketimi ölçümleri büyük miktarda hücre popülasyonu üzerinde yapılır. Otofloresan görüntüleme, bu teknolojilerin mekansal çözünürlük engelinin üstesinden gelir ve hücresel metabolizmayı ölçmek için invaziv olmayan bir yöntem sağlar.
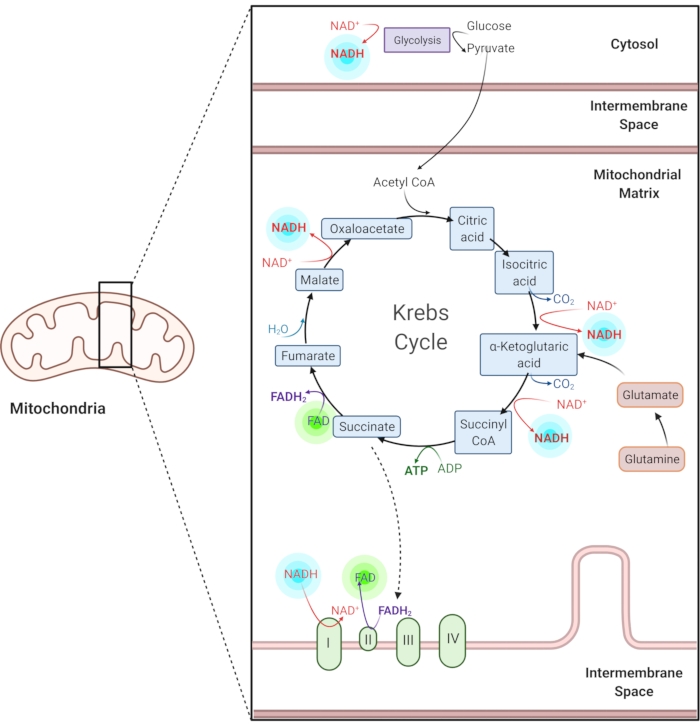
Şekil 1: Ortak metabolik yollarda NADH ve FAD. NADH ve FAD, glikoliz, Krebs döngüsü ve elektron taşıma zincirinde kullanılan koenzimlerdir. Bu moleküllerin otofloresan görüntülemesi hücresel metabolizma hakkında bilgi sağlar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
İndirgenmiş nikotinamid adenin (fosfat) dinükleotid (NAD (P) H) ve oksitlenmiş flavin adenin dinükleotid (FAD), glikoliz, oksidatif fosforilasyon ve glutaminoliz dahil olmak üzere metabolik reaksiyonların koenzimleridir (Şekil 1). Hem NAD(P)H hem de FAD otofloresandır ve floresan görüntüleme için endojen kontrast sağlar1,15. NADPH, NADH'ye benzer floresan özelliklere sahiptir. Bu nedenle, NAD (P) H genellikle NADH ve NADPH2,16'nın birleşik sinyalini temsil etmek için kullanılır.
Floresan ömür boyu görüntüleme (FLIM), floresan ömrünü veya bir floroforun uyarılmış durumda olduğu süreyi ölçer. Floresan ömürleri, floroforların mikro ortamına duyarlıdır ve hücresel metabolizma hakkında bilgi sağlar17. NAD (P) H ve FAD, her biri farklı bir ömre sahip olan proteine bağlı veya serbest konformasyonlardaki hücrelerde bulunabilir. Serbest NAD (P) H, proteine bağlı NAD (P) H'den daha kısa bir ömre sahiptir; tersine, serbest FAD, bağlı FAD18,19'dan daha uzun bir ömre sahiptir. Yaşam süreleri ve ömür boyu bileşen ağırlıkları, floresan ömür boyu bozunma verilerinden Ek. (1)20 aracılığıyla ölçülebilir:
I(t) = α 1e-t/τ1 + α 2e-t/τ2 + C (1)
Eq (1), zamanın bir fonksiyonu olarak normalleştirilmiş floresan yoğunluğunu temsil eder. Bu denklemdeki α 1 ve α 2, sırasıyla kısa ve uzun ömürlerin orantılı bileşenlerini temsil eder (α 1+ α 2=1), τ1 ve τ2 sırasıyla kısa ve uzun ömürleri temsil eder ve C, arka plan ışığını7,20 oluşturur. Burada τm olarak temsil edilen genlik ağırlıklı yaşam süresi, Ek. (2) kullanılarak hesaplanır.
τm= α 1τ1+ α 2τ2 (2)
Ortalama bir ömür, floroforun yoğunluk bozunumu üzerinde ortalama "t" ile hesaplanabilir, bu da iki üstel bir bozunma için Eq. (3) 17,21 ile gösterilir.
τ*m= (α 1τ12+ α 2τ22)/ (α 1τ1+ α 2τ2) (3)
Bir floresan yoğunluğu görüntüsü, floresan ömür boyu bozunumu entegre edilerek ömür boyu görüntüden hesaplanabilir. Otofloresan görüntüleme, canlı hücrelerin metabolizmasını hücre altı çözünürlükte karakterize etmek için kullanılabilecek tahribatsız ve etiketsiz bir yöntemdir. Optik redoks oranı, hücrenin kimyasal redoks durumunun optik analog metriğini sağlar ve NAD (P) H ve FAD yoğunluklarının oranı olarak hesaplanır. Optik redoks oranının hesaplanması için formül standartlaştırılmamış olsa da22,23,24,25, burada NAD (P) H ve FAD'nin birleşik yoğunlukları üzerindeki FAD yoğunluğu olarak tanımlanmaktadır. Bu tanım kullanılır, çünkü paydadaki toplam yoğunluk metriği 0 ile 1 arasında normalleştirir ve siyanür inhibisyonunun beklenen sonucu redoks oranında bir azalmadır. Serbest NAD(P)H ve FAD'ın floresan ömürleri, pH, sıcaklık, oksijene yakınlık ve ozmolarite dahil olmak üzere metabolik çözücü mikro ortamındaki değişiklikler hakkında fikir verir17.
NAD(P)H ve FAD'nin bağlı fraksiyonlarının floresan ömründeki değişiklikler, metabolik yol kullanımını ve substrata özgü metabolizmayı gösterebilir26. Komponent ağırlıkları, koenzimlerin serbest ila bağlı fraksiyonundaki değişiklikler için yorumlanabilir18,19. Toplamda, bu kantitatif otofloresan yaşam boyu metrikleri hücresel metabolizmanın analizine izin verir ve otofloresan görüntüleme normal dokulardan neoplazmları tanımlamak27,28, kök hücreleri karakterize etmek29,30, bağışıklık hücresi fonksiyonunu değerlendirmek31,32,33,34,35, nörolojik aktiviteyi ölçmek için kullanılmıştır36, 37,38 ve meme kanseri ve baş boyun kanseri gibi kanser türlerinde ilaç etkinliğini anlamak21,39,40,41,42. Yüksek çözünürlüklü otofloresan görüntüleme, tek hücreli analiz ve popülasyon içi heterojenitenin nicelleştirilmesi için görüntü segmentasyonu ile birleştirilebilir43,44,45,46,47.
NAD (P) H ve FAD, yoğunluk veya ömür boyu görüntüleme için yapılandırılmış tek fotonlu veya çok fotonlu floresan mikroskoplarda görüntülenebilir. Tek fotonlu mikroskoplar için, NAD (P) H ve FAD, bu dalga boylarındaki ortak lazer kaynakları nedeniyle, sırasıyla 375-405 nm ve 488 nm dalga boylarında tipik olarak uyarılır48. İki fotonlu floresan uyarımında, NAD (P) H ve FAD sırasıyla yaklaşık 700 ila 750 nm ve 700 ila 900 nm dalga boylarında uyaracaktır, 15,49. Floroforlar uyarıldığında, NAD (P) H ve FAD sırasıyla ~ 410 nm ila ~ 490 nm ve ~ 510 nm ila ~ 640 nm arasındaki dalga boylarında fotonlar yayar15. NAD (P) H ve FAD maksimuma emisyon dalga boyları sırasıyla yaklaşık 450 nm ve 535 nm'dir48.
Farklı uyarma ve emisyon dalga boyları nedeniyle, iki metabolik koenzimin floresansı spektral olarak izole edilebilir. NAD(P)H ve FAD'ın spektral özelliklerinin anlaşılması, otofloresan görüntüleme protokollerinin tasarımı ve optimizasyonu için gereklidir. Siyanür bir elektron taşıma zinciri (ETC) kompleks IV inhibitörüdür. Siyanürün hücresel metabolizma üzerindeki etkileri ve hücrelerdeki NAD(P)H ve FAD'ın otofloresan yoğunlukları ve ömürleri iyi karakterize edilmiştir27,40. Bu nedenle, bir siyanür pertürbasyon deneyi, NAD (P) H ve FAD görüntüleme protokollerini doğrulamak için etkili bir araçtır. Başarılı bir siyanür deneyi, NAD (P) H ve FAD görüntüleme protokolünün bilinmeyen grupların veya bozulmaların metabolizmasını değerlendirmek için kullanılabileceğine dair güven sağlar.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Görüntüleme için hücre kaplaması
- Ortamı, MCF-7 hücrelerinin %80-90'lık bir T-75 şişesinden aspire edin, hücreleri 10 mL steril fosfat tamponlu salin (PBS) ile durulayın ve hücreleri şişe tabanından ayırmak için 2 mL% 0.25 tripsin (1x) ekleyin.
- Şişeyi ~ 4 dakika boyunca 37 ° C'de inkübe edin. Ayrılmayı onaylamak için mikroskop altındaki hücreleri kontrol edin.
- Tripsini devre dışı bırakmak için hemen 8 mL kültür ortamı ekleyin.
- Hücreleri konik bir tüpte toplayın (15 mL veya 50 mL). Bir hemositometre kullanarak hücreleri sayın.
- Hücreleri 5 dakika boyunca 200 × g santrifüj edin.
- Santrifüj edildikten sonra, süpernatanı aspire edin. Hücrelerin peletini 1 mL kültür ortamında yeniden askıya alın ve tohum 4 × 105 hücreyi 35 mm'lik cam tabanlı bir görüntüleme kabına (veya kullanılan mikroskop için uygun numune tutucuya) yerleştirin.
- Hücre metabolizmasını korumak için görüntüleme kabına 2 mL kültür ortamı ekleyin.
- Hücrelerin logaritmik büyüme fazına yapışması ve ulaşması için görüntülemeden önce hücreleri 37 ° C'de 24-48 saat boyunca% 5 CO2 ile inkübe edin.
NOT: Büyüme aşaması, bu hücrelerle ilgili önceki deneyimlerle belirlendi ve hücre veri sayfası ile doğrulandı.
2. NAD (P) H ve FAD'nin multifoton FLIM görüntülemesi
- Mikroskop, lazer kaynağı ve kullanılan dedektörler dahil olmak üzere çoklu foton floresan ömür boyu mikroskobunun tüm bileşenlerini açın.
- Örnek yerleştirme
- Parlak alan lambasını açın. Işığın göz merceğinin içine girdiğinden emin olun. Hücre görüntüleme için genellikle 20x, 40x veya 100x olmak üzere bir hedef seçin. Hedefin üzerine 1 damla uygun daldırma ortamı uygulayın [bir hava hedefi kullanıyorsanız atlayın].
- Hedefe dokunmadan numuneyi düzgün bir şekilde yerleştirmek için hedefi aşağı doğru hareket ettirin. Cam tabanlı kabı mikroskop aşamasındaki numune tutucuya yerleştirin. Numunenin güvenli olduğundan ve görüntüleme sırasında hareket etmeyeceğinden emin olun.
- X-Y aşama kontrolünü kullanarak numuneyi hedefle ortalayın. Bu yapıldıktan sonra, göz merceğine bakın ve hücrelere odaklanmak için hedefi yukarı doğru hareket ettirin.
- Mikroskop bir mahfaza içindeyse, ışık kutusu kapağını kapatın. Görüntü alma yazılımını açın, Multiphoton Imaging sekmesine tıklayın ve aşağıdaki multifoton görüntüleme parametrelerini ayarlayın: görüntü boyutu = 256 x 256 piksel; piksel bekleme süresi = 4-25 μs; toplam görüntü alma süresi = ~ 60 sn; Tek foton sayımı için optimize edilmiş dedektör kazancı = %85 (kullanılan sisteme özgü).
- Cihaz Tepki Fonksiyonunun (IRF) ve Floresan Yaşam Ömrü Standardının Görüntülenmesi
- Üre kristallerini cam tabanlı bir tabağa yerleştirin ve çanak kapağını bant veya parafilm ile sabitleyin.
NOT: Üre kristalleri oda sıcaklığında aylarca sabit kalır. - Üre kristallerini görüntüleyin.
- Üre kabını mikroskop aşamasına yerleştirin ve bir üre kristaline odaklanın.
- Uyarma lazerinin dalga boyunu 900 nm olarak ayarlayın.
- 450 nm dalga boylarını yakalayan bir emisyon filtresi kullanın.
- Numunede lazer gücüyle üre kristalinin floresan ömrü görüntüsünü elde edin <1 mW ve adım 2.2.4'te belirtilen önerilen görüntüleme parametrelerini kullanın.
- Sarı-yeşil (YG) boncukları floresan ömrü standardı olarak hayal edin.
- YG boncuk çözeltisini steril suda 1:1.000 oranında seyrelterek bir YG boncuk kaydırağı oluşturun. Slayt veya cam tabanlı bir kabağın üzerine küçük bir hacim (~ 30 μL) yerleştirin. Bir kapak kayması ile örtün ve kapak kaymasının kenarlarını şeffaf oje ile kapatın.
- YG boncuk kaydırağını mikroskop sahnesine, slaytın kapak kaydırma tarafı hedefe doğru olacak şekilde yerleştirin.
- Uyarma lazerinin dalga boyunu 890 nm'ye ayarlayın
- ~500-600 nm dalga boylarını yakalayan bir emisyon filtresi kullanın.
- Numunede <1 mW'lık bir lazer gücü ve önerilen görüntü parametrelerini kullanarak YG boncuğunun floresan ömür boyu görüntüsünü elde edin [adım 2.2.4].
- Ürenin IRF'sini kullanarak boncuğun ömrünü kontrol edin. Kullanım ömrü ~ 2.1 ns değilse, boncuğun floresan söndürmeye katkıda bulunan başka bir boncukla temas halinde olup olmadığını, boncuk çözeltisinin kuruduğunu, boncuk odak dışı, IRF'nin doğru olmadığını veya IRF ile floresan bozunması arasındaki geçişin optimize edilmediğini kontrol edin [bkz. adım 4.2.4].
NOT: ~ 2.1 ns'lik kullanım ömrü zaman içinde kararlıdır.
- Üre kristallerini cam tabanlı bir tabağa yerleştirin ve çanak kapağını bant veya parafilm ile sabitleyin.
- NAD(P)H görüntüleme
- Cam tabanlı kabı mikroskop aşamasındaki hücrelerle birlikte yerleştirin ve hücrelere odaklanın.
NOT: Görüntü elde etme sırasında ısı, nem ve CO2 seviyelerini korumak için hücrelerin bir çevre odasına yerleştirilmesi önerilir, çünkü bu parametreler hücresel metabolizmayı etkileyebilir. - Dedektörün kazancını FLIM için en uygun değere ayarlayın. Ek olarak, istenen bekleme süresine geçin - lazerin numunenin her pikselinde harcadığı zamanı gösteren bir parametre.
NOT: Bu parametreler prosedürün geri kalanı boyunca AYNI kalmalıdır. Bu, lazer gücüne, tarama parametrelerine ve dedektör kazancına bağlı olan yoğunluğa dayalı ölçümlerin geçerliliğini sağlamak için lazer aydınlatma ve dedektör ayarlarında tutarlılık sağlamaktır. Tek foton sayma modunda dedektörleri çalıştırmak için optimize edilmiş bir dedektör kazancı vardır; değer, başvurulan sistem için %85'tir. - Çoklu foton lazeri 750 nm'ye ayarlayın. Lazer üzerindeki deklanşörü açtıktan sonra hücrelerin zarar görmemesi için lazer için güç kontrolünün başlangıçta sıfıra ayarlandığından emin olun.
NOT: 700-750 nm'de geniş emilime sahip olmasına rağmen, NAD (P) H için 750 nm'de uyarma önerilir. FAD için 890 nm'de uyarma önerilir, ancak 700-900 nm'de geniş emilime sahiptir. - ~400-500 nm'de emisyon dalga boylarını toplamak için bir emisyon filtresi ayarlayın veya seçin.
- Görüntü ayarlarını optimize etmek için görüntülemeye odaklama veya canlı görüntü biçiminde başlayın.
NOT: Lazer şu anda çalışıyor. Bu noktada mikroskop muhafazasını açmayın. Uygun kişisel koruyucu ekipman giyin. - Lazer gücünü numunede yavaşça ~ 3-8 mW'a yükseltin ve aynı zamanda hücrelerin odaklanmasını sağlayın. Ayarlandıktan sonra, kullanılan maksimum gücü kaydedin. NAD(P)H görüntüleme için Petri kabının diğer segmentlerinde görüntüleme için bu güç ayarını kullanın.
NOT: Numunedeki veya bir toplama penceresindeki lazer gücünü ölçmek ve pockels hücreleri kararlı olmadığından pockels hücre voltajına güvenmemek önemlidir. Genellikle lazer gücü, görüntüleme sırasında numune yerine bir toplama penceresi ile izlenir. Hedefte ikinci bir güç ölçer kullanılarak, alma penceresindeki güç ile numunedeki güç arasındaki ilişki, numunedeki yaklaşık gücü pick-off penceresi ölçümlerinden tahmin etmek için kullanılabilir. - 60 sn'lik görüntü entegrasyon süresine sahip bir NAD(P)H FLIM görüntüsü toplayın.
- Görüntünün, floresan ömür boyu bozunma eğrisi içinde yeterli fotona (bir sitoplazma pikseli için ~ 100 fotonun zirvesi) sahip olup olmadığını kontrol edin. Foton sayısı çok düşükse, lazer gücünü veya görüntü alma süresini artırın.
NOT: Floresan üstel bozunumu içindeki fotonların minimum tepe sayısı, zamansal çözünürlük, IRF ve arka plan gürültüsü dahil olmak üzere sistem parametrelerine bağlıdır.
- Cam tabanlı kabı mikroskop aşamasındaki hücrelerle birlikte yerleştirin ve hücrelere odaklanın.
- FAD görüntüleme
- Multifoton lazeri 890 nm'ye ayarlayın ve yeni dalga boyunda mod kilitlemesini bekleyin. Lazer üzerindeki deklanşörü açtıktan sonra hücrelerin zarar görmemesi için lazer için güç kontrolünün başlangıçta sıfıra ayarlandığından emin olun.
NOT: Bu adımı gerçekleştirirken sahne alanını veya objektif odağı hareket ettirmeyin. FAD görüş alanı (FOV), bu görüntü için NAD(P)H FOV ile doğrudan eşleşmelidir. - ~500-600 nm'de emisyon dalga boylarını toplamak için bir emisyon filtresi ayarlayın veya seçin.
- Görüntü ayarlarını optimize etmek için görüntülemeye odaklama veya canlı görüntü biçiminde başlayın.
NOT: Lazer şu anda çalışıyor. Bu noktada mikroskop muhafazasını açmayın. - Lazer gücünü numunede yavaşça ~ 5-10 mW'a yükseltin ve kullanılan maksimum gücü kaydedin. Bunu, FAD görüntüleme için Petri kabının diğer segmentlerinde görüntüleme için güç ayarı olarak kullanın.
- 60 sn'lik bir görüntü entegrasyon süresine sahip bir FAD FLIM görüntüsü toplayın.
- Görüntünün, floresan ömür boyu bozunma eğrisi içinde yeterli fotona (bir sitoplazma pikseli için ~ 100 fotonun zirvesi) sahip olup olmadığını kontrol edin. Foton sayısı çok düşükse, lazer gücünü veya görüntü alma süresini artırın.
NOT: Floresan üstel bozunumu içindeki fotonların minimum tepe sayısı, zamansal çözünürlük, IRF ve arka plan gürültüsü dahil olmak üzere sistem parametrelerine bağlıdır.
- Multifoton lazeri 890 nm'ye ayarlayın ve yeni dalga boyunda mod kilitlemesini bekleyin. Lazer üzerindeki deklanşörü açtıktan sonra hücrelerin zarar görmemesi için lazer için güç kontrolünün başlangıçta sıfıra ayarlandığından emin olun.
- 2.4-2.5 arasındaki adımları ek dört ila beş FOV'da yineleyin. Her görüntünün, görüntülenen konumlardan en az 2 FOV uzağa yerleştirildiğinden emin olun.
3. Siyanür deneyi hazırlama
- 80 mM (20x) sodyum siyanür çözeltisi oluşturmak için 130.24 mg sodyum siyanürü 25 mL PBS içinde çözün.
NOT: Siyanür toksiktir. Uygun kişisel koruyucu ekipman giyin. - Çanaktan 100 μL kültür ortamını aspire edin. Çanakta 4 mM'lik bir siyanür konsantrasyonu elde etmek için bunu 100 μL sodyum siyanür çözeltisi ile değiştirin.
- Hücrelerin siyanür çözeltisi ile reaksiyona girmesine izin vermek için hücreleri 5 dakika boyunca bir inkübatöre koyun.
- Siyanüre maruz kaldıktan sonra hücrelerin NAD (P) H ve FAD görüntülerini elde etmek için 2.4-2.6 arasındaki adımları tekrarlayın.
NOT: Siyanüre uzun süre maruz kalmak hücreleri öldürür. Postsiyanür görüntüleri, siyanür ilavesinden sonraki 30 dakika içinde elde edilir.
4. FLIM görüntü analizi
- FLIM yaşam boyu analiz yazılımını açın.
- Ölçülen IRF'yi elde etmek için üre görüntüsünü açın.
- Üre görüntüsünü içe aktarın. Görüntü analizi için kullanılacak üre kristalinin görüntüsünde bir nokta seçin. Ana yazılım arabiriminde bulunan Bin değişkenini değiştirerek, FLIM verilerini birden çok pikselden 1 veya daha yüksek piksellerden 1 veya daha yüksek bir değere entegre etmek için uzamsal depo değerini 100 foton > bir bozunma zirvesi için artırın.
- Verileri IRF olarak kaydedin.
- Başvurulan yazılımda, IRF başlıklı açılır menüye tıklayın, Decay Data'dan Kopyala'yı seçin. Bundan sonra, deney sırasında çekilen görüntünün görüntü analizinde kullanılmak üzere Panoya Kopyala'yı tıklayın.
- NAD(P)H ve FAD ömür boyu görüntülerin görüntü analizi
- Görüntü dosyasını floresan ömrü analiz yazılımına aktarın.
- Gerekirse yoğunluğu ve kontrastı değiştirerek hücreleri ve hücre altı bölmeleri görmek için görüntü görselleştirmeyi geliştirin.
- Seçenekler açılır menüsünü tıklayın ve Yoğunluk'u seçin. Burada, yoğunluğu ve kontrastı istediğiniz gibi değiştirin ve Tamam'ı tıklayın.
- IRF'yi üre görüntüsünden alın.
- IRF açılır menüsünü tıklayın ve Panodan Yapıştır'ı seçin.
- Multiexponential Decay parametrelerini ayarlayın50.
- Sitoplazma pikselleri için bozunmaları değerlendirmek üzere bir eşik değeri ayarlayın.
NOT: Burada 50 değeri kullanılmıştır. Değer, birkaç temsili arka plan ve çekirdek pikselinin floresan tepe değerleri ile birkaç sitoplazma pikselinin tepe değeri karşılaştırılarak seçildi. Çekirdek pikselleri ve sitoplazma pikselleri arasında bir değer eşik için seçildi.
- Sitoplazma pikselleri için bozunmaları değerlendirmek üzere bir eşik değeri ayarlayın.
- Shift değerinin IRF'yi floresanın yükselen kenarına göre hizaladığından emin olun. Gerekirse kaydırmayı, Ki-kare değerini en aza indiren bir değere ayarlayın.
- Uzamsal bölmeyi, sitoplazma piksellerinin floresan tepe değerlerinin 100 veya üzerinde olması için artırın.
NOT: Uzamsal bölmenin artırılması, uzamsal çözünürlüğün azalmasına neden olur. - Görüntüdeki tüm pikseller için floresan yaşam sürelerini hesaplayın.
- Başvurulan programda, Hesapla açılır menüsünü tıklatın | Bozunma Matrisi.
NOT: Başarı, genlik ağırlıklı floresan ömrüne yanlış renkli bir görüntü ile gösterilir.
- Başvurulan programda, Hesapla açılır menüsünü tıklatın | Bozunma Matrisi.
- Floresan ömür boyu verilerini kaydedin.
- Dosya açılır menüsüne tıklayın | İhracat. Analiz için istediğiniz parametreleri seçin ve Tamam'ı tıklatın. Resmi kaydedin.
- Görüntülenen floresan yaşam süresi metriğini, renk yapılandırmasını B-G-R olarak ayarlamak için Seçenekler açılır menüsünden Renk düğmesini seçin ve floresan ömrü görüntüsünün renk ölçeğini ayarlamak için belirli renk çubuğu minimum ve maksimum değerlerini ayarlayın.
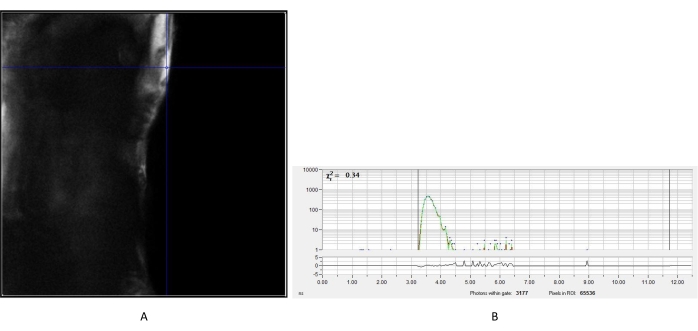
Şekil 2: Üre kristalinin IRF'si ölçüldü. (A) Üreden elde edilen yoğunluk görüntüsü. Hücrelerin floresan ömür boyu görüntülerinin daha sonraki analizi için IRF bozunma eğrisini (B) oluşturmak üzere temsili bir piksel seçildi. Kısaltma: IRF = enstrüman tepki fonksiyonu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Hücre segmentasyonu
NOT: Burada açıklanan protokol bir görüntü analiz yazılımı kullanır51. Temsili MCF-7 görüntüleri ve veri analiz kodu sağlanır52.- MCF7_Segmentation_Final.cpproj dosyası52 dosyasını indirin.
- Dosya MCF7_Segmentation'na tıklayarak | İşlem Hattını içe aktarın | içe aktar Dosyadan işlem hattı, MCF7_Segmentation_Final.cpproj dosyasını seçin.
- Görüntüler modülünü tıklayın ve bölümlere ayrılacak NAD(P)H yoğunluklu görüntüleri ekleyin.
NOT: Görüntüler .tif, .png veya .jpg formatında olmalıdır. - Sol alttaki Görüntüleri Analiz Et düğmesine basın.
NOT: İşlem hattı, farklı sistemlerde elde edilen görüntüler için optimizasyon gerektirebilir. Sorun giderme için aşağıdaki alt adımları deneyin- Farklı parametreleri test etmek için Test Modunu kullanın: Test Modunu Başlat'ı tıklatın ve modül adının yanındaki oynat düğmesini tıklatarak her modülü çalıştırın.
- İlk IdentifyPrimaryObjects modülünü tıklatın ve Nesnelerin tipik çapını, piksel birimleri (Min, Maks) cinsinden hücrelerin çapıyla eşleşecek şekilde ayarlayın.
NOT: MCF-7 hücreleri için, minimum ve maksimum için sırasıyla 10 ve 40 piksel kullanılmıştır. - EnhanceOrSuppressFeatures modülünü tıklatın ve seçilen Unsur türünün tanımlanmasını iyileştirmek için Unsur boyutunu ayarlayın.
NOT: MCF-7 hücreleri için 10 piksellik bir özellik boyutu kullanılmıştır. - İkinci EnhanceOrSuppressFeatures modülüne tıklayın ve nükleer bölgelerin geliştirilmesini optimize etmek için Delik boyutları aralığını ayarlayın.
NOT: MCF-7 hücreleri için 5-20 aralığı kullanılmıştır. - İkinci IdentifyPrimaryObjects modülünü tıklatın ve çekirdeklerin tanımlanmasını optimize etmek için parametreleri (Eşik stratejisi, Eşik yöntemi, Eşik yumuşatma ölçeği ve Eşik düzeltme faktörü) ayarlayın. En uygun ayarları belirlemek ve IdentifySecondaryObjects modülüne uygulamak için her parametrenin yanındaki ? işaretine tıklayın.
- FilterObjects modülüne tıklayın ve alan şeklini ayarlayın. Tanımlanacak alan şeklinin minimum ve maksimum pikselini seçin.
NOT: MCF-7 hücreleri için, maksimum ve minimum için sırasıyla 100 ve 500 kullanılmıştır. Çekirdeğin tanımlanması ve hücre sınırlarına yayılarak hücre segmentasyonu süreci Walsh ve Skala47 tarafından ayrıntılı olarak açıklanmaktadır.
- Hücre sitoplazma maskelerini kullanarak, görüntüdeki her hücre için floresan yaşam süresi çıktı değişkenlerinin ortalaması alınır.

Şekil 3: Tek tek hücrelerin tanımlanması ve segmentasyonu. MCF7 hücrelerinin (A) NAD(P)H yoğunluk görüntüsü, floresan ömür boyu görüntü entegre edilerek elde edilir. Hücreler, 60 s için 5 mW'ta 750 nm uyarma kullanılarak görüntülendi. X ve y eksenleri görüntünün piksel konumunu temsil eder. (A) Tek tek hücreler tanımlandı. Veri kümesindeki herhangi bir arka plan gürültüsünü ortadan kaldırmak için hücreler maskelendi (B). Çekirdek daha sonra tanımlandı (C) ve hücre maskesine (D) yansıtıldı. Hücreler daha sonra tipik hücrelerin boyutuna uymayan maskeli alanları çıkarmak için filtrelendi (E). Ölçek çubuğu = 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. Alternatif yöntem: Floresan yoğunluklu görüntüleme
- Deney sırasında kullanılacak ekipmanı açın.
NOT: Floresan yoğunluklu görüntüler geniş alan floresan mikroskopları, konfokal floresan mikroskopları veya çoklu foton mikroskopları ile elde edilebilir.- Kullanılacak mikroskobun NAD(P)H (tek foton dalga boyu ~370-405 nm: iki foton dalga boyu ~700-750 nm) ve FAD (tek foton dalga boyu ~488 nm, iki foton dalga boyu ~890 nm) için uygun bir uyarma kaynağına sahip olduğundan emin olun.
- Mikroskopta NAD (P) H emisyonunun (~ 400-500 nm) izolasyonu için bir filtreye sahip olduğundan emin olun.
NOT: 4',6-Diamidino-2-fenilindol (DAPI) ayarları genellikle NAD (P) H için çalışır. - Mikroskopta FAD emisyonunun (~ 500-600 nm) izolasyonu için bir filtreye sahip olduğundan emin olun.
NOT: Yeşil floresan protein (GFP) ayarları genellikle FAD için çalışır.
- Mikroskopu hazırlayın.
- Parlak alan lambasını açın. Işığın göz merceğinin içine girdiğinden emin olun. Gerekirse ilgili hedefin üzerine 1 damla uygun daldırma ortamı uygulayın.
- Numuneleri herhangi bir müdahale olmadan düzgün bir şekilde yerleştirmek için hedefi aşağı doğru hareket ettirin. Petri kabını sahneye düzgün bir şekilde yerleştirin. Numunenin güvenli olduğundan ve görüntüleme sırasında hareket etmeyeceğinden emin olun.
NOT: Görüntü elde etme sırasında ısı, nem ve CO2 seviyelerini korumak için hücrelerin bir çevre odasına yerleştirilmesi önerilir, çünkü bu parametreler hücresel metabolizmayı etkileyebilir. - Numuneyi hedefle ortalayın. Bu yapıldıktan sonra, göz merceğine bakın ve hücreler odakta görünene kadar hedefi hareket ettirin.
- Yoğunluk görüntülemeye başlayın.
- Görüntüleme yazılımını açın ve görüntü alma yazılımındaki Yakala sekmesine tıklayarak ve NAD(P)H uyarma ve emisyon filtresini mikroskop taretine yerleştirerek NAD(P)H'yi yakalamak için uyarma ve emisyon yapılandırmasını ayarlayın.
NOT: NAD(P)H görüntüleme için 357/44 uyarma filtresi, 409 longpass dikroik ve 447/60 emisyon filtresi kullanılmıştır. - Uyarma aydınlatmasını ve dedektör parametrelerini optimize edin. Ağartma bir sorunsa, aydınlatma yoğunluğunu azaltın ve görüntü entegrasyon süresini artırın.
NOT: NAD(P)H zayıf bir sinyaldir; Çok fazla güç kullanılırsa ağartmaya dikkat edin. - İstediğiniz görüntü boyutunda bir NAD(P)H görüntüsü alın. Görüntünün kaydedildiğinden emin olun.
- FAD'yi yakalamak için uyarma ve emisyon konfigürasyonunu ayarlayın. Uyarma aydınlatmasını ve dedektör parametrelerini optimize edin.
NOT: FAD görüntüleme için 458/64 uyarma filtresi, 495 longpass dikroik ve 550/88 emisyon filtresi kullanılmıştır. - Bir FAD görüntüsü edinin. Görüntünün kaydedildiğinden emin olun.
NOT: NAD(P)H ve FAD görüntü alma parametreleri (aydınlatma yoğunluğu, görüntü boyutu, dedektör kazancı) görüntüleme deneyi boyunca aynı kalmalıdır. - İşlemi, görüntülenen konumlardan en az 2 FOV uzağa yerleştirilmiş beş konumda daha tekrarlayın.
- Görüntüleme yazılımını açın ve görüntü alma yazılımındaki Yakala sekmesine tıklayarak ve NAD(P)H uyarma ve emisyon filtresini mikroskop taretine yerleştirerek NAD(P)H'yi yakalamak için uyarma ve emisyon yapılandırmasını ayarlayın.
- Görüntü düzeyinde redoks oranı veri analizi
- NAD(P)H ve FAD yoğunluklu görüntüleri bir görüntü işleme programında açın.
- Sitoplazma piksellerini korumak için NAD(P)H üzerinde bir eşik belirleyin ve arka plan ve çekirdek piksellerini 0 olarak ayarlayın.
- Eşikli NAD(P)H görüntüsünü kullanarak her pikselde FAD/(NAD(P)H+FAD) denklemini değerlendirerek redoks oranı görüntüsünü hesaplayın.
- 0 olmayan piksellerin ortalama değerini hesaplayın.
NOT: Bu adımlar görüntü analiz yazılımında gerçekleştirilebilir veya doğrudan komut dosyalarıyla kodlanabilir.
- Hücre düzeyinde redoks oranı analizi
- Her NAD(P)H görüntüsündeki hücrelerin maske görüntüsünü elde etmek için 4.3.1-4.3.5 adımlarını izleyin.
- Her pikselde FAD/(NAD(P)H+FAD) denklemini değerlendirerek redoks oranı görüntüsünü hesaplayın.
- Hücre sitoplazma maskesini kullanarak, görüntüdeki her hücre için tüm pikseller için redoks oranının ortalamasını alın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Epitelyal meme kanseri hücre hattı MCF-7, DMEM'de %10 fetal sığır serumu (FBS) ve %1 penisilin-streptomisin ile desteklenerek kültüre alındı. Floresan görüntüleme için, hücreler görüntülemeden 48 saat önce 35 mm cam tabanlı görüntüleme kabı başına 4 × 105 hücre yoğunluğunda tohumlandı. Hücreler, yukarıda belirtilen protokoller kullanılarak siyanür tedavisinden önce ve sonra görüntülendi. Siyanür deneyinin amacı, NAD (P) H ve FAD floresansının spektral izolasyonunu doğ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Otofloresan yoğunluğu ve ömür boyu görüntüleme, hücrelerdeki metabolizmayı değerlendirmek için yaygın olarak kullanılmaktadır21,55. FLIM yüksek çözünürlüktedir ve bu nedenle kanser çalışmaları için önemli olan tek hücreleri çözer, çünkü hücresel heterojenlik tümör saldırganlığına ve ilaç direncine katkıda bulunur7,39,41,44,45,46,58.
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Finansman kaynakları arasında Teksas Kanser Önleme ve Araştırma Enstitüsü (CPRIT RP200668) ve Texas A & M Üniversitesi bulunmaktadır. Şekil 1, BioRender.com ile oluşturulmuştur.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-deoxy-d-glucose (2-DG) | Sigma | AC111980000; AC111980010; AC111980050; AC111980250 | |
| Antibiotic Antimicrobial (pen-strep) | Gibco | 15240096 | |
| Cell Samples | American Type Culture Collection | N/A | MCF-7 cancer line |
| CellProfiler | Broad Institute | N/A | Image analysis software |
| Conical Tube | VWR | 89039-664 | 15 mL conical tube |
| DMEM | ThermoFisher | 11965092 | Culture media |
| FAD dichroic mirror | Semrock | FF495-Di03-25x36 | 495 nm |
| FAD emission filter | Semrock | FF01-550/88-25 | 550/88 nm |
| FAD excitation filter | Semrock | FF01-458/64-25 | 458/64 nm |
| FBS | ThermoFisher | 16000036 | |
| Fluorescence Lifetime Microscope | 3i | N/A | |
| Glass bottom dish | MatTek Corp | P35G-1.0-14-C | |
| Multiphoton Laser | Coherent | N/A | 2P Coherent Laser, Tunable 680 nm-1080 nm |
| NAD(P)H dichroic mirror | Semrock | FF409-Di03-25x36 | 409 nm |
| NAD(P)H emission filter | Semrock | FF02-447/60-25 | 447/60 nm |
| NAD(P)H excitation filter | Semrock | FF01-357/44-25 | 357/44 nm |
| PBS | ThermoFisher | 70011044 | |
| Potassium Cyanide | Sigma-Aldrich | 380970 | |
| SlideBooks 6 | 3i | N/A | Image acquisition software |
| SPCImage | Becker & Hickl GmbH | N/A | Fluorescence lifetime analysis software |
| Stage Top Incubator | okoLab | N/A | |
| Trypsin | Biosciences | 786-262 | |
| Urea | Sigma-Aldrich | U5128 | |
| YG beads | Polysciences | 19096-2 | Yg microspheres (20.0 µm) |
Referanslar
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomarkers in Medicine. 4 (2), 241-263 (2010).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Zheng, J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation (Review). Oncology Letters. 4 (6), 1151-1157 (2012).
- Potter, M., Newport, E., Morten, K. J. The Warburg effect: 80 years on. Biochemical Society Transactions. 44 (5), 1499-1505 (2016).
- Zhao, Y., Butler, E. B., Tan, M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death and Disease. 4 (3), 532(2013).
- Patel, S., Ahmed, S. Emerging field of metabolomics: Big promise for cancer biomarker identification and drug discovery. Journal of Pharmaceutical and Biomedical Analysis. 107, 63-74 (2015).
- Walsh, A. J., Cook, R. S., Skala, M. C. Functional optical imaging of primary human tumor organoids: Development of a personalized drug screen. Journal of Nuclear Medicine. 58 (9), 1367-1372 (2017).
- Zaal, E. A., Berkers, C. R. The influence of metabolism on drug response in cancer. Frontiers in Oncology. 8, 500(2018).
- Little, A. C., et al. High-content fluorescence imaging with the metabolic flux assay reveals insights into mitochondrial properties and functions. Communications Biology. 3 (1), 271(2020).
- Wang, X., et al. Comparison of magnetic resonance spectroscopy and positron emission tomography in detection of tumor recurrence in posttreatment of glioma: A diagnostic meta-analysis. Asia-Pacific Journal of Clinical Oncology. 11 (2), 97-105 (2015).
- Nabi, H. A., Zubeldia, J. M. Clinical applications of 18F-FDG in oncology. Journal of Nuclear Medicine Technology. 30 (1), 3-9 (2002).
- Kostakoglu, L., Agress, H., Goldsmith, S. J. Clinical role of FDG PET in evaluation of cancer patients. Radiographics. 23 (2), 315-340 (2003).
- Hoh, C. K. Clinical use of FDG PET. Nuclear Medicine and Biology. 34 (7), 737-742 (2007).
- van de Weijer, T., Schrauwen-Hinderling, V. B. Application of magnetic resonance spectroscopy in metabolic research. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1865 (4), 741-748 (2019).
- Huang, S., Heikal, A. A., Webb, W. W. Two-photon fluorescence spectroscopy and microscopy of NAD(P)H and Flavoprotein. Biophysical Journal. 82, 2811-2825 (2002).
- Lagarto, J. L., et al. Characterization of NAD(P)H and FAD autofluorescence signatures in a Langendorff isolated-perfused rat heart model. Biomedical Optics Express. 9 (10), 4961-4978 (2018).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. , Springer. Boston, MA. (2013).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proceedings of the National Academy of the Sciences of the United States of America. 89 (4), 1271-1275 (1992).
- Nakashima, N., Yoshihara, K., Tanaka, F., Yagi, K. Picosecond fluorescence lifetime of the coenzyme of D-amino acid oxidase. Journal of Biological Chemistry. 255 (11), 5261-5263 (1980).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomedical Optics Express. 11 (10), 5674-5688 (2020).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (7), 1-43 (2020).
- Liu, Z., et al. Mapping metabolic changes by noninvasive, multiparametric, high-resolution imaging using endogenous contrast. Science Advances. 4 (3), (2018).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Cancer Research. 74 (11), 3067-3075 (2014).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. Journal of Biological Chemistry. 254 (11), 4764-4771 (1979).
- Sharick, J. T., et al. Protein-bound NAD(P)H lifetime is sensitive to multiple fates of glucose carbon. Scientific Reports. 8 (1), 5456(2018).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19494-19499 (2007).
- Skala, M. C., et al. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. Journal of Biomedical Optics. 12 (2), 024014(2007).
- Uchugonova, A. A., König, K. Two-photon autofluorescence and second-harmonic imaging of adult stem cells. Journal of Biomedical Optics. 13 (5), 054068(2008).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nature Methods. 11 (11), 1161-1169 (2014).
- Walsh, A. J., et al. Classification of T-cell activation via autofluorescence lifetime imaging. Nature Biomedical Engineering. 5 (1), 77-88 (2021).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Cancer Research. 80 (23), 5408-5423 (2020).
- Pavillon, N., Hobro, A. J., Akira, S., Smith, N. I. Noninvasive detection of macrophage activation with single-cell resolution through machine learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 2676-2685 (2018).
- Chang, C. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- Kaech, S. M., Cui, W. Transcriptional control of effector and memory CD8+ T cell differentiation. Nature Reviews. Immunology. 12 (11), 749-761 (2012).
- Gómez, C. A., Fu, B., Sakadžić, S., Yaseena, M. A. Cerebral metabolism in a mouse model of Alzheimer's disease characterized by two-photon fluorescence lifetime microscopy of intrinsic NADH. Neurophotonics. 5 (4), 045008(2018).
- Yaseen, M. A., et al. In vivo imaging of cerebral energy metabolism with two-photon fluorescence lifetime microscopy of NADH. Biomedical Optics Express. 4 (2), 307-321 (2013).
- Bower, A. J., et al. High-speed label-free two-photon fluorescence microscopy of metabolic transients during neuronal activity. Applied Physics Letters. 118 (8), 081104(2021).
- Walsh, A. J., et al. Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer. Cancer Research. 74 (18), 5184-5194 (2014).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Cancer Research. 73 (20), 6164-6174 (2013).
- Chowdary, M. V. P., et al. Autofluorescence of breast tissues: Evaluation of discriminating algorithms for diagnosis of normal, benign, and malignant conditions. Photomedicine and Laser Surgery. 27 (2), 241-252 (2009).
- Demos, S. G., Bold, R., White, R. D., Ramsamooj, R. Investigation of near-infrared autofluorescence imaging for the detection of breast cancer. IEEE Journal of Selected Topics in Quantum Electronics. 11 (4), 791-798 (2005).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Cancer Research. 80 (23), 5408-5423 (2020).
- Sharick, J. T., et al. Cellular metabolic heterogeneity in vivo is recapitulated in tumor organoids. Neoplasia. 21 (6), 615-626 (2019).
- Shah, A. T., Diggins, K. E., Walsh, A. J., Irish, J. M., Skala, M. C. In vivo autofluorescence imaging of tumor heterogeneity in response to treatment. Neoplasia. 17 (12), 862-870 (2015).
- Walsh, A. J., Skala, M. C. Optical metabolic imaging quantifies heterogeneous cell populations. Biomedical Optics Express. 6 (2), 559-573 (2015).
- Walsh, A. J., Skala, M. C. An automated image processing routine for segmentation of cell cytoplasms in high-resolution autofluorescence images. Multiphoton Microscopy in the Biomedical Sciences XIV. , (2014).
- Skala, M., Ramanujam, N. Methods in Molecular Biology. 594, 155-162 (2010).
- Stringari, C., et al. Multicolor two-photon imaging of endogenous fluorophores in living tissues by wavelength mixing. Scientific Reports. 7, 3792(2017).
- SPCImage 2.9: Data analysis software for fluorescence lifetime imaging microscopy. SPCImage. , Available from: https://biology.uiowa.edu/sites/biology.uiowa.edu/files/SPCIMAGE29.pdf (2007).
- CellProfiler. , Available from: https://cellprofiler.org/releases (2007).
- Autofluorescence Imaging. GitHub. , Available from: https://github.com/walshlab/Autofluorescence-Imaging (2021).
- Ramey, N. A., Park, C. Y., Gehlbach, P. L., Chuck, R. S. Imaging mitochondria in living corneal endothelial cells using autofluorescence microscopy. Photochemistry and Photobiology. 83 (6), 1325-1329 (2007).
- Walsh, A., Cook, R. S., Rexer, B., Arteaga, C. L., Skala, M. C. Optical imaging of metabolism in HER2 overexpressing breast cancer cells. Biomedical Optics Express. 3 (1), 75-85 (2012).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxidants & Redox Signaling. 30, 875-889 (2019).
- Bird, D. K., et al. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of the coenzyme NADH. Cancer Research. 65, 8766-8773 (2005).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Cancer Research. 73 (20), 6164-6174 (2013).
- Walsh, A. J., Castellanos, J. A., Nagathihalli, N. S., Merchant, N. B., Skala, M. C. Optical imaging of drug-induced metabolism changes in murine and human pancreatic cancer organoids reveals heterogeneous drug response. Pancreas. 45 (6), 863-869 (2016).
- Gubser, P. M., et al. Rapid effector function of memory CD8+ T cells requires an immediate-early glycolytic switch. Nature Immunology. 14 (10), 1064-1072 (2013).
- Papalexi, E., Satija, R. Single-cell RNA sequencing to explore immune cell heterogeneity. Nature Review. Immunology. 18 (1), 35-45 (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. The Journals of Gerontology: Series A. 67 (10), 1022-1035 (2012).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-protocol. 8 (10), 2850(2018).
- Becker, W. The bh TCSPC Handbook. , Available from: https://www.becker-hickl.com/wp-content/uploads/2021/10/SPC-handbook-9ed-05a.pdf (2021).
- Gadella, T. W. J. Fluorescent and Luminescent Probes for Biological Activity. Mason, W. T. 34, Ch. 34 467-479 (1999).
- Miller, D. R., Jarrett, J. W., Hassan, A. M., Dunna, A. K. Deep tissue iImaging with multiphoton fluorescence microscopy. Current Opinion in Biomedical Engineering. 4, 32-39 (2017).
- Berezin, M. Y., Achilefu, S. Fluorescence lifetime measurements and biological imaging. Chemical Reviews. 110 (5), 2641-2684 (2010).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır