Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie par autofluorescence pour évaluer le métabolisme cellulaire
Dans cet article
Résumé
Ce protocole décrit l’imagerie par fluorescence et l’analyse des coenzymes métaboliques endogènes, du dinucléotide réduit en nicotinamide adénine (phosphate) (NAD(P)H) et du dinucléotide de flavine adénine oxydé (FAD). L’imagerie par autofluorescence du NAD(P)H et du FAD fournit une méthode non destructive sans étiquette pour évaluer le métabolisme cellulaire.
Résumé
Le métabolisme cellulaire est le processus par lequel les cellules génèrent de l’énergie, et de nombreuses maladies, y compris le cancer, sont caractérisées par un métabolisme anormal. La réduction de la nicotinamide adénine (phosphate), du dinucléotide (NAD(P)H) et de la flavine adénine dinucléotide (FAD) oxydée sont des coenzymes de réactions métaboliques. Le NAD(P)H et le FAD présentent une autofluorescence et peuvent être isolés spectralement par des longueurs d’onde d’excitation et d’émission. Les deux coenzymes, NAD(P)H et FAD, peuvent exister dans une configuration libre ou liée aux protéines, chacune ayant une durée de vie de fluorescence distincte - le temps pendant lequel le fluorophore reste à l’état excité. L’imagerie par durée de vie de fluorescence (FLIM) permet de quantifier l’intensité de fluorescence et la durée de vie du NAD(P)H et du FAD pour une analyse sans étiquette du métabolisme cellulaire. L’intensité de fluorescence et la durée de vie des microscopes peuvent être optimisés pour l’imagerie NAD(P)H et FAD en sélectionnant les longueurs d’onde d’excitation et d’émission appropriées. Les perturbations métaboliques par le cyanure vérifient les protocoles d’imagerie par autofluorescence pour détecter les changements métaboliques dans les cellules. Cet article démontrera la technique d’imagerie par autofluorescence du NAD(P)H et du FAD pour mesurer le métabolisme cellulaire.
Introduction
Le métabolisme est le processus cellulaire de production d’énergie. Le métabolisme cellulaire englobe de multiples voies, y compris la glycolyse, la phosphorylation oxydative et la glutaminolyse. Les cellules saines utilisent ces voies métaboliques pour générer de l’énergie pour la prolifération et la fonction, comme la production de cytokines par les cellules immunitaires. De nombreuses maladies, y compris les troubles métaboliques, le cancer et la neurodégénérescence, sont caractérisées par une altération du métabolisme cellulaire1. Par exemple, certains types de cellules cancéreuses ont des taux élevés de glycolyse, même en présence d’oxygène, pour générer des molécules pour la synthèse d’acides nucléiques, de protéines et de lipides2,3. Ce phénomène, connu sous le nom d’effet Warburg, est une caractéristique de nombreux types de cancer, y compris le cancer du sein, le cancer du poumon et les glioblastomes4. En raison des altérations du métabolisme cellulaire associées à la progression du cancer, le métabolisme cellulaire peut être un biomarqueur de substitution de la réponse aux médicaments5,6. De plus, la compréhension de l’efficacité des médicaments au niveau cellulaire est cruciale, car l’hétérogénéité cellulaire peut entraîner des réponses différentes aux médicaments chez les individus7,8.
Les technologies qui identifient et quantifient les changements dans le métabolisme cellulaire sont essentielles pour les études sur le cancer et la réponse aux médicaments. Les analyses chimiques et protéiques sont utilisées pour évaluer le métabolisme des cellules ou des tissus, mais manquent de résolution unicellulaire et d’informations spatiales. Les tests basés sur des lecteurs de plaques métaboliques peuvent mesurer le pH et la consommation d’oxygène dans l’échantillon au fil du temps et la perturbation métabolique subséquente par les produits chimiques. Le pH peut être utilisé pour calculer le taux d’acidification extracellulaire (ECAR), ce qui donne un aperçu de l’activité glycolytique des cellules9. Les méthodes d’imagerie du corps entier, y compris la tomographie par émission de positons 2-[fluor-18] fluoro-D-glucose (FDG PET) et la spectroscopie par résonance magnétique (MRS), sont des modalités d’imagerie non invasives utilisées cliniquement pour identifier la récidive tumorale et l’efficacité des médicaments par des mesures métaboliques10,11,12,13,14.
FDG-PET image l’absorption tissulaire de FDG, un analogue du glucose radiomarqué. L’absorption accrue de FDG-PET par les tumeurs par rapport aux tissus environnants est due à l’effet Warburg12,13. MRS image les noyaux communs des molécules utilisées pour le métabolisme, telles que le 13C et le 31P, et peut obtenir des informations dynamiques sur la façon dont le métabolisme change en réponse à des stimuli, tels que l’exercice ou l’alimentation14. Bien que fdG-PET et MRS puissent être utilisés cliniquement, ces technologies n’ont pas la résolution spatiale nécessaire pour résoudre l’hétérogénéité intratumorale. De même, les mesures de consommation d’oxygène sont effectuées sur une population en vrac de cellules. L’imagerie par autofluorescence surmonte l’obstacle de résolution spatiale de ces technologies et fournit une méthode non invasive de quantification du métabolisme cellulaire.
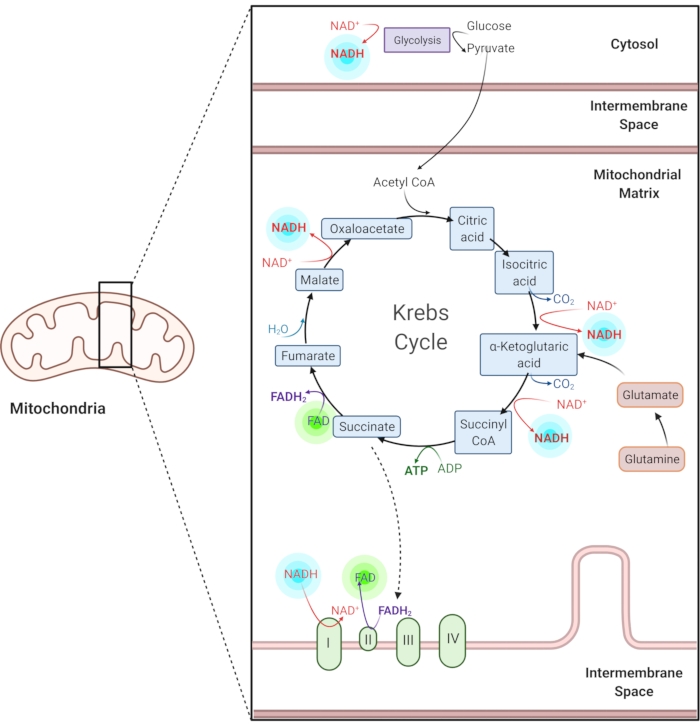
Figure 1 : NADH et FAD dans les voies métaboliques courantes. Le NADH et le FAD sont des coenzymes utilisées dans la glycolyse, le cycle de Krebs et la chaîne de transport d’électrons. L’imagerie par autofluorescence de ces molécules fournit des informations sur le métabolisme cellulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La nicotinamide adénine (phosphate) dinucléotide (NAD(P)H) réduite et la flavine adénine dinucléotide (FAD) oxydée sont des coenzymes de réactions métaboliques, y compris la glycolyse, la phosphorylation oxydative et la glutaminolyse (Figure 1). Le NAD(P)H et le FAD sont tous deux autofluorescents et fournissent un contraste endogène pour l’imagerie par fluorescence1,15. Le NADPH a des propriétés fluorescentes similaires à celles du NADH. Pour cette raison, nad(P)H est souvent utilisé pour représenter le signal combiné du NADH et du NADPH2,16.
L’imagerie de la durée de vie de la fluorescence (FLIM) quantifie la durée de vie de la fluorescence ou le temps pendant lequel un fluorophore est à l’état excité. Les durées de vie de la fluorescence sont sensibles au microenvironnement des fluorophores et fournissent des informations sur le métabolisme cellulaire17. Le NAD(P)H et le FAD peuvent exister dans les cellules dans des conformations liées aux protéines ou libres, chacune ayant une durée de vie différente. Le NAD(P)H libre a une durée de vie plus courte que le NAD(P)H lié aux protéines; à l’inverse, le FAD libre a une durée de vie plus longue que le FAD lié18,19. Les durées de vie et les poids des composants à vie peuvent être quantifiés à partir des données de désintégration de la durée de vie de la fluorescence via Eq. (1)20:
I(t) = α 1e-t/τ1 + α 2e-t/τ2 + C (1)
Eq (1) représente l’intensité de fluorescence normalisée en fonction du temps. Les α 1 et α 2 de cette équation représentent les composantes proportionnelles des durées de vie courtes et longues (α 1+ α 2=1), respectivement, τ1 et τ2 représentent les durées de vie courtes et longues, respectivement, et C représente la lumière de fond7,20. La durée de vie pondérée en fonction de l’amplitude, représentée ici par τm, est calculée à l’aide de Eq. (2).
τm= α 1τ1+ α 2τ2 (2)
Une durée de vie moyenne peut être calculée en faisant la moyenne de « t » sur la désintégration d’intensité du fluorophore, qui pour une désintégration à deux exponentielles est montrée par Eq. (3)17,21.
τ*m= (α 1τ12+ α 2τ22)/ (α 1τ1+ α 2τ2) (3)
Une image d’intensité de fluorescence peut être calculée à partir de l’image de durée de vie en intégrant la désintégration de la durée de vie de fluorescence. L’imagerie par autofluorescence est une méthode non destructive et sans étiquette qui peut être utilisée pour caractériser le métabolisme des cellules vivantes à une résolution subcellulaire. Le rapport redox optique fournit une métrique analogique optique de l’état redox chimique de la cellule et est calculé comme le rapport des intensités NAD(P)H et FAD. Bien que la formule de calcul du rapport redox optique ne soit pas normalisée22,23,24,25, elle est définie ici comme l’intensité de la DCP par rapport aux intensités combinées de NAD(P)H et de FAD. Cette définition est utilisée parce que l’intensité totale dans le dénominateur normalise la métrique entre 0 et 1, et le résultat attendu de l’inhibition du cyanure est une diminution du rapport redox. Les durées de vie en fluorescence du NAD(P)H libre et du FAD donnent un aperçu des changements dans le microenvironnement du solvant métabolique, y compris le pH, la température, la proximité de l’oxygène et l’osmolarité17.
Les changements dans la durée de vie de fluorescence des fractions liées de NAD(P)H et de FAD peuvent indiquer l’utilisation de la voie métabolique et le métabolisme spécifique du substrat26. Les poids des composants peuvent être interprétés pour les changements dans la fraction libre à la fraction liée des coenzymes18,19. Dans l’ensemble, ces mesures quantitatives de la durée de vie de l’autofluorescence permettent l’analyse du métabolisme cellulaire, et l’imagerie par autofluorescence a été utilisée pour identifier les néoplasmes des tissus normaux27,28, caractériser les cellules souches29,30, évaluer la fonction des cellules immunitaires31,32,33,34,35, évaluer l’activité neurologique36, 37,38, et comprendre l’efficacité des médicaments dans les types de cancer tels que le cancer du sein et le cancer de la tête et du cou21,39,40,41,42. L’imagerie par autofluorescence à haute résolution peut être combinée à la segmentation d’images pour l’analyse unicellulaire et la quantification de l’hétérogénéité intrapopulation43,44,45,46,47.
Le NAD(P)H et le FAD peuvent être imagés sur des microscopes à fluorescence monophotonique ou multiphotonique configurés pour l’imagerie d’intensité ou de durée de vie. Pour les microscopes monophotoniques, le NAD(P)H et le FAD sont généralement excités à des longueurs d’onde de 375-405 nm et 488 nm, respectivement, en raison de sources laser courantes à ces longueurs d’onde48. Dans l’excitation par fluorescence à deux photons, le NAD(P)H et le FAD s’exciteront à des longueurs d’onde d’environ 700 à 750 nm et de 700 à 900 nm, respectivement15,49. Une fois les fluorophores excités, le NAD(P)H et le FAD émettent des photons à des longueurs d’onde comprises respectivement entre ~410 nm et ~510 nm à ~640 nm15. Les longueurs d’onde d’émission maximales NAD(P)H et FAD sont respectivement d’environ 450 nm et 535 nm48.
En raison de leurs différentes longueurs d’onde d’excitation et d’émission, la fluorescence des deux coenzymes métaboliques peut être isolée spectralement. Une compréhension des caractéristiques spectrales du NAD(P)H et du FAD est nécessaire pour la conception et l’optimisation des protocoles d’imagerie par autofluorescence. Le cyanure est un inhibiteur IV du complexe IV de la chaîne de transport d’électrons (ETC). Les effets du cyanure sur le métabolisme cellulaire et les intensités d’autofluorescence et la durée de vie du NAD(P)H et du FAD dans les cellules sont bien caractérisés27,40. Par conséquent, une expérience de perturbation du cyanure est un moyen efficace de valider les protocoles d’imagerie NAD(P)H et FAD. Une expérience réussie sur le cyanure permet de s’assurer que le protocole d’imagerie NAD(P)H et FAD peut être utilisé pour évaluer le métabolisme de groupes inconnus ou de perturbations.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Placage cellulaire pour l’imagerie
- Aspirer le milieu à partir d’une fiole T-75 confluente à 80-90% de cellules MCF-7, rincer les cellules avec 10 mL de solution saline stérile tamponnée au phosphate (PBS) et ajouter 2 mL de trypsine à 0,25% (1x) pour détacher les cellules du fond de la fiole.
- Incuber la fiole à 37 °C pendant environ 4 min. Vérifiez les cellules au microscope pour confirmer le détachement.
- Ajouter immédiatement 8 mL de milieu de culture pour désactiver la trypsine.
- Recueillir les cellules dans un tube conique (15 mL ou 50 mL). Comptez les cellules à l’aide d’un hémocytomètre.
- Centrifugez les cellules de 200 × g pendant 5 min.
- Une fois centrifugé, aspirer le surnageant. Remettre en suspension la pastille de cellules dans 1 mL de milieu de culture et ensemencer 4 × 105 cellules sur une boîte d’imagerie à fond de verre de 35 mm (ou le porte-échantillon approprié pour le microscope utilisé).
- Ajouter 2 mL de milieu de culture à la boîte d’imagerie pour maintenir le métabolisme cellulaire.
- Incuber les cellules à 37 °C avec 5 % de CO2 pendant 24 à 48 h avant l’imagerie pour que les cellules adhèrent et atteignent la phase de croissance logarithmique.
REMARQUE: La phase de croissance a été déterminée par l’expérience antérieure avec ces cellules et confirmée par la fiche technique des cellules.
2. Imagerie FLIM multiphotonique du NAD(P)H et du FAD
- Allumez tous les composants du microscope à fluorescence multiphotonique à vie, y compris le microscope, la source laser et les détecteurs utilisés.
- Placement de l’échantillon
- Allumez la lampe à champ lumineux. Assurez-vous que la lumière pénètre dans l’oculaire. Choisissez un objectif, généralement 20x, 40x ou 100x pour l’imagerie cellulaire. Appliquer 1 goutte du milieu d’immersion approprié sur le dessus de l’objectif [sauter si vous utilisez un objectif aérien].
- Déplacez l’objectif vers le bas pour placer correctement l’échantillon sans toucher l’objectif. Placez le plat à fond de verre sur le porte-échantillon sur la scène du microscope. Assurez-vous que l’échantillon est sécurisé et ne bougera pas pendant l’imagerie.
- Centrez l’échantillon avec l’objectif à l’aide de la commande d’étage X-Y. Une fois cela fait, regardez dans l’oculaire et déplacez l’objectif vers le haut pour vous concentrer sur les cellules.
- Si le microscope se trouve dans un boîtier, fermez la porte de la boîte à lumière. Ouvrez le logiciel d’acquisition d’images, cliquez sur l’onglet Imagerie multiphotonique et définissez les paramètres d’imagerie multiphotonique suivants : taille de l’image = 256 x 256 pixels ; temps de séjour en pixels = 4-25 μs; temps total d’acquisition d’image = ~60 s; gain de détecteur optimisé pour le comptage de photons uniques = 85% (spécifique au système utilisé).
- Imagerie de la fonction de réponse de l’instrument (IRF) et de la norme de durée de vie fluorescente
- Placez les cristaux d’urée sur un plat à fond de verre et fixez le couvercle du plat avec du ruban adhésif ou un parafilm.
REMARQUE: Les cristaux d’urée restent stables à température ambiante pendant des mois. - Imagez les cristaux d’urée.
- Placez la boîte d’urée sur la scène du microscope et concentrez-vous sur un cristal d’urée.
- Réglez la longueur d’onde du laser d’excitation sur 900 nm.
- Utilisez un filtre d’émission qui capture des longueurs d’onde de 450 nm.
- Obtenez une image de fluorescence à vie du cristal d’urée avec une puissance laser à l’échantillon <1 mW et utilisez les paramètres d’imagerie recommandés mentionnés à l’étape 2.2.4.
- Imagez les perles jaune-vert (YG) comme norme de durée de vie de fluorescence.
- Créez une lame de perle YG en diluant la solution de perles YG 1:1 000 dans de l’eau stérile. Placez un petit volume (~30 μL) sur une glissière ou un plat à fond de verre. Couvrez avec un couvercle et scellez les bords du couvercle avec du vernis à ongles transparent.
- Placez la lame de perle YG sur l’étage du microscope avec le côté couvercle de la lame vers l’objectif.
- Réglez la longueur d’onde du laser d’excitation à 890 nm
- Utilisez un filtre d’émission qui capture des longueurs d’onde d’environ 500 à 600 nm.
- Obtenez une image de fluorescence à vie de la bille YG à l’aide d’une puissance laser à l’échantillon <1 mW et des paramètres d’image recommandés [étape 2.2.4].
- Vérifiez la durée de vie de la perle à l’aide de l’IRF de l’urée. Si la durée de vie n’est pas d’environ 2,1 ns, vérifiez si la perle est en contact avec une autre perle contribuant à la trempe par fluorescence, si la solution de billes a séché, si la perle est floue, si l’IRF n’est pas précise ou si le décalage entre l’IRF et la désintégration de fluorescence n’est pas optimisé [voir étape 4.2.4].
REMARQUE: La durée de vie de ~ 2,1 ns est stable dans le temps.
- Placez les cristaux d’urée sur un plat à fond de verre et fixez le couvercle du plat avec du ruban adhésif ou un parafilm.
- Imagerie NAD(P)H
- Placez la boîte à fond de verre avec les cellules sur la scène du microscope et concentrez-vous sur les cellules.
REMARQUE: Il est recommandé de placer les cellules dans une chambre environnementale pour maintenir les niveaux de chaleur, d’humidité et de CO2 lors de l’acquisition d’images, car ces paramètres peuvent influencer le métabolisme cellulaire. - Ajustez le gain du détecteur à la valeur optimale pour FLIM. De plus, modifiez le temps de séjour souhaité - un paramètre indiquant le temps que le laser passe à chaque pixel de l’échantillon.
REMARQUE : Ces paramètres doivent rester les MÊMES tout au long du reste de la procédure. Il s’agit d’assurer la cohérence de l’éclairage laser et des paramètres du détecteur pour assurer la validité des mesures basées sur l’intensité, qui dépendent de la puissance du laser, des paramètres de balayage et du gain du détecteur. Il existe un gain de détecteur optimisé pour le fonctionnement des détecteurs en mode de comptage de photons uniques; la valeur est de 85 % pour le système référencé. - Réglez le laser multiphoton sur 750 nm. Assurez-vous que le contrôle de puissance du laser est initialement réglé à zéro afin que les cellules ne soient pas endommagées lors de l’ouverture de l’obturateur sur le laser.
REMARQUE: L’excitation à 750 nm est recommandée pour le NAD(P)H, bien qu’il ait une large absorption à 700-750 nm. L’excitation à 890 nm est recommandée pour le FAD, bien qu’il ait une large absorption à 700-900 nm. - Réglez ou sélectionnez un filtre d’émission pour collecter les longueurs d’onde d’émission à ~400-500 nm.
- Commencez à créer des images de manière focalisée ou en direct pour optimiser les paramètres de l’image.
REMARQUE: Le laser fonctionne maintenant. N’ouvrez pas le boîtier du microscope à ce stade. Portez un équipement de protection individuelle approprié. - Augmentez lentement la puissance du laser à ~ 3-8 mW à l’échantillon tout en vous assurant que les cellules sont au point. Une fois réglé, notez la puissance maximale utilisée. Utilisez ce paramètre d’alimentation pour l’imagerie sur d’autres segments de la boîte de Petri pour l’imagerie NAD(P)H.
REMARQUE: Il est important de mesurer la puissance laser à l’échantillon ou à une fenêtre de prélèvement et de ne pas compter sur la tension de la cellule pockels car les cellules pockels ne sont pas stables. Souvent, la puissance du laser est surveillée pendant l’imagerie avec une fenêtre de prélèvement plutôt qu’à l’échantillon. À l’aide d’un deuxième capteur de puissance à l’objectif, la relation entre la puissance à la fenêtre de prélèvement et la puissance à l’échantillon peut être utilisée pour estimer la puissance approximative à l’échantillon à partir des mesures de la fenêtre de prélèvement. - Collectez une image NAD(P)H FLIM avec un temps d’intégration d’image de 60 s.
- Vérifiez que l’image contient suffisamment de photons (pic d’environ 100 photons pour un pixel de cytoplasme) dans la courbe de désintégration de la durée de vie de la fluorescence. Si le nombre de photons est trop faible, augmentez la puissance laser ou la durée d’acquisition de l’image.
REMARQUE: Le nombre maximal minimal de photons dans la désintégration exponentielle de fluorescence dépend des paramètres du système, notamment la résolution temporelle, l’IRF et le bruit de fond.
- Placez la boîte à fond de verre avec les cellules sur la scène du microscope et concentrez-vous sur les cellules.
- Imagerie FAD
- Réglez le laser multiphoton sur 890 nm et attendez qu’il se verrouille en mode à la nouvelle longueur d’onde. Assurez-vous que le contrôle de puissance du laser est initialement réglé à zéro afin que les cellules ne soient pas endommagées lors de l’ouverture de l’obturateur sur le laser.
REMARQUE: Ne déplacez pas la scène ou l’objectif lors de cette étape. Le champ de vision FAD (FOV) doit correspondre directement au champ de vision NAD(P)H pour cette image. - Réglez ou sélectionnez un filtre d’émission pour collecter les longueurs d’onde d’émission à ~500-600 nm.
- Commencez à créer des images de manière focalisée ou en direct pour optimiser les paramètres de l’image.
REMARQUE: Le laser fonctionne maintenant. N’ouvrez pas le boîtier du microscope à ce stade. - Augmentez lentement la puissance du laser à ~5-10 mW à l’échantillon et enregistrez la puissance maximale utilisée. Utilisez-le comme réglage d’alimentation pour l’imagerie sur d’autres segments de la boîte de Petri pour l’imagerie FAD.
- Collectez une image FAD FLIM avec un temps d’intégration d’image de 60 s.
- Vérifiez que l’image contient suffisamment de photons (pic d’environ 100 photons pour un pixel de cytoplasme) dans la courbe de désintégration de la durée de vie de la fluorescence. Si le nombre de photons est trop faible, augmentez la puissance laser ou la durée d’acquisition de l’image.
REMARQUE: Le nombre maximal minimal de photons dans la désintégration exponentielle de fluorescence dépend des paramètres du système, notamment la résolution temporelle, l’IRF et le bruit de fond.
- Réglez le laser multiphoton sur 890 nm et attendez qu’il se verrouille en mode à la nouvelle longueur d’onde. Assurez-vous que le contrôle de puissance du laser est initialement réglé à zéro afin que les cellules ne soient pas endommagées lors de l’ouverture de l’obturateur sur le laser.
- Répétez les étapes 2.4 à 2.5 à quatre ou cinq FOV supplémentaires. Assurez-vous que chaque image est espacée d’au moins 2 FOF des emplacements imagés.
3. Préparation de l’expérience au cyanure
- Dissoudre 130,24 mg de cyanure de sodium dans 25 mL de PBS pour obtenir une solution de cyanure de sodium de 80 mM (20x).
REMARQUE: Le cyanure est toxique. Portez un équipement de protection individuelle approprié. - Aspirer 100 μL de milieu de culture du plat. Remplacez-le par 100 μL de solution de cyanure de sodium pour obtenir une concentration de cyanure de 4 mM dans la boîte.
- Mettez les cellules dans un incubateur pendant 5 min pour permettre aux cellules de réagir avec la solution de cyanure.
- Répétez les étapes 2.4 à 2.6 pour obtenir des images NAD(P)H et FAD des cellules après une exposition au cyanure.
REMARQUE: Une exposition prolongée au cyanure tuera les cellules. Les images postcyanides sont acquises dans les 30 minutes suivant l’ajout de cyanure.
4. Analyse d’images FLIM
- Ouvrez le logiciel d’analyse de la durée de vie FLIM.
- Ouvrez l’image d’urée pour acquérir l’IRF mesuré.
- Importez l’image d’urée. Sélectionnez un point sur l’image du cristal d’urée à utiliser pour l’analyse d’image. Augmentez la valeur du bac spatial pour intégrer les données FLIM de plusieurs pixels à 1 ou plus pour un pic de désintégration > 100 photons en modifiant la variable Bin située sur l’interface principale du logiciel.
- Enregistrez les données en tant qu’IRF.
- Dans le logiciel référencé, cliquez sur le menu déroulant intitulé IRF, sélectionnez Copier à partir des données de désintégration. Après cela, cliquez sur Copier dans le Presse-papiers pour l’utiliser dans l’analyse d’image de l’image prise pendant l’expérience.
- Analyse d’images d’images NAD(P)H et FAD à vie
- Importez le fichier image dans un logiciel d’analyse de la durée de vie de la fluorescence.
- Améliorez la visualisation de l’image pour voir les cellules et les compartiments subcellulaires en modifiant l’intensité et le contraste si nécessaire.
- Cliquez sur le menu déroulant Options et sélectionnez Intensité. Ici, modifiez l’intensité et le contraste comme vous le souhaitez et cliquez sur OK.
- Importez l’IRF à partir de l’image d’urée.
- Cliquez sur le menu déroulant IRF et sélectionnez Coller dans le Presse-papiers.
- Définissez les paramètres de désintégration multiexponentielle50.
- Définissez une valeur seuil pour évaluer les désintégrations pour les pixels du cytoplasme.
REMARQUE: Ici, une valeur de 50 a été utilisée. La valeur a été sélectionnée en comparant les valeurs de pic de fluorescence de plusieurs pixels d’arrière-plan et de noyau représentatifs avec la valeur de crête de plusieurs pixels de cytoplasme. Une valeur entre les pixels du noyau et les pixels du cytoplasme a été sélectionnée pour le seuil.
- Définissez une valeur seuil pour évaluer les désintégrations pour les pixels du cytoplasme.
- Vérifiez que la valeur Shift aligne l’IRF par rapport au bord ascendant de la fluorescence. Ajustez le décalage si nécessaire à une valeur qui minimise la valeur du Chi carré.
- Augmentez le bac spatial de sorte que les pixels du cytoplasme aient des valeurs de pic de fluorescence égales ou supérieures à 100.
REMARQUE: L’augmentation du bac spatial entraînera une diminution de la résolution spatiale. - Calculez les durées de vie de fluorescence pour tous les pixels de l’image.
- Dans le programme référencé, cliquez sur le menu déroulant Calculer | Matrice de désintégration.
REMARQUE: Le succès est indiqué par une image faussement colorée à la durée de vie de la fluorescence pondérée en amplitude.
- Dans le programme référencé, cliquez sur le menu déroulant Calculer | Matrice de désintégration.
- Enregistrez les données de durée de vie de la fluorescence.
- Cliquez sur le menu déroulant Fichier | Exporter. Choisissez les paramètres souhaités pour l’analyse et cliquez sur OK. Enregistrez l’image.
- Sélectionnez le bouton Couleur dans le menu déroulant Options pour ajuster la mesure de durée de vie de fluorescence affichée, la configuration des couleurs sur B-G-R et définissez les valeurs minimales et maximales de la barre de couleur spécifique pour ajuster l’échelle de couleur de l’image de durée de vie de fluorescence.
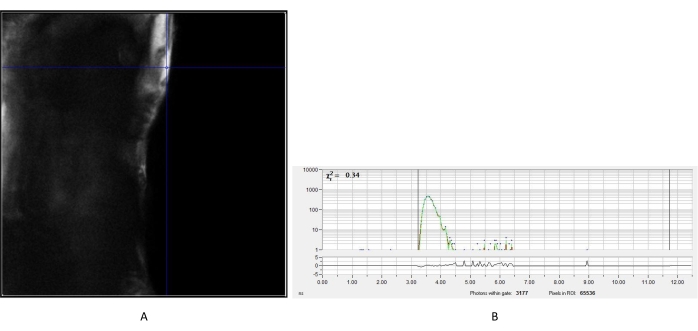
Figure 2 : IRF mesuré du cristal d’urée. (A) Image d’intensité obtenue à partir de l’urée. Un pixel représentatif a été choisi pour créer la courbe de désintégration IRF (B) pour l’analyse ultérieure des images de fluorescence à vie des cellules. Abréviation : IRF = fonction de réponse de l’instrument. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Segmentation cellulaire
REMARQUE : Le protocole décrit ici utilise un logiciel d’analyse d’images51. Des images MCF-7 représentatives et un code d’analyse de données sont fournis52.- Téléchargez le fichier MCF7_Segmentation_Final.cpproj52.
- Importez le pipeline MCF7_Segmentation en cliquant sur File | Importer | Pipeline à partir du fichier, sélectionnez le fichier MCF7_Segmentation_Final.cpproj.
- Cliquez sur le module Images et ajoutez les images d’intensité NAD(P)H à segmenter.
REMARQUE : Les images doivent être au format.tif, .png ou .jpg. - Appuyez sur le bouton Analyser les images en bas à gauche.
REMARQUE: Le pipeline peut nécessiter une optimisation pour les images acquises sur différents systèmes. Pour le dépannage, essayez les sous-étapes suivantes- Utilisez le mode Test pour tester différents paramètres : Cliquez sur Démarrer le mode Test et exécutez chaque module en cliquant sur le bouton de lecture à côté du nom du module.
- Cliquez sur le premier module IdentifyPrimaryObjects et ajustez le diamètre typique des objets, en unités de pixels (Min, Max) pour correspondre au diamètre des cellules.
REMARQUE: Pour les cellules MCF-7, 10 et 40 pixels ont été utilisés pour le minimum et le maximum, respectivement. - Cliquez sur le module EnhanceOrSuppressFeatures et ajustez la taille de la fonction pour améliorer l’identification du type de fonction sélectionné.
REMARQUE : Une taille de fonction de 10 pixels a été utilisée pour les cellules MCF-7. - Cliquez sur le deuxième module EnhanceOrSuppressFeatures et ajustez la plage de tailles de trous pour optimiser l’amélioration des régions nucléaires.
REMARQUE: Une plage de 5 à 20 a été utilisée pour les cellules MCF-7. - Cliquez sur le deuxième module IdentifyPrimaryObjects et ajustez les paramètres (stratégie de seuil, méthode de seuil, échelle de lissage de seuil et facteur de correction de seuil) pour optimiser l’identification des noyaux. Cliquez sur le ? par chaque paramètre pour identifier les paramètres optimaux et appliquer au module IdentifySecondaryObjects .
- Cliquez sur le module FilterObjects et ajustez la forme de la zone. Sélectionnez un pixel minimum et maximum de la forme de zone à identifier.
REMARQUE: Pour les cellules MCF-7, 100 et 500 ont été utilisées pour le maximum et le minimum, respectivement. Le processus de segmentation cellulaire par l’identification du noyau et la propagation aux limites cellulaires est expliqué en détail par Walsh et Skala47.
- À l’aide des masques de cytoplasme cellulaire, faites la moyenne des variables de sortie de la durée de vie de la fluorescence pour chaque cellule de l’image.

Figure 3 : Identification et segmentation des cellules individuelles. L’image d’intensité NAD(P)H des cellules MCF7 (A) obtenue en intégrant une image de fluorescence à vie. Les cellules ont été imagées en utilisant une excitation de 750 nm à 5 mW pendant 60 s. Les axes x et y représentent l’emplacement en pixels de l’image. (A) Des cellules individuelles ont été identifiées. Les cellules ont été masquées (B) pour éliminer tout bruit de fond de l’ensemble de données. Le noyau a ensuite été identifié (C) et projeté sur le masque cellulaire (D). Les cellules ont ensuite été filtrées (E) pour éliminer les zones masquées qui ne correspondent pas à la taille des cellules typiques. Barre d’échelle = 50 μm. Veuillez cliquer ici pour afficher une version agrandie de cette figure.
5. Méthode alternative: imagerie de l’intensité de fluorescence
- Allumez l’équipement qui sera utilisé pendant l’expérience.
REMARQUE: Les images d’intensité de fluorescence peuvent être acquises avec des microscopes à fluorescence à grand champ, des microscopes à fluorescence confocaux ou des microscopes multiphotons.- Assurez-vous que le microscope à utiliser dispose d’une source d’excitation appropriée pour le NAD(P)H (longueur d’onde monophotonique ~370-405 nm : longueur d’onde à deux photons ~700-750 nm) et le FAD (longueur d’onde monophotonique ~488 nm, longueur d’onde à deux photons ~890 nm).
- Assurez-vous que le microscope dispose d’un filtre pour l’isolation de l’émission de NAD(P)H (~400-500 nm).
REMARQUE: Les paramètres 4',6-Diamidino-2-phénylindole (DAPI) fonctionnent souvent pour NAD(P)H. - Assurez-vous que le microscope dispose d’un filtre pour isoler l’émission de FAD (~500-600 nm).
REMARQUE: Les paramètres de protéine fluorescente verte (GFP) fonctionnent souvent pour fad.
- Préparez le microscope.
- Allumez la lampe à champ lumineux. Assurez-vous que la lumière pénètre dans l’oculaire. Appliquer 1 goutte du milieu d’immersion approprié sur l’objectif correspondant si nécessaire.
- Déplacez l’objectif vers le bas pour placer correctement les échantillons sans aucune interférence. Placez correctement la boîte de Petri sur la scène. Assurez-vous que l’échantillon est sécurisé et ne bougera pas pendant l’imagerie.
REMARQUE: Il est recommandé de placer les cellules dans une chambre environnementale pour maintenir les niveaux de chaleur, d’humidité et de CO2 lors de l’acquisition d’images, car ces paramètres peuvent influencer le métabolisme cellulaire. - Centrez le spécimen avec l’objectif. Une fois cela fait, regardez dans l’oculaire et déplacez l’objectif jusqu’à ce que les cellules semblent être au point.
- Commencez l’imagerie d’intensité.
- Ouvrez le logiciel d’imagerie et réglez la configuration d’excitation et d’émission pour capturer le NAD(P)H en cliquant sur l’onglet Capture du logiciel d’acquisition d’images et en positionnant le filtre d’excitation et d’émission NAD(P)H dans la tourelle du microscope.
REMARQUE: Un filtre d’excitation 357/44, un filtre dichroïque longue passe 409 et un filtre d’émission 447/60 ont été utilisés pour l’imagerie NAD(P)H. - Optimisez l’éclairage d’excitation et les paramètres du détecteur. Si le blanchiment est un problème, réduisez l’intensité de l’éclairage et augmentez le temps d’intégration de l’image.
REMARQUE: NAD(P)H est un signal faible; soyez conscient du blanchiment si trop d’énergie est utilisée. - Acquérir une image NAD(P)H de la taille d’image souhaitée. Assurez-vous que l’image est enregistrée.
- Définissez la configuration d’excitation et d’émission pour capturer le FAD. Optimisez l’éclairage d’excitation et les paramètres du détecteur.
REMARQUE: Un filtre d’excitation 458/64, un filtre dichroïque 495 passes longues et un filtre d’émission 550/88 ont été utilisés pour l’imagerie FAD. - Acquérir une image FAD. Assurez-vous que l’image est enregistrée.
REMARQUE: Les paramètres d’acquisition d’images NAD(P)H et FAD (intensité d’éclairage, taille de l’image, gain du détecteur) doivent rester les mêmes tout au long de l’expérience d’imagerie. - Répétez le processus à cinq emplacements supplémentaires, espacés d’au moins 2 FOV des emplacements imagés.
- Ouvrez le logiciel d’imagerie et réglez la configuration d’excitation et d’émission pour capturer le NAD(P)H en cliquant sur l’onglet Capture du logiciel d’acquisition d’images et en positionnant le filtre d’excitation et d’émission NAD(P)H dans la tourelle du microscope.
- Analyse des données du rapport redox au niveau de l’image
- Ouvrez les images d’intensité NAD(P)H et FAD dans un programme de traitement d’image.
- Définissez un seuil sur le NAD(P)H pour conserver les pixels du cytoplasme et définissez les pixels d’arrière-plan et de noyau sur 0.
- Calculez l’image du rapport redox en évaluant l’équation FAD/(NAD(P)H+FAD) à chaque pixel à l’aide de l’image NAD(P)H seuillée.
- Calculez la valeur moyenne des pixels non-0.
REMARQUE: Ces étapes peuvent être effectuées dans un logiciel d’analyse d’images ou codées directement avec des scripts.
- Analyse du rapport redox au niveau cellulaire
- Suivez les étapes 4.3.1 à 4.3.5 pour obtenir une image de masque des cellules dans chaque image NAD(P)H.
- Calculez l’image du rapport redox en évaluant l’équation FAD/(NAD(P)H+FAD) à chaque pixel.
- À l’aide du masque de cytoplasme cellulaire, faites la moyenne du rapport redox pour tous les pixels de chaque cellule de l’image.
Access restricted. Please log in or start a trial to view this content.
Résultats
La lignée cellulaire du cancer du sein épithélial, MCF-7, a été cultivée dans du DMEM complété par 10% de sérum bovin fœtal (FBS) et 1% de pénicilline-streptomycine. Pour l’imagerie par fluorescence, les cellules ont été ensemencées à une densité de 4 × 105 cellules par antenne d’imagerie à fond de verre de 35 mm 48 h avant l’imagerie. Les cellules ont été imagées avant et après le traitement au cyanure en utilisant les protocoles énoncés ci-dessus. L’objectif de l’expérience...
Access restricted. Please log in or start a trial to view this content.
Discussion
L’intensité de l’autofluorescence et l’imagerie à vie ont été largement utilisées pour évaluer le métabolisme dans les cellules21,55. FLIM est à haute résolution et résout donc les cellules individuelles, ce qui est important pour les études sur le cancer car l’hétérogénéité cellulaire contribue à l’agression tumorale et à la résistance aux médicaments7,39,41,44,45,46,58.
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les sources de financement comprennent le Cancer Prevention and Research Institute of Texas (CPRIT RP200668) et la Texas A & M University. La figure 1 a été créée avec BioRender.com.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 2-deoxy-d-glucose (2-DG) | Sigma | AC111980000; AC111980010; AC111980050; AC111980250 | |
| Antibiotic Antimicrobial (pen-strep) | Gibco | 15240096 | |
| Cell Samples | American Type Culture Collection | N/A | MCF-7 cancer line |
| CellProfiler | Broad Institute | N/A | Image analysis software |
| Conical Tube | VWR | 89039-664 | 15 mL conical tube |
| DMEM | ThermoFisher | 11965092 | Culture media |
| FAD dichroic mirror | Semrock | FF495-Di03-25x36 | 495 nm |
| FAD emission filter | Semrock | FF01-550/88-25 | 550/88 nm |
| FAD excitation filter | Semrock | FF01-458/64-25 | 458/64 nm |
| FBS | ThermoFisher | 16000036 | |
| Fluorescence Lifetime Microscope | 3i | N/A | |
| Glass bottom dish | MatTek Corp | P35G-1.0-14-C | |
| Multiphoton Laser | Coherent | N/A | 2P Coherent Laser, Tunable 680 nm-1080 nm |
| NAD(P)H dichroic mirror | Semrock | FF409-Di03-25x36 | 409 nm |
| NAD(P)H emission filter | Semrock | FF02-447/60-25 | 447/60 nm |
| NAD(P)H excitation filter | Semrock | FF01-357/44-25 | 357/44 nm |
| PBS | ThermoFisher | 70011044 | |
| Potassium Cyanide | Sigma-Aldrich | 380970 | |
| SlideBooks 6 | 3i | N/A | Image acquisition software |
| SPCImage | Becker & Hickl GmbH | N/A | Fluorescence lifetime analysis software |
| Stage Top Incubator | okoLab | N/A | |
| Trypsin | Biosciences | 786-262 | |
| Urea | Sigma-Aldrich | U5128 | |
| YG beads | Polysciences | 19096-2 | Yg microspheres (20.0 µm) |
Références
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomarkers in Medicine. 4 (2), 241-263 (2010).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Zheng, J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation (Review). Oncology Letters. 4 (6), 1151-1157 (2012).
- Potter, M., Newport, E., Morten, K. J. The Warburg effect: 80 years on. Biochemical Society Transactions. 44 (5), 1499-1505 (2016).
- Zhao, Y., Butler, E. B., Tan, M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death and Disease. 4 (3), 532(2013).
- Patel, S., Ahmed, S. Emerging field of metabolomics: Big promise for cancer biomarker identification and drug discovery. Journal of Pharmaceutical and Biomedical Analysis. 107, 63-74 (2015).
- Walsh, A. J., Cook, R. S., Skala, M. C. Functional optical imaging of primary human tumor organoids: Development of a personalized drug screen. Journal of Nuclear Medicine. 58 (9), 1367-1372 (2017).
- Zaal, E. A., Berkers, C. R. The influence of metabolism on drug response in cancer. Frontiers in Oncology. 8, 500(2018).
- Little, A. C., et al. High-content fluorescence imaging with the metabolic flux assay reveals insights into mitochondrial properties and functions. Communications Biology. 3 (1), 271(2020).
- Wang, X., et al. Comparison of magnetic resonance spectroscopy and positron emission tomography in detection of tumor recurrence in posttreatment of glioma: A diagnostic meta-analysis. Asia-Pacific Journal of Clinical Oncology. 11 (2), 97-105 (2015).
- Nabi, H. A., Zubeldia, J. M. Clinical applications of 18F-FDG in oncology. Journal of Nuclear Medicine Technology. 30 (1), 3-9 (2002).
- Kostakoglu, L., Agress, H., Goldsmith, S. J. Clinical role of FDG PET in evaluation of cancer patients. Radiographics. 23 (2), 315-340 (2003).
- Hoh, C. K. Clinical use of FDG PET. Nuclear Medicine and Biology. 34 (7), 737-742 (2007).
- van de Weijer, T., Schrauwen-Hinderling, V. B. Application of magnetic resonance spectroscopy in metabolic research. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1865 (4), 741-748 (2019).
- Huang, S., Heikal, A. A., Webb, W. W. Two-photon fluorescence spectroscopy and microscopy of NAD(P)H and Flavoprotein. Biophysical Journal. 82, 2811-2825 (2002).
- Lagarto, J. L., et al. Characterization of NAD(P)H and FAD autofluorescence signatures in a Langendorff isolated-perfused rat heart model. Biomedical Optics Express. 9 (10), 4961-4978 (2018).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. , Springer. Boston, MA. (2013).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proceedings of the National Academy of the Sciences of the United States of America. 89 (4), 1271-1275 (1992).
- Nakashima, N., Yoshihara, K., Tanaka, F., Yagi, K. Picosecond fluorescence lifetime of the coenzyme of D-amino acid oxidase. Journal of Biological Chemistry. 255 (11), 5261-5263 (1980).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomedical Optics Express. 11 (10), 5674-5688 (2020).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (7), 1-43 (2020).
- Liu, Z., et al. Mapping metabolic changes by noninvasive, multiparametric, high-resolution imaging using endogenous contrast. Science Advances. 4 (3), (2018).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Cancer Research. 74 (11), 3067-3075 (2014).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. Journal of Biological Chemistry. 254 (11), 4764-4771 (1979).
- Sharick, J. T., et al. Protein-bound NAD(P)H lifetime is sensitive to multiple fates of glucose carbon. Scientific Reports. 8 (1), 5456(2018).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19494-19499 (2007).
- Skala, M. C., et al. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. Journal of Biomedical Optics. 12 (2), 024014(2007).
- Uchugonova, A. A., König, K. Two-photon autofluorescence and second-harmonic imaging of adult stem cells. Journal of Biomedical Optics. 13 (5), 054068(2008).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nature Methods. 11 (11), 1161-1169 (2014).
- Walsh, A. J., et al. Classification of T-cell activation via autofluorescence lifetime imaging. Nature Biomedical Engineering. 5 (1), 77-88 (2021).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Cancer Research. 80 (23), 5408-5423 (2020).
- Pavillon, N., Hobro, A. J., Akira, S., Smith, N. I. Noninvasive detection of macrophage activation with single-cell resolution through machine learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 2676-2685 (2018).
- Chang, C. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- Kaech, S. M., Cui, W. Transcriptional control of effector and memory CD8+ T cell differentiation. Nature Reviews. Immunology. 12 (11), 749-761 (2012).
- Gómez, C. A., Fu, B., Sakadžić, S., Yaseena, M. A. Cerebral metabolism in a mouse model of Alzheimer's disease characterized by two-photon fluorescence lifetime microscopy of intrinsic NADH. Neurophotonics. 5 (4), 045008(2018).
- Yaseen, M. A., et al. In vivo imaging of cerebral energy metabolism with two-photon fluorescence lifetime microscopy of NADH. Biomedical Optics Express. 4 (2), 307-321 (2013).
- Bower, A. J., et al. High-speed label-free two-photon fluorescence microscopy of metabolic transients during neuronal activity. Applied Physics Letters. 118 (8), 081104(2021).
- Walsh, A. J., et al. Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer. Cancer Research. 74 (18), 5184-5194 (2014).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Cancer Research. 73 (20), 6164-6174 (2013).
- Chowdary, M. V. P., et al. Autofluorescence of breast tissues: Evaluation of discriminating algorithms for diagnosis of normal, benign, and malignant conditions. Photomedicine and Laser Surgery. 27 (2), 241-252 (2009).
- Demos, S. G., Bold, R., White, R. D., Ramsamooj, R. Investigation of near-infrared autofluorescence imaging for the detection of breast cancer. IEEE Journal of Selected Topics in Quantum Electronics. 11 (4), 791-798 (2005).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Cancer Research. 80 (23), 5408-5423 (2020).
- Sharick, J. T., et al. Cellular metabolic heterogeneity in vivo is recapitulated in tumor organoids. Neoplasia. 21 (6), 615-626 (2019).
- Shah, A. T., Diggins, K. E., Walsh, A. J., Irish, J. M., Skala, M. C. In vivo autofluorescence imaging of tumor heterogeneity in response to treatment. Neoplasia. 17 (12), 862-870 (2015).
- Walsh, A. J., Skala, M. C. Optical metabolic imaging quantifies heterogeneous cell populations. Biomedical Optics Express. 6 (2), 559-573 (2015).
- Walsh, A. J., Skala, M. C. An automated image processing routine for segmentation of cell cytoplasms in high-resolution autofluorescence images. Multiphoton Microscopy in the Biomedical Sciences XIV. , (2014).
- Skala, M., Ramanujam, N. Methods in Molecular Biology. 594, 155-162 (2010).
- Stringari, C., et al. Multicolor two-photon imaging of endogenous fluorophores in living tissues by wavelength mixing. Scientific Reports. 7, 3792(2017).
- SPCImage 2.9: Data analysis software for fluorescence lifetime imaging microscopy. SPCImage. , Available from: https://biology.uiowa.edu/sites/biology.uiowa.edu/files/SPCIMAGE29.pdf (2007).
- CellProfiler. , Available from: https://cellprofiler.org/releases (2007).
- Autofluorescence Imaging. GitHub. , Available from: https://github.com/walshlab/Autofluorescence-Imaging (2021).
- Ramey, N. A., Park, C. Y., Gehlbach, P. L., Chuck, R. S. Imaging mitochondria in living corneal endothelial cells using autofluorescence microscopy. Photochemistry and Photobiology. 83 (6), 1325-1329 (2007).
- Walsh, A., Cook, R. S., Rexer, B., Arteaga, C. L., Skala, M. C. Optical imaging of metabolism in HER2 overexpressing breast cancer cells. Biomedical Optics Express. 3 (1), 75-85 (2012).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxidants & Redox Signaling. 30, 875-889 (2019).
- Bird, D. K., et al. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of the coenzyme NADH. Cancer Research. 65, 8766-8773 (2005).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Cancer Research. 73 (20), 6164-6174 (2013).
- Walsh, A. J., Castellanos, J. A., Nagathihalli, N. S., Merchant, N. B., Skala, M. C. Optical imaging of drug-induced metabolism changes in murine and human pancreatic cancer organoids reveals heterogeneous drug response. Pancreas. 45 (6), 863-869 (2016).
- Gubser, P. M., et al. Rapid effector function of memory CD8+ T cells requires an immediate-early glycolytic switch. Nature Immunology. 14 (10), 1064-1072 (2013).
- Papalexi, E., Satija, R. Single-cell RNA sequencing to explore immune cell heterogeneity. Nature Review. Immunology. 18 (1), 35-45 (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. The Journals of Gerontology: Series A. 67 (10), 1022-1035 (2012).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-protocol. 8 (10), 2850(2018).
- Becker, W. The bh TCSPC Handbook. , Available from: https://www.becker-hickl.com/wp-content/uploads/2021/10/SPC-handbook-9ed-05a.pdf (2021).
- Gadella, T. W. J. Fluorescent and Luminescent Probes for Biological Activity. Mason, W. T. 34, Ch. 34 467-479 (1999).
- Miller, D. R., Jarrett, J. W., Hassan, A. M., Dunna, A. K. Deep tissue iImaging with multiphoton fluorescence microscopy. Current Opinion in Biomedical Engineering. 4, 32-39 (2017).
- Berezin, M. Y., Achilefu, S. Fluorescence lifetime measurements and biological imaging. Chemical Reviews. 110 (5), 2641-2684 (2010).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon