A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم أكسدة الركيزة الطاقة في المختبر مع 14CO2 Trapping
In This Article
Summary
يصف هذا البروتوكول طريقة سهلة الاستخدام لفحص أكسدة الركيزة عن طريق تتبع إنتاج 14CO2 في المختبر.
Abstract
تستضيف الميتوكوندريا آلية دورة حمض ثلاثي الكربوكسيل (TCA) وسلسلة نقل الإلكترون (ETC) ، والتي تولد الأدينوسين ثلاثي الفوسفات (ATP) للحفاظ على توازن الطاقة. الجلوكوز والأحماض الدهنية والأحماض الأمينية هي ركائز الطاقة الرئيسية التي تغذي التنفس الميتوكوندريا في معظم الخلايا الجسدية. تشير الأدلة إلى أن أنواع الخلايا المختلفة قد يكون لها تفضيل واضح لبعض الركائز. ومع ذلك ، لم تتم دراسة استخدام الركيزة من قبل الخلايا المختلفة في الهيكل العظمي بالتفصيل. علاوة على ذلك ، نظرا لأن الأيض الخلوي متناغم مع التغيرات الفسيولوجية والفسيولوجية المرضية ، فإن التقييمات المباشرة لاعتماد الركيزة في الخلايا الهيكلية قد توفر رؤى مهمة حول التسبب في أمراض العظام.
يعتمد البروتوكول التالي على مبدأ إطلاق ثاني أكسيد الكربون من جزيئات الركيزة بعد الفسفرة التأكسدية. باستخدام ركائز تحتوي على ذرات كربون موسومة إشعاعيا (14درجة مئوية) ، توفر الطريقة فحصا حساسا وسهل الاستخدام لمعدل أكسدة الركيزة في زراعة الخلايا. توضح دراسة حالة مع الخلايا النجمية الأولية قبل العظمية مقابل البلاعم المشتقة من نخاع العظام (BMMs) استخداما مختلفا للركائز الرئيسية بين نوعي الخلايا.
Introduction
الفسفرة التأكسدية (OXPHOS) في حقيقيات النوى هي العملية التي يتم من خلالها تكسير العناصر الغذائية داخل الميتوكوندريا لإطلاق الطاقة الكيميائية في شكل ATP من خلال استهلاك الأكسجين. إن هدم الركائز المختلفة داخل الميتوكوندريا من خلال دورة حمض ثلاثي الكربوكسيل (TCA) يولد عددا قليلا من جزيئات ATP مباشرة ، ولكنه يخزن الطاقة من خلال تقليل حاملات الإلكترونات نيكوتيناميد الأدينين ثنائي النوكليوتيد (NAD+) وفلافين الأدينين ثنائي النوكليوتيد (FAD +). ثم تتأكسد الناقلات المخفضة بواسطة ETC الموجود على الغشاء الداخلي للميتوكوندريا لتوليد تدرج تركيز البروتون عبر الغشاء. تتدفق البروتونات في النهاية إلى أسفل تدرجها مرة أخرى إلى مصفوفة الميتوكوندريا من خلال سينثاز ATP لإنتاج ATP. OXPHOS هي الوسيلة الأكثر كفاءة لإنتاج ATP من ركائز الطاقة ويفضل عموما في البيئات الهوائية. في السابق ، كان يعتقد أن تحلل السكر الهوائي - إنتاج اللاكتات من الجلوكوز أثناء وجود الأكسجين - هو فيزيولوجي مرضي ، وغالبا ما يكون سمة مميزة للخلايا السرطانية. يتم اكتشاف المزيد والمزيد من أن بعض أنواع الخلايا الطبيعية تستخدم تحلل السكر الهوائي لأسباب لم يتم فك رموزها بالكامل بعد.
المرونة الأيضية هي قدرة الخلايا أو الكائنات الحية على التكيف مع متطلبات الطاقة المتغيرة ومصادر الوقود المتاحة. على سبيل المثال ، يتم تلبية الطلب النشط على العضلات الهيكلية بشكل رئيسي بواسطة OXPHOS في حالة مستقرة ولكن عن طريق تحلل السكر اللاهوائي أثناء التمرين عالي الكثافة1. مع زيادة مدة التمرين ، تساهم أكسدة الجلوكوز والأحماض الدهنية بشكل أكبر في إنتاج الطاقة الكلي2. ومع ذلك ، فإن استخدام الركيزة لا يعتمد فقط على التوافر ، حيث تتنافس الركائز بشكل عدائي أثناء الأكسدة. وعلى الأخص ، ثبت أن أكسدة الأحماض الدهنية تمنع استخدام الجلوكوز بواسطة العضلات الهيكلية في ظاهرة تعرف باسم تأثير راندل3. وقد ثبت وجود تأثير متبادل من خلال الدراسات اللاحقة 4,5. بالإضافة إلى ذلك ، ترتبط العديد من الأمراض بتغيير في تفضيل الركيزة وتطوير عدم المرونة الأيضية في الخلايا. على سبيل المثال ، يتم تقليل أكسدة الأحماض الدهنية في العضلات الهيكلية لمرضى السكري من النوع الثاني مقارنة بموضوعات التحكم العادية6. التغيرات الأيضية في إعدادات المرض هي موضوع تحقيق مكثف لأنها قد تسهم في الإمراض.
استقلاب الطاقة في أنواع الخلايا الهيكلية غير مدروس نسبيا ولكنه اكتسب الاهتمام في السنوات الأخيرة7. أظهرت الأبحاث السابقة أن تحلل السكر الهوائي هو مسار الطاقة المهيمن في الخلايا العظمية الكلفارية، في حين أن أكسدة الجلوكوز من خلال دورة TCA تلعب دورا في تكوين الخلايا العظميةالعظمية 8,9. وقدم آخرون أدلة على الأحماض الدهنية كمصدر للطاقة للخلايا العظمية10. كما ثبت أن هدم الجلوتامين يدعم تمايز الأرومة العظمية عن السلف11,12. ومع ذلك ، لا يزال هناك نقص في فهم شامل لاستخدام الركيزة من قبل أنواع مختلفة من الخلايا الهيكلية. بالإضافة إلى ذلك ، من المتوقع أن تؤدي التغيرات في التمثيل الغذائي الخلوي أثناء تمايز الخلايا أو استجابة للإشارات المرضية إلى تغيير استخدام ركيزة الوقود. الموضح أدناه هو بروتوكول سهل الاستخدام لفحص أكسدة الركيزة في المختبر.
Protocol
يتطلب استخدام المواد المشعة (RAM) موافقة مسبقة من لجنة أمان معينة في كل مؤسسة. تمت الموافقة على ذاكرة الوصول العشوائي المستخدمة في هذا البروتوكول من قبل الصحة البيئية والسلامة الإشعاعية (EHRS) في جامعة بنسلفانيا. يتطلب استخدام الحيوانات موافقة مسبقة من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات (IACUC) في المؤسسة المنزلية. تمت الموافقة على الدراسة التالية من قبل IACUC في مستشفى الأطفال في فيلادلفيا.
1. إعداد حلول المخزون ل 14ركيزة تحمل علامة C
- اصنع محلول مخزون مصل البقر (BSA) سعة 4 ملليمتر عن طريق خلط 11 جم من BSA و 33.1 مل من محلول ملحي مخزن بالفوسفات (DPBS) من Dulbecco وهزه بلطف في درجة حرارة الغرفة لمدة 3 ساعات تقريبا حتى يتم إذابة BSA بالكامل. قم بتسخين محلول مخزون BSA في حمام مائي 70 درجة مئوية قبل الاستخدام.
- جاف في الهواء 50 μCi 14C-oleate (50 μCi / μmol في الإيثانول) في القارورة مع إيقاف الغطاء لمدة 8 ساعات في غطاء عمل RAM مخصص. أضف 312.5 ميكرولتر من H2O ثم 3.5 ملغ (11.5 ميكرومول) من أوليات الصوديوم. اخلطي جيدا.
- قم بتسخين المحلول الناتج إلى 70 درجة مئوية في حمام مائي. أضف 0.9375 مل من محلول مخزون BSA المسخن مسبقا لإنتاج محلول مخزون أوليات ساخن 10 ملليمتر (يحتوي على نسبة 1:11.5 من 14C-oleate إلى oleate غير الملصق). Aliquot حل المخزون وتخزينه في -20 درجة مئوية للاستخدام على المدى الطويل.
- استخدم 14 C-glucose و 14C-glutamine مباشرة بعد الذوبان.
2. إعداد وسيط يحتوي على 14ركيزة تحمل علامة C
ملاحظة: لضمان تركيزات موثوقة من ركائز الطاقة في الوسائط، يجب استخدام الوسائط المصنوعة حسب الطلب مع ركائز جديدة تضاف قبل وقت قصير من الاستخدام. هنا ، يتم استخدام الحد الأدنى من الوسط الأساسي (MEMα) المصنوع خصيصا بدون الجلوكوز أو البيروفات أو الجلوتامين أو الفينول الأحمر أو بيكربونات الصوديوم. ومع ذلك ، يجب تحديد الوسط الأمثل لكل نوع من أنواع الخلايا.
- أعد تشكيل 8.67 جم من المسحوق المتوسط في 1 لتر من الماء النقي. أضف 2.2 جم من بيكربونات الصوديوم لتحقيق درجة حموضة 7.4 وقم بتصفية المحلول باستخدام ترشيح فراغي 0.22 ميكرومتر.
- أضف مكونات طازجة للحصول على الوسط الكامل (cMEMα) بتركيزات نهائية من الجلوكوز 5.5 ملليمتر ، والجلوتامين 2 مل ، والبيروفات 1 ملم ، ومصل البقر الجنيني 10٪ (FBS). مزيد من المكملات cMEMα مع 100 mM L-carnitine و 10 μM HEPES لتسهيل أكسدة الأحماض الدهنية.
- قبل الاستخدام مباشرة، أضف 14ركيزة تحمل علامة C إلى cMEMα المحضرة حديثا لصنع وسائط ساخنة. لجعل الوسط الساخن أوليات، أضف محلول مخزون الأوليت الساخن 10 ملليمتر إلى cMEMα للحصول على تركيز نهائي قدره 100 ميكرومتر أوليت (تخفيف 1:100، النشاط الإشعاعي النهائي 0.4 ميكروسي/مل).
ملاحظة: يستخدم مخزون الأوليت الساخن 10 مللي متر الذي يحتوي على نسبة 1:11.5 من الأوليت الساخن:البارد (انظر الخطوة 1.3) لتحقيق مستوى فسيولوجي يبلغ 100 ميكرومتر إجمالي أوليات في الوسائط مع تقليل كمية المواد المشعة. - اصنع 10 ملليمتر من مرق الأولات غير المسمى بإضافة 24.36 ملغ من أوليات الصوديوم إلى 2 مل من H2O في حمام مائي عند 70 درجة مئوية لمدة 20 دقيقة تقريبا حتى يذوب تماما قبل الخلط بسرعة مع 6 مل من محلول مخزون BSA 4 mM المسخن مسبقا إلى 70 درجة مئوية. انقل إلى حمام مائي 37 درجة مئوية لمدة 1 ساعة وقم بالتصفية من خلال مرشح 0.22 ميكرومتر. Aliquot وتخزينها في -20 درجة مئوية للاستخدام على المدى الطويل.
- لجعل الجلوكوز وسط ساخن ، أضف 14C-glucose إلى تركيز نهائي قدره 1.333 ميكرومتر (تخفيف 1: 4،125 ، النشاط الإشعاعي النهائي 0.4 μCi / mL). لجعل وسط الجلوتامين ساخنا ، أضف 14C-glutamine إلى التركيز النهائي البالغ 2 ميكرومتر (تخفيف 1: 1000 ، النشاط الإشعاعي النهائي 0.4 μCi / mL).
- استكمل وسط الجلوكوز والجلوتامين الساخن بمحلول مخزون 10 mM من oleate غير المسمى من الخطوة 2.4 لتحقيق التركيز النهائي ل 100 ميكرومتر أوليت ، وهو نفس التركيز الموجود في الوسط الساخن oleate.
3. إعداد الخلايا
ملاحظة: تستخدم الأرومات النجمية الكلفارية والبلاعم في نخاع العظم كأمثلة هنا. يجب على المستخدمين إعداد نوع الخلية التي يختارونها وفقا للبروتوكولات المناسبة. تحسين تركيز الكولاجيناز II لاستخدامه في الهضم في التجارب التجريبية لأن النشاط الأنزيمي قد يختلف بين الكثير المختلفة.
- عزل وزراعة الخلايا النجمية الكهلبية
- التضحية يوم ما بعد الولادة 3-5 (P3-5) الجراء عن طريق قطع الرأس ونقلها إلى DPBS الباردة الجليدية التي تحتوي على البنسلين الستربتومايسين (P / S).
- تعريض الكالفاريا عن طريق إزالة الجلد والأنسجة الرخوة. اجمع المنطقة الوسطى عن طريق قطع الأنسجة المحيطة بها من الخلف إلى الأمام في DPBS (الشكل 1A). خدش الأسطح الداخلية والخارجية للكالفاريا بلطف باستخدام ملاقط للمساعدة في إطلاق الخلايا عند الهضم اللاحق.
- تحضير 2 ملغ / مل ومحلول 4 ملغ / مل من الكولاجيناز من النوع الثاني في DPBS وتصفية كل محلول مع مرشح جديد 0.22 ميكرومتر. هضم الكالفاريا النظيفة أولا بمحلول الكولاجيناز 2 ملغم / مل لمدة 15 دقيقة وتخلص من محلول الهضم. هضم العينات التي تم تنظيفها في محلول كولاجيناز 4 ملغم / مل 3 مرات لمدة 15 دقيقة في كل مرة ، وتجميع وحفظ محلول الهضم.
- قم بتصفية محلول الهضم من خلال مصافي خلايا 70 ميكرومتر وقم بالطرد المركزي للترشيح عند 300 × جم لمدة 5 دقائق. أعد تعليق حبيبات الخلايا في cMEMα (انظر الخطوة 2.2) التي تحتوي على 10٪ FBS وP/S.
- عد الخلايا وزرعها في 4 × 104 خلايا / سم2 في لوحات 10 سم. استزرع الخلايا في حاضنة 37 درجة مئوية مع 5٪ CO2 لمدة 3 أيام.
- فصل الخلايا عند 37 درجة مئوية مع 0.25 ٪ التربسين-EDTA. عد الخلايا وزرعها في لوحات زراعة الخلايا المكونة من 24 بئرا مع cMEMα يحتوي على 10٪ FBS و P / S عند 7.5 × 105 / سم2. زرع ما لا يقل عن 4 آبار لكل نوع خلية لكل ركيزة وثلاثة آبار إضافية على الأقل لكل نوع خلية لحساب الخلايا قبل الفحص.
- استزرع الخلايا عند 37 درجة مئوية بين عشية وضحاها قبل اختبارات أكسدة الركيزة.
- عزل وثقافة BMMs
ملاحظة: تتطلب زراعة BMMs عامل تحفيز مستعمرة البلاعم (M-CSF) ، والذي يمكن شراؤه تجاريا كبروتين مؤتلف. الوسط المشروط من خط الخلية CMG14-12 المصمم للتعبير عن M-CSF هو بديل اقتصادي يستخدم هنا13.- جمع عظم الفخذ و tibias من الفئران البالغة من العمر 8 أسابيع بعد إزالة العضلات والأنسجة الضامة. قطع وتجاهل طرفي العظام بمقص حاد.
- اطرد نخاع العظم من عظم الفخذ والساق إلى طبق بتري 10 سم مع حقنة مزودة بإبرة 23 جم تحتوي على 15 مل من cMEMα مع 10٪ FBS ، P / S ، و 10٪ CMG14-12 متوسطة مكيفة (BMM medium). استزرع الخلايا في طبق بتري في حاضنة 37 درجة مئوية مع 5٪ CO2.
- بعد 3 أيام ، تخلص من وسائط الثقافة وشطفها باستخدام DPBS. افصل الخلايا المرفقة عند 37 درجة مئوية مع 0.25٪ من التربسين-EDTA لمدة 5 دقائق. جهاز طرد مركزي وإعادة تعليق بيليه الخلية في وسط BMM.
- عد الخلايا وزرعها في لوحات زراعة الخلايا المكونة من 24 بئرا عند 7.5 × 105 / سم2 بنفس الطريقة الموضحة في 3.1.6. استزرع عند 37 درجة مئوية بين عشية وضحاها في وسط BMM قبل البدء في الفحوصات.
4. اختبار أكسدة الركيزة مع فخ CO2
ملاحظة: يجب تحديد كثافة البذر المناسبة لكل نوع من أنواع الخلايا لتحقيق التقاء 80-90٪ قبل بدء الفحص. لاحظ أن كثافة الخلايا يمكن أن تؤثر على الحالة الأيضية للخلايا.
- اغسل الخلايا في الآبار الإضافية مرتين باستخدام DPBS. قم بفصل الخلايا بنسبة 0.25٪ من التربسين-EDTA وخلايا 20 ميكرولتر المختلطة المعاد تعليقها في DPBS مع 20 ميكرولتر من محلول صبغة تجارية جاهز للاستخدام من الأكريدين البرتقالي / البروبيديوم (AO / PI). حدد عدد الخلايا الحية باستخدام عداد خلايا آلي وسجل العدد للحسابات النهائية.
- اغسل الخلايا في آبار الفحص مرتين باستخدام DPBS. أضف 500 ميكرولتر من الوسط الساخن إلى كل فحص جيدا في غطاء زراعة الأنسجة المخصص لذاكرة الوصول العشوائي. قم بإغلاق الألواح باستخدام البارافيلم واحتضن الخلايا في حاضنة مخصصة لذاكرة الوصول العشوائي عند 37 درجة مئوية لمدة 4 ساعات.
- أثناء الحضانة ، قم بتقطيع ورق الترشيح إلى قطع دائرية أكبر قليلا من المساحة داخل غطاء أنابيب الطرد المركزي الدقيقة سعة 1.5 مل وأدخل الورق بشكل مريح في الغطاء (الشكل 1B). أضف 200 ميكرولتر من حمض البيركلوريك 1 متر إلى كل أنبوب و 20 ميكرولتر من هيدروكسيد الصوديوم إلى ورقة الترشيح المثبتة داخل الغطاء.
- بعد حضانة الخلايا ، انقل 400 ميكرولتر من وسط الثقافة من كل بئر إلى الأنابيب المحضرة وأغلق الأغطية على الفور. اترك الأنابيب في رف أنبوب في درجة حرارة الغرفة لمدة 1 ساعة.
- أثناء الحضانة ، قم بإعداد قارورة تلألؤ لكل أنبوب واملأها ب 4 مل من سائل اللمعان. انقل كل قطعة من ورق الترشيح إلى قارورة تلألؤ واحتضنها في درجة حرارة الغرفة لمدة 30 دقيقة.
- قم بإجراء اختبارات المسح على غطاء محرك السيارة ، والحمام المائي (المستخدم لإعداد 14C-oleate) ، والثلاجة ، والحاضنة ، والحوض ، والأرض ، وأي منطقة عمل أخرى لتلوث ذاكرة الوصول العشوائي المحتملة. ضع مناديل الورق في قوارير تلألؤ تحتوي على سائل لمعان.
- قياس النشاط الإشعاعي 14درجة مئوية في قوارير التلألؤ باستخدام عداد اللمعان. سجل نتائج القراءة. تطهير بيئة العمل وفقا لإرشادات السلامة الإشعاعية إذا لزم الأمر.
5. تحليل البيانات
ملاحظة: بافتراض أن كل ركيزة تتأكسد بالكامل لإطلاق CO 2 ، يمكن حساب معدل أكسدة الركيزة من النشاط الإشعاعي CO2 المحاصر.
- احسب معدل أكسدة الركيزة باستخدام Eq (1) وقيم X و Y و Z الواردة في الجدول 1 للركائز المختلفة.
معدل أكسدة الركيزة (ميكرومول / خلية / ساعة) =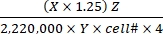 (1)
(1)- احسب إجمالي التفكك لكل دقيقة (DPM) لكل تفاعل بشكل جيد. بالنسبة إلى X، استخدم قيمة DPM (قراءة عداد اللمعان) من 0.4 مل من وسط التفاعل المستخدم لاحتجاز ثاني أكسيد الكربون2 من 0.5 مل من وسط التفاعل الكلي. لذلك ، فإن إجمالي DPM من كل بئر تفاعل هو X × 1.25.
- اقسم إجمالي DPM على عامل 2,220,000 للتحويل إلى μCi.
- تحويل النشاط الإشعاعي في μCi إلى عدد 14جزيئا يحمل علامة C. اقسم قيمة μCi على النشاط المحدد (Y) لكل ركيزة مسماة. استخدم قيم Y التالية (الجدول 1): 14C-glucose: 300 mCi/mmol; 14 C-الجلوتامين: 200 mCi / mmol ؛ 14 C-oleate: 50 mCi / mmol.
- احسب العدد الإجمالي للجزيئات المؤكسدة من الجزيئات المؤكسدة ذات العلامات C 14عن طريق ضرب الأخير في عامل التخفيف من الساخن إلى الكلي (Z). استخدم قيم Z التالية (الجدول 1): الجلوكوز: 4,125; الجلوتامين: 1000 ؛ أوليات: 12.5.
- قسم الناتج الناتج على رقم الخلية (cell#) و 4 (لوقت التفاعل البالغ 4 ساعات) لتحديد معدل أكسدة الركيزة لكل خلية. استخدم الخلية # المحددة في الآبار المتوازية في بداية الفحص.
النتائج
في هذا المثال ، يتم استخدام طريقة الاصطياد CO2 لمقارنة أكسدة الركيزة بواسطة الخلايا النجمية الأولية مقابل BMMs ، والتي تستخدم بشكل متكرر في تمايز الخلايا العظمية في المختبر أو osteoclast ، على التوالي. بعد مرور الخلايا الأولية وزراعتها في cMEMα بين عشية وضحاها ، فإنها تصل عادة إلى 80-90٪ من ...
Discussion
يوفر البروتوكول طريقة سهلة الاستخدام لتحديد معدل أكسدة ركائز الطاقة الرئيسية. إنه بديل أبسط للبروتوكولات الأخرى التي تستخدم قوارير تحتوي على بئر مركزي ومغطاة بسدادات مطاطية14،15،16. على الرغم من أن دراسة المثال هنا يتم إجراؤها باستخدام زر...
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم العمل جزئيا من خلال منحة المعاهد الوطنية للصحة R01 AR060456 (FL). نشكر الدكتور مايكل روبنسون وإليزابيث كريزمان (مستشفى الأطفال في فيلادلفيا) على مساعدتهما السخية في عداد التلألؤ.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm filters | Sigma-Aldrich | SLGVM33RS | Used to filter BSA solution |
| 0.25% Trypsin-EDTA | Gibco | 25200056 | Dissociate cells from cell culture plates |
| 1.5 mL Eppendorf tubes | PR1MA | PR MCT17 RB | Used for reaction incubation |
| 10 cm plates | TPP | 93100 | Used for cell culture |
| 10 mL syringe | BD | 302995 | Used to flush marrow from long bones |
| 10% FBS | Atlanta biologicals | S11550 | For Cell culture medium preparation |
| 14C-Glucose | PerkinElmer | NEC042X050UC | Used to make hot media |
| 14C-glutamine | PerkinElmer | NEC451050UC | Used to make hot media |
| 14C-oleate | PerkinElmer | NEC317050UC | Used to make hot media |
| 23 G needle | BD | 305120 | Used to flush marrow from long bones |
| 24-well plates | TPP | 92024 | Used for cell culture |
| 70 μm cell strainers | MIDSCI | 70CELL | Used to filter supernatant during cavarial digestion |
| Acridine Orange/Propidium Iodide (AO/PI) dye | Nexcelom Biosciences | CS2-0106 | Stains live cells to determine seed density |
| Bovine Serum Ablumin | Proliant Biologicals | 68700 | Used for fatty acid conjugation |
| Cellometer Auto 2000 | Nexcelom Biosciences | Determine the number of viable cells | |
| Centrifuge | Thermo Fisher | Legend Micro 21R | Used to pellet cells |
| Collagenase type II | Worthington | LS004176 | Dissociate cells from tissue |
| Custom MEM alpha | GIBCO | SKU: ME 18459P1 | Used to create custom hot media |
| Dulbecco's Phosphate-Buffered Saline | Gibco | 10010023 | Used to dissolve and dilute reagents, and wash culture dishes |
| Filter Paper | Millipore-Sigma | WHA1001090 | Traps CO2 with sodium hydroxide |
| Glucose | Sigma-Aldrich | g7528 | Used to make custom media |
| HEPES | Gibco | 15630080 | Traps CO2 during cell culture |
| L-carnitine | Sigma-Aldrich | C0283 | Supplemented for fatty acid oxidation |
| L-Glutamine | Sigma-Aldrich | g3126 | Used to make custom media |
| MEM alpha | Thermo | A10490 | Cell culture medium |
| Parafilm | Pecheney Plastic Packaging | PM998 | Used to seal cell culture dishes |
| Penicillin-Streptomycin | Thermo Fisher | 15140122 | Prevents contamination in cell culture |
| Perchloric Acid | Sigma-Aldrich | 244252 | Releases CO2 during metabolic assay |
| Pyruvate | Sigma-Aldrich | p5280 | Used to make custom media |
| Scintillation Counter | Beckman Coulter | LS6500 | Determines radioactivity from the filter paper |
| Scintillation Fluid | MP Biomedicals | 882453 | Absorb the energy emitted by RAMs and re-emit it as flashes of light |
| Scintillation Vial | Fisher Scientific | 03-337-1 | Reaction containers for scintillation fluid |
| Sodium carbonate | Sigma-Aldrich | S5761 | Balance buffer for medium |
| Sodium Hydroxide | Sigma-Aldrich | 58045 | Traps CO2 during metaboilc assay |
| Sodium oleate | SANTA CRUZ | SC-215879 | BSA conjugated fatty acid preparation |
| Vaccum filtration 1000 | TPP | 99950 | Filter cMEMα |
References
- Hargreaves, M., Spriet, L. L. Skeletal muscle energy metabolism during exercise. Nature Metabolism. 2 (9), 817-828 (2020).
- Jeukendrup, A. E. Regulation of fat metabolism in skeletal muscle. Annals of the New York Academy of Sciences. 967, 217-235 (2002).
- Randle, P. J., Garland, P. B., Hales, C. N., Newsholme, E. A. The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus. Lancet. 1 (7285), 785-789 (1963).
- Randle, P. J., Newsholme, E. A., Garland, P. B. Regulation of glucose uptake by muscle. 8. Effects of fatty acids, ketone bodies and pyruvate, and of alloxan-diabetes and starvation, on the uptake and metabolic fate of glucose in rat heart and diaphragm muscles. Biochemical Journal. 93 (3), 652-665 (1964).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochemical Journal. 186 (3), 701-711 (1980).
- Cha, B. S., et al. Impaired fatty acid metabolism in type 2 diabetic skeletal muscle cells is reversed by PPARgamma agonists. American Journal of Physiology. Endocrinology and Metabolism. 289 (1), 151-159 (2005).
- Lee, W. C., Guntur, A. R., Long, F., Rosen, C. J. Energy metabolism of the osteoblast: implications for osteoporosis. Endocrine Reviews. 38 (3), 255-266 (2017).
- Li, B., et al. Both aerobic glycolysis and mitochondrial respiration are required for osteoclast differentiation. FASEB Journal. 34 (8), 11058-11067 (2020).
- Lee, W. C., Ji, X., Nissim, I., Long, F. Malic enzyme couples mitochondria with aerobic glycolysis in osteoblasts. Cell Reports. 32 (10), 108108 (2020).
- Kim, S. P., et al. Fatty acid oxidation by the osteoblast is required for normal bone acquisition in a sex- and diet-dependent manner. JCI Insight. 2 (16), 92704 (2017).
- Yu, Y., et al. Glutamine metabolism regulates proliferation and lineage allocation in skeletal stem cells. Cell Metabolism. 29 (4), 966-978 (2019).
- Karner, C. M., Esen, E., Okunade, A. L., Patterson, B. W., Long, F. Increased glutamine catabolism mediates bone anabolism in response to WNT signaling. The Journal of Clinical Investigation. 125 (2), 551-562 (2015).
- Takeshita, S., Kaji, K., Kudo, A. Identification and characterization of the new osteoclast progenitor with macrophage phenotypes being able to differentiate into mature osteoclasts. Journal of Bone and Mineral Research. 15 (8), 1477-1488 (2000).
- Itoh, Y., et al. Dichloroacetate effects on glucose and lactate oxidation by neurons and astroglia in vitro and on glucose utilization by brain in vivo. Proceedings of the National Academy of Sciences of the United States of America. 100 (8), 4879-4884 (2003).
- Oba, M., Baldwin, R. L. 4. t. h., Bequette, B. J. Oxidation of glucose, glutamate, and glutamine by isolated ovine enterocytes in vitro is decreased by the presence of other metabolic fuels. Journal of Animal Science. 82 (2), 479-486 (2004).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Huynh, F. K., Green, M. F., Koves, T. R., Hirschey, M. D. Measurement of fatty acid oxidation rates in animal tissues and cell lines. Methods in Enzymology. 542, 391-405 (2014).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
- Abdelmagid, S. A., et al. Comprehensive profiling of plasma fatty acid concentrations in young healthy Canadian adults. PLoS One. 10 (2), 0116195 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved