È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione dell'ossidazione del substrato energetico in vitro con 14INtrappolamento di CO 2
In questo articolo
Riepilogo
Questo protocollo descrive un metodo facile da usare per esaminare l'ossidazione del substrato monitorando la produzione di 14CO2 in vitro.
Abstract
I mitocondri ospitano i macchinari per il ciclo dell'acido tricarbossilico (TCA) e la catena di trasporto degli elettroni (ETC), che generano adenosina trifosfato (ATP) per mantenere l'omeostasi energetica. Glucosio, acidi grassi e amminoacidi sono i principali substrati energetici che alimentano la respirazione mitocondriale nella maggior parte delle cellule somatiche. L'evidenza mostra che diversi tipi di cellule possono avere una netta preferenza per determinati substrati. Tuttavia, l'utilizzo del substrato da parte di varie cellule nello scheletro non è stato studiato in dettaglio. Inoltre, poiché il metabolismo cellulare è in sintonia con i cambiamenti fisiologici e fisiopatologici, le valutazioni dirette della dipendenza dal substrato nelle cellule scheletriche possono fornire importanti informazioni sulla patogenesi delle malattie ossee.
Il seguente protocollo si basa sul principio del rilascio di anidride carbonica dalle molecole del substrato dopo fosforilazione ossidativa. Utilizzando substrati contenenti atomi di carbonio marcati radioattivamente (14C), il metodo fornisce un saggio sensibile e facile da usare per il tasso di ossidazione del substrato in coltura cellulare. Un caso di studio con preosteoblasti calvariali primari rispetto a macrofagi derivati dal midollo osseo (BMM) dimostra un diverso utilizzo dei substrati principali tra i due tipi di cellule.
Introduzione
La fosforilazione ossidativa (OXPHOS) negli eucarioti è il processo attraverso il quale i nutrienti vengono scomposti all'interno dei mitocondri per rilasciare energia chimica sotto forma di ATP attraverso il consumo di ossigeno. Il catabolismo di vari substrati all'interno dei mitocondri attraverso il ciclo dell'acido tricarbossilico (TCA) genera direttamente poche molecole di ATP, ma piuttosto immagazzina energia attraverso la riduzione dei portatori di elettroni nicotinamide adenina dinucleotide (NAD +) e flavina adenina dinucleotide (FAD +). I portatori ridotti vengono quindi ossidati da ETC situati sulla membrana interna dei mitocondri per generare un gradiente di concentrazione protonica attraverso la membrana. I protoni alla fine fluiscono lungo il loro gradiente nella matrice mitocondriale attraverso l'ATP sintasi per produrre ATP. OXPHOS è il mezzo più efficiente di produzione di ATP da substrati energetici e generalmente preferito in ambienti aerobici. In precedenza, la glicolisi aerobica - produzione di lattato dal glucosio mentre l'ossigeno è presente - era ritenuta fisiopatologica, spesso un segno distintivo delle cellule tumorali. Sempre di più, si sta scoprendo che alcuni tipi di cellule normali usano la glicolisi aerobica per ragioni che devono ancora essere completamente decifrate.
La flessibilità metabolica è la capacità delle cellule o degli organismi di adattarsi alle mutevoli richieste di energia e alle fonti di combustibile disponibili. Ad esempio, la domanda energetica del muscolo scheletrico è soddisfatta principalmente da OXPHOS allo stato stazionario, ma dalla glicolisi anaerobica durante l'esercizio ad alta intensità1. Con l'aumentare della durata dell'esercizio, l'ossidazione del glucosio e degli acidi grassi contribuisce maggiormente alla produzione complessiva di energia2. Tuttavia, l'uso del substrato non dipende solo dalla disponibilità, poiché i substrati competono antagonisticamente durante l'ossidazione. In particolare, l'ossidazione degli acidi grassi ha dimostrato di inibire l'utilizzo del glucosio da parte del muscolo scheletrico in un fenomeno noto come effetto Randle3. Un effetto reciproco è stato dimostrato da studi successivi 4,5. Inoltre, molte malattie sono associate a un cambiamento nella preferenza del substrato e allo sviluppo di inflessibilità metabolica nelle cellule. Ad esempio, l'ossidazione degli acidi grassi è ridotta nel muscolo scheletrico dei pazienti diabetici di tipo II rispetto ai normali soggetti di controllo6. I cambiamenti metabolici nelle impostazioni della malattia sono oggetto di intense indagini in quanto possono contribuire alla patogenesi.
Il metabolismo energetico nei tipi di cellule scheletriche è relativamente poco studiato, ma ha attirato l'attenzione negli ultimi anni7. Lavori precedenti hanno dimostrato che la glicolisi aerobica è la via energetica dominante negli osteoblasti calvariali, mentre l'ossidazione del glucosio attraverso il ciclo TCA svolge un ruolo nella formazione degli osteoclasti 8,9. Altri hanno fornito prove per gli acidi grassi come fonte di energia per gli osteoblasti10. Il catabolismo della glutammina ha anche dimostrato di supportare la differenziazione degli osteoblasti dai progenitori11,12. Tuttavia, manca ancora una comprensione completa dell'utilizzo del substrato da parte di vari tipi di cellule scheletriche. Inoltre, si prevede che i cambiamenti nel metabolismo cellulare durante la differenziazione cellulare o in risposta a segnali patologici alterino l'utilizzo del substrato del carburante. Di seguito è descritto un protocollo di facile utilizzo per l'analisi dell'ossidazione del substrato in vitro.
Protocollo
L'uso di materiali radioattivi (RAM) richiede l'approvazione preventiva di un comitato di sicurezza designato presso ciascuna istituzione. Le RAM utilizzate in questo protocollo sono state approvate da Environmental Health & Radiation Safety (EHRS) presso l'Università della Pennsylvania. L'uso di animali richiede l'approvazione preventiva da parte del Comitato istituzionale per la cura e l'uso degli animali (IACUC) presso l'istituzione di origine. Il seguente studio è stato approvato dalla IACUC presso il Children's Hospital di Philadelphia.
1. Preparazione di soluzioni stock per 14substrati con etichetta C
- Produrre 4 mM di soluzione madre di albumina sierica bovina (BSA) mescolando 11 g di BSA e 33,1 mL di soluzione salina tamponata con fosfato (DPBS) di Dulbecco e agitandola delicatamente a temperatura ambiente per ~ 3 ore fino a quando BSA non è completamente disciolto. Riscaldare la soluzione madre BSA a bagnomaria a 70 °C prima dell'uso.
- Asciugare all'aria 50 μCi 14C-oleato (50 μCi/μmol in etanolo) nel flaconcino con il coperchio spento per 8 ore in una cappa di lavoro RAM designata. Aggiungere 312,5 μL di H2O e poi 3,5 mg (11,5 μmol) di oleato di sodio. Mescolare accuratamente.
- Riscaldare la soluzione risultante a 70 °C a bagnomaria. Aggiungere 0,9375 mL della soluzione madre BSA preriscaldata per produrre 10 mM di soluzione madre di oleato caldo (contenente un rapporto 1:11,5 di 14C-oleato e oleato non etichettato). Aliquotare la soluzione madre e conservarla a -20 °C per un uso a lungo termine.
- Utilizzare 14C-glucosio e 14C-glutammina direttamente dopo lo scongelamento.
2. Preparazione di un mezzo contenente 14substrati marcati con etichetta C
NOTA: per garantire concentrazioni affidabili di substrati energetici nel fluido, è necessario utilizzare supporti personalizzati con substrati freschi aggiunti poco prima dell'uso. Qui viene utilizzato un minimum essential medium (MEMα) su misura senza glucosio, piruvato, glutammina, rosso fenolo o bicarbonato di sodio. Tuttavia, un mezzo ottimale dovrebbe essere determinato per ogni tipo di cellula.
- Ricostituire 8,67 g di polvere media in 1 L di acqua purificata. Aggiungere 2,2 g di bicarbonato di sodio per ottenere un pH di 7,4 e filtrare la soluzione utilizzando la filtrazione sotto vuoto da 0,22 μm.
- Aggiungere ingredienti freschi per ottenere il mezzo completo (cMEMα) con concentrazioni finali di 5,5 mM di glucosio, 2 mM di glutammina, 1 mM di piruvato e 10% di siero bovino fetale (FBS). Integrare ulteriormente cMEMα con 100 mM di L-carnitina e 10 μM HEPES per facilitare l'ossidazione degli acidi grassi.
- Immediatamente prima dell'uso, aggiungere 14substrati con etichetta C a cMEMα appena preparato per ottenere supporti caldi. Per rendere il mezzo oleato caldo, aggiungere la soluzione madre di oleato caldo da 10 mM a cMEMα per una concentrazione finale di oleato di 100 μM (diluizione 1:100, radioattività finale 0,4 μCi/mL).
NOTA: il materiale oleato caldo da 10 mM contenente un rapporto 1:11,5 di oleato caldo/freddo (vedere punto 1.3) viene utilizzato per raggiungere un livello fisiologico di oleato totale di 100 μM nel fluido riducendo al minimo la quantità di materiale radioattivo. - Produrre 10 mM di brodo di oleato non etichettato aggiungendo 24,36 mg di oleato di sodio a 2 mL di H2O a bagnomaria a 70 °C per ~20 minuti fino a completa dissoluzione prima di mescolare rapidamente con 6 mL della soluzione madre BSA da 4 mM preriscaldata a 70 °C. Trasferire a bagnomaria a 37 °C per 1 ora e filtrare attraverso un filtro da 0,22 μm. Aliquota e conservazione a -20 °C per uso a lungo termine.
- Per produrre glucosio mezzo caldo, aggiungere 14C-glucosio ad una concentrazione finale di 1,333 μM (diluizione 1:4.125, radioattività finale 0,4 μCi/mL). Per rendere la glutammina media calda, aggiungere 14C-glutammina alla concentrazione finale di 2 μM (diluizione 1:1.000, radioattività finale 0,4 μCi/mL).
- Integrare il mezzo caldo di glucosio e glutammina con una soluzione madre da 10 mM di oleato non marcato dal punto 2.4 per ottenere la concentrazione finale di oleato di 100 μM, la stessa di quella nel mezzo caldo oleato.
3. Preparazione delle cellule
NOTA: I preosteoblasti calvariali e i macrofagi del midollo osseo sono usati come esempi qui. Gli utenti dovrebbero preparare il loro tipo di cella di scelta in base ai protocolli appropriati. Ottimizzare la concentrazione di collagenasi II da utilizzare per la digestione in esperimenti pilota in quanto l'attività enzimatica può variare tra diversi lotti.
- Isolamento e coltura dei preosteoblasti calvariali
- Sacrificare i cuccioli postnatali giorno 3-5 (P3-5) per decapitazione e trasferirli in DPBS ghiacciato contenente penicillina-streptomicina (P / S).
- Esporre la calvaria rimuovendo la pelle e i tessuti molli. Raccogliere la regione centrale tagliando via i tessuti circostanti da dietro a davanti in DPBS (Figura 1A). Gratta delicatamente le superfici interne ed esterne della calvaria usando una pinzetta per aiutare a rilasciare le cellule dopo la successiva digestione.
- Preparare una soluzione da 2 mg/mL e una soluzione da 4 mg/mL di collagenasi di tipo II in DPBS e filtrare ogni soluzione con un filtro fresco da 0,22 μm. Digerire prima la calvaria pulita con la soluzione di collagenasi da 2 mg/ mL per 15 minuti e scartare la soluzione di digestione. Digerire i campioni puliti in soluzione di collagenasi da 4 mg/mL 3 volte per 15 minuti ogni volta, mettendo in comune e risparmiando la soluzione di digestione.
- Filtrare la soluzione di digestione attraverso filtri cellulari da 70 μm e centrifugare il filtrato a 300 × g per 5 minuti. Sospendere il pellet cellulare in cMEMα (vedere punto 2.2) contenente il 10% di FBS e P/S.
- Contare e seminare le cellule a 4 × 104 cellule/cm2 in piastre da 10 cm. Coltivare le cellule in un incubatore a 37 °C con il 5% di CO2 per 3 giorni.
- Dissociare le cellule a 37 °C con lo 0,25% di tripsina-EDTA. Contare e seminare le cellule in piastre di coltura cellulare a 24 pozzetti con cMEMα contenente il 10% di FBS e P/S a 7,5 × 105/cm2. Seminare almeno 4 pozzetti per tipo di cellula per substrato e almeno tre pozzetti extra per ogni tipo di cellula per il conteggio delle cellule prima del test.
- Coltivare le cellule a 37 °C durante la notte prima dei test di ossidazione del substrato.
- Isolamento e cultura dei BMM
NOTA: La coltura di BBM richiede un fattore stimolante le colonie di macrofagi (M-CSF), che può essere acquistato commercialmente come proteina ricombinante. Il mezzo condizionato dalla linea cellulare CMG14-12 progettato per esprimere M-CSF è un'alternativa economica utilizzata qui13.- Raccogli femori e tibie da topi di 8 settimane dopo aver rimosso il muscolo e i tessuti connettivi. Tagliare e scartare entrambe le estremità delle ossa con forbici affilate.
- Sciacquare il midollo osseo da un femore e una tibia in una capsula di Petri di 10 cm con una siringa dotata di un ago da 23 G contenente 15 ml di cMEMα con il 10% di FBS, P/S e il 10% di CMG14-12 di mezzo condizionato (mezzo BMM). Coltivare le cellule nella capsula di Petri in un incubatore a 37 °C con il 5% di CO2.
- Dopo 3 giorni, scartare il terreno di coltura e risciacquare con DPBS. Dissociare le cellule attaccate a 37 °C con lo 0,25% di tripsina-EDTA per 5 minuti. Centrifugare e risospendare il pellet cellulare nel mezzo BMM.
- Contare e seminare le cellule in piastre di coltura cellulare a 24 pozzetti a 7,5 × 105/cm2 nello stesso modo descritto al punto 3.1.6. Coltura a 37 °C durante la notte nel mezzo BMM prima di iniziare i test.
4. Saggio di ossidazione del substrato con trappola di CO2
NOTA: deve essere determinata una densità di semina appropriata per ciascun tipo di cellula per raggiungere una confluenza dell'80-90% prima dell'inizio del test. Si noti che la densità cellulare può influenzare lo stato metabolico delle cellule.
- Lavare le cellule nei pozzetti extra due volte con DPBS. Dissociare le cellule con lo 0,25% di tripsina-EDTA e cellule miste da 20 μL risospese in DPBS con 20 μL di acridina arancia/ioduro di propidio (AO/PI) pronta all'uso soluzione colorante commerciale. Determinare il numero di cellule vive con un contatore di celle automatizzato e registrare il numero per i calcoli finali.
- Lavare le cellule nei pozzetti di analisi due volte con DPBS. Aggiungere 500 μL di mezzo caldo a ciascun test bene nella cappa di coltura tissutale designata dalla RAM. Sigillare le piastre con parafilm e incubare le celle in un incubatore designato dalla RAM a 37 °C per 4 ore.
- Durante l'incubazione, tagliare la carta da filtro in pezzi circolari leggermente più grandi dell'area all'interno del cappuccio di tubi di microcentrifuga da 1,5 ml e inserire la carta comodamente nel cappuccio (Figura 1B). Aggiungere 200 μL di acido perclorico 1 M a ciascun tubo e 20 μL di idrossido di sodio alla carta da filtro montata all'interno del tappo.
- Dopo l'incubazione delle cellule, trasferire 400 μL di terreno di coltura da ciascun pozzetto ai tubi preparati e chiudere immediatamente i tappi. Lasciare i tubi in un portatubi a temperatura ambiente per 1 ora.
- Durante l'incubazione, impostare una fiala di scintillazione per ogni tubo e riempirla con 4 ml di liquido di scintillazione. Trasferire ogni pezzo di carta da filtro in un flaconcino scintillante e incubare a temperatura ambiente per 30 minuti.
- Eseguire test di pulizia sulla cappa di coltura del tessuto, sul bagno d'acqua (utilizzato per la preparazione di 14C-oleato), sul frigorifero, sull'incubatore, sul lavandino, sul terreno e su qualsiasi altra area di lavoro per una potenziale contaminazione da RAM. Mettere le salviette di carta in flaconcini di scintillazione contenenti liquido di scintillazione.
- Misurare la radioattività di 14C nei flaconcini di scintillazione con un contatore di scintillazione. Registrare i risultati di lettura. Decontaminare l'ambiente di lavoro secondo le linee guida sulla sicurezza delle radiazioni, se necessario.
5. Analisi dei dati
NOTA: Supponendo che ogni substrato sia completamente ossidato per rilasciare CO2, il tasso di ossidazione del substrato può essere calcolato dalla radioattività CO2 intrappolata .
- Calcolare il tasso di ossidazione del substrato utilizzando Eq (1) e i valori X, Y e Z indicati nella Tabella 1 per diversi substrati.
Tasso di ossidazione del substrato (μmol/cell/h) =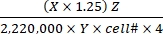 (1)
(1)- Calcola le disintegrazioni totali al minuto (DPM) per ogni reazione bene. Per X, utilizzare il valore DPM (lettura del contatore di scintillazione) da 0,4 mL del mezzo di reazione utilizzato per l'intrappolamento di CO2 su 0,5 mL del mezzo di reazione totale. Pertanto, il DPM totale di ciascun pozzo di reazione è X × 1,25.
- Dividere il DPM totale per un fattore di 2.220.000 da convertire in μCi.
- Convertire la radioattività in μCi nel numero di 14molecole marcate con C. Dividere il valore μCi per l'attività specifica (Y) di ciascun substrato etichettato. Utilizzare i seguenti valori Y (Tabella 1): 14C-glucosio: 300 mCi/mmol; 14 anni C-glutammina: 200 mCi/mmol; 14 anni C-oleato: 50 mCi/mmol.
- Calcola il numero totale di molecole ossidate dalle 14molecole marcate C ossidate moltiplicando queste ultime per il fattore di diluizione da caldo a totale (Z). Utilizzare i seguenti valori Z (Tabella 1): Glucosio: 4.125; glutammina: 1.000; oleato: 12.5.
- Dividere il prodotto risultante per numero di cella (cell#) e 4 (per il tempo di reazione di 4 h) per determinare il tasso di ossidazione del substrato per cella. Utilizzare il cell# determinato nei pozzetti paralleli all'inizio del test.
Risultati
In questo esempio, il metodo di intrappolamento della CO2 viene utilizzato per confrontare l'ossidazione del substrato da parte dei preosteoblasti calvariali primari rispetto ai BMM, che vengono spesso utilizzati rispettivamente per la differenziazione in vitro degli osteoblasti o degli osteoclasti. Dopo che le cellule primarie sono passate e coltivate in cMEMα durante la notte, in genere raggiungono l'80-90% della confluenza e mostrano la loro morfologia caratteristica. I preosteoblasti calvariali s...
Discussione
Il protocollo fornisce un metodo facile da usare per determinare il tasso di ossidazione dei principali substrati energetici. È un'alternativa più semplice ad altri protocolli che utilizzano palloni contenenti un pozzo centrale e ricoperti da tappi di gomma 14,15,16. Sebbene lo studio di esempio qui sia eseguito con coltura cellulare, il metodo può essere facilmente adattato per espianti tissutali o omogeneizzati tissutali co...
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Il lavoro è stato sostenuto in parte dalla sovvenzione NIH R01 AR060456 (FL). Ringraziamo il Dr. Michael Robinson ed Elizabeth Krizman (The Children's Hospital of Philadelphia) per il loro generoso aiuto con il contatore di scintillazione.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µm filters | Sigma-Aldrich | SLGVM33RS | Used to filter BSA solution |
| 0.25% Trypsin-EDTA | Gibco | 25200056 | Dissociate cells from cell culture plates |
| 1.5 mL Eppendorf tubes | PR1MA | PR MCT17 RB | Used for reaction incubation |
| 10 cm plates | TPP | 93100 | Used for cell culture |
| 10 mL syringe | BD | 302995 | Used to flush marrow from long bones |
| 10% FBS | Atlanta biologicals | S11550 | For Cell culture medium preparation |
| 14C-Glucose | PerkinElmer | NEC042X050UC | Used to make hot media |
| 14C-glutamine | PerkinElmer | NEC451050UC | Used to make hot media |
| 14C-oleate | PerkinElmer | NEC317050UC | Used to make hot media |
| 23 G needle | BD | 305120 | Used to flush marrow from long bones |
| 24-well plates | TPP | 92024 | Used for cell culture |
| 70 μm cell strainers | MIDSCI | 70CELL | Used to filter supernatant during cavarial digestion |
| Acridine Orange/Propidium Iodide (AO/PI) dye | Nexcelom Biosciences | CS2-0106 | Stains live cells to determine seed density |
| Bovine Serum Ablumin | Proliant Biologicals | 68700 | Used for fatty acid conjugation |
| Cellometer Auto 2000 | Nexcelom Biosciences | Determine the number of viable cells | |
| Centrifuge | Thermo Fisher | Legend Micro 21R | Used to pellet cells |
| Collagenase type II | Worthington | LS004176 | Dissociate cells from tissue |
| Custom MEM alpha | GIBCO | SKU: ME 18459P1 | Used to create custom hot media |
| Dulbecco's Phosphate-Buffered Saline | Gibco | 10010023 | Used to dissolve and dilute reagents, and wash culture dishes |
| Filter Paper | Millipore-Sigma | WHA1001090 | Traps CO2 with sodium hydroxide |
| Glucose | Sigma-Aldrich | g7528 | Used to make custom media |
| HEPES | Gibco | 15630080 | Traps CO2 during cell culture |
| L-carnitine | Sigma-Aldrich | C0283 | Supplemented for fatty acid oxidation |
| L-Glutamine | Sigma-Aldrich | g3126 | Used to make custom media |
| MEM alpha | Thermo | A10490 | Cell culture medium |
| Parafilm | Pecheney Plastic Packaging | PM998 | Used to seal cell culture dishes |
| Penicillin-Streptomycin | Thermo Fisher | 15140122 | Prevents contamination in cell culture |
| Perchloric Acid | Sigma-Aldrich | 244252 | Releases CO2 during metabolic assay |
| Pyruvate | Sigma-Aldrich | p5280 | Used to make custom media |
| Scintillation Counter | Beckman Coulter | LS6500 | Determines radioactivity from the filter paper |
| Scintillation Fluid | MP Biomedicals | 882453 | Absorb the energy emitted by RAMs and re-emit it as flashes of light |
| Scintillation Vial | Fisher Scientific | 03-337-1 | Reaction containers for scintillation fluid |
| Sodium carbonate | Sigma-Aldrich | S5761 | Balance buffer for medium |
| Sodium Hydroxide | Sigma-Aldrich | 58045 | Traps CO2 during metaboilc assay |
| Sodium oleate | SANTA CRUZ | SC-215879 | BSA conjugated fatty acid preparation |
| Vaccum filtration 1000 | TPP | 99950 | Filter cMEMα |
Riferimenti
- Hargreaves, M., Spriet, L. L. Skeletal muscle energy metabolism during exercise. Nature Metabolism. 2 (9), 817-828 (2020).
- Jeukendrup, A. E. Regulation of fat metabolism in skeletal muscle. Annals of the New York Academy of Sciences. 967, 217-235 (2002).
- Randle, P. J., Garland, P. B., Hales, C. N., Newsholme, E. A. The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus. Lancet. 1 (7285), 785-789 (1963).
- Randle, P. J., Newsholme, E. A., Garland, P. B. Regulation of glucose uptake by muscle. 8. Effects of fatty acids, ketone bodies and pyruvate, and of alloxan-diabetes and starvation, on the uptake and metabolic fate of glucose in rat heart and diaphragm muscles. Biochemical Journal. 93 (3), 652-665 (1964).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochemical Journal. 186 (3), 701-711 (1980).
- Cha, B. S., et al. Impaired fatty acid metabolism in type 2 diabetic skeletal muscle cells is reversed by PPARgamma agonists. American Journal of Physiology. Endocrinology and Metabolism. 289 (1), 151-159 (2005).
- Lee, W. C., Guntur, A. R., Long, F., Rosen, C. J. Energy metabolism of the osteoblast: implications for osteoporosis. Endocrine Reviews. 38 (3), 255-266 (2017).
- Li, B., et al. Both aerobic glycolysis and mitochondrial respiration are required for osteoclast differentiation. FASEB Journal. 34 (8), 11058-11067 (2020).
- Lee, W. C., Ji, X., Nissim, I., Long, F. Malic enzyme couples mitochondria with aerobic glycolysis in osteoblasts. Cell Reports. 32 (10), 108108 (2020).
- Kim, S. P., et al. Fatty acid oxidation by the osteoblast is required for normal bone acquisition in a sex- and diet-dependent manner. JCI Insight. 2 (16), 92704 (2017).
- Yu, Y., et al. Glutamine metabolism regulates proliferation and lineage allocation in skeletal stem cells. Cell Metabolism. 29 (4), 966-978 (2019).
- Karner, C. M., Esen, E., Okunade, A. L., Patterson, B. W., Long, F. Increased glutamine catabolism mediates bone anabolism in response to WNT signaling. The Journal of Clinical Investigation. 125 (2), 551-562 (2015).
- Takeshita, S., Kaji, K., Kudo, A. Identification and characterization of the new osteoclast progenitor with macrophage phenotypes being able to differentiate into mature osteoclasts. Journal of Bone and Mineral Research. 15 (8), 1477-1488 (2000).
- Itoh, Y., et al. Dichloroacetate effects on glucose and lactate oxidation by neurons and astroglia in vitro and on glucose utilization by brain in vivo. Proceedings of the National Academy of Sciences of the United States of America. 100 (8), 4879-4884 (2003).
- Oba, M., Baldwin, R. L. 4. t. h., Bequette, B. J. Oxidation of glucose, glutamate, and glutamine by isolated ovine enterocytes in vitro is decreased by the presence of other metabolic fuels. Journal of Animal Science. 82 (2), 479-486 (2004).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Huynh, F. K., Green, M. F., Koves, T. R., Hirschey, M. D. Measurement of fatty acid oxidation rates in animal tissues and cell lines. Methods in Enzymology. 542, 391-405 (2014).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
- Abdelmagid, S. A., et al. Comprehensive profiling of plasma fatty acid concentrations in young healthy Canadian adults. PLoS One. 10 (2), 0116195 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon