Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка окисления энергетического субстрата in vitro с улавливанием 14CO2
В этой статье
Резюме
Этот протокол описывает простой в использовании метод исследования окисления субстрата путем отслеживания производства 14CO2 in vitro.
Аннотация
Митохондрии содержат механизм для цикла трикарбоновой кислоты (TCA) и цепи переноса электронов (ETC), которые генерируют аденозинтрифосфат (АТФ) для поддержания энергетического гомеостаза. Глюкоза, жирные кислоты и аминокислоты являются основными энергетическими субстратами, подпитывающими митохондриальное дыхание в большинстве соматических клеток. Фактические данные показывают, что различные типы клеток могут иметь явное предпочтение определенным субстратам. Однако использование субстрата различными клетками скелета подробно не изучено. Более того, поскольку клеточный метаболизм настроен на физиологические и патофизиологические изменения, прямые оценки субстратной зависимости в скелетных клетках могут дать важное представление о патогенезе заболеваний костей.
Следующий протокол основан на принципе высвобождения углекислого газа из молекул субстрата после окислительного фосфорилирования. Используя субстраты, содержащие радиоактивно меченые атомы углерода (14С), способ обеспечивает чувствительный и простой в использовании анализ скорости окисления субстрата в клеточной культуре. Тематическое исследование с первичными кальвариальными преостеобластами по сравнению с макрофагами, полученными из костного мозга (BMM), демонстрирует различное использование основных субстратов между двумя типами клеток.
Введение
Окислительное фосфорилирование (OXPHOS) у эукариот — это процесс, посредством которого питательные вещества расщепляются внутри митохондрий для высвобождения химической энергии в виде АТФ за счет потребления кислорода. Катаболизм различных субстратов внутри митохондрий через цикл трикарбоновой кислоты (TCA) генерирует несколько молекул АТФ напрямую, а скорее накапливает энергию за счет восстановления носителей электронов никотинамидадениндинуклеотида (NAD+) и флавинадениндинуклеотида (FAD+). Восстановленные носители затем окисляются ETC, расположенными на внутренней мембране митохондрий, чтобы генерировать градиент концентрации протонов по всей мембране. Протоны в конечном итоге текут вниз по своему градиенту обратно в митохондриальный матрикс через АТФ-синтазу с образованием АТФ. OXPHOS является наиболее эффективным средством производства АТФ из энергетических субстратов и, как правило, предпочтительным в аэробных средах. Ранее аэробный гликолиз - производство лактата из глюкозы при наличии кислорода - считался патофизиологическим, часто отличительной чертой раковых клеток. Все больше и больше обнаруживается, что некоторые нормальные типы клеток используют аэробный гликолиз по причинам, которые еще предстоит полностью расшифровать.
Метаболическая гибкость — это способность клеток или организмов адаптироваться к изменяющимся потребностям в энергии и доступным источникам топлива. Например, энергетическая потребность скелетных мышц в основном удовлетворяется OXPHOS в устойчивом состоянии, но анаэробным гликолизом во время высокоинтенсивных упражнений1. По мере увеличения продолжительности упражнений окисление глюкозы и жирных кислот вносит больший вклад в общее производство энергии2. Однако использование субстрата зависит не только от доступности, так как субстраты антагонистически конкурируют во время окисления. В частности, было показано, что окисление жирных кислот ингибирует утилизацию глюкозы скелетными мышцами в явлении, известном как эффект Рэндла3. Обратный эффект был продемонстрирован последующими исследованиями 4,5. Кроме того, многие заболевания связаны с изменением предпочтения субстрата и развитием метаболической негибкости в клетках. Например, окисление жирных кислот снижается в скелетных мышцах пациентов с диабетом II типа по сравнению с нормальными контрольными субъектами6. Метаболические изменения в условиях заболевания являются предметом интенсивного исследования, поскольку они могут способствовать патогенезу.
Энергетический метаболизм в типах скелетных клеток относительно недостаточно изучен, но привлек к себе внимание в последние годы7. Предыдущая работа показала, что аэробный гликолиз является доминирующим энергетическим путем в кальвариальных остеобластах, в то время как окисление глюкозы через цикл TCA играет роль в образовании остеокластов 8,9. Другие предоставили доказательства того, что жирные кислоты являются источником энергии для остеобластов10. Было также показано, что катаболизм глутамина поддерживает дифференциацию остеобластов от прародителей11,12. Тем не менее, всестороннее понимание использования субстрата различными типами клеток скелета все еще отсутствует. Кроме того, ожидается, что изменения клеточного метаболизма во время дифференцировки клеток или в ответ на патологические сигналы изменят использование топливного субстрата. Ниже описан простой в использовании протокол для анализа окисления субстрата in vitro.
протокол
Использование радиоактивных материалов (ОЗУ) требует предварительного одобрения назначенного комитета по безопасности в каждом учреждении. RAM, используемые в этом протоколе, были одобрены Environmental Health & Radiation Safety (EHRS) в Университете Пенсильвании. Использование животных требует предварительного одобрения Институционального комитета по уходу за животными и их использованию (IACUC) в домашнем учреждении. Следующее исследование было одобрено IACUC в Детской больнице Филадельфии.
1. Подготовка стоковых растворов для 14субстратов с маркировкой C
- Сделайте 4 мМ раствора сывороточного альбумина крупного рогатого скота (BSA), смешав 11 г BSA и 33,1 мл фосфатно-буферного физиологического раствора Dulbecco (DPBS) и осторожно встряхнув его при комнатной температуре в течение ~ 3 ч до полного растворения BSA. Прогрейте раствор BSA на водяной бане при температуре 70 °C перед использованием.
- Сушка на воздухе 50 мкКи 14С-олеата (50 мкКи/мкмоль в этаноле) во флаконе со снятой крышкой в течение 8 ч в специально отведенном рабочем вытяжке RAM. Добавьте 312,5 мклH2O, а затем 3,5 мг (11,5 мкмоль) олеата натрия. Тщательно перемешать.
- Нагрейте полученный раствор до 70 °C на водяной бане. Добавьте 0,9375 мл предварительно расплавленного раствора BSA для получения 10 мМ горячего раствора олеата (содержащего соотношение 1:11,5 14C-олеата к немаркированному олеату). Aliquot стоковый раствор и храните его при -20 °C для длительного использования.
- Используйте 14С-глюкозы и 14С-глутамина непосредственно после оттаивания.
2. Приготовление среды, содержащей 14С-меченых субстратов
ПРИМЕЧАНИЕ: Для обеспечения надежной концентрации энергетических подложек в среде необходимо использовать специальные среды со свежими подложками, добавленными незадолго до использования. Здесь используется изготовленная на заказ минимальная необходимая среда (MEMα) без глюкозы, пирувата, глутамина, фенола красного или бикарбоната натрия. Однако для каждого типа клеток должна быть определена оптимальная среда.
- Восстанавливают 8,67 г среднего порошка в 1 л очищенной воды. Добавьте 2,2 г бикарбоната натрия для достижения рН 7,4 и отфильтруйте раствор с помощью вакуумной фильтрации 0,22 мкм.
- Добавьте свежие ингредиенты для получения полной среды (cMEMα) с конечными концентрациями глюкозы 5,5 мМ, 2 мМ глутамина, пирувата 1 мМ и 10% фетальной бычьей сыворотки (FBS). Дополнительно дополняют cMEMα 100 мМ L-карнитина и 10 мкМ HEPES для облегчения окисления жирных кислот.
- Непосредственно перед использованием добавьте 14субстратов с маркировкой C к свежеприготовленному cMEMα для получения горячей среды. Чтобы получить олеатную горячую среду, добавьте 10 мМ раствор горячего олеата в cMEMα для конечной концентрации 100 мкМ олеата (разбавление 1:100, конечная радиоактивность 0,4 мкКи/мл).
ПРИМЕЧАНИЕ: Запас горячего олеата 10 мМ, содержащий соотношение 1:11,5 горячего и холодного олеата (см. этап 1.3), используется для достижения физиологического уровня 100 мкМ общего олеата в среде при минимизации количества радиоактивного материала. - Внесите 10 мМ немаркированного олеатного бульона, добавив 24,36 мг олеата натрия к 2 млH2O на водяной бане при 70 °C в течение ~ 20 мин до полного растворения перед быстрым смешиванием с 6 мл 4 мМ раствора BSA предварительно расплавленным до 70 °C. Переложить на водяную баню при температуре 37 °C в течение 1 ч и процедить через фильтр 0,22 мкм. Аликвот и хранить при -20 °C для длительного использования.
- Чтобы сделать глюкозу горячей средой, добавляют 14С-глюкозы к конечной концентрации 1,333 мкМ (разведение 1:4,125, конечная радиоактивность 0,4 мкКи/мл). Чтобы сделать глютамин горячей средой, добавляют 14С-глутамина к конечной концентрации 2 мкМ (разбавление 1:1000, конечная радиоактивность 0,4 мкКи/мл).
- Дополнить горячую среду глюкозой и глютамином 10 мМ раствором немаркированного олеата со стадии 2.4 для достижения конечной концентрации олеата 100 мкМ, такой же, как в олеатной горячей среде.
3. Подготовка клеток
ПРИМЕЧАНИЕ: В качестве примеров здесь используются кальвариальные преостеобласты и макрофаги костного мозга. Пользователи должны подготовить свой тип ячейки к выбору в соответствии с соответствующими протоколами. Оптимизировать концентрацию коллагеназы II для использования для пищеварения в пилотных экспериментах, так как ферментативная активность может варьироваться между различными партиями.
- Выделение и культивирование кальвариальных преостеобластов
- Приносят в жертву послеродового дня 3-5 (Р3-5) детенышей путем обезглавливания и переносят их в ледяной DPBS, содержащий пенициллин-стрептомицин (P/S).
- Обнажите кальварию путем удаления кожи и мягких тканей. Соберите среднюю область, отрезав окружающие ткани сзади спереди в DPBS (рисунок 1A). Поцарапайте внутреннюю и внешнюю поверхности кальварии осторожно, используя пинцет, чтобы помочь освободить клетки при последующем пищеварении.
- Готовят 2 мг/мл и 4 мг/мл раствора коллагеназы типа II в DPBS и фильтруют каждый раствор свежим фильтром 0,22 мкм. Переварить очищенную кальварию сначала раствором коллагеназы 2 мг/мл в течение 15 мин и отказаться от раствора для пищеварения. Переварить очищенные образцы в растворе коллагеназы 4 мг/мл 3 раза по 15 мин каждый раз, объединяя и сохраняя раствор для пищеварения.
- Процедить раствор для пищеварения через клеточные ситечки 70 мкм и центрифугировать фильтрат при 300 × г в течение 5 мин. Повторное суспендирование клеточной гранулы в cMEMα (см. этап 2.2), содержащей 10% FBS и P/S.
- Подсчитайте и посейте клетки через 4 × 104 ячейки /см2 в пластинах 10 см. Культивируйте клетки в инкубаторе с температурой 37 °C с 5% CO2 в течение 3 дней.
- Диссоциируют клетки при 37 °C с 0,25% трипсина-ЭДТА. Подсчитайте и засейте клетки в 24-луночные пластины для культивирования клеток с cMEMα, содержащими 10% FBS и P/S при 7,5 × 105/см2. Засейте по меньшей мере 4 лунки на тип ячейки на субстрат и, по меньшей мере, три дополнительные скважины для каждого типа клеток для подсчета клеток перед анализом.
- Культивируйте клетки при 37 °C в течение ночи перед анализом окисления субстрата.
- Изоляция и культура БММ
ПРИМЕЧАНИЕ: Культура ИММ требует макрофагального колониестимулирующего фактора (M-CSF), который можно приобрести коммерчески в качестве рекомбинантного белка. Кондиционированная среда из клеточной линии CMG14-12, спроектированная для экспрессии M-CSF, является экономичной альтернативой, используемой здесь13.- Соберите бедренные и большеберцовые кости у 8-недельных мышей после удаления мышечной и соединительной тканей. Отрежьте и выбросьте оба конца костей острыми ножницами.
- Смывайте костный мозг из одной бедренной кости и одной большеберцовой кости в 10-сантиметровую чашку Петри со шприцем, снабженным иглой 23 г, содержащей 15 мл cMEMα с 10% FBS, P / S и 10% кондиционированной средой CMG14-12 (среда BMM). Культивируйте клетки в чашке Петри в инкубаторе с температурой 37 °C с 5% CO2.
- Через 3 дня отбросить питательные среды и промыть ДПБС. Диссоциируют прикрепленные клетки при 37 °C с 0,25% трипсина-ЭДТА в течение 5 мин. Центрифуга и повторное суспендирование ячейки гранулы в среде BMM.
- Подсчитайте и посейте клетки в 24-луночных пластинах для культивирования клеток при 7,5 × 105/см2 таким же образом, как описано в 3.1.6. Культивируйте при 37 °C в течение ночи в среде BMM перед началом анализов.
4. Анализ окисления субстрата с помощью ловушки CO2
ПРИМЕЧАНИЕ: Для каждого типа клеток должна быть определена соответствующая плотность посева для достижения 80-90% слияния до начала анализа. Обратите внимание, что плотность клеток может влиять на метаболическое состояние клеток.
- Промывайте ячейки в дополнительных колодцах дважды с помощью DPBS. Диссоциируют клетки с 0,25% трипсин-ЭДТА и смешивают 20 мкл клеток, повторно суспендированных в DPBS с 20 мкл готового к использованию раствора красителя акридина оранжевого/пропидия йодида (AO/PI). Определите количество живых ячеек с помощью автоматического счетчика ячеек и запишите их количество для окончательных вычислений.
- Промывайте ячейки в пробирных колодцах дважды с помощью DPBS. Добавьте 500 мкл горячей среды к каждому анализу хорошо в оболочке для культивирования тканей, назначенной RAM. Запечатайте пластины парапленкой и инкубируйте клетки в инкубаторе, назначенном RAM, при 37 °C в течение 4 ч.
- Во время инкубации нарежьте фильтровальную бумагу на круглые кусочки, немного большие, чем площадь внутри колпачка микроцентрифужных трубок объемом 1,5 мл, и плотно вставьте бумагу в колпачок (рисунок 1B). Добавьте 200 мкл 1 М хлорной кислоты в каждую трубку и 20 мкл гидроксида натрия в фильтровальную бумагу, установленную внутри колпачка.
- После инкубации клеток переложите 400 мкл питательной среды из каждой лунки в подготовленные пробирки и немедленно закройте колпачки. Оставьте трубки в трубчатой стойке при комнатной температуре на 1 ч.
- Во время инкубации установите для каждой трубки сцинтилляционный флакон и заполните его 4 мл сцинтилляционной жидкости. Каждый кусочек фильтровальной бумаги переложить в сцинтилляционный флакон и инкубировать при комнатной температуре в течение 30 мин.
- Проведите тесты салфетки на вытяжке для культивирования тканей, водяной бане (используется для приготовления 14С-олеата), холодильнике, инкубаторе, раковине, земле и любой другой рабочей зоне для потенциального загрязнения RAM. Поместите бумажные салфетки в сцинтилляционные флаконы, содержащие сцинтилляционную жидкость.
- Измерьте радиоактивность 14С в сцинтилляционных флаконах со сцинтилляционным счетчиком. Запишите результаты чтения. При необходимости обеззараживайте рабочую среду в соответствии с руководящими принципами радиационной безопасности.
5. Анализ данных
ПРИМЕЧАНИЕ: Предполагая, что каждая подложка полностью окислена для высвобождения CO2, скорость окисления субстрата может быть рассчитана на основе захваченной радиоактивности CO2 .
- Рассчитайте скорость окисления субстрата, используя значения Eq (1) и значения X, Y и Z , приведенные в таблице 1 для различных субстратов.
Скорость окисления субстрата (мкмоль/клетка/ч) =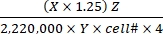 (1)
(1)- Рассчитайте общее количество распадов в минуту (DPM) для каждой реакционной скважины. Для X используйте значение DPM (показания сцинтилляционного счетчика) из 0,4 мл реакционной среды, используемой для улавливанияCO2 , из 0,5 мл общей реакционной среды. Таким образом, суммарный ДПМ из каждой реакционной скважины составляет X × 1,25.
- Разделите общий DPM на коэффициент 2 220 000 для преобразования в μCi.
- Преобразуйте радиоактивность в μCi в число 14С-меченых молекул. Разделите значение μCi на удельную активность (Y) каждого меченого субстрата. Используйте следующие значения Y (таблица 1): 14С-глюкоза: 300 мКи/ммоль; 14 См. С-глютамин: 200 мКи/ммоль; 14 См. С-олеат: 50 мКи/ммоль.
- Рассчитайте общее число окисленных молекул из окисленных 14С-меченых молекул, умножив последние на коэффициент горячего к общему разбавлению (Z). Используйте следующие значения Z (таблица 1): Глюкоза: 4,125; глютамин: 1000; олеат: 12,5.
- Разделите полученный продукт на номер ячейки (cell#) и 4 (для времени реакции 4 ч), чтобы определить скорость окисления субстрата на клетку. Используйте ячейку#, определенную в параллельных скважинах в начале анализа.
Результаты
В этом примере метод улавливания CO2 используется для сравнения окисления субстрата первичными кальвариальными преостеобластами по сравнению с БММ, которые часто используются для дифференцировки остеобластов in vitro или остеокластов, соответственно. После того, как первичные...
Обсуждение
Протокол обеспечивает простой в использовании метод определения скорости окисления основных энергетических субстратов. Это более простая альтернатива другим протоколам, которые используют колбы, содержащие центральный колодец и увенчанные резиновыми пробками 14,15,16.<...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Работа была частично поддержана грантом NIH R01 AR060456 (FL). Мы благодарим доктора Майкла Робинсона и Элизабет Кризман (Детская больница Филадельфии) за их щедрую помощь со сцинтилляционным счетчиком.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm filters | Sigma-Aldrich | SLGVM33RS | Used to filter BSA solution |
| 0.25% Trypsin-EDTA | Gibco | 25200056 | Dissociate cells from cell culture plates |
| 1.5 mL Eppendorf tubes | PR1MA | PR MCT17 RB | Used for reaction incubation |
| 10 cm plates | TPP | 93100 | Used for cell culture |
| 10 mL syringe | BD | 302995 | Used to flush marrow from long bones |
| 10% FBS | Atlanta biologicals | S11550 | For Cell culture medium preparation |
| 14C-Glucose | PerkinElmer | NEC042X050UC | Used to make hot media |
| 14C-glutamine | PerkinElmer | NEC451050UC | Used to make hot media |
| 14C-oleate | PerkinElmer | NEC317050UC | Used to make hot media |
| 23 G needle | BD | 305120 | Used to flush marrow from long bones |
| 24-well plates | TPP | 92024 | Used for cell culture |
| 70 μm cell strainers | MIDSCI | 70CELL | Used to filter supernatant during cavarial digestion |
| Acridine Orange/Propidium Iodide (AO/PI) dye | Nexcelom Biosciences | CS2-0106 | Stains live cells to determine seed density |
| Bovine Serum Ablumin | Proliant Biologicals | 68700 | Used for fatty acid conjugation |
| Cellometer Auto 2000 | Nexcelom Biosciences | Determine the number of viable cells | |
| Centrifuge | Thermo Fisher | Legend Micro 21R | Used to pellet cells |
| Collagenase type II | Worthington | LS004176 | Dissociate cells from tissue |
| Custom MEM alpha | GIBCO | SKU: ME 18459P1 | Used to create custom hot media |
| Dulbecco's Phosphate-Buffered Saline | Gibco | 10010023 | Used to dissolve and dilute reagents, and wash culture dishes |
| Filter Paper | Millipore-Sigma | WHA1001090 | Traps CO2 with sodium hydroxide |
| Glucose | Sigma-Aldrich | g7528 | Used to make custom media |
| HEPES | Gibco | 15630080 | Traps CO2 during cell culture |
| L-carnitine | Sigma-Aldrich | C0283 | Supplemented for fatty acid oxidation |
| L-Glutamine | Sigma-Aldrich | g3126 | Used to make custom media |
| MEM alpha | Thermo | A10490 | Cell culture medium |
| Parafilm | Pecheney Plastic Packaging | PM998 | Used to seal cell culture dishes |
| Penicillin-Streptomycin | Thermo Fisher | 15140122 | Prevents contamination in cell culture |
| Perchloric Acid | Sigma-Aldrich | 244252 | Releases CO2 during metabolic assay |
| Pyruvate | Sigma-Aldrich | p5280 | Used to make custom media |
| Scintillation Counter | Beckman Coulter | LS6500 | Determines radioactivity from the filter paper |
| Scintillation Fluid | MP Biomedicals | 882453 | Absorb the energy emitted by RAMs and re-emit it as flashes of light |
| Scintillation Vial | Fisher Scientific | 03-337-1 | Reaction containers for scintillation fluid |
| Sodium carbonate | Sigma-Aldrich | S5761 | Balance buffer for medium |
| Sodium Hydroxide | Sigma-Aldrich | 58045 | Traps CO2 during metaboilc assay |
| Sodium oleate | SANTA CRUZ | SC-215879 | BSA conjugated fatty acid preparation |
| Vaccum filtration 1000 | TPP | 99950 | Filter cMEMα |
Ссылки
- Hargreaves, M., Spriet, L. L. Skeletal muscle energy metabolism during exercise. Nature Metabolism. 2 (9), 817-828 (2020).
- Jeukendrup, A. E. Regulation of fat metabolism in skeletal muscle. Annals of the New York Academy of Sciences. 967, 217-235 (2002).
- Randle, P. J., Garland, P. B., Hales, C. N., Newsholme, E. A. The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus. Lancet. 1 (7285), 785-789 (1963).
- Randle, P. J., Newsholme, E. A., Garland, P. B. Regulation of glucose uptake by muscle. 8. Effects of fatty acids, ketone bodies and pyruvate, and of alloxan-diabetes and starvation, on the uptake and metabolic fate of glucose in rat heart and diaphragm muscles. Biochemical Journal. 93 (3), 652-665 (1964).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochemical Journal. 186 (3), 701-711 (1980).
- Cha, B. S., et al. Impaired fatty acid metabolism in type 2 diabetic skeletal muscle cells is reversed by PPARgamma agonists. American Journal of Physiology. Endocrinology and Metabolism. 289 (1), 151-159 (2005).
- Lee, W. C., Guntur, A. R., Long, F., Rosen, C. J. Energy metabolism of the osteoblast: implications for osteoporosis. Endocrine Reviews. 38 (3), 255-266 (2017).
- Li, B., et al. Both aerobic glycolysis and mitochondrial respiration are required for osteoclast differentiation. FASEB Journal. 34 (8), 11058-11067 (2020).
- Lee, W. C., Ji, X., Nissim, I., Long, F. Malic enzyme couples mitochondria with aerobic glycolysis in osteoblasts. Cell Reports. 32 (10), 108108 (2020).
- Kim, S. P., et al. Fatty acid oxidation by the osteoblast is required for normal bone acquisition in a sex- and diet-dependent manner. JCI Insight. 2 (16), 92704 (2017).
- Yu, Y., et al. Glutamine metabolism regulates proliferation and lineage allocation in skeletal stem cells. Cell Metabolism. 29 (4), 966-978 (2019).
- Karner, C. M., Esen, E., Okunade, A. L., Patterson, B. W., Long, F. Increased glutamine catabolism mediates bone anabolism in response to WNT signaling. The Journal of Clinical Investigation. 125 (2), 551-562 (2015).
- Takeshita, S., Kaji, K., Kudo, A. Identification and characterization of the new osteoclast progenitor with macrophage phenotypes being able to differentiate into mature osteoclasts. Journal of Bone and Mineral Research. 15 (8), 1477-1488 (2000).
- Itoh, Y., et al. Dichloroacetate effects on glucose and lactate oxidation by neurons and astroglia in vitro and on glucose utilization by brain in vivo. Proceedings of the National Academy of Sciences of the United States of America. 100 (8), 4879-4884 (2003).
- Oba, M., Baldwin, R. L. 4. t. h., Bequette, B. J. Oxidation of glucose, glutamate, and glutamine by isolated ovine enterocytes in vitro is decreased by the presence of other metabolic fuels. Journal of Animal Science. 82 (2), 479-486 (2004).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Huynh, F. K., Green, M. F., Koves, T. R., Hirschey, M. D. Measurement of fatty acid oxidation rates in animal tissues and cell lines. Methods in Enzymology. 542, 391-405 (2014).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
- Abdelmagid, S. A., et al. Comprehensive profiling of plasma fatty acid concentrations in young healthy Canadian adults. PLoS One. 10 (2), 0116195 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены