Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Enerji Substrat Oksidasyonunun In Vitro 14CO2 Trapping ile Değerlendirilmesi
Bu Makalede
Özet
Bu protokol, in vitro 14CO2 üretimini izleyerek substrat oksidasyonunu incelemek için kullanımı kolay bir yöntemi açıklar.
Özet
Mitokondri, enerji homeostazını korumak için adenozin trifosfat (ATP) üreten trikarboksilik asit (TCA) döngüsü ve elektron taşıma zinciri (ETC) için makinelere ev sahipliği yapar. Glikoz, yağ asitleri ve amino asitler, çoğu somatik hücrede mitokondriyal solunumu besleyen başlıca enerji substratlarıdır. Kanıtlar, farklı hücre tiplerinin belirli substratlar için farklı bir tercihe sahip olabileceğini göstermektedir. Bununla birlikte, iskeletteki çeşitli hücreler tarafından substrat kullanımı ayrıntılı olarak çalışılmamıştır. Ayrıca, hücresel metabolizma fizyolojik ve patofizyolojik değişikliklere uyum sağladığından, iskelet hücrelerinde substrat bağımlılığının doğrudan değerlendirilmesi, kemik hastalıklarının patogenezi hakkında önemli bilgiler sağlayabilir.
Aşağıdaki protokol, oksidatif fosforilasyonu takiben substrat moleküllerinden karbondioksit salınımı prensibine dayanmaktadır. Radyoaktif olarak etiketlenmiş karbon atomları (14C) içeren substratları kullanarak, yöntem hücre kültüründeki substrat oksidasyon oranı için hassas ve kullanımı kolay bir test sağlar. Primer kalvarial preosteoblastlara karşı kemik iliği kaynaklı makrofajlar (BMM'ler) ile yapılan bir vaka çalışması, iki hücre tipi arasındaki ana substratların farklı kullanımlarını göstermektedir.
Giriş
Ökaryotlardaki oksidatif fosforilasyon (OXPHOS), oksijen tüketimi yoluyla ATP şeklinde kimyasal enerjiyi serbest bırakmak için besinlerin mitokondri içinde parçalandığı işlemdir. Trikarboksilik asit (TCA) döngüsü yoluyla mitokondri içindeki çeşitli substratların katabolizması doğrudan az sayıda ATP molekülü üretir, ancak elektron taşıyıcıları nikotinamid adenin dinükleotid (NAD +) ve flavin adenin dinükleotidin (FAD +) indirgenmesi yoluyla enerji depolar. İndirgenmiş taşıyıcılar daha sonra membran boyunca bir proton konsantrasyon gradyanı oluşturmak için mitokondrinin iç zarında bulunan ETC tarafından oksitlenir. Protonlar sonunda ATP üretmek için gradyanlarını ATP sentaz yoluyla mitokondriyal matrise geri akarlar. OXPHOS, enerji substratlarından ATP üretiminin en verimli aracıdır ve genellikle aerobik ortamlarda tercih edilir. Önceden, aerobik glikolizin - oksijen mevcutken glikozdan laktat üretimi - patofizyolojik olduğu, genellikle kanser hücrelerinin bir işareti olduğu düşünülüyordu. Giderek daha fazla, bazı normal hücre tiplerinin henüz tam olarak deşifre edilmemiş nedenlerden dolayı aerobik glikoliz kullandığı keşfedilmektedir.
Metabolik esneklik, hücrelerin veya organizmaların değişen enerji taleplerine ve mevcut yakıt kaynaklarına uyum sağlama kapasitesidir. Örneğin, iskelet kasının enerjik talebi esas olarak sabit durumda OXPHOS tarafından karşılanır, ancak yüksek yoğunluklu egzersiz sırasında anaerobik glikoliz1. Egzersiz süresi arttıkça, glikoz ve yağ asidi oksidasyonu genel enerji üretimine daha fazla katkıda bulunur2. Bununla birlikte, substrat kullanımı sadece kullanılabilirliğe bağlı değildir, çünkü substratlar oksidasyon sırasında antagonistik olarak rekabet eder. En önemlisi, yağ asidi oksidasyonunun, Randle etkisi3 olarak bilinen bir fenomende iskelet kası tarafından glikoz kullanımını inhibe ettiği gösterilmiştir. Karşılıklı bir etki sonraki çalışmalarla gösterilmiştir 4,5. Ek olarak, birçok hastalık substrat tercihindeki bir değişiklik ve hücrelerde metabolik esnekliğin gelişmesi ile ilişkilidir. Örneğin, tip II diyabetik hastaların iskelet kasında yağ asidi oksidasyonu normal kontrol deneklerine kıyasla azalır6. Hastalık ortamlarındaki metabolik değişiklikler patogeneze katkıda bulunabileceği için yoğun bir araştırma konusudur.
İskelet hücre tiplerinde enerji metabolizması nispeten az çalışılmakla birlikte son yıllarda dikkat çekmektedir7. Önceki çalışmalar, aerobik glikolizin kalvarial osteoblastlarda baskın enerji yolu olduğunu, TCA döngüsü boyunca glikoz oksidasyonunun osteoklast oluşumunda rol oynadığını göstermiştir 8,9. Diğerleri, osteoblastlar için bir enerji kaynağı olarak yağ asitleri için kanıt sağlamıştır10. Glutamin katabolizmasının da osteoblast farklılaşmasını progenitörlerden11,12 desteklediği gösterilmiştir. Bununla birlikte, çeşitli iskelet hücresi tipleri tarafından substrat kullanımının kapsamlı bir şekilde anlaşılması hala eksiktir. Ek olarak, hücre farklılaşması sırasında veya patolojik sinyallere yanıt olarak hücresel metabolizmadaki değişikliklerin yakıt substrat kullanımını değiştirmesi beklenir. Aşağıda açıklanan, in vitro substrat oksidasyonunu test etmek için kullanımı kolay bir protokoldür.
Protokol
Radyoaktif malzemelerin (RAM) kullanımı, her kurumda belirlenmiş bir güvenlik komitesi tarafından önceden onay alınmasını gerektirir. Bu protokolde kullanılan RAM'ler, Pennsylvania Üniversitesi'ndeki Çevre Sağlığı ve Radyasyon Güvenliği (EHRS) tarafından onaylanmıştır. Hayvanların kullanımı, ev kurumundaki Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından önceden onay alınmasını gerektirir. Aşağıdaki çalışma IACUC tarafından Philadelphia Çocuk Hastanesi'nde onaylanmıştır.
1. 14C etiketli substrat için stok çözeltilerinin hazırlanması
- 11 g BSA ve 33,1 mL Dulbecco'nun fosfat tamponlu salinini (DPBS) karıştırarak ve BSA tamamen çözünene kadar oda sıcaklığında ~3 saat hafifçe çalkalayarak 4 mM sığır serum albümini (BSA) stok çözeltisi yapın. BSA stok solüsyonunu kullanmadan önce 70 °C'lik bir su banyosunda ısıtın.
- Şişede 50 μCi 14C-oleat (etanol içinde 50 μCi/μmol) hava ile kurutun, kapak 8 saat kapalıyken belirlenmiş bir RAM çalışma davlumbazında. 312.5 μLH2O ve daha sonra 3.5 mg (11.5 μmol) sodyum oleat ekleyin. İyice karıştırın.
- Elde edilen çözeltiyi bir su banyosunda 70 ° C'ye ısıtın. 10 mM sıcak oleat stok çözeltisi elde etmek için önceden ısıtılmış BSA stok çözeltisinin 0,9375 mL'sini ekleyin (14 C-oleatın etiketsiz oleata 1:11,5oranını içerir). Stok çözeltisini serbest bırakın ve uzun süreli kullanım için -20 ° C'de saklayın.
- Çözüldükten hemen sonra 14C-glikoz ve 14C-glutamin kullanın.
2. 14C etiketli substrat içeren ortamın hazırlanması
NOT: Ortamdaki enerji substratlarının güvenilir konsantrasyonlarını sağlamak için, kullanımdan kısa bir süre önce eklenen taze substratlarla birlikte ısmarlama ortam kullanılmalıdır. Burada, glikoz, piruvat, glutamin, fenol kırmızısı veya sodyum bikarbonat içermeyen özel yapım bir Minimum Esansiyel Ortam (MEMa) kullanılır. Bununla birlikte, her hücre tipi için en uygun ortam belirlenmelidir.
- 1 L arıtılmış suda 8.67 g orta tozu yeniden oluşturun. 7.4 pH elde etmek için 2.2 g sodyum bikarbonat ekleyin ve 0.22 μm vakum filtrasyonu kullanarak çözeltiyi filtreleyin.
- Son konsantrasyonlarda 5.5 mM glikoz, 2 mM glutamin, 1 mM piruvat ve% 10 fetal sığır serumu (FBS) ile tam ortamı (cMEMa) elde etmek için taze bileşenler ekleyin. Ayrıca yağ asidi oksidasyonunu kolaylaştırmak için cMEMα'yı 100 mM L-karnitin ve 10 μM HEPES ile destekleyin.
- Kullanmadan hemen önce, sıcak ortam yapmak için taze hazırlanmış cMEMα'ya 14C etiketli substrat ekleyin. Oleat sıcak ortamını yapmak için, 100 μM oleatın son konsantrasyonu (1:100 seyreltme, son radyoaktivite 0,4 μCi / mL) için cMEMa'ya 10 mM sıcak oleat stok çözeltisini ekleyin.
NOT: 1:11.5 oranında sıcak:soğuk oleat içeren 10 mM sıcak oleat stoğu (bkz. adım 1.3), radyoaktif madde miktarını en aza indirirken ortamda toplam 100 μM fizyolojik oleat seviyesine ulaşmak için kullanılır. - 70 ° C'de bir su banyosunda 2 mL H2 O'ya 24.36 mg sodyum oleat ekleyerek ~20dakika boyunca tamamen çözünene kadar 10 mM etiketsiz oleat stoğu yapın, 70 ° C'ye önceden ısıtılmış 4 mM BSA stok çözeltisinin 6 mL'si ile hızlı bir şekilde karıştırmadan önce. 37 °C'lik bir su banyosuna 1 saat boyunca aktarın ve 0,22 μm filtreden süzün. Aliquot ve uzun süreli kullanım için -20 ° C'de saklayın.
- Glikozu sıcak ortam yapmak için, 1.333 μM'lik bir son konsantrasyona 14C-glikoz ekleyin (1: 4.125 seyreltme, son radyoaktivite 0.4 μCi / mL). Glutamin sıcak ortam yapmak için, 2 μM'lik son konsantrasyona 14C-glutamin ekleyin (1: 1.000 seyreltme, son radyoaktivite 0.4 μCi / mL).
- Glikoz ve glutamin sıcak ortamını, oleat sıcak ortamındakiyle aynı olan 100 μM oleatın nihai konsantrasyonunu elde etmek için adım 2.4'ten itibaren 10 mM'lik etiketsiz oleat stok çözeltisi ile destekleyin.
3. Hücrelerin hazırlanması
NOT: Kalvarial preosteoblastlar ve kemik iliği makrofajları burada örnek olarak kullanılmıştır. Kullanıcılar seçtikleri hücre tipini uygun protokollere göre hazırlamalıdır. Enzimatik aktivite farklı partiler arasında değişebileceğinden, pilot deneylerde sindirim için kullanılacak kollajenaz II konsantrasyonunu optimize edin.
- Kalvarial preosteoblastların izolasyonu ve kültürü
- Doğum sonrası gün 3-5 (P3-5) yavrularını kafalarını keserek kurban edin ve onları Penisilin-Streptomisin (P / S) içeren buz gibi soğuk DPB'lere aktarın.
- Cildi ve yumuşak dokuyu çıkararak kalvariyi açığa çıkarın. DPBS'de çevredeki dokuları arkadan öne doğru keserek orta bölgeyi toplayın (Şekil 1A). Kalvarinin iç ve dış yüzeylerini, sonraki sindirimde hücrelerin serbest bırakılmasına yardımcı olmak için cımbız kullanarak hafifçe çizin.
- DPBS'de 2 mg / mL ve 4 mg / mL'lik bir Kollajenaz tip II çözeltisi hazırlayın ve her bir çözeltiyi taze bir 0.22 μm filtre ile filtreleyin. Temizlenmiş kalvariyi önce 2 mg / mL kollajenaz çözeltisi ile 15 dakika boyunca sindirin ve sindirim çözeltisini atın. Temizlenen numuneleri her seferinde 15 dakika boyunca 3 kez 4 mg / mL kollajenaz çözeltisinde sindirin, sindirim çözeltisini bir araya getirin ve saklayın.
- Çürütme çözeltisini 70 μm hücre süzgeçlerinden süzün ve filtrazı 5 dakika boyunca 300 × g'da santrifüj edin. Hücre peletini cMEMα'da (bkz. adım 2.2) %10 FBS ve P/S içeren yeniden askıya alın.
- Hücreleri 10 cm'lik plakalarda 4 × 104 hücre/cm2'de sayın ve tohumlayın. Hücreleri 3 gün boyunca% 5 CO2 ile 37 ° C'lik bir inkübatörde kültürleyin.
- Hücreleri 37 ° C'de% 0.25 tripsin-EDTA ile ayırın. 7.5 × 105 / cm2'de% 10 FBS ve P / S içeren cMEMα ile24 kuyucuklu hücre kültürü plakalarındaki hücreleri sayın ve tohumlayın. Substrat başına hücre tipi başına en az 4 kuyucuk ve tahlilden önce hücre sayımı için her hücre tipi için en az üç ekstra kuyucuk tohumlayın.
- Substrat oksidasyon testlerinden önce hücreleri gece boyunca 37 ° C'de kültürleyin.
- BMM'lerin izolasyonu ve kültürü
NOT: BMM'lerin kültürü, rekombinant protein olarak ticari olarak satın alınabilen makrofaj koloni uyarıcı faktör (M-CSF) gerektirir. M-CSF'yi eksprese etmek için tasarlanmış CMG14-12 hücre hattından şartlandırılmış ortam, burada kullanılan ekonomik bir alternatiftir13.- Kas ve bağ dokularını çıkardıktan sonra 8 haftalık farelerden femurları ve tibiasları toplayın. Kemiklerin her iki ucunu keskin makasla kesin ve atın.
- Kemik iliğini bir femur ve bir tibia'dan% 10 FBS, P / S ve% 10 CMG14-12 şartlandırılmış ortam (BMM ortamı) ile 15 mL cMEMa içeren 23 G'lik bir iğne ile donatılmış bir şırınga ile 10 cm'lik bir Petri kabına yıkayın. Petri kabındaki hücreleri% 5 CO 2 ile 37 ° C'lik bir inkübatördekültürleyin.
- 3 gün sonra, kültür ortamını atın ve DPBS ile durulayın. Bağlı hücreleri 37 ° C'de% 0.25 tripsin-EDTA ile 5 dakika boyunca ayırın. BMM ortamında hücre peletini santrifüj yapın ve yeniden askıya alın.
- 24 kuyucuklu hücre kültürü plakalarındaki hücreleri 7.5 × 105 /cm2'de 3.1.6'da tarif edildiği gibi sayın ve tohumlayın. Tahlillere başlamadan önce BMM ortamında gece boyunca 37 ° C'de kültür.
4. CO2 tuzaklı substrat oksidasyon testi
NOT: Tahlil başlamadan önce %80-90 birleşme elde etmek için her hücre tipi için uygun bir tohumlama yoğunluğu belirlenmelidir. Hücre yoğunluğunun hücrelerin metabolik durumunu etkileyebileceğini unutmayın.
- Ekstra kuyucuklardaki hücreleri DPBS ile iki kez yıkayın. Hücreleri% 0.25 tripsin-EDTA ile ayırın ve DPBS'de yeniden askıya alınan karışık 20 μL hücreleri, 20 μL akridin turuncu / propidium iyodür (AO / PI) kullanıma hazır ticari boya çözeltisi ile ayırın. Otomatik bir hücre sayacı ile canlı hücre sayısını belirleyin ve son hesaplamalar için sayıyı kaydedin.
- Tahlil kuyucuklarındaki hücreleri DPBS ile iki kez yıkayın. RAM tarafından belirlenen doku kültürü başlığındaki her tahlil kuyusuna 500 μL sıcak ortam ekleyin. Plakaları parafilm ile kapatın ve hücreleri 4 saat boyunca 37 ° C'de RAM tarafından belirlenmiş bir inkübatörde inkübe edin.
- Kuluçka sırasında, filtre kağıdını 1,5 ml'lik mikrosantrifüj tüplerinin kapağının içindeki alandan biraz daha büyük dairesel parçalar halinde kesin ve kağıdı kapağa sıkıca yerleştirin (Şekil 1B). Her tüpe 200 μL 1 M perklorik asit ve kapağın içine takılı filtre kağıdına 20 μL sodyum hidroksit ekleyin.
- Hücrelerin inkübasyonundan sonra, her bir kuyucuktan hazırlanan tüplere 400 μL kültür ortamı aktarın ve kapakları hemen kapatın. Tüpleri oda sıcaklığında 1 saat boyunca bir tüp rafında bırakın.
- Kuluçka sırasında, her tüp için bir parıltı şişesi ayarlayın ve 4 mL sintilasyon sıvısı ile doldurun. Her bir filtre kağıdı parçasını bir parıltı şişesine aktarın ve 30 dakika boyunca oda sıcaklığında inkübe edin.
- Doku kültürü davlumbazında, su banyosunda ( 14C-oleat hazırlama için kullanılır), buzdolabında, inkübatörde, lavaboda, zeminde ve potansiyel RAM kontaminasyonu için diğer çalışma alanlarında silme testleri yapın. Kağıt mendilleri parıltı sıvısı içeren parıltı şişelerine koyun.
- Bir parıltı sayacı ile parıltı şişelerinde 14C radyoaktivite ölçün. Okuma sonuçlarını kaydedin. Gerekirse çalışma ortamını radyasyon güvenliği kurallarına göre dekontamine edin.
5. Veri analizi
NOT: Her bir substratınCO2'yi serbest bırakmak için tamamen oksitlendiği varsayılırsa, substrat oksidasyon hızı sıkışmış CO2 radyoaktivitesinden hesaplanabilir.
- Farklı substratlar için Eq (1) ve Tablo 1'de verilen X, Y ve Z değerlerini kullanarak substrat oksidasyon hızını hesaplayın.
Substrat oksidasyon hızı (μmol/hücre/h) =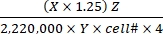 (1)
(1)- Her reaksiyon için dakika başına toplam parçalanma miktarını (DPM) iyi hesaplayın. X için, toplam reaksiyon ortamının 0,5 mL'sinden CO2 yakalama için kullanılan reaksiyon ortamının 0,4 mL'sinden DPM değerini (parıltı sayacı okuma) kullanın. Bu nedenle, her reaksiyon kuyucuğundan toplam DPM, X × 1,25'tir.
- μCi'ye dönüştürmek için toplam DPM'yi 2.220.000 faktörüne bölün.
- μCi'deki radyoaktiviteyi 14C etiketli molekül sayısına dönüştürün. μCi değerini, etiketlenmiş her bir substratın spesifik aktivitesine (Y) bölün. Aşağıdaki Y değerlerini kullanın (Tablo 1): 14C-glukoz: 300 mCi/mmol; 14 adet C-glutamin: 200 mCi/mmol; 14 adet C-oleat: 50 mCi/mmol.
- Oksitlenmiş 14C etiketli molekülden oksitlenmiş moleküllerin toplam sayısını, ikincisini sıcak-toplam seyreltme faktörü (Z) ile çarparak hesaplayın. Aşağıdaki Z değerlerini kullanın (Tablo 1): Glikoz: 4,125; glutamin: 1.000; oleat: 12.5.
- Hücre başına substrat oksidasyon hızını belirlemek için elde edilen ürünü hücre numarasına (hücre #) ve 4'e (4 saatlik reaksiyon süresi için) bölün. Tahlilin başlangıcındaki paralel kuyucuklarda belirlenen cell# değerini kullanın.
Sonuçlar
Bu örnekte, CO2 yakalama yöntemi, sırasıyla in vitro osteoblast veya osteoklast farklılaşması için sıklıkla kullanılan primer kalvarial preosteoblastlar ile BMM'ler arasındaki substrat oksidasyonunu karşılaştırmak için kullanılmıştır. Birincil hücreler bir gecede cMEMa'da paslanıp kültürlendikten sonra, tipik olarak birleşmenin% 80-90'ına ulaşırlar ve karakteristik morfolojilerini sergilerler. Kalvarial preosteoblastlar BMM'lerden önemli ölçüde daha büyüktür (
Tartışmalar
Protokol, ana enerji substratlarının oksidasyon oranını belirlemek için kullanımı kolay bir yöntem sağlar. Merkezi bir kuyu içeren ve14,15,16 kauçuk tıpalarla kaplı şişeler kullanan diğer protokollere daha basit bir alternatiftir. Buradaki örnek çalışma hücre kültürü ile yapılmasına rağmen, yöntem daha önce tarif edildiği gibi doku eksplantları veya bozulmamış mitokondri içeren doku homojenatlar...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Çalışma kısmen NIH hibe R01 AR060456 (FL) tarafından desteklenmiştir. Dr. Michael Robinson ve Elizabeth Krizman'a (Philadelphia Çocuk Hastanesi) parıltı sayacı konusundaki cömert yardımları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm filters | Sigma-Aldrich | SLGVM33RS | Used to filter BSA solution |
| 0.25% Trypsin-EDTA | Gibco | 25200056 | Dissociate cells from cell culture plates |
| 1.5 mL Eppendorf tubes | PR1MA | PR MCT17 RB | Used for reaction incubation |
| 10 cm plates | TPP | 93100 | Used for cell culture |
| 10 mL syringe | BD | 302995 | Used to flush marrow from long bones |
| 10% FBS | Atlanta biologicals | S11550 | For Cell culture medium preparation |
| 14C-Glucose | PerkinElmer | NEC042X050UC | Used to make hot media |
| 14C-glutamine | PerkinElmer | NEC451050UC | Used to make hot media |
| 14C-oleate | PerkinElmer | NEC317050UC | Used to make hot media |
| 23 G needle | BD | 305120 | Used to flush marrow from long bones |
| 24-well plates | TPP | 92024 | Used for cell culture |
| 70 μm cell strainers | MIDSCI | 70CELL | Used to filter supernatant during cavarial digestion |
| Acridine Orange/Propidium Iodide (AO/PI) dye | Nexcelom Biosciences | CS2-0106 | Stains live cells to determine seed density |
| Bovine Serum Ablumin | Proliant Biologicals | 68700 | Used for fatty acid conjugation |
| Cellometer Auto 2000 | Nexcelom Biosciences | Determine the number of viable cells | |
| Centrifuge | Thermo Fisher | Legend Micro 21R | Used to pellet cells |
| Collagenase type II | Worthington | LS004176 | Dissociate cells from tissue |
| Custom MEM alpha | GIBCO | SKU: ME 18459P1 | Used to create custom hot media |
| Dulbecco's Phosphate-Buffered Saline | Gibco | 10010023 | Used to dissolve and dilute reagents, and wash culture dishes |
| Filter Paper | Millipore-Sigma | WHA1001090 | Traps CO2 with sodium hydroxide |
| Glucose | Sigma-Aldrich | g7528 | Used to make custom media |
| HEPES | Gibco | 15630080 | Traps CO2 during cell culture |
| L-carnitine | Sigma-Aldrich | C0283 | Supplemented for fatty acid oxidation |
| L-Glutamine | Sigma-Aldrich | g3126 | Used to make custom media |
| MEM alpha | Thermo | A10490 | Cell culture medium |
| Parafilm | Pecheney Plastic Packaging | PM998 | Used to seal cell culture dishes |
| Penicillin-Streptomycin | Thermo Fisher | 15140122 | Prevents contamination in cell culture |
| Perchloric Acid | Sigma-Aldrich | 244252 | Releases CO2 during metabolic assay |
| Pyruvate | Sigma-Aldrich | p5280 | Used to make custom media |
| Scintillation Counter | Beckman Coulter | LS6500 | Determines radioactivity from the filter paper |
| Scintillation Fluid | MP Biomedicals | 882453 | Absorb the energy emitted by RAMs and re-emit it as flashes of light |
| Scintillation Vial | Fisher Scientific | 03-337-1 | Reaction containers for scintillation fluid |
| Sodium carbonate | Sigma-Aldrich | S5761 | Balance buffer for medium |
| Sodium Hydroxide | Sigma-Aldrich | 58045 | Traps CO2 during metaboilc assay |
| Sodium oleate | SANTA CRUZ | SC-215879 | BSA conjugated fatty acid preparation |
| Vaccum filtration 1000 | TPP | 99950 | Filter cMEMα |
Referanslar
- Hargreaves, M., Spriet, L. L. Skeletal muscle energy metabolism during exercise. Nature Metabolism. 2 (9), 817-828 (2020).
- Jeukendrup, A. E. Regulation of fat metabolism in skeletal muscle. Annals of the New York Academy of Sciences. 967, 217-235 (2002).
- Randle, P. J., Garland, P. B., Hales, C. N., Newsholme, E. A. The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus. Lancet. 1 (7285), 785-789 (1963).
- Randle, P. J., Newsholme, E. A., Garland, P. B. Regulation of glucose uptake by muscle. 8. Effects of fatty acids, ketone bodies and pyruvate, and of alloxan-diabetes and starvation, on the uptake and metabolic fate of glucose in rat heart and diaphragm muscles. Biochemical Journal. 93 (3), 652-665 (1964).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochemical Journal. 186 (3), 701-711 (1980).
- Cha, B. S., et al. Impaired fatty acid metabolism in type 2 diabetic skeletal muscle cells is reversed by PPARgamma agonists. American Journal of Physiology. Endocrinology and Metabolism. 289 (1), 151-159 (2005).
- Lee, W. C., Guntur, A. R., Long, F., Rosen, C. J. Energy metabolism of the osteoblast: implications for osteoporosis. Endocrine Reviews. 38 (3), 255-266 (2017).
- Li, B., et al. Both aerobic glycolysis and mitochondrial respiration are required for osteoclast differentiation. FASEB Journal. 34 (8), 11058-11067 (2020).
- Lee, W. C., Ji, X., Nissim, I., Long, F. Malic enzyme couples mitochondria with aerobic glycolysis in osteoblasts. Cell Reports. 32 (10), 108108 (2020).
- Kim, S. P., et al. Fatty acid oxidation by the osteoblast is required for normal bone acquisition in a sex- and diet-dependent manner. JCI Insight. 2 (16), 92704 (2017).
- Yu, Y., et al. Glutamine metabolism regulates proliferation and lineage allocation in skeletal stem cells. Cell Metabolism. 29 (4), 966-978 (2019).
- Karner, C. M., Esen, E., Okunade, A. L., Patterson, B. W., Long, F. Increased glutamine catabolism mediates bone anabolism in response to WNT signaling. The Journal of Clinical Investigation. 125 (2), 551-562 (2015).
- Takeshita, S., Kaji, K., Kudo, A. Identification and characterization of the new osteoclast progenitor with macrophage phenotypes being able to differentiate into mature osteoclasts. Journal of Bone and Mineral Research. 15 (8), 1477-1488 (2000).
- Itoh, Y., et al. Dichloroacetate effects on glucose and lactate oxidation by neurons and astroglia in vitro and on glucose utilization by brain in vivo. Proceedings of the National Academy of Sciences of the United States of America. 100 (8), 4879-4884 (2003).
- Oba, M., Baldwin, R. L. 4. t. h., Bequette, B. J. Oxidation of glucose, glutamate, and glutamine by isolated ovine enterocytes in vitro is decreased by the presence of other metabolic fuels. Journal of Animal Science. 82 (2), 479-486 (2004).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Huynh, F. K., Green, M. F., Koves, T. R., Hirschey, M. D. Measurement of fatty acid oxidation rates in animal tissues and cell lines. Methods in Enzymology. 542, 391-405 (2014).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
- Abdelmagid, S. A., et al. Comprehensive profiling of plasma fatty acid concentrations in young healthy Canadian adults. PLoS One. 10 (2), 0116195 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır