É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação da oxidação do substrato de energia in vitro com 14armadilhas de CO2
Neste Artigo
Resumo
Este protocolo descreve um método fácil de usar para examinar a oxidação do substrato rastreando a produção de 14CO2 in vitro.
Resumo
Mitocôndrias hospedam o maquinário para o ciclo de ácido tricarboxílico (TCA) e cadeia de transporte de elétrons (ETC), que geram triptosfato de adenosina (ATP) para manter a homeostase energética. Glicose, ácidos graxos e aminoácidos são os principais substratos de energia que alimentam a respiração mitocondrial na maioria das células somáticas. Evidências mostram que diferentes tipos de células podem ter uma preferência distinta por certos substratos. No entanto, a utilização do substrato por várias células no esqueleto não foi estudada em detalhes. Além disso, como o metabolismo celular está sintonizado com alterações fisiológicas e fisiodicos, avaliações diretas da dependência de substratos em células esqueléticas podem fornecer insights importantes sobre a patogênese das doenças ósseas.
O protocolo a seguir baseia-se no princípio da liberação de dióxido de carbono de moléculas de substrato após a fosforilação oxidativa. Ao usar substratos contendo átomos de carbono radioativos rotulados (14C), o método fornece um ensaio sensível e fácil de usar para a taxa de oxidação de substrato na cultura celular. Um estudo de caso com preosteoblasts primários do calvário versus macrófagos derivados da medula óssea (MMC) demonstra diferente utilização dos principais substratos entre os dois tipos de células.
Introdução
A fosforilação oxidativa (OXPHOS) em eucariotes é o processo pelo qual os nutrientes são divididos dentro das mitocôndrias para liberar energia química na forma de ATP através do consumo de oxigênio. O catabolismo de vários substratos dentro das mitocôndrias através do ciclo do ácido tricarboxílico (TCA) gera poucas moléculas de ATP diretamente, mas armazena energia através da redução dos portadores de nicotinamida adenina dinucleotídeo (NAD+) e dinucleotídeo de adenina flavin (FAD+). Os portadores reduzidos são então oxidados por ETC localizados na membrana interna das mitocôndrias para gerar um gradiente de concentração de prótons através da membrana. Os prótons eventualmente fluem de volta para a matriz mitocondrial através da synthase ATP para produzir ATP. Oxphos é o meio mais eficiente de produção de ATP a partir de substratos de energia e geralmente preferido em ambientes aeróbicos. Anteriormente, a produção de glicólise aeróbica de lactato a partir da glicose, enquanto o oxigênio está presente- pensava-se ser fiofosiológica, muitas vezes uma marca registrada das células cancerosas. Cada vez mais, está sendo descoberto que alguns tipos normais de células usam glicolise aeróbica por razões que ainda não foram totalmente decifradas.
Flexibilidade metabólica é a capacidade de células ou organismos se adaptarem às mudanças nas demandas energéticas e às fontes de combustível disponíveis. Por exemplo, a demanda energética do músculo esquelético é atendida principalmente pelo OXPHOS em estado estável, mas por glicólise anaeróbica durante o exercício de alta intensidade1. À medida que a duração do exercício aumenta, a oxidação da glicose e do ácido graxo contribuem mais para a produção global de energia2. No entanto, o uso de substrato não depende apenas da disponibilidade, pois substratos competem antagonistamente durante a oxidação. Mais notavelmente, a oxidação por ácidos graxos tem sido demonstrada para inibir a utilização da glicose pelo músculo esquelético em um fenômeno conhecido como efeito Randle3. Um efeito recíproco foi demonstrado pelos estudos subsequentes 4,5. Além disso, muitas doenças estão associadas à mudança na preferência por substrato e ao desenvolvimento da inflexibilidade metabólica nas células. Por exemplo, a oxidação por ácidos graxos é reduzida no músculo esquelético dos pacientes diabéticos tipo II em comparação com os sujeitos de controle normal6. As alterações metabólicas nos cenários da doença são objeto de intensa investigação, pois podem contribuir para a patogênese.
O metabolismo energético nos tipos de células esqueléticas é relativamente pouco estudado, mas ganhou atenção nos últimos anos7. Trabalhos anteriores mostraram que a glicólise aeróbica é a via de energia dominante nos osteoblastos calvariais, enquanto a oxidação da glicose através do ciclo TCA desempenha um papel na formação osteoclasta 8,9. Outros forneceram evidências de ácidos graxos como fonte de energia para os osteoblastos10. O catabolismo da glutamina também tem sido demonstrado para apoiar a diferenciação do osteoblasto dos progenitores11,12. No entanto, ainda falta uma compreensão abrangente da utilização de substratos por vários tipos de células esqueléticas. Além disso, espera-se que mudanças no metabolismo celular durante a diferenciação celular ou em resposta a sinais patológicos alterem a utilização do substrato de combustível. Descrito abaixo é um protocolo fácil de usar para avaliar a oxidação de substrato in vitro.
Protocolo
O uso de materiais radioativos (RAM) requer aprovação prévia por um comitê de segurança designado em cada instituição. Os RAMs usados neste protocolo foram aprovados pela Environmental Health & Radiation Safety (EHRS) na Universidade da Pensilvânia. O uso de animais requer aprovação prévia do Comitê Institucional de Atenção e Uso de Animais (IACUC) na instituição de origem. O estudo seguinte foi aprovado pela IACUC no Hospital Infantil da Filadélfia.
1. Preparação de soluções de estoque para substratos rotulados em C
- Faça 4 mM de solução de estoque de soro bovino (BSA) misturando 11 g de BSA e 33,1 mL de soro tamponado de Dulbecco (DPBS) e sacudindo-o suavemente à temperatura ambiente por ~3 h até que a BSA esteja totalmente dissolvida. Aqueça a solução de estoque BSA em um banho de água de 70 °C antes de usar.
- Ar seco 50 μCi 14C-oleate (50 μCi/μmol no etanol) no frasco com a tampa desligada por 8h em uma capa de trabalho RAM designada. Adicione 312,5 μL de H2O e depois 3,5 mgs (11,5 μmol) de oleato de sódio. Homogeneizar.
- Aqueça a solução resultante a 70 °C em banho-maria. Adicione 0,9375 mL da solução de estoque BSA pré-armada para produzir uma solução de estoque de oleato quente de 10 mM (contendo uma razão de 1:11,5 de 14C-oleate a oleato não rotulado). Aliquot a solução de estoque e armazene-a a -20 °C para uso a longo prazo.
- Use 14C-glicose e 14C-glutamina diretamente após o descongelamento.
2. Preparação de meio contendo substratos rotulados em C
NOTA: Para garantir concentrações confiáveis de substratos de energia na mídia, as mídias personalizadas devem ser usadas com substratos frescos adicionados pouco antes do uso. Aqui, é utilizado um meio essencial mínimo personalizado (MEMα) sem glicose, piruvato, glutamina, vermelho fenol ou bicarbonato de sódio. No entanto, um meio ideal deve ser determinado para cada tipo de célula.
- Reconstituir 8,67 g do pó médio em 1 L de água purificada. Adicione 2,2 g de bicarbonato de sódio para obter um pH de 7,4 e filtrar a solução usando filtragem de vácuo de 0,22 μm.
- Adicione ingredientes frescos para obter o meio completo (cMEMα) com concentrações finais de glicose de 5,5 mM, glutamina de 2 mM, piruvato de 1 mM e 10% de soro bovino fetal (FBS). Suplementar cMEMα com L-carnitina de 100 mM e HEPES de 10 μM para facilitar a oxidação de ácidos graxos.
- Imediatamente antes do uso, adicione substratos com 14C rotulados ao cMEMα recém-preparado para fazer mídia quente. Para fazer o meio quente oleato, adicione a solução de estoque de oleato quente de 10 mM ao cMEMα para uma concentração final de 100 μM oleate (diluição de 1:100, radioatividade final 0,4 μCi/mL).
NOTA: O estoque de oleato quente de 10 mM contendo uma proporção de 1:11,5 de oleato quente:frio (ver passo 1.3) é usado para atingir um nível fisiológico de 100 μM total oleato na mídia, minimizando a quantidade de material radioativo. - Faça 10 mM de estoque de oleato sem rótulo adicionando 24,36 mg de oleato de sódio a 2 mL de H2O em um banho de água a 70 °C por ~20 min até dissolver completamente antes de misturar rapidamente com 6 mL da solução de estoque BSA de 4 mM pré-rebocada a 70 °C. Transfira para um banho de água de 37 °C por 1h e filtre através de um filtro de 0,22 μm. Alíquota e armazenamento a -20 °C para uso a longo prazo.
- Para tornar a glicose média quente, adicione 14C-glicose a uma concentração final de 1,333 μM (diluição de 1:4.125, radioatividade final 0,4 μCi/mL). Para fazer glutamina meio quente, adicione 14C-glutamina à concentração final de 2 μM (diluição de 1:1.000, radioatividade final 0,4 μCi/mL).
- Suplemente o meio quente de glicose e glutamina com uma solução de estoque de 10 mM de oleato não rotulado a partir da etapa 2.4 para alcançar a concentração final de 100 μM oleato, o mesmo que no meio quente oleato.
3. Preparação de células
NOTA: Preosteoblasts calvariais e macrófagos de medula óssea são usados como exemplos aqui. Os usuários devem preparar seu tipo de escolha celular de acordo com os protocolos apropriados. Otimize a concentração de colagenase II para ser usada para digestão em experimentos piloto, pois a atividade enzimática pode variar entre diferentes lotes.
- Isolamento e cultura de preosteoblasts calvariais
- Sacrifique filhotes pós-natal 3-5 (P3-5) por decapitação e transfira-os para DPBS gelado contendo Penicilina-Streptomycin (P/S).
- Exponha a calvária removendo a pele e o tecido mole. Recolher a região média cortando os tecidos circundantes de trás para frente na DPBS (Figura 1A). Coce as superfícies internas e externas da calvária suavemente usando pinças para ajudar a liberar as células após a digestão subsequente.
- Prepare uma solução de 2 mg/mL e uma solução de 4 mg/mL de Collagenase tipo II em DPBS e filtre cada solução com um filtro fresco de 0,22 μm. Digerir a calvaria limpa primeiro com a solução de colagenase de 2 mg/mL por 15 minutos e descartar a solução de digestão. Digerir as amostras limpas em 4 mg/mL solução de colagenase 3 vezes por 15 minutos cada vez, agrupando e salvando a solução de digestão.
- Filtre a solução de digestão através de cepas de células de 70 μm e centrifugar o filtrado a 300 × g por 5 min. Resuspende a pelota de célula em cMEMα (ver passo 2.2) contendo 10% de FBS e P/S.
- Conte e semee as células a 4 × 104 células/cm2 em placas de 10 cm. Cultura as células em uma incubadora de 37 °C com 5% de CO2 durante 3 dias.
- Dissociar as células a 37 °C com 0,25% de trypsin-EDTA. Conte e semee as células em placas de cultura celular de 24 poços com cMEMα contendo 10% de FBS e P/S a 7,5 × 105/cm2. Semente pelo menos 4 poços por célula tipo por substrato e pelo menos três poços extras para cada tipo de célula para contagem celular antes do ensaio.
- Cultuize as células a 37 °C durante a noite antes que os ensaios de oxidação do substrato.
- Isolamento e cultura de BMMs
NOTA: A cultura dos BMMs requer fator estimulante para colônias de macrófagos (M-CSF), que pode ser adquirido comercialmente como uma proteína recombinante. O meio condicionado da linha celular CMG14-12 projetado para expressar M-CSF é uma alternativa econômica usada aqui13.- Coletar fêmures e tíbias de camundongos de 8 semanas de idade depois de remover os tecidos musculares e conjuntivos. Corte e descarte as duas extremidades dos ossos com uma tesoura afiada.
- Retire a medula óssea de um fêmur e uma tíbia em uma placa de Petri de 10 cm com uma seringa equipada com uma agulha de 23 G contendo 15 mL de cMEMα com 10% de FBS, P/S e 10% cmg14-12 meio condicionado (meio BMM). Cultume as células da placa de Petri em uma incubadora de 37 °C com 5% de CO2.
- Após 3 dias, descarte os meios de cultura e enxágue com DPBS. Dissociar as células anexadas a 37 °C com 0,25% de trypsin-EDTA por 5 min. Centrifugar e resuspensar a pelota celular no meio BMM.
- Conte e semee as células em placas de cultura celular de 24 poços a 7,5 × 105/cm2 da mesma forma descrita em 3.1.6. Cultura a 37 °C durante a noite no meio BMM antes de iniciar os ensaios.
4. Ensaio de oxidação de substrato com armadilha de CO2
NOTA: Uma densidade de semeadura adequada deve ser determinada para que cada tipo de célula atinja 80-90% de confluência antes do início do ensaio. Note que a densidade celular pode afetar o estado metabólico das células.
- Lave as células nos poços extras duas vezes com DPBS. Dissociar as células com 0,25% de trippsina-EDTA e células mistas de 20 μL resuspended em DPBS com 20 μL de laranja acridina/iodeto de propídio (AO/PI) solução de corante comercial pronta para uso. Determine o número de células vivas com um contador celular automatizado e regise o número para cálculos finais.
- Lave as células nos poços de ensaio duas vezes com DPBS. Adicione 500 μL de meio quente a cada ensaio bem na capa de cultura de tecido designada pela RAM. Sele as placas com parafilm e incuba as células em uma incubadora designada pela RAM a 37 °C por 4h.
- Durante a incubação, corte o papel filtro em pedaços circulares ligeiramente maiores que a área dentro da tampa de tubos de microcentrifus de microcentragem de 1,5 ml e insira o papel snugly na tampa (Figura 1B). Adicione 200 μL de ácido per polemérico de 1 M a cada tubo e 20 μL de hidróxido de sódio ao papel filtro instalado dentro da tampa.
- Após a incubação das células, transfira 400 μL de meio de cultura de cada poço para os tubos preparados e feche as tampas imediatamente. Deixe os tubos em um rack de tubo em temperatura ambiente por 1h.
- Durante a incubação, configure um frasco de cintilação para cada tubo e preencha-o com 4 mL de fluido de cintilação. Transfira cada pedaço de papel filtro para um frasco de cintilação e incubar à temperatura ambiente por 30 minutos.
- Realizar testes de limpeza na capa de cultura tecidual, no banho de água (usado para a preparação de 14C-oleate), geladeira, incubadora, pia, terra e qualquer outra área de trabalho para possível contaminação por RAM. Coloque os lenços de papel em frascos de cintilação contendo fluido de cintilação.
- Meça radioatividade 14C nos frascos de cintilação com um contador de cintilação. Regissuam os resultados da leitura. Descontaminar o ambiente de trabalho de acordo com as diretrizes de segurança da radiação, se necessário.
5. Análise de dados
NOTA: Supondo que cada substrato esteja totalmente oxidado para liberar CO2, a taxa de oxidação do substrato pode ser calculada a partir da radioatividade de CO2 preso.
- Calcule a taxa de oxidação do substrato utilizando os valores Eq (1) e X, Y e Z dados na Tabela 1 para diferentes substratos.
Taxa de oxidação do substrato (μmol/célula/h) =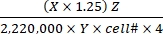 (1)
(1)- Calcule bem as desintegrações totais por minuto (DPM) para cada reação. Para X, use o valor DPM (leitura de contador de cintilação) a partir de 0,4 mL do meio de reação utilizado para captura de CO2 de 0,5 mL do meio de reação total. Portanto, o DPM total de cada reação bem é X × 1,25.
- Divida o DPM total por um fator de 2.220.000 para converter para μCi.
- Converta a radioatividade em μCi para o número de 14moléculas rotuladas em C. Divida o valor μCi pela atividade específica (Y) de cada substrato rotulado. Utilize os seguintes valores Y (Tabela 1): 14C-glicose: 300 mCi/mmol; 14 C-glutamina: 200 mCi/mmol; 14 C-oleate: 50 mCi/mmol.
- Calcule o número total de moléculas oxidadas das moléculas oxidadas de 14C rotuladas multiplicando-as com o fator de diluição quente-total (Z). Utilizar os seguintes valores Z (Tabela 1): Glicose: 4.125; glutamina: 1.000; oleate: 12,5.
- Divida o produto resultante por número celular (célula#) e 4 (pelo tempo de reação de 4h) para determinar a taxa de oxidação do substrato por célula. Use a célula# determinada nos poços paralelos no início do ensaio.
Resultados
Neste exemplo, o método de captura de CO2 é usado para comparar a oxidação do substrato por preosteoblasts pré-sísceros do calvário primário versus BMMs, que são frequentemente usados para a diferenciação de osteoblasto in vitro ou osteoclasta, respectivamente. Depois que as células primárias são passaged e cultivadas em cMEMα durante a noite, elas normalmente atingem 80-90% de confluência e exibem sua morfologia característica. Os preosteoblastas calvariais são notavelmente maiores ...
Discussão
O protocolo fornece um método fácil de usar para determinar a taxa de oxidação dos principais substratos de energia. É uma alternativa mais simples a outros protocolos que usam frascos contendo um poço central e tampados com rolhas de borracha 14,15,16. Embora o exemplo de estudo aqui seja realizado com cultura celular, o método pode ser facilmente adaptado para explantos teciduais ou homogeneizadores de tecidos contendo ...
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
O trabalho foi apoiado em parte pela concessão do NIH R01 AR060456 (FL). Agradecemos ao Dr. Michael Robinson e Elizabeth Krizman (Hospital Infantil da Filadélfia) por sua generosa ajuda com o contador de cintilação.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm filters | Sigma-Aldrich | SLGVM33RS | Used to filter BSA solution |
| 0.25% Trypsin-EDTA | Gibco | 25200056 | Dissociate cells from cell culture plates |
| 1.5 mL Eppendorf tubes | PR1MA | PR MCT17 RB | Used for reaction incubation |
| 10 cm plates | TPP | 93100 | Used for cell culture |
| 10 mL syringe | BD | 302995 | Used to flush marrow from long bones |
| 10% FBS | Atlanta biologicals | S11550 | For Cell culture medium preparation |
| 14C-Glucose | PerkinElmer | NEC042X050UC | Used to make hot media |
| 14C-glutamine | PerkinElmer | NEC451050UC | Used to make hot media |
| 14C-oleate | PerkinElmer | NEC317050UC | Used to make hot media |
| 23 G needle | BD | 305120 | Used to flush marrow from long bones |
| 24-well plates | TPP | 92024 | Used for cell culture |
| 70 μm cell strainers | MIDSCI | 70CELL | Used to filter supernatant during cavarial digestion |
| Acridine Orange/Propidium Iodide (AO/PI) dye | Nexcelom Biosciences | CS2-0106 | Stains live cells to determine seed density |
| Bovine Serum Ablumin | Proliant Biologicals | 68700 | Used for fatty acid conjugation |
| Cellometer Auto 2000 | Nexcelom Biosciences | Determine the number of viable cells | |
| Centrifuge | Thermo Fisher | Legend Micro 21R | Used to pellet cells |
| Collagenase type II | Worthington | LS004176 | Dissociate cells from tissue |
| Custom MEM alpha | GIBCO | SKU: ME 18459P1 | Used to create custom hot media |
| Dulbecco's Phosphate-Buffered Saline | Gibco | 10010023 | Used to dissolve and dilute reagents, and wash culture dishes |
| Filter Paper | Millipore-Sigma | WHA1001090 | Traps CO2 with sodium hydroxide |
| Glucose | Sigma-Aldrich | g7528 | Used to make custom media |
| HEPES | Gibco | 15630080 | Traps CO2 during cell culture |
| L-carnitine | Sigma-Aldrich | C0283 | Supplemented for fatty acid oxidation |
| L-Glutamine | Sigma-Aldrich | g3126 | Used to make custom media |
| MEM alpha | Thermo | A10490 | Cell culture medium |
| Parafilm | Pecheney Plastic Packaging | PM998 | Used to seal cell culture dishes |
| Penicillin-Streptomycin | Thermo Fisher | 15140122 | Prevents contamination in cell culture |
| Perchloric Acid | Sigma-Aldrich | 244252 | Releases CO2 during metabolic assay |
| Pyruvate | Sigma-Aldrich | p5280 | Used to make custom media |
| Scintillation Counter | Beckman Coulter | LS6500 | Determines radioactivity from the filter paper |
| Scintillation Fluid | MP Biomedicals | 882453 | Absorb the energy emitted by RAMs and re-emit it as flashes of light |
| Scintillation Vial | Fisher Scientific | 03-337-1 | Reaction containers for scintillation fluid |
| Sodium carbonate | Sigma-Aldrich | S5761 | Balance buffer for medium |
| Sodium Hydroxide | Sigma-Aldrich | 58045 | Traps CO2 during metaboilc assay |
| Sodium oleate | SANTA CRUZ | SC-215879 | BSA conjugated fatty acid preparation |
| Vaccum filtration 1000 | TPP | 99950 | Filter cMEMα |
Referências
- Hargreaves, M., Spriet, L. L. Skeletal muscle energy metabolism during exercise. Nature Metabolism. 2 (9), 817-828 (2020).
- Jeukendrup, A. E. Regulation of fat metabolism in skeletal muscle. Annals of the New York Academy of Sciences. 967, 217-235 (2002).
- Randle, P. J., Garland, P. B., Hales, C. N., Newsholme, E. A. The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus. Lancet. 1 (7285), 785-789 (1963).
- Randle, P. J., Newsholme, E. A., Garland, P. B. Regulation of glucose uptake by muscle. 8. Effects of fatty acids, ketone bodies and pyruvate, and of alloxan-diabetes and starvation, on the uptake and metabolic fate of glucose in rat heart and diaphragm muscles. Biochemical Journal. 93 (3), 652-665 (1964).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochemical Journal. 186 (3), 701-711 (1980).
- Cha, B. S., et al. Impaired fatty acid metabolism in type 2 diabetic skeletal muscle cells is reversed by PPARgamma agonists. American Journal of Physiology. Endocrinology and Metabolism. 289 (1), 151-159 (2005).
- Lee, W. C., Guntur, A. R., Long, F., Rosen, C. J. Energy metabolism of the osteoblast: implications for osteoporosis. Endocrine Reviews. 38 (3), 255-266 (2017).
- Li, B., et al. Both aerobic glycolysis and mitochondrial respiration are required for osteoclast differentiation. FASEB Journal. 34 (8), 11058-11067 (2020).
- Lee, W. C., Ji, X., Nissim, I., Long, F. Malic enzyme couples mitochondria with aerobic glycolysis in osteoblasts. Cell Reports. 32 (10), 108108 (2020).
- Kim, S. P., et al. Fatty acid oxidation by the osteoblast is required for normal bone acquisition in a sex- and diet-dependent manner. JCI Insight. 2 (16), 92704 (2017).
- Yu, Y., et al. Glutamine metabolism regulates proliferation and lineage allocation in skeletal stem cells. Cell Metabolism. 29 (4), 966-978 (2019).
- Karner, C. M., Esen, E., Okunade, A. L., Patterson, B. W., Long, F. Increased glutamine catabolism mediates bone anabolism in response to WNT signaling. The Journal of Clinical Investigation. 125 (2), 551-562 (2015).
- Takeshita, S., Kaji, K., Kudo, A. Identification and characterization of the new osteoclast progenitor with macrophage phenotypes being able to differentiate into mature osteoclasts. Journal of Bone and Mineral Research. 15 (8), 1477-1488 (2000).
- Itoh, Y., et al. Dichloroacetate effects on glucose and lactate oxidation by neurons and astroglia in vitro and on glucose utilization by brain in vivo. Proceedings of the National Academy of Sciences of the United States of America. 100 (8), 4879-4884 (2003).
- Oba, M., Baldwin, R. L. 4. t. h., Bequette, B. J. Oxidation of glucose, glutamate, and glutamine by isolated ovine enterocytes in vitro is decreased by the presence of other metabolic fuels. Journal of Animal Science. 82 (2), 479-486 (2004).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Huynh, F. K., Green, M. F., Koves, T. R., Hirschey, M. D. Measurement of fatty acid oxidation rates in animal tissues and cell lines. Methods in Enzymology. 542, 391-405 (2014).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
- Abdelmagid, S. A., et al. Comprehensive profiling of plasma fatty acid concentrations in young healthy Canadian adults. PLoS One. 10 (2), 0116195 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados