Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation de l’oxydation du substrat énergétique in vitro avec piégeage de 14CO2
Dans cet article
Résumé
Ce protocole décrit une méthode facile à utiliser pour examiner l’oxydation du substrat en suivant la production de 14CO2 in vitro.
Résumé
Les mitochondries hébergent la machinerie du cycle de l’acide tricarboxylique (TCA) et de la chaîne de transport d’électrons (ETC), qui génèrent de l’adénosine triphosphate (ATP) pour maintenir l’homéostasie énergétique. Le glucose, les acides gras et les acides aminés sont les principaux substrats énergétiques alimentant la respiration mitochondriale dans la plupart des cellules somatiques. Les preuves montrent que différents types de cellules peuvent avoir une préférence distincte pour certains substrats. Cependant, l’utilisation du substrat par diverses cellules du squelette n’a pas été étudiée en détail. De plus, comme le métabolisme cellulaire est adapté aux changements physiologiques et physiopathologiques, des évaluations directes de la dépendance au substrat dans les cellules squelettiques peuvent fournir des informations importantes sur la pathogenèse des maladies osseuses.
Le protocole suivant est basé sur le principe de la libération de dioxyde de carbone par les molécules de substrat après phosphorylation oxydative. En utilisant des substrats contenant des atomes de carbone marqués radioactivement (14C), la méthode fournit un test sensible et facile à utiliser pour le taux d’oxydation du substrat en culture cellulaire. Une étude de cas avec des préostéoblastes calvariaires primaires par rapport à des macrophages dérivés de la moelle osseuse (MGM) démontre une utilisation différente des principaux substrats entre les deux types de cellules.
Introduction
La phosphorylation oxydative (OXPHOS) chez les eucaryotes est le processus par lequel les nutriments sont décomposés à l’intérieur des mitochondries pour libérer de l’énergie chimique sous forme d’ATP par la consommation d’oxygène. Le catabolisme de divers substrats à l’intérieur des mitochondries par le cycle de l’acide tricarboxylique (TCA) génère directement peu de molécules d’ATP, mais stocke plutôt de l’énergie par réduction des transporteurs d’électrons nicotinamide adénine dinucléotide (NAD+) et flavine adénine dinucléotide (FAD+). Les porteurs réduits sont ensuite oxydés par ETC situé sur la membrane interne des mitochondries pour générer un gradient de concentration de protons à travers la membrane. Les protons finissent par descendre leur gradient dans la matrice mitochondriale à travers l’ATP synthase pour produire de l’ATP. OXPHOS est le moyen le plus efficace de production d’ATP à partir de substrats énergétiques et généralement préféré dans les environnements aérobies. Auparavant, la glycolyse aérobie - la production de lactate à partir du glucose alors que l’oxygène est présent - était considérée comme physiopathologique, souvent une caractéristique des cellules cancéreuses. De plus en plus, on découvre que certains types de cellules normales utilisent la glycolyse aérobie pour des raisons qui n’ont pas encore été entièrement déchiffrées.
La flexibilité métabolique est la capacité des cellules ou des organismes à s’adapter à l’évolution des demandes d’énergie et des sources de carburant disponibles. Par exemple, la demande énergétique du muscle squelettique est principalement satisfaite par OXPHOS à l’état d’équilibre mais par la glycolyse anaérobie lors d’exercices de haute intensité1. À mesure que la durée de l’exercice augmente, l’oxydation du glucose et des acides gras contribue davantage à la production globale d’énergie2. Cependant, l’utilisation du substrat ne dépend pas seulement de la disponibilité, car les substrats rivalisent de manière antagoniste lors de l’oxydation. Plus particulièrement, il a été démontré que l’oxydation des acides gras inhibe l’utilisation du glucose par le muscle squelettique dans un phénomène connu sous le nom d’effet Randle3. Un effet réciproque a été démontré par des études ultérieures 4,5. En outre, de nombreuses maladies sont associées à un changement de préférence de substrat et au développement d’une rigidité métabolique dans les cellules. Par exemple, l’oxydation des acides gras est réduite dans le muscle squelettique des patients diabétiques de type II par rapport aux sujets témoins normaux6. Les changements métaboliques dans les contextes de la maladie font l’objet d’une enquête intense car ils peuvent contribuer à la pathogenèse.
Le métabolisme énergétique dans les types de cellules squelettiques est relativement peu étudié, mais a attiré l’attention ces dernières années7. Des travaux antérieurs ont montré que la glycolyse aérobie est la voie énergétique dominante dans les ostéoblastes calvariaires, tandis que l’oxydation du glucose par le cycle TCA joue un rôle dans la formation d’ostéoclastes 8,9. D’autres ont fourni des preuves que les acides gras étaient une source d’énergie pour les ostéoblastes10. Il a également été démontré que le catabolisme de la glutamine favorise la différenciation des ostéoblastes par rapport aux progéniteurs11,12. Cependant, une compréhension globale de l’utilisation du substrat par divers types de cellules squelettiques fait encore défaut. En outre, les changements dans le métabolisme cellulaire au cours de la différenciation cellulaire ou en réponse à des signaux pathologiques devraient modifier l’utilisation du substrat de carburant. Décrit ci-dessous est un protocole facile à utiliser pour tester l’oxydation du substrat in vitro.
Protocole
L’utilisation de matières radioactives (RAM) nécessite l’approbation préalable d’un comité de sûreté désigné dans chaque établissement. Les RAM utilisés dans ce protocole ont été approuvés par Environmental Health & Radiation Safety (EHRS) de l’Université de Pennsylvanie. L’utilisation d’animaux nécessite l’approbation préalable du Comité institutionnel de soins et d’utilisation des animaux (IACUC) de l’établissement d’origine. L’étude suivante a été approuvée par l’IACUC à l’hôpital pour enfants de Philadelphie.
1. Préparation de solutions mères pour 14substrats marqués C
- Préparer une solution mère d’albumine sérique bovine (BSA) de 4 mM en mélangeant 11 g de BSA et 33,1 mL de solution saline tamponnée au phosphate (DPBS) de Dulbecco et en la agitant doucement à température ambiante pendant environ 3 h jusqu’à ce que la BSA soit complètement dissoute. Réchauffer la solution mère BSA dans un bain-marie à 70 °C avant utilisation.
- Sécher à l’air libre 50 μCi 14C-oléate (50 μCi/μmol dans l’éthanol) dans le flacon avec le couvercle fermé pendant 8 h dans une hotte de travail RAM désignée. Ajouter 312,5 μL deH2O puis 3,5 mg (11,5 μmol) d’oléate de sodium. Mélanger.
- Réchauffer la solution obtenue à 70 °C au bain-marie. Ajouter 0,9375 mL de la solution mère de BSA préavertie pour obtenir une solution mère d’oléate chaud de 10 mM (contenant un rapport de 1:11,5 de 14anéate C par rapport à l’oléate non marqué). Aliquotez la solution mère et conservez-la à -20 °C pour une utilisation à long terme.
- Utilisez 14C-glucose et 14C-glutamine directement après la décongélation.
2. Préparation d’un milieu contenant 14substrats marqués C
REMARQUE: Pour assurer des concentrations fiables de substrats énergétiques dans les milieux, les milieux sur mesure doivent être utilisés avec des substrats frais ajoutés peu de temps avant utilisation. Ici, un milieu essentiel minimum (MEMα) sur mesure sans glucose, pyruvate, glutamine, rouge de phénol ou bicarbonate de sodium est utilisé. Cependant, un milieu optimal doit être déterminé pour chaque type de cellule.
- Reconstituer 8,67 g de la poudre moyenne dans 1 L d’eau purifiée. Ajouter 2,2 g de bicarbonate de sodium pour obtenir un pH de 7,4 et filtrer la solution à l’aide d’une filtration sous vide de 0,22 μm.
- Ajouter des ingrédients frais pour obtenir le milieu complet (cMEMα) avec des concentrations finales de 5,5 mM de glucose, 2 mM de glutamine, 1 mM de pyruvate et 10% de sérum fœtal bovin (FBS). Complétez en outre cMEMα avec 100 mM de L-carnitine et 10 μM d’HEPES pour faciliter l’oxydation des acides gras.
- Immédiatement avant utilisation, ajouter 14substrats marqués C au cMEMα fraîchement préparé pour obtenir un milieu chaud. Pour rendre le milieu oléate chaud, ajouter la solution mère d’oléate chaud de 10 mM à cMEMα pour une concentration finale de 100 μM d’oléate (dilution 1:100, radioactivité finale 0,4 μCi/mL).
REMARQUE : Le stock d’oléate chaud de 10 mM contenant un rapport de 1:11,5 d’oléate chaud/froid (voir l’étape 1.3) est utilisé pour atteindre un niveau physiologique de 100 μM d’oléate total dans le milieu tout en minimisant la quantité de matière radioactive. - Préparer 10 mM d’oléate non marqué en ajoutant 24,36 mg d’oléate de sodium à 2 mL deH2O au bain-marie à 70 °C pendant environ 20 min jusqu’à dissolution complète avant de mélanger rapidement avec 6 mL de la solution mère de BSA de 4 mM préavertilée à 70 °C. Transférer dans un bain-marie à 37 °C pendant 1 h et filtrer à travers un filtre de 0,22 μm. Aliquote et conserver à -20 °C pour une utilisation à long terme.
- Pour rendre le glucose chaud, ajouter 14C-glucose à une concentration finale de 1,333 μM (dilution 1:4 125, radioactivité finale 0,4 μCi/mL). Pour rendre la glutamine en milieu chaud, ajouter 14C-glutamine à la concentration finale de 2 μM (dilution 1:1 000, radioactivité finale 0,4 μCi/mL).
- Compléter le milieu chaud de glucose et de glutamine avec une solution mère de 10 mM d’oléate non marqué de l’étape 2.4 pour atteindre la concentration finale de 100 μM d’oléate, la même que celle du milieu chaud oléate.
3. Préparation des cellules
REMARQUE: Les préostéoblastes calvariaires et les macrophages de la moelle osseuse sont utilisés comme exemples ici. Les utilisateurs doivent préparer le type de cellule de leur choix selon les protocoles appropriés. Optimiser la concentration de collagénase II à utiliser pour la digestion dans des expériences pilotes, car l’activité enzymatique peut varier d’un lot à l’autre.
- Isolement et culture des préostéoblastes calvariaires
- Sacrifiez les chiots du jour postnatal 3-5 (P3-5) par décapitation et transférez-les dans un DPBS glacé contenant de la pénicilline-streptomycine (P / S).
- Exposez le calvaire en enlevant la peau et les tissus mous. Prélever la région médiane en coupant les tissus environnants de l’arrière vers l’avant dans le DPBS (Figure 1A). Grattez doucement les surfaces interne et externe de la calvarie à l’aide d’une pince à épiler pour aider à libérer les cellules lors de la digestion ultérieure.
- Préparer une solution de 2 mg/mL et une solution de 4 mg/mL de collagénase de type II dans du DPBS et filtrer chaque solution avec un filtre frais de 0,22 μm. Digérer d’abord la calvaire nettoyée avec la solution de collagénase de 2 mg/mL pendant 15 min et jeter la solution de digestion. Digérer les échantillons nettoyés dans une solution de collagénase de 4 mg/mL 3 fois pendant 15 min à chaque fois, en regroupant et en sauvegardant la solution de digestion.
- Filtrer la solution de digestion à travers des tamis cellulaires de 70 μm et centrifuger le filtrat à 300 × g pendant 5 min. Remettre en suspension la pastille de cellule en cMEMα (voir étape 2.2) contenant 10 % de FBS et de P/S.
- Compter et ensemencer les cellules à 4 × 104 cellules/cm2 dans des plaques de 10 cm. Cultivez les cellules dans un incubateur à 37 °C avec 5% de CO2 pendant 3 jours.
- Dissocier les cellules à 37 °C avec 0,25 % de trypsine-EDTA. Compter et ensemencer les cellules dans des plaques de culture cellulaire à 24 puits avec cMEMα contenant 10% de FBS et P/S à 7,5 × 105/cm2. Ensemencez au moins 4 puits par type de cellule et par substrat et au moins trois puits supplémentaires pour chaque type de cellule pour le comptage cellulaire avant le test.
- Cultiver les cellules à 37 °C pendant la nuit avant les essais d’oxydation du substrat.
- Isolement et culture des BMM
REMARQUE: La culture des MMO nécessite un facteur de stimulation des colonies de macrophages (M-CSF), qui peut être acheté commercialement en tant que protéine recombinante. Le milieu conditionné de la lignée cellulaire CMG14-12 conçu pour exprimer le M-CSF est une alternative économique utilisée ici13.- Recueillir les fémurs et les tibias de souris de 8 semaines après avoir enlevé le muscle et les tissus conjonctifs. Coupez et jetez les deux extrémités des os avec des ciseaux tranchants.
- Débusquez la moelle osseuse d’un fémur et d’un tibia dans une boîte de Petri de 10 cm avec une seringue équipée d’une aiguille de 23 G contenant 15 mL de cMEMα avec 10% de FBS, P / S et 10% de milieu conditionné CMG14-12 (milieu BMM). Cultiver les cellules dans la boîte de Pétri dans un incubateur à 37 °C avec 5% de CO2.
- Après 3 jours, jeter le milieu de culture et rincer avec du DPBS. Dissocier les cellules attachées à 37 °C avec 0,25 % de trypsine-EDTA pendant 5 min. Centrifuger et remettre en suspension la pastille de cellule dans le milieu BMM.
- Compter et ensemencer les cellules dans des plaques de culture cellulaire à 24 puits à 7,5 × 105/cm2 de la même manière que celle décrite au point 3.1.6. Culture à 37 °C pendant la nuit dans le milieu BMM avant de commencer les essais.
4. Dosage d’oxydation du substrat avec piège à CO2
REMARQUE: Une densité d’ensemencement appropriée doit être déterminée pour chaque type de cellule afin d’atteindre une confluence de 80 à 90% avant le début de l’essai. Notez que la densité cellulaire peut affecter l’état métabolique des cellules.
- Lavez les cellules dans les puits supplémentaires deux fois avec DPBS. Dissocier les cellules avec 0,25 % de trypsine-EDTA et mélanger des cellules de 20 μL remises en suspension dans du DPBS avec 20 μL de solution de colorant commercial prêt à l’emploi d’acridine orange/iodure de propidium (AO/PI). Déterminez le nombre de cellules vivantes à l’aide d’un compteur de cellules automatisé et enregistrez le nombre pour les calculs finaux.
- Lavez les cellules dans les puits d’essai deux fois avec DPBS. Ajouter 500 μL de milieu chaud à chaque puits d’essai dans la hotte de culture tissulaire désignée ram. Scellez les plaques avec un parafilm et incubez les cellules dans un incubateur désigné RAM à 37 °C pendant 4 h.
- Pendant l’incubation, coupez le papier filtre en morceaux circulaires légèrement plus grands que la zone à l’intérieur du capuchon des tubes de microcentrifugation de 1,5 ml et insérez le papier bien dans le capuchon (Figure 1B). Ajouter 200 μL d’acide perchlorique 1 M dans chaque tube et 20 μL d’hydroxyde de sodium sur le papier filtre inséré à l’intérieur du bouchon.
- Après l’incubation des cellules, transférer 400 μL de milieu de culture de chaque puits vers les tubes préparés et fermer immédiatement les bouchons. Laisser les tubes dans un porte-tubes à température ambiante pendant 1 h.
- Pendant l’incubation, installez un flacon de scintillation pour chaque tube et remplissez-le de 4 mL de liquide de scintillation. Transférer chaque morceau de papier filtre dans un flacon de scintillation et incuber à température ambiante pendant 30 min.
- Effectuez des tests d’essuyage sur la hotte de culture tissulaire, le bain-marie (utilisé pour la préparation de 14C-oléate), le réfrigérateur, l’incubateur, l’évier, le sol et toute autre zone de travail pour une contamination potentielle par la RAM. Mettez les lingettes en papier dans des flacons de scintillation contenant du liquide de scintillation.
- Mesurez la radioactivité de 14C dans les flacons de scintillation avec un compteur de scintillation. Enregistrez les résultats de lecture. Décontaminer l’environnement de travail selon les directives de radioprotection si nécessaire.
5. Analyse des données
REMARQUE: En supposant que chaque substrat est complètement oxydé pour libérer du CO2, le taux d’oxydation du substrat peut être calculé à partir de la radioactivité du CO2 piégé.
- Calculez le taux d’oxydation du substrat à l’aide de Eq (1) et des valeurs X, Y et Z indiquées dans le tableau 1 pour différents substrats.
Taux d’oxydation du substrat (μmol/cellule/h) =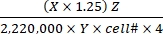 (1)
(1)- Calculer les désintégrations totales par min (DPM) pour chaque puits de réaction. Pour X, utilisez la valeur DPM (lecture du compteur de scintillation) à partir de 0,4 mL du milieu réactionnel utilisé pour le piégeage du CO2 sur 0,5 mL du milieu réactionnel total. Par conséquent, le DPM total de chaque puits de réaction est de X × 1,25.
- Divisez le DPM total par un facteur de 2 220 000 pour convertir en μCi.
- Convertir la radioactivité en μCi en nombre de 14molécules marquées C. Divisez la valeur μCi par l’activité spécifique (Y) de chaque substrat marqué. Utilisez les valeurs Y suivantes (tableau 1) : 14C-glucose : 300 mCi/mmol ; 14 C-glutamine : 200 mCi/mmol ; 14 C-oléate : 50 mCi/mmol.
- Calculer le nombre total de molécules oxydées à partir des 14molécules oxydées marquées C en multipliant ces dernières par le facteur de dilution chaud à total (Z). Utilisez les valeurs Z suivantes (tableau 1) : Glucose : 4 125; glutamine : 1 000; oléate: 12,5.
- Divisez le produit résultant par nombre de cellules (cellule#) et 4 (pour un temps de réaction de 4 h) pour déterminer le taux d’oxydation du substrat par cellule. Utilisez la cellule# déterminée dans les puits parallèles au début de l’essai.
Résultats
Dans cet exemple, la méthode de piégeage du CO2 est utilisée pour comparer l’oxydation du substrat par les préostéoblastes calvariaires primaires par rapport aux MBM, qui sont fréquemment utilisés pour la différenciation in vitro des ostéoblastes ou des ostéoclastes, respectivement. Une fois que les cellules primaires sont passées et cultivées dans cMEMα pendant la nuit, elles atteignent généralement 80 à 90% de la confluence et présentent leur morphologie caractéristique. Les pré...
Discussion
Le protocole fournit une méthode facile à utiliser pour déterminer le taux d’oxydation des principaux substrats énergétiques. C’est une alternative plus simple aux autres protocoles qui utilisent des flacons contenant un puits central et coiffés de bouchons en caoutchouc 14,15,16. Bien que l’exemple d’étude ici soit réalisé avec une culture cellulaire, la méthode peut être facilement adaptée pour les explante...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Le travail a été soutenu en partie par la subvention R01 AR060456 (FL) des NIH. Nous remercions le Dr Michael Robinson et Elizabeth Krizman (The Children’s Hospital of Philadelphia) pour leur généreuse aide avec le compteur de scintillation.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm filters | Sigma-Aldrich | SLGVM33RS | Used to filter BSA solution |
| 0.25% Trypsin-EDTA | Gibco | 25200056 | Dissociate cells from cell culture plates |
| 1.5 mL Eppendorf tubes | PR1MA | PR MCT17 RB | Used for reaction incubation |
| 10 cm plates | TPP | 93100 | Used for cell culture |
| 10 mL syringe | BD | 302995 | Used to flush marrow from long bones |
| 10% FBS | Atlanta biologicals | S11550 | For Cell culture medium preparation |
| 14C-Glucose | PerkinElmer | NEC042X050UC | Used to make hot media |
| 14C-glutamine | PerkinElmer | NEC451050UC | Used to make hot media |
| 14C-oleate | PerkinElmer | NEC317050UC | Used to make hot media |
| 23 G needle | BD | 305120 | Used to flush marrow from long bones |
| 24-well plates | TPP | 92024 | Used for cell culture |
| 70 μm cell strainers | MIDSCI | 70CELL | Used to filter supernatant during cavarial digestion |
| Acridine Orange/Propidium Iodide (AO/PI) dye | Nexcelom Biosciences | CS2-0106 | Stains live cells to determine seed density |
| Bovine Serum Ablumin | Proliant Biologicals | 68700 | Used for fatty acid conjugation |
| Cellometer Auto 2000 | Nexcelom Biosciences | Determine the number of viable cells | |
| Centrifuge | Thermo Fisher | Legend Micro 21R | Used to pellet cells |
| Collagenase type II | Worthington | LS004176 | Dissociate cells from tissue |
| Custom MEM alpha | GIBCO | SKU: ME 18459P1 | Used to create custom hot media |
| Dulbecco's Phosphate-Buffered Saline | Gibco | 10010023 | Used to dissolve and dilute reagents, and wash culture dishes |
| Filter Paper | Millipore-Sigma | WHA1001090 | Traps CO2 with sodium hydroxide |
| Glucose | Sigma-Aldrich | g7528 | Used to make custom media |
| HEPES | Gibco | 15630080 | Traps CO2 during cell culture |
| L-carnitine | Sigma-Aldrich | C0283 | Supplemented for fatty acid oxidation |
| L-Glutamine | Sigma-Aldrich | g3126 | Used to make custom media |
| MEM alpha | Thermo | A10490 | Cell culture medium |
| Parafilm | Pecheney Plastic Packaging | PM998 | Used to seal cell culture dishes |
| Penicillin-Streptomycin | Thermo Fisher | 15140122 | Prevents contamination in cell culture |
| Perchloric Acid | Sigma-Aldrich | 244252 | Releases CO2 during metabolic assay |
| Pyruvate | Sigma-Aldrich | p5280 | Used to make custom media |
| Scintillation Counter | Beckman Coulter | LS6500 | Determines radioactivity from the filter paper |
| Scintillation Fluid | MP Biomedicals | 882453 | Absorb the energy emitted by RAMs and re-emit it as flashes of light |
| Scintillation Vial | Fisher Scientific | 03-337-1 | Reaction containers for scintillation fluid |
| Sodium carbonate | Sigma-Aldrich | S5761 | Balance buffer for medium |
| Sodium Hydroxide | Sigma-Aldrich | 58045 | Traps CO2 during metaboilc assay |
| Sodium oleate | SANTA CRUZ | SC-215879 | BSA conjugated fatty acid preparation |
| Vaccum filtration 1000 | TPP | 99950 | Filter cMEMα |
Références
- Hargreaves, M., Spriet, L. L. Skeletal muscle energy metabolism during exercise. Nature Metabolism. 2 (9), 817-828 (2020).
- Jeukendrup, A. E. Regulation of fat metabolism in skeletal muscle. Annals of the New York Academy of Sciences. 967, 217-235 (2002).
- Randle, P. J., Garland, P. B., Hales, C. N., Newsholme, E. A. The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus. Lancet. 1 (7285), 785-789 (1963).
- Randle, P. J., Newsholme, E. A., Garland, P. B. Regulation of glucose uptake by muscle. 8. Effects of fatty acids, ketone bodies and pyruvate, and of alloxan-diabetes and starvation, on the uptake and metabolic fate of glucose in rat heart and diaphragm muscles. Biochemical Journal. 93 (3), 652-665 (1964).
- Taegtmeyer, H., Hems, R., Krebs, H. A. Utilization of energy-providing substrates in the isolated working rat heart. Biochemical Journal. 186 (3), 701-711 (1980).
- Cha, B. S., et al. Impaired fatty acid metabolism in type 2 diabetic skeletal muscle cells is reversed by PPARgamma agonists. American Journal of Physiology. Endocrinology and Metabolism. 289 (1), 151-159 (2005).
- Lee, W. C., Guntur, A. R., Long, F., Rosen, C. J. Energy metabolism of the osteoblast: implications for osteoporosis. Endocrine Reviews. 38 (3), 255-266 (2017).
- Li, B., et al. Both aerobic glycolysis and mitochondrial respiration are required for osteoclast differentiation. FASEB Journal. 34 (8), 11058-11067 (2020).
- Lee, W. C., Ji, X., Nissim, I., Long, F. Malic enzyme couples mitochondria with aerobic glycolysis in osteoblasts. Cell Reports. 32 (10), 108108 (2020).
- Kim, S. P., et al. Fatty acid oxidation by the osteoblast is required for normal bone acquisition in a sex- and diet-dependent manner. JCI Insight. 2 (16), 92704 (2017).
- Yu, Y., et al. Glutamine metabolism regulates proliferation and lineage allocation in skeletal stem cells. Cell Metabolism. 29 (4), 966-978 (2019).
- Karner, C. M., Esen, E., Okunade, A. L., Patterson, B. W., Long, F. Increased glutamine catabolism mediates bone anabolism in response to WNT signaling. The Journal of Clinical Investigation. 125 (2), 551-562 (2015).
- Takeshita, S., Kaji, K., Kudo, A. Identification and characterization of the new osteoclast progenitor with macrophage phenotypes being able to differentiate into mature osteoclasts. Journal of Bone and Mineral Research. 15 (8), 1477-1488 (2000).
- Itoh, Y., et al. Dichloroacetate effects on glucose and lactate oxidation by neurons and astroglia in vitro and on glucose utilization by brain in vivo. Proceedings of the National Academy of Sciences of the United States of America. 100 (8), 4879-4884 (2003).
- Oba, M., Baldwin, R. L. 4. t. h., Bequette, B. J. Oxidation of glucose, glutamate, and glutamine by isolated ovine enterocytes in vitro is decreased by the presence of other metabolic fuels. Journal of Animal Science. 82 (2), 479-486 (2004).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Huynh, F. K., Green, M. F., Koves, T. R., Hirschey, M. D. Measurement of fatty acid oxidation rates in animal tissues and cell lines. Methods in Enzymology. 542, 391-405 (2014).
- Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Progress in Lipid Research. 47 (5), 348-380 (2008).
- Abdelmagid, S. A., et al. Comprehensive profiling of plasma fatty acid concentrations in young healthy Canadian adults. PLoS One. 10 (2), 0116195 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon