A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام الموائع الدقيقة والمجهر الفلوري لدراسة ديناميكيات تجميع خيوط وحزم الأكتين المفردة
In This Article
Summary
نحن نقدم بروتوكولات لفحوصات الموائع الدقيقة البسيطة لخيوط الأكتين ، بالاشتراك مع الفحص المجهري الفلوري ، والتي تسمح للمرء بمراقبة خيوط الأكتين الفردية بدقة في الوقت الفعلي مع تعريضها بالتتابع لحلول البروتين المختلفة.
Abstract
من أجل فك رموز الآليات الجزيئية المعقدة التي تنظم تجميع وتفكيك خيوط الأكتين ، يعد من الأصول العظيمة مراقبة التفاعلات الفردية التي تعيش في ظروف يتم التحكم فيها بشكل جيد. للقيام بذلك ، ظهرت تجارب حية أحادية الخيط على مدى السنوات ال 20 الماضية ، معظمها باستخدام المجهر الفلوري الداخلي الكلي للانعكاس (TIRF) ، وقدمت مجموعة من النتائج الرئيسية. في عام 2011 ، من أجل توسيع إمكانيات هذه التجارب وتجنب القطع الأثرية الإشكالية المتكررة ، أدخلنا الموائع الدقيقة البسيطة في هذه المقاييس. تفصل هذه الدراسة بروتوكولنا الأساسي ، حيث يتم تثبيت خيوط الأكتين الفردية بواسطة طرف واحد على سطح الغطاء المخمل ، وتتماشى مع التدفق ، ويمكن أن تتعرض على التوالي لمحاليل البروتين المختلفة. كما نقدم بروتوكولات لتطبيقات محددة ونشرح كيف يمكن تطبيق القوى الميكانيكية التي يتم التحكم فيها ، وذلك بفضل السحب اللزج للمحلول المتدفق. نسلط الضوء على المحاذير التقنية لهذه التجارب ونقدم بإيجاز التطورات المحتملة بناء على هذه التقنية. هذه البروتوكولات والتفسيرات، جنبا إلى جنب مع توافر اليوم من معدات الموائع الدقيقة سهلة الاستخدام، ينبغي أن تسمح لغير المتخصصين بتنفيذ هذا الفحص في مختبراتهم.
Introduction
يتم التحكم في تجميع وتفكيك خيوط الأكتين وشبكات خيوط الأكتين بواسطة العديد من التفاعلات الكيميائية الحيوية وتعتمد على السياق الميكانيكي. من أجل اكتساب نظرة ثاقبة على هذه الآليات المعقدة ، من غير القيم أن تكون قادرا على مراقبة ردود الفعل الفردية على الخيوط الفردية (بأعداد كبيرة بما فيه الكفاية). على مدى العقود الماضية ، ظهرت مراقبة خيوط الأكتين الديناميكية في الوقت الفعلي ، ومعظمها باستخدام الفحص المجهري الكلي للتألق الداخلي للانعكاس (TIRF) ، كتقنية رئيسية وقدمت قائمة رائعة من النتائج التي لم يكن من الممكن الحصول عليها باستخدام المقايسات الكيميائية الحيوية للمحلول السائب1.
لتحقيق ذلك ، يحتاج المرء إلى الحفاظ على خيوط الأكتين المصنفة بالفلورسنت بالقرب من سطح غطاء المجهر مع تعريضها لمحاليل البروتينات المرتبطة بالأكتين (ABPs) ، والتي يمكن أيضا تصنيفها بالفلورسنت. ويوفر القيام بذلك وسيلة لرصد الأحداث التي تحدث على خيوط فردية في ظروف كيميائية حيوية جيدة التحكم، وبالتالي تحديد معدلات التفاعل كميا. ومع ذلك، ينبغي النظر في عدد من القيود المحددة. يمكن أن يؤدي الحفاظ على خيوط قريبة من السطح بشكل مصطنع ، غالبا بفضل نقاط تثبيت متعددة أو باستخدام عامل ازدحام مثل ميثيل سليلوز ، إلى تغيير سلوكها (على سبيل المثال ، التسبب في توقف مؤقت في البلمرة وإزالة البلمرة2). يمكن أن يكون تتبع محيط كل خيط أمرا صعبا ، خاصة إذا تراكمت خيوط أو شظايا خيوط جديدة في مجال الرؤية بمرور الوقت. تحدث التفاعلات في حجم محدود حيث يمكن أن يختلف تركيز مونومرات الأكتين و ABPs بمرور الوقت ، مما قد يجعل من الصعب اشتقاق ثوابت معدل دقيقة. وأخيرا، من الصعب تجديد أو تغيير محلول ABPs في أقل من 30 ثانية وغالبا ما يؤدي إلى محتوى بروتين غير متجانس في العينة.
منذ ما يزيد قليلا عن 10 سنوات ، مستوحاة مما تم القيام به بالفعل لدراسة خيوط حمض ديوكسي ريبونوكلييك (DNA) الفردية3 ، قدمنا تقنية جديدة تعتمد على الموائع الدقيقة لمراقبة خيوط الأكتين الفردية ومعالجتها4. يسمح للمرء بالتحايل على القيود المذكورة أعلاه لتقنيات الخيوط المفردة الكلاسيكية. في مقايسات الموائع الدقيقة هذه ، تزرع خيوط الأكتين من بذور الطيف الأكتين الممتصة على الغطاء. وبالتالي يتم تثبيت الخيوط من طرف واحد فقط في الجزء السفلي من غرفة الموائع الدقيقة وتتقلب فوق السطح دون الالتصاق. تتماشى الخيوط مع تدفق المحاليل الواردة ، وبالتالي تسهيل مراقبة طول محيطها والحفاظ عليها في منطقة ضحلة فوق الغطاء حيث يمكن استخدام TIRF. يتم تدفق حلول مختلفة في وقت واحد إلى الغرفة دون خلط ، ويمكن أن تتعرض الخيوط لها بالتتابع والسرعة.
هنا ، نقترح سلسلة من البروتوكولات الأساسية لإعداد اختبارات الموائع الدقيقة أحادية الأكتين في المختبر. يمكن تحضير غرف الأغطية والموائع الدقيقة مقدما (في نصف يوم) ، ويتم إجراء التجربة نفسها ، حيث يمكن اختبار العديد من الظروف الكيميائية الحيوية ، في أقل من يوم.
Protocol
1. إعداد غرفة الموائع الدقيقة
- حدد قالب رئيسي SU-8 مع العديد من أنماط الغرفة. الغرف النموذجية متقاطعة الشكل مع ثلاثة مداخل ومنفذ واحد ، بارتفاع 20 ميكرومتر وعرض 800 ميكرومتر (الشكل 1). يمكن شراء هذه القوالب الرئيسية من شركات خارجية أو صنعها في مختبرات أكاديمية (على سبيل المثال ، Gicquel ، Y. et al.5).
- ضع الشريط حول حافة القالب.
- ضع شريطا مكتبيا شفافا قياسيا بطول 50 سم وعرضه 19 مم (انظر جدول المواد) على مقعد ، جانب لزج لأعلى. ضع القالب عموديا في أحد طرفيه وعلى طول خط الوسط للشريط.
- لف القالب إلى الطرف الآخر من الشريط لإنشاء حد 1 سم حول القالب. قم بطي الشريط لأسفل فوق الجزء السفلي من القالب.
- تحضير محلول بولي ثنائي ميثيل سيلوكسان (PDMS).
- في طبق وزن يمكن التخلص منه ، صب مباشرة 25-30 جم من قاعدة PDMS (جدول المواد). أضف 10٪ من الوزن / الوزن عامل معالجة PDMS (جدول المواد) باستخدام ماصة باستور بلاستيكية يمكن التخلص منها.
- تخلط يدويا وجيدا بعصا بلاستيكية. تأكد من دمج عامل المعالجة بشكل جيد في قاعدة PDMS ، حتى لو كان التحريك يخلق الكثير من الفقاعات.
- قم بتفريغ محلول PDMS في مجفف فراغ (جدول المواد) لمدة 5 دقائق على الأقل في درجة حرارة الغرفة (RT). سوف تتوسع الفقاعات ، وترتفع إلى السطح ، وتنفجر عندما يتم كسر الفراغ.
- صب محلول PDMS فوق قالب SU-8. استخدم عصا بلاستيكية لكشط ونقل أكبر قدر ممكن من الخليط.
- Degas PDMS للمرة الثانية (5 دقائق في مجفف الفراغ). تأكد من التخلص من معظم الفقاعات (بعض الفقاعات الصغيرة في السطح العلوي على ما يرام).
- ضع القالب في فرن على درجة حرارة 70 درجة مئوية لمدة 5 ساعات على الأقل حتى يتفاعل PDMS ويتصلب.
- إزالة غرف PDMS الصلبة من القالب.
تنبيه: رقائق السيليكون لقوالب SU-8 هشة للغاية ، لذلك يجب توخي الحذر الشديد عند فصل PDMS عن الرقائق. اعمل على سطح صلب ومستو وحافظ على الرقاقة مسطحة على السطح.- باستخدام شفرة حلاقة ، قم بعمل قطع دائري في PDMS ، على بعد حوالي 1 سم من حافة القالب. يجب أن تكون جميع الأنماط 0.5 سم على الأقل داخل القطع. قشر بلطف كتلة PDMS المركزية باستخدام أدوات شد لطيفة.
تنبيه: عند التقشير، حافظ على قالب SU-8 مسطحا على سطح الطاولة لمنع كسره. - ضع PDMS على رقائق الألومنيوم النظيفة ، السطح المصبوب المواجه لرقائق الألومنيوم ، لحماية سطحه من الغبار ولجعل الأنماط أكثر وضوحا.
- باستخدام شفرة حلاقة ، قم بعمل قطع دائري في PDMS ، على بعد حوالي 1 سم من حافة القالب. يجب أن تكون جميع الأنماط 0.5 سم على الأقل داخل القطع. قشر بلطف كتلة PDMS المركزية باستخدام أدوات شد لطيفة.
- اختر وقطع غرفة بشفرة حلاقة على بعد 0.5 سم على الأقل من النمط. يبلغ ارتفاع كتلة PDMS الناتجة حوالي 0.5 سم وعرضها 1.5 سم وطولها 3 سم. اخترق ثلاثة مداخل ومنفذ واحد مع لكمة خزعة 0.75 مم معرف (جدول المواد).
- نظف غرفة PDMS بالإيثانول فائق النقاء (جدول المواد) وجففه في الهواء باستخدام مسدس بخاخ أمان (جدول المواد). ضع PDMS مع توجيه النمط لأعلى في طبق بتري نظيف ، وأغلق الطبق بغطائه.
2. تنظيف الغطاء الزجاجي
ملاحظة: هنا ، يتم تفصيل إجراء تنظيف غطاء قياسي ، استنادا إلى سلسلة من خطوات الصوتنة. تم وصف إجراءات تنظيف الغطاء الزجاجي الأخرى في العديد من المنشورات الأخرى التي يمكن أن تحقق نتائج مرضية مماثلة6،7،8،9.
- ضع 10-20 غطاء (بطول 40 مم) على حامل البولي تترافلورو إيثيلين (PTFE) (جدول المواد). قم بإلغاء صوت الغطاء في محلول تنظيف الزجاج بنسبة 0.5 لتر بنسبة 2٪ (جدول المواد) في كوب زجاجي سعة 1 لتر (35 درجة مئوية ، 30 دقيقة).
- تخلص من محلول تنظيف الزجاج واشطف الأغطية على نطاق واسع باستخدام dH2O في ثلاثة حمامات متتالية سعة 0.5 لتر على الأقل.
- تحضير 0.5 لتر من 2 م كوه في كوب زجاجي سعة 1 لتر. قم بسونيك الأغطية في KOH (RT ، 30 دقيقة). تخلص من KOH واشطف الأغطية باستخدام dH2O في ثلاثة حمامات سعة 0.5 لتر على الأقل.
تنبيه: استخدم معدات حماية السلامة المناسبة في المختبر (القفازات والنظارات ومعطف المختبر). - نقل وسونيك الأغطية في 0.5 لتر من الإيثانول فائق النقاء (RT ، 30 دقيقة). يمكن الاحتفاظ ب Coverslips في الإيثانول لمدة تصل إلى 2 أسابيع. أغلق الكأس بفيلم اللدائن الحرارية (جدول المواد) لمنع التبخر. قبل الاستخدام ، جفف الغطاء مع تدفق الهواء.
3. جمعية غرفة PDMS
- سخني الصفيحة الساخنة إلى 100 درجة مئوية. ضع ما يصل إلى ثلاث غرف PDMS نظيفة وأغطية زجاجية في طبق بتري نظيف. ضع طبق بتري المفتوح في منظف عميق للأشعة فوق البنفسجية (λ = 185 نانومتر ، انظر جدول المواد) وقم بتعريضه للأشعة فوق البنفسجية لمدة 3-5 دقائق.
ملاحظة: بدلا من ذلك ، يمكن أن تتعرض غرف PDMS وأغطية الغطاء للهواء أو بلازما الأكسجين لمدة 30 ثانية. - ضع غرفة PDMS برفق فوق الغطاء الزجاجي. تأكد من أن السطحين الملامسين للتلامس تعرضا مباشرة للأشعة فوق البنفسجية. يلتصق PDMS تلقائيا بالزجاج وتصبح الغرفة مرئية بوضوح.
- لإزالة أي هواء محبوس في واجهة PDMS-coverslip ، اضغط برفق شديد على السطح بإصبع. للحصول على ترابط أكثر إحكاما، اضغط بقوة أكبر على الزوايا والجوانب. تأكد من أن سقف الغرفة لا يتلامس مع السطح الزجاجي.
- ضع الغرفة مع الجزء السفلي الزجاجي المواجه للصفيحة الساخنة عند 100 درجة مئوية لمدة 5 دقائق. بعد هذه الخطوة ، تصبح روابط الزجاج PDMS دائمة ، ولا يمكن استخدام الغرف إلا مرة واحدة. استخدم الغرفة على الفور أو قم بتخزينها في طبق بتري نظيف لمدة تصل إلى أسبوع.
4. [اختياري] التخميل المباشر والوظيفية
ملاحظة: اعتمادا على التطبيق، يمكن تخميل الغرف وتشغيلها إما بمجرد توصيلها بجهاز التحكم في الموائع الدقيقة (انظر جدول المواد) أو عن طريق حقن المحاليل يدويا مباشرة في الغرفة باستخدام ماصة قبل توصيلها بجهاز الموائع الدقيقة. يوفر هذا الأخير ميزة استهلاك كمية أقل من الكاشف وتجنب التلوث المحتمل عن طريق تدفق المحلول عبر أنابيب كيتون الأثير متعدد الأثير (PEEK) لجهاز الموائع الدقيقة. في جميع الخطوات التالية ، يتم حقن المحاليل عن طريق لصق طرف الماصة مباشرة في المخرج. من أجل تجنب إنشاء فقاعات داخل الغرفة ، تأكد من وجود قطرة صغيرة تخرج من طرف الماصة عند توصيل الطرف بمخرج غرفة PDMS. وبالمثل ، قم بإزالة طرف الماصة قبل حقن الحجم بأكمله.
- حقن 20 ميكرولتر من PLL-PEG (1 ملغ / مل في محلول ملحي مخزن بالفوسفات (PBS)). احتضان لمدة لا تقل عن 1 ساعة (أو بين عشية وضحاها) في RT. لمنع التبخر ، ضع غرفة PDMS في صندوق رطب (على سبيل المثال ، صندوق طرف فارغ به ماء في المقصورة السفلية وغرفة PDMS على منصة تثبيت البقشيش).
- حقن 20 ميكرولتر من بذور سطيفي أكتين 100 جزء في المليون (في المخزن F-buffer، انظر الجدول 1 والجدول 2). انتظر لمدة لا تزيد عن 1 دقيقة. اضبط تركيز البذور وتوقيتها لضبط كثافة سطح البذور ، عالية بما يكفي للإحصاءات الكبيرة ومنخفضة بما يكفي لعدم تداخل الخيوط.
ملاحظة: بدلا من ذلك، في حالة عدم توفر بذور سبكترين-أكتين، استخدم شرائح خيوط قصيرة تعمل بالبيوتين سيتم تجميدها على غطاء مغلف بالستربتافيدين 9,10. - [اختياري] حقن 20 ميكرولتر من 5٪ من ألبومين مصل البقر (BSA) في F-buffer. اتركيه في RT لمدة 10 دقائق.
- [اختياري] حقن 20 ميكرولتر من 1 ملغ / مل β الكازين في F-buffer. اتركيه في RT لمدة 10 دقائق.
ملاحظة: اتبع الخطوتين 4.3 و/أو 4.4 لزيادة تخميل الغرفة. يعتمد اختيار التخميل على البروتينات المستخدمة ولا يعمل بشكل جيد على قدم المساواة مع جميع ABPs. عند استخدام الأكتين وحده ، يكون PLL-PEG أو BSA كافيا.
5. قم بتوصيل جهاز الموائع الدقيقة
ملاحظة: استخدم نظاما للموائع الدقيقة قائما على الضغط مع ما يصل إلى أربع قنوات للتحكم في التدفقات في غرفة الموائع الدقيقة (الشكل 1 ألف، انظر جدول المواد). لتجنب تشكل الفقاعات في أنابيب الموائع الدقيقة وزعزعة استقرار التدفق ، قم بإزالة جميع الحلول. ضع 5 مل من dH20 و 10 مل من مخزون F-buffer في مجفف فراغ متصل بمضخة تفريغ (فراغ نهائي <250 مللي بار) وقم بالتخلص من الغاز لمدة 1 ساعة على الأقل في RT.
- شطف مداخل + أنابيب مخرج مع dH2O (500 ميكرولتر ، 300 مللي بار).
- املأ جميع أنابيب الخزان سعة 2 مل (انظر جدول المواد) ب 300 ميكرولتر من المخزن المؤقت F. اضبط الضغط على 300 مللي بار واترك خمس إلى ثماني قطرات تضيع. كرر ذلك لكل قناة واضبط الضغط على 0.
- قم بتوصيل المخرج وشطف الغرفة على نطاق واسع.
- اضبط ضغط أنبوب الخزان 4 (المخرج) على 50 مللي بار. بمجرد خروج قطرة من نهاية الأنابيب ، قم بتوصيل الأنبوب بمخرج غرفة PDMS. يملأ السائل في الغرفة ويخرج من جميع المداخل.
- [اختياري] إذا تم تخميل الغرفة مباشرة (القسم 4) ، فاضبط الضغط على 100 مللي بار لشطف الغرفة ب 50-100 ميكرولتر من F-buffer (3-5 دقائق). قم بإزالة السائل الزائد عند المداخل باستخدام منديل تنظيف.
- اضبط الضغط على 20 مللي بار.
- قم بتوصيل المداخل.
- اضبط الضغط لأنبوب الخزان من 1 إلى 50 مللي بار. لتجنب إدخال فقاعات الهواء ، تأكد من خروج قطرة من الأنابيب ومدخل PDMS.
- قم بتوصيل الأنبوب بالمدخل 1 (تندمج القطرتان عند الاتصال). اضبط الضغط على 30 مللي بار.
- كرر الخطوات 5.4.1-5.4.2 لتوصيل المدخلين 2 و3.
- اضبط ضغط جميع المداخل على 20 مللي بار وضغط المخرج على 0 مللي بار. تأكد من أن معدلات التدفق في المداخل متساوية تقريبا (راجع قسم استكشاف الأخطاء وإصلاحها).
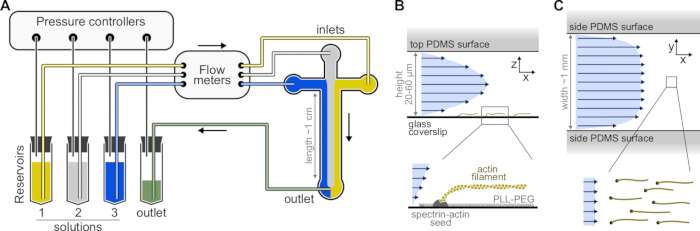
الشكل 1: حقن المحاليل من خلال غرفة الموائع الدقيقة . (أ) الإعداد القياسي للموائع الدقيقة لتجارب خيوط الأكتين المفردة. يتم دفع محاليل البروتين ، الموضوعة في الخزانات 1-3 ، إلى الغرفة عن طريق ضبط الضغط في مرحلة الغاز. يتم قياس معدلات التدفق المتولدة بواسطة عدادات التدفق. داخل غرف الموائع الدقيقة ، لا تختلط المحاليل وتشغل مساحة اعتمادا على الضغوط النسبية المطبقة (هنا ، ضغط متساو على جميع المداخل). الأبعاد النموذجية: تحتوي أنابيب الخزان على ما يصل إلى 2 مل من المحلول. تربط أنابيب PEEK (قطرها الداخلي 0.25 مم) الخزانات بمقاييس التدفق (بعد 10 سم من الأنابيب) ثم بغرفة PDMS (بعد 70 سم أخرى). تستخدم أنابيب السيليكون وقارنات أنابيب الفولاذ المقاوم للصدأ لتوصيل أنابيب PEEK بمداخل PDMS. يبلغ ارتفاع القناة الموائع الدقيقة الرئيسية 20-60 ميكرومتر ، بعرض حوالي 1 مم وطول 1 سم. (ب، ج) ملامح التدفق داخل غرفة الموائع الدقيقة. (B) يولد السائل مظهرا مكافئا عبر ارتفاع الغرفة: v(z) = 6z(h-z)R/h3w، حيث h وw هما ارتفاع الغرفة وعرضها، وR هو معدل التدفق الكلي. القاع: خيوط أكتين واحدة مبلمرة من بذور الطيف والأكتين المثبتة على السطح. (ج) عندما يكون عرض الغرفة أكبر بكثير من ارتفاعها ، يكون التدفق منتظما تقريبا عبر الغرفة ، باستثناء أسطح PDMS ، حيث يذهب إلى الصفر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. تكوين الإعداد مع معدلات التدفق القياسية
ملاحظة: يسمح نظام الضغط الذي يتم التحكم فيه بواسطة الكمبيوتر بضبط سهل ودقيق لضغوط جميع المداخل / المخارج المتصلة بغرفة PDMS ، وبالتالي التحكم في معدلات التدفق الوارد والصادر. يمكن حفظ التكوينات المعدة مسبقا وتشغيلها / إيقاف تشغيلها بنقرة ماوس واحدة. فيما يلي التكوينات الموصى بها (ما لم ينص على خلاف ذلك ، يتم ضبط ضغط المخرج على 0 مللي بار). انظر الجدول 3 للاطلاع على معدلات التدفق المتوقعة لهذه التكوينات المعدة مسبقا. يجب ضبط الضغوط المشار إليها هنا اعتمادا على هندسة الغرفة وتكوين النظام.
-
التغيير: استخدم هذا الإعداد المسبق عند تغيير خزان (خزان) واحد أو أكثر. يخلق تدفقا خفيفا للخلف في الأنابيب ذات الأهمية لمنع إدخال الفقاعات.
- اضبط جميع ضغوط المدخل على 12 مللي بار وضغط المخرج على 5 مللي بار (الشكل 2B).
-
التدفق العالي "الكل": استخدم هذا الإعداد المسبق لحقن ثلاثة حلول بسرعة بالتوازي. سوف يصلون إلى الغرفة في غضون 4 دقائق.
- اضبط جميع ضغوط المدخل على 150 مللي بار.
-
التدفق العالي "x": استخدم هذا الإعداد المسبق لحقن محلول بسرعة. وسيصل إلى الغرفة في غضون 3 دقائق (الشكل 3A-C).
- اضبط ضغط المدخل "x" على 150 مللي بار (~ 15 ميكرولتر / دقيقة). يتم ضبط الضغط في المداخل الأخرى إلى حوالي 100 مللي بار ، بحيث يكون معدل التدفق الناتج في هذه المداخل ~ 500 nL / min.
-
منتصف التدفق "الكل": استخدم هذا الإعداد المسبق لإيقاف النظام مؤقتا.
- اضبط جميع المداخل على 20 مللي بار (الشكل 2A).
-
منتصف التدفق "x": استخدم هذا الإعداد المسبق للسماح للحل "x" بملء معظم عرض القناة الرئيسية (انظر الشكل 2C ، D) ، مع تقييد حلول المدخل الأخرى على جوانب القناة. وبالتالي فإن خيوط الأكتين في الغرفة ستتعرض للحالة الكيميائية الحيوية التي يفرضها الحل "x" فقط.
- اضبط ضغط المدخل "x" على 12 مللي بار. اضبط الضغط في المداخل الأخرى واضبط على ~ 9 مللي بار ، بحيث تكون معدلات التدفق الخاصة بها ~ 150 نانولتر / دقيقة.
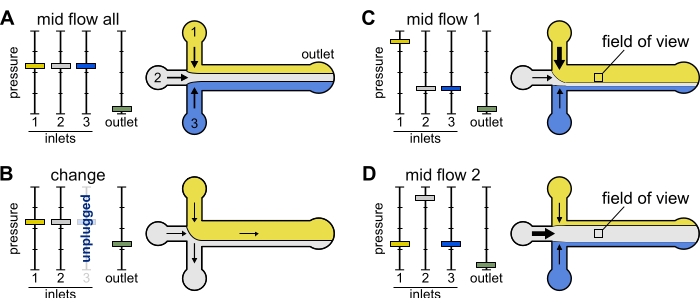
الشكل 2: يتحكم الضغط المطبق على كل خزان في التقسيم / التوزيع المكاني للمحاليل داخل غرفة الموائع الدقيقة. (أ) مع الضغط المتساوي المطبق على الخزانات ، يشغل كل محلول ثلث الغرفة. (ب) عند تغيير أنبوب الخزان (هنا الخزان 3) ، ينخفض الضغط الفعال إلى الصفر ، مما يخلق تدفقا عكسيا. (ج، د) زيادة الضغط النسبي على أحد الخزانات يسمح بتعرض السطح الزجاجي لمحلول واحد. يمكن أن يتعرض مجال الرؤية في منتصف الغرفة بالتتابع للحلين 1 و 2 بالتناوب بين التكوين Mid Flow 1 (C) و Mid Flow 2 (D). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. تغيير الحل "x"
ملاحظة: كما هو موضح في الشكل 3A-C ، من المهم أن نضع في اعتبارنا أن المحاليل تستغرق دقائق للتدفق من أنبوب الخزان إلى القناة الرئيسية للغرفة. يتم فرض هذا الحد الأدنى من الوقت "الميت" من خلال حجم السائل الموجود في الأنابيب وملف تعريف التدفق داخل الأنابيب (الشكل 3A-C).
- تحضير 200-300 ميكرولتر من المحلول في أنبوب خزان جديد. اضبط الضغط على تغيير الإعداد (انظر القسم 6).
- قم بفك أنبوب خزان المدخل "x". سوف يتدفق المحلول الموجود في الأنابيب ببطء إلى الوراء ، من الغرفة إلى طرف الأنابيب الحر. يصبح معدل التدفق المقاس سالبا (الشكل 2B).
- بمجرد أن تتشكل قطرة صغيرة عند طرف الأنابيب ، قم بالمسمار في الأنبوب الجديد باستخدام المحلول الطازج. بمجرد تشديد الأنبوب بشكل صحيح على نظام الضغط ، يعود معدل تدفق المدخل إلى إيجابي.
- اضبط إعداد الضغط على التدفق العالي "x".
- اعتمادا على تكوين الموائع الدقيقة وهندسة الغرفة ، انتظر لمدة 3-5 دقائق حتى يملأ المحلول الأنابيب بالكامل ويصل إلى الغرفة.
- [اختياري] اتبع هذه العملية عن طريق قياس الزيادة في التألق بمرور الوقت (الشكل 3C).
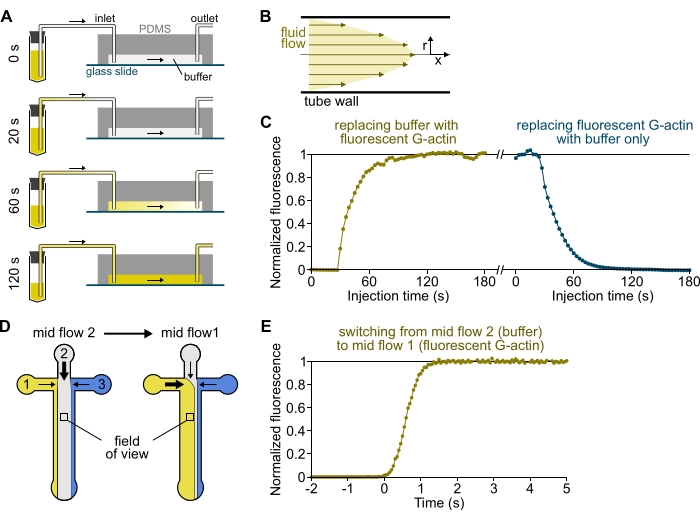
الشكل 3: تأخر وصول المحاليل من الخزانات إلى غرفة PDMS والتغير السريع في الظروف البيوكيميائية. (أ-ج) تأخر وصول المحاليل من الخزانات إلى غرفة PDMS. (أ) اعتمادا على هندسة الحجرة وطول الأنبوب والضغط المطبق عند المدخل (المداخل) ، فإن استبدال محلول بآخر ليس فوريا. بعد تغيير أنبوب الخزان إلى أنبوب يحتوي على محلول فلورسنت (0 دقيقة) ، يملأ المحلول تدريجيا الأنابيب (0.4 دقيقة) وغرفة PDMS (1-2 دقيقة). يتم إعطاء توقيت إرشادي لضغط مطبق 150 مللي بار ، وأنابيب PEEK 80 سم ، وغرفة PDMS بعرض 1600 ميكرومتر ، وارتفاع 20 ميكرومتر. (ب) يولد ملف تعريف التدفق المكافئ داخل أنابيب PEEK تدرجا فعالا للتألق على طول المظهر الشعاعي للأنابيب وداخل الغرفة (انظر أيضا الشكل 1B). (ج) يمكن تحديد تأخر وصول المحاليل كميا عن طريق قياس إشارة التألق في الخلفية في الغرفة كدالة للوقت. الظروف التجريبية: يتم حقن 0.5 ميكرومتر 10٪ من الأكتين المسمى Alexa-568 ب 150 مللي بار من خلال مقياس تدفق وأنابيب PEEK 80 سم. (دال ، ه) التغير السريع في الظروف البيوكيميائية. (د) نمط الحلول الواردة في حالتين متوسطتي التدفق . (ه) زيادة في التألق في الخلفية كقراءة لتركيز الأكتين. يتم تعيين الوقت t = 0 مع بداية زيادة التألق. الحل 1: 0.5 ميكرومتر 10٪ من اليكسا 488 المسمى G-actin ، الحل 2: F-buffer. (ج، هاء) غرفة PDMS: ارتفاع 20 ميكرومتر وعرض 1600 ميكرومتر. تم قياس شدة التألق ، ~ 2 ميكرومتر فوق السطح ، عن طريق حساب متوسط الإشارة على مجال الرؤية الكامل ، وتطبيعه إلى 0 في حالة عدم وجود فلوروفور و 1 عند أقصى كثافة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
8. تجربة الخيوط المفردة الأساسية: إزالة البلمرة من الأدينوسين ثنائي الفوسفات (ADP) - الأكتين الشائك
ملاحظة: يفترض هذا القسم وجود غرفة غير عاملة (القسم 5 فقط). إذا كانت الغرفة تعمل مباشرة (القسم 4) ، فابدأ في الخطوة 8.4.
- تشغيل السطح مع بذور خيوط الأكتين:
- تغيير الحل من 3 إلى 200 ميكرولتر من بذور الطيف الأكتين 50 جزء في المليون11 في المخزن المؤقت F (انظر القسم 7).
ملاحظة: بدلا من ذلك، إذا لم تكن بذور ستيكترين-أكتين متوفرة، يمكن للمرء استخدام شرائح خيوط قصيرة تعمل بالبيوتين والتي سيتم تجميدها على غطاء مغلف بالستربتافيدين (راجع 9,10 للحصول على التفاصيل). - حقن لمدة 2 دقيقة مع تدفق عالية 3.
ملاحظة: اضبط التركيز والوقت اعتمادا على كثافة البذور النهائية.
- تغيير الحل من 3 إلى 200 ميكرولتر من بذور الطيف الأكتين 50 جزء في المليون11 في المخزن المؤقت F (انظر القسم 7).
- التخميل السطحي:
- تغيير أنبوب 3 مع 300 ميكرولتر من 5٪ BSA في F-buffer.
- حقن لمدة 5 دقائق في High Flow 3 ، تليها 5 دقائق في Mid Flow 3. خلال هذه الخطوة الثانية ، قم بتقليل الضغط في القنوات 1 و 2 إلى 7-8 مللي بار للحصول على تدفق مضاد ~-100 nL / min ، بحيث يتم تخميل أسطح الغرفة بأكملها BSA.
ملاحظة: نظرا لأن حل BSA أكثر لزوجة ، فيجب تعديل الضغوط وفقا لذلك.
- قم بتغيير الأنبوب 3 إلى F-buffer وشطف القناة (5 دقائق ، تدفق عالي 3).
- قم بإعداد المحاليل التالية 200-300 ميكرولتر ، وجميع البروتينات التي يتم تخفيفها في F-buffer:
مدخل 1 ، محلول البلمرة: 1 ميكرومتر 10 ٪ اليكسا 488 المسمى G-actin ، 1 ميكرومتر profilin (الجدول 1).
مدخل 2 ، حل الشيخوخة: 0.15 ميكرومتر 10 ٪ اليكسا 488 المسمى G-actin.
مدخل 3، محلول إزالة البلمرة: F-buffer فقط.
ملاحظة: يستخدم البروفيلين هنا لمنع النوى التلقائي والحفاظ على تركيز ثابت من G-actin. - تغيير الأنابيب من 1 إلى 3 (القسم 7). حقن باستخدام عالية التدفق كل مسبقا لمدة 3-4 دقائق. وقد ملأت الحلول الثلاثة الآن أنابيب PEEK ووصلت إلى الغرفة (الشكل 3A). يمكن أن يتعرض السطح الزجاجي لأي محلول مدخل دون وقت ميت (<1 ثانية ، الشكل 3D ، E).
- قم بتشغيل المجهر. اضبط الإعدادات: ليزر الإثارة 150 ميجاوات 488 نانومتر بقوة 10٪ -20٪ ، وقت تعرض الكاميرا 100-200 مللي ثانية ، عمق اختراق TIRF 200-300 نانومتر ، هدف 60x. يتم استخدام هذه الإعدادات في جميع أنحاء المخطوطة.
- بلمرة الخيوط (الشكل 4 أ):
- اضبط إعداد الضغط على Mid Flow 1 لمدة 10 دقائق تقريبا.
- [اختياري] بلمرة قياسية (1 إطار / 20 ثانية ، TIRF). يجب أن تتبلمر الخيوط عند حوالي 10 وحدات فرعية / ثانية (فرعية / ثانية) 1,12.
- شيخوخة الخيوط: اضبط إعداد الضغط على Mid Flow 2 لمدة 15 دقيقة. عند التركيز الحرج ، 0.15 ميكرومتر G-actin ، سيظل طول الخيوط ثابتا ، وستتحول الخيوط إلى >99٪ ADP-F-actin4.
- إزالة البلمرة (الشكل 4 ألف):
- ابدأ الاكتساب في 1 إطار / 5 ثانية ، في وضع epifluorescence. نظرا لوجود خلفية فلورية منخفضة للغاية في القناتين 2 و 3 ، فليس من الضروري استخدام TIRF.
- بعد إطار إلى إطارين، قم بالتبديل إلى Mid Flow 3. يجب أن تزول الخيوط من البلمرة عند حوالي 10 فرعيات / ثانية (المرجع12).
- لإعادة تعيين التجربة ، قم بكسر جميع الخيوط المصنفة بالفلورسنت عن طريق تعريضها باستمرار لليزر بأقصى طاقة لمدة 2 دقيقة تقريبا. لاختبار ظروف مختلفة ، قم بتغيير المحاليل 1 أو 2 أو 3 وحقنها (تدفق عالي ، 3-4 دقائق). كرر الخطوات 8.7-8.9.
9. تجارب أخرى أحادية الخيط
- اختبار تفاعلات برامج الجسر الأكاديمي مع F-actin
ملاحظة: تم استخدام الموائع الدقيقة بنجاح لتحديد نشاط العديد من ABPs الملزمة جانبيا، مثل cofilin و tropomyosinو Arp2/3. وفقا للبروتوكول الوارد في القسم 8:- تغيير القناة 3 إلى ABP الفلورسنت من الاهتمام في F-buffer. حقن (تدفق عالي 3 ، 3 دقائق).
- بلمرة الخيوط: اضبط إعداد الضغط على منتصف التدفق 1 لمدة 10 دقائق.
- ربط ABP: ابدأ الاستحواذ باستخدام TIRF. اضبط معدل الإطارات اعتمادا على تركيز ABP. بعد 1-2 إطار، قم بالتبديل إلى منتصف التدفق 3.
ملاحظة: اعتمادا على برنامج الجسر الأكاديمي، قد يكون من الممكن أيضا التبديل بسرعة (على سبيل المثال، لأقل من 5 ثوان) إلى Mid Flow 2 لتقليل تألق الخلفية عند التقاط صورة. - إلغاء ربط ABP: أثناء مواصلة عملية الاستحواذ ، قم بالتبديل إلى Mid Flow 2.
- البلمرة مع الفورمين في النهاية الشائكة الحرة
ملاحظة: ثبت أن الفورمينات تؤثر على بلمرة نهاية الخيوط الشائكة. يتم تكييف الموائع الدقيقة بشكل خاص لقياس معدلات ربط الفورمين وغير الملزمة وتأثيرها على استطالة الخيوط.- قم بإعداد الحلول التالية:
القناة 1: فورمين 10 نانومتر في المخزن المؤقت F (الجدول 1).
القناة 2: 1 ميكرومتر 10٪ اليكسا 488 المسمى G-الأكتين، 4 ميكرومتر بروفيلين.
القناة 3: F-buffer. - تغيير الأنابيب 1 و 2 و 3 (القسم 7). حقن باستخدام عالية التدفق كل مسبقا لمدة 3-4 دقائق.
- بدء بلمرة الخيوط: اضبط إعداد الضغط على منتصف التدفق 2 لمدة دقيقتين.
- ربط الفورمين بنهاية الخيوط الشائكة: اضبط إعدادات الضغط على Mid Flow 1 لمدة 30 ثانية.
- البلمرة بوساطة فورمين: اضبط إعداد الضغط على منتصف التدفق 2. مع وجود الفورمين mDia1 في نهايتها الشائكة ، يجب أن تتبلمر الخيوط عند حوالي 50 sub / s13,14,15.
- قم بإعداد الحلول التالية:
- البلمرة / إزالة البلمرة من الفورمين المثبتة على السطح
ملاحظة: تبين أن معدلات البلمرة وإزالة البلمرة للنهايات الشائكة المزينة بالفورمين تعتمد على التوتر المطبق على الخيوط. في الموائع الدقيقة ، يولد احتكاك تدفق السائل على طول جانب الخيوط توترا يتناسب مع طول الخيوط ومعدل التدفق14,16.- استخدم الطريقة الواردة في القسم 8 الموضح أعلاه، واستبدل الخطوات 8.1 و8.2 و8.3 لتخميل السطح بما يلي:
- تغيير أنبوب 3 إلى 1 ميكروغرام / مل المضادة له الجسم المضاد في F-العازلة. حقن لمدة 2 دقيقة مع تدفق عالية 3.
- تغيير أنبوب 3 مع 5٪ BSA في F-العازلة. حقن لمدة 5 دقائق في High Flow 3 ، تليها 5 دقائق في Mid Flow 3. خلال هذه الخطوة الثانية ، قم بتقليل الضغط في القنوات 1 و 2 إلى 7-8 مللي بار للحصول على تدفق مضاد ~-100 nL / min بحيث يتم تخميل أسطح الغرفة بأكملها BSA.
- تغيير أنبوب 3 إلى 100 نانومتر فورمين له الموسومة في F-buffer. حقن لمدة 5 دقائق مع تدفق عالية 3. تغيير الأنبوب 3 مع F-العازل. حقن لمدة 5 دقائق مع تدفق عالية 3 لضمان عدم بقاء الفورمينات في الأنابيب.
- تحضير وحقن المحاليل التالية (200-300 ميكرولتر لكل منها ، في F-buffer):
القناة 1: 1 ميكرومتر 10٪ اليكسا 488 المسمى G-actin.
القناة 2: 1 ميكرومتر غير المسمى G-actin ، 4 ميكرومتر profilin.
القناة 3: F-buffer فقط. - نواة الخيوط: تعريض الفورمينات المثبتة على السطح إلى G-actin (إعداد منتصف التدفق 1).
- بلمرة الخيوط: تعريض الغرفة للبروفيلين أكتين باستخدام Mid Flow 2.
- بدء الاستحواذ: 1 إطار / 2 ثانية ، epifluorescence. مع الفورمين mDia1 ، يجب أن تتبلمر الخيوط عند 50-80 sub / s ، اعتمادا على طول الخيوط ومعدل التدفق14.
- إزالة بلمرة الخيوط: بدء الاكتساب (1 إطار / 4 ثانية ، epifluorescence). بعد 1-2 إطار، قم بتعريض الخيوط للمخزن المؤقت F-buffer، Mid Flow 3. مع الفورمين mDia1 ، يجب أن تزول الخيوط من البلمرة عند 5-15 sub / s ، اعتمادا على طول الخيوط ومعدل التدفق14.
- استخدم الطريقة الواردة في القسم 8 الموضح أعلاه، واستبدل الخطوات 8.1 و8.2 و8.3 لتخميل السطح بما يلي:
- خيوط الأكتين مع شرائح غير مصنفة
ملاحظة: يؤدي وضع العلامات الفلورية على الأكتين إلى إنشاء العديد من القطع الأثرية ، مثل التوقف المؤقت أثناء إزالة البلمرة17 وتغيير ربط التروبوميوسين18. الحل البديل لهذه القطع الأثرية هو استخدام الموائع الدقيقة لتجميع الخيوط التي تعرض شرائح غير مسماة.- تحضير وحقن المحاليل التالية (200-300 ميكرولتر في F-buffer):
القناة 1: 1 ميكرومتر غير المسمى G-actin ، 1 ميكرومتر profilin.
القناة 2: 0.3 ميكرومتر 10٪ اليكسا 488 المسمى G-actin. - يعرض السطح بالتتابع للقناة 2 (5 دقائق) والقناة 1 (10 دقائق) والقناة 2 (15 دقيقة) لإنشاء مقاطع ADP-actin غير مصنفة مع شرائح موسومة بالفلورسنت في كل نهاية.
- تحضير وحقن المحاليل التالية (200-300 ميكرولتر في F-buffer):
- خيوط ملحية مثبتة في النهاية مع جيلسولين
ملاحظة: مع بذور الطيف الأكتين، تتبلمر الخيوط في نهايتها الشائكة الحرة بينما تستقر النهاية المدببة بواسطة بذور سبكترين-أكتين. البديل هو تثبيت الخيوط باستخدام غطاء شائك مثل الجيلسولين.- قم بإعداد محلول F-actin من 4 μM 10٪ Alexa-488 المسمى G-actin في 20 ميكرولتر من F-buffer. دع الأكتين ينوي تلقائيا ويتبلمر في RT لمدة 30 دقيقة على الأقل على مقاعد البدلاء. لف الأنبوب بورق الألومنيوم لحمايته من الضوء.
- وفي الوقت نفسه ، قم بإعداد غرفة الموائع الدقيقة وتخميل السطح بمزيج من 5٪ BSA و 1٪ بيوتين-BSA (انظر الخطوة 8.2).
- اشطف القناة 3 باستخدام F-buffer (2 دقيقة عند التدفق العالي 3). حقن 10 ميكروغرام / مل نيوترافيدين في F-buffer (4 دقائق في High Flow 3).
- تغيير الأنابيب إلى:
القناة 1: 10 نانومتر البيوتين-جيلسولين (الجدول 1).
القناة 2: F-buffer.
القناة 3: 0.4 ميكرومتر F-actin المبلمر مسبقا. - حقن جميع الحلول معا باستخدام إعداد High Flow All لمدة 3 دقائق.
- تعريض الغرفة بأكملها للجيلسولين (منتصف التدفق 1 ، 30 ثانية).
- قم بتوصيل الخيوط بالسطح (التدفق المنخفض 3: القناة 3 عند 3 مللي بار ، القناتان 1 و 2 عند ~ 2 مللي بار ، لمدة دقيقتين تقريبا).
- [اختياري] إذا كانت كثافة الخيوط منخفضة جدا، كرر الخطوتين 9.5.6 و9.5.7.
- إزالة البلمرة ذات النهاية المدببة: بدء الاكتساب (1 إطار / 30 ثانية ، التألق الفائق). بعد 1-2 إطار، قم بتعريض الخيوط للمخزن المؤقت فقط، Mid Flow 2. يجب أن تزيل الخيوط من البلمرة عند حوالي 0.2 sub / s.
10. تشكيل حزمة خيوط ناجمة عن اللفافة وتفكيكها بواسطة ADF / cofilin
ملاحظة: لتشكيل حزم خيوط الأكتين ، تأكد من وجود كثافة بذور خيوط عالية بما فيه الكفاية على سطح الغرفة. عند التعرض لبروتين الفاتنة ، فإن الخيوط المجاورة التي تتقلب أفقيا ستكون مرتبطة ديناميكيا بواسطة بروتينات الفاشية. نظرا لأن اللفافة تتفكك بسرعة من جانب الخيوط19 ، يجب أن يكون الفافة موجودا باستمرار في الحل المتدفق الرئيسي من أجل الحفاظ على تجميع الخيوط.
- اتبع الخطوات من 8.1 إلى 8.3.
- قم بإعداد الحلول التالية (200-300 ميكرولتر في المخزن المؤقت F):
القناة 1 ، محلول البلمرة: 1 ميكرومتر 10٪ Alexa-488 المسمى G-actin ، 1 ميكرومتر profilin.
القناة 2 ، حل التجميع: 200 نانومتر فاكن (الجدول 1) ، 0.15 ميكرومتر 10٪ Alexa-488 المسمى G-actin.
القناة 3 ، حل التفكيك: 200 نانومتر ADF / cofilin (الجدول 1) ، 100 نانومتر اللفافة ، 0.15 ميكرومتر 10٪ Alexa-488 المسمى G-actin. - تغيير الأنابيب من 1 إلى 3 (القسم 7). حقن باستخدام الإعداد المسبق عالي التدفق للجميع ، لمدة 3-4 دقائق.
- بلمرة الخيوط: اضبط إعداد الضغط على منتصف التدفق 1 لمدة 10 دقائق تقريبا. يمكن تصوير البلمرة باستخدام TIRF.
- تجميع الخيوط (الشكل 4C): بدء الحصول على الصورة (1 إطار / 5 ثانية ، epifluorescence). بعد 1-2 إطار، اضبط إعداد الضغط على منتصف التدفق 2 وراقب تجميع الخيوط.
- تجزئة الحزمة: بدء الحصول على الصورة (1 إطار/5 ثوان، التألق). بعد 1-2 إطار، اضبط إعداد الضغط على منتصف التدفق 3 وراقب التفكيك الناجم عن الكوفيلين لكل من الخيوط المفردة والحزم.
11. إجراء تنظيف جهاز الموائع الدقيقة
ملاحظة: لتجنب أي تلوث من تجربة إلى أخرى، من الضروري تنظيف جميع الأنابيب وعدادات التدفق على نطاق واسع وتجفيفها بالكامل بعد كل تجربة.
- افصل جميع الأنابيب عن غرفة PDMS وتخلص من الغرفة.
- لتنظيف أنابيب PEEK وعدادات التدفق ، قم بربط نهايات الأنابيب في أنبوب بلاستيكي فارغ سعة 15 مل وحقن المحاليل التالية بأقصى ضغط حتى يصبح الخزان فارغا تقريبا:
400 ميكرولتر من F-buffer.
400 ميكرولتر من 0.5 M NaOH.
400 ميكرولتر من الماء النقي.
200 ميكرولتر من الأيزوبروبانول. - استبدله بخزان فارغ ونفخ الهواء حتى تجف الأنابيب تماما (~ 2-4 دقائق ، أقصى ضغط).
12. تحليل الصور
ملاحظة: بينما تركز هذه المخطوطة على طريقة تجميع خيوط الأكتين المفردة ومعالجتها وتصورها في الموائع الدقيقة ، يتم توفير طريقة موجزة لتحليل الأفلام المكتسبة هنا. يتم إجراء التحليل على صور 16 بت، باستخدام ImageJ، بعد القسم 8.
- معالجة الصور هي الحد الأدنى:
- استيراد مكدس صور البلمرة أو إزالة البلمرة.
- [اختياري] تجانس كثافة الصورة باستخدام وظيفة طرح الخلفية (الإعدادات الافتراضية (أي "نصف قطر الكرة المتدحرجة" = 50 بكسل)). هذا مفيد بشكل خاص إذا تغير التألق في الخلفية أثناء الفيلم أو إذا كانت إضاءة التألق غير متجانسة على مجال الرؤية.
- اضبط السطوع والتباين (الخلفية بالقرب من الصفر ، الخيوط بالقرب من الحد الأقصى).
- إنشاء كيموجراف خيط:
- حدد خيطا لا يتوقف مؤقتا أو ينفصل أو ينفصل. لا تحدد بناء على سلوك خلاف ذلك. ارسم خطا 1-2 بكسل أعلاه (أداة الخط المستقيم). احفظ رقم الخيوط (أضف في مدير عائد الاستثمار).
- تطبيق وظيفة Reslice (عدد الشرائح: 5 بكسل). حساب الحد الأقصى للكثافة (الدالة Zprojection).
- قياس معدل البلمرة / إزالة البلمرة:
- على الكيموغراف ، ارسم خطا على طول نهاية الخيوط الشائكة (أداة الخط المستقيم ، الشكل 4A). قياس عرض الخط وارتفاعه ( قياس الوظيفة).
- كرر الخطوات 12.2-12.3 على خيوط متعددة. حساب معدلات البلمرة/إزالة البلمرة (الشكل 4 ألف):
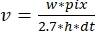 ، حيث v هو المعدل (في sub/s)، w عرض الخط (بكسل)، pix حجم البكسل (nm)، h ارتفاع الخط (الإطارات)، وdt الوقت بين الإطارات (بالثانية). هنا ، يتوافق 2.7 نانومتر مع المساهمة الفعالة لوحدة فرعية من الأكتين في طول الخيوط.
، حيث v هو المعدل (في sub/s)، w عرض الخط (بكسل)، pix حجم البكسل (nm)، h ارتفاع الخط (الإطارات)، وdt الوقت بين الإطارات (بالثانية). هنا ، يتوافق 2.7 نانومتر مع المساهمة الفعالة لوحدة فرعية من الأكتين في طول الخيوط.
النتائج
بالنسبة لجميع التجارب الموصوفة أعلاه ، يجب أن تكون خيوط الأكتين المصنفة بالفلورسنت مرئية بوضوح ، مع تباين جيد ، مما يدل على التألق المنخفض للخلفية من السطح (الشكل 4 ، انظر الملف التكميلي 1 لاستكشاف الأخطاء وإصلاحها للمشكلات الشائعة). يجب ألا تلتصق خيوط الأكتين أيض?...
Discussion
بالمقارنة مع الطرق القياسية أحادية الخيط حيث يتم تثبيت خيوط الأكتين على السطح بواسطة نقاط متعددة على طولها أو الحفاظ عليها بالقرب منه بواسطة عامل ازدحام مثل ميثيل السليلوز ، توفر الموائع الدقيقة عددا من المزايا. نظرا لأن التفاعلات مع السطح ضئيلة ، فإن التوقفات الاصطناعية التي يمكن أن تحد...
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
ونحن ممتنون ل B. Ladoux و R.-M. مختبر Mège لاستخدام معدات التنظيف بالأشعة فوق البنفسجية الخاصة بهم ، و J. Heuvingh و 0. دو روور للتدريب الأولي الذي تلقيناه على إعداد القوالب على رقائق السيليكون وتقديم نصائح حول الموائع الدقيقة. نحن نقر بالتمويل المقدم من منحة مجلس البحوث الأوروبي StG-679116 (إلى A.J.) والوكالة الوطنية للبحث العلمي Muscactin و Conformin (إلى G.R.-L).
Materials
| Name | Company | Catalog Number | Comments |
| β-Casein | Merck | C6905 | Used at 8 mg/mL |
| Biopsy punch (with plunger) | Ted Pella | 15115-2 | ID 0.75 mm, OD 1.07 mm |
| Biotin-BSA | Merck | A8549 | Used at 1 mg/mL |
| BSA | Merck | A8022 | Used at 50 mg/mL |
| Coverslip Mini-Rack Teflon holder | Invitrogen | C14784 | for 8 coverslips |
| Coverslips 22x40mm Thickness #1.5 | Menzel Gläser | 631-1370 | |
| DABCO | Merck | D27802 | component in f-buffer |
| DTT | Euromedex | EU0006-D | component in f-buffer |
| Ester NHS Alexa Fluor 488 | Invitrogen | A20000 | Fluorophore for actin labeling on Lys328. |
| EZ-Link Sulfo-NHS-Biotin | Thermo Scientific | 21338 | To biotinylate actin on Lys328 |
| Hellmanex III | Hellma | 9-307-011-4-507 | Glass cleaning detergent |
| ImageJ | NIH | N/A | open source software |
| Laboport | KNF | 811kn.18 | vacuum pump (ultimate vacuum: 240 mbar) |
| Magic invisible tape | Scotch | 7100024666 | standard transparent office tape |
| Micrewtube | Simport | T341-6T | 2 mL microfluidic reservoir tubes |
| Microfluidic device Part 1: Flow Unit S | Fluigent | FLU-S-D-PCKB | Flowmeter |
| Microfluidic device Part 2: Fluiwell-4C-2 mL | Fluigent | 14002001PCK | Reservoir holder |
| Microfluidic device Part 3: MFCS-EZ | Fluigent | EZ-11000001 EZ-00345001 | Pressure controller |
| Model 42 - UVO-Cleaner | Jelight Inc. | 42-220 | Ultraviolet cleaner |
| N6-(6-Aminohexyl)-ATP-ATTO-488 | Jena Bioscience | NU-805-488 | ATP-ATTO used to label actin |
| neutravidin | Thermo Scientific | 31000 | |
| PLL-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | Use at 1 mg/mL in PBS. |
| Polydimethylsiloxane (PDMS) Sylgard 184 Silicon Elastomer | Dow Corning | 1673921 | Contains PDMS base and curing agent |
| Polyetheretherketone (PEEK) tubing | Merck | Z226661 | “Blue” : I.D. = 0.25 mm |
| Safety blow gun | Coilhose Pneumatics | 700-S | filtered air |
| Silicon tubing | VWR | 228-0701P | connect PEEK to coupler |
| Stainless steel catheter coupler | Prime Bioscience | SC22/15 | Inserted into PDMS inlets and outlet to connect to PEEK tubing |
| Thermoplastic film | Sigma Aldrich | PM996 | Standard "parafilm" |
| Ultrapure ethanol | VWR | 64-17-5 | |
| Ultrasonic cleaning bath | VWR | USC200TH | To accomodate 1 L beakers |
| Vacuum dessicator | SP Bel-Art | F42022-0000 | to degas the PDMS or solutions |
References
- Wioland, H., Jégou, A., Romet-Lemonne, G. Celebrating 20 years of live single-actin-filament studies with five golden rules. Proceedings of the National Academy of Sciences of the United States of America. 119 (3), 2109506119 (2022).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophysical Journal. 88 (2), 1387-1402 (2005).
- Brewer, L. R., Bianco, P. R. Laminar flow cells for single-molecule studies of DNA-protein interactions. Nature Methods. 5 (6), 517-525 (2008).
- Jégou, A., et al. Individual actin filaments in a microfluidic flow reveal the mechanism of ATP hydrolysis and give insight into the properties of profilin. PLoS Biology. 9 (9), 1001161 (2011).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal x-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133 (2018).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments: JoVE. (86), e50549 (2014).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Zimmermann, D., Morganthaler, A. N., Kovar, D. R., Suarez, C. In vitro biochemical characterization of cytokinesis actin-binding proteins. Methods in Molecular Biology. 1369, 151-179 (2016).
- Funk, J., et al. Profilin and formin constitute a pacemaker system for robust actin filament growth. eLife. 8, 50963 (2019).
- Pandit, N. G., et al. Force and phosphate release from Arp2/3 complex promote dissociation of actin filament branches. Proceedings of the National Academy of Sciences of the United States of America. 117 (24), 13519-13528 (2020).
- Wioland, H., et al. ADF/Cofilin accelerates actin dynamics by severing filaments and promoting their depolymerization at both ends. Current Biology: CB. 27 (13), 1956-1967 (2017).
- Pollard, T. D., Mooseker, M. S. Direct measurement of actin polymerization rate constants by electron microscopy of actin filaments nucleated by isolated microvillus cores. The Journal of Cell Biology. 88 (3), 654-659 (1981).
- Kovar, D. R., Harris, E. S., Mahaffy, R., Higgs, H. N., Pollard, T. D. Control of the assembly of ATP- and ADP-actin by formins and profilin. Cell. 124 (2), 423-435 (2006).
- Jégou, A., Carlier, M. -. F., Romet-Lemonne, G. Formin mDia1 senses and generates mechanical forces on actin filaments. Nature Communications. 4, 1883 (2013).
- Breitsprecher, D., et al. Rocket launcher mechanism of collaborative actin assembly defined by single-molecule imaging. Science. 336 (6085), 1164-1168 (2012).
- Courtemanche, N., Lee, J. Y., Pollard, T. D., Greene, E. C. Tension modulates actin filament polymerization mediated by formin and profilin. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9752-9757 (2013).
- Niedermayer, T., et al. Intermittent depolymerization of actin filaments is caused by photo-induced dimerization of actin protomers. Proceedings of the National Academy of Sciences. 109 (27), 10769-10774 (2012).
- Gateva, G., et al. Tropomyosin isoforms specify functionally distinct actin filament populations in vitro. Current Biology: CB. 27 (5), 705-713 (2017).
- Aratyn, Y. S., Schaus, T. E., Taylor, E. W., Borisy, G. G. Intrinsic dynamic behavior of fascin in filopodia. Molecular Biology of the Cell. 18 (10), 3928-3940 (2007).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. The Journal of Cell Biology. 103, 2747-2754 (1986).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Torsional stress generated by ADF/cofilin on cross-linked actin filaments boosts their severing. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2595-2602 (2019).
- Colombo, J., et al. A functional family of fluorescent nucleotide analogues to investigate actin dynamics and energetics. Nature Communications. 12 (1), 548 (2021).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. The Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Romet-Lemonne, G., Guichard, B., Jégou, A. Using microfluidics single filament assay to study formin control of actin assembly. Methods in Molecular Biology. 1805, 75-92 (2018).
- Gieselmann, R., Kwiatkowski, D. J., Janmey, P. A., Witke, W. Distinct biochemical characteristics of the two human profilin isoforms. European Journal of Biochemistry. 229 (3), 621-628 (1995).
- Lin, D. C., Lin, S. Actin polymerization induced by a motility-related high-affinity cytochalasin binding complex from human erythrocyte membrane. Proceedings of the National Academy of Sciences of the United States of America. 76 (5), 2345-2349 (1979).
- Casella, J. F., Maack, D. J., Lin, S. Purification and initial characterization of a protein from skeletal muscle that caps the barbed ends of actin filaments. The Journal of Biological Chemistry. 261 (23), 10915-10921 (1986).
- Kremneva, E., et al. Cofilin-2 controls actin filament length in muscle sarcomeres. Developmental Cell. 31 (2), 215-226 (2014).
- Le Clainche, C., Carlier, M. -. F. Actin-based motility assay. Current Protocols in Cell Biology. , 1-20 (2004).
- Vignjevic, D., et al. Formation of filopodia-like bundles in vitro from a dendritic network. The Journal of Cell Biology. 160 (6), 951-962 (2003).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. eLife. 5, 13470 (2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Molecular Biology of the Cell. 27 (22), 3563-3573 (2016).
- Suzuki, E. L., et al. Geometrical constraints greatly hinder formin mDia1 activity. Nano Letters. 20 (1), 22-32 (2020).
- Wioland, H., Suzuki, E., Cao, L., Romet-Lemonne, G., Jegou, A. The advantages of microfluidics to study actin biochemistry and biomechanics. Journal of Muscle Research and Cell Motility. 41 (1), 175-188 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved