A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש במיקרופלואידיקה ובמיקרוסקופיה פלואורסצנטית כדי לחקור את דינמיקת ההרכבה של חוטי אקטין בודדים וחבילות
In This Article
Summary
אנו מציגים פרוטוקולים לבדיקות מיקרופלואידיות פשוטות של נימת אקטין, בשילוב עם מיקרוסקופיה פלואורסצנטית, המאפשרות לנטר במדויק חוטי אקטין בודדים בזמן אמת תוך חשיפתם ברצף לתמיסות חלבון שונות.
Abstract
על מנת לפענח את המנגנונים המולקולריים המורכבים המווסתים את ההרכבה והפירוק של חוטי אקטין, זהו נכס נהדר לניטור תגובות בודדות לחיות בתנאים מבוקרים היטב. כדי לעשות זאת, ניסויים חיים של נימה אחת הופיעו במהלך 20 השנים האחרונות, בעיקר באמצעות מיקרוסקופיה פלואורסצנטית של השתקפות פנימית כוללת (TIRF), וסיפקו שפע של תוצאות מפתח. בשנת 2011, על מנת להרחיב עוד יותר את האפשרויות של ניסויים אלה וכדי למנוע ממצאים בעייתיים חוזרים ונשנים, הצגנו מיקרופלואידיקה פשוטה במבחנים אלה. מחקר זה מפרט את הפרוטוקול הבסיסי שלנו, שבו חוטי אקטין בודדים מעוגנים בקצה אחד למשטח הכיסוי הפסיווי, מתיישרים עם הזרימה, ויכולים להיחשף ברצף לתמיסות חלבון שונות. אנו גם מציגים את הפרוטוקולים עבור יישומים ספציפיים ומסבירים כיצד ניתן ליישם כוחות מכניים מבוקרים, הודות לגרירה הצמיגית של הפתרון הזורם. אנו מדגישים את האזהרות הטכניות של ניסויים אלה ומציגים בקצרה התפתחויות אפשריות המבוססות על טכניקה זו. פרוטוקולים והסברים אלה, יחד עם הזמינות של כיום של ציוד מיקרופלואידיקה קל לשימוש, אמורים לאפשר למי שאינם מומחים ליישם בדיקה זו במעבדותיהם.
Introduction
ההרכבה והפירוק של חוטי אקטין ורשתות חוטי אקטין נשלטים על ידי מספר תגובות ביוכימיות ותלויים בהקשר המכני. על מנת לקבל תובנה על מנגנונים מורכבים אלה, זה לא יסולא בפז כדי להיות מסוגל לצפות בתגובות בודדות על חוטים בודדים (במספרים גדולים מספיק). במהלך העשורים האחרונים, התצפית על חוטי אקטין דינמיים בזמן אמת, בעיקר באמצעות מיקרוסקופיה פלואורסצנטית של השתקפות פנימית כוללת (TIRF), התגלתה כטכניקה מרכזית וסיפקה רשימה מרשימה של תוצאות שלא ניתן היה להשיג באמצעות בדיקות ביוכימיות של תמיסה בתפזורת1.
כדי להשיג זאת, יש לשמור על חוטי אקטין בעלי תווית פלואורסצנטית קרוב לפני השטח של כיסוי המיקרוסקופ תוך חשיפתם לתמיסות של חלבונים קושרי אקטין (ABPs), שגם אותם ניתן לתייג באופן פלואורסצנטי. פעולה זו מספקת אמצעי לניטור אירועים המתרחשים על חוטים בודדים בתנאים ביוכימיים מבוקרים היטב, ובכך לכמת את שיעורי התגובה. עם זאת, יש לקחת בחשבון מספר מגבלות ספציפיות. שמירה מלאכותית על חוטים קרוב לפני השטח, לעתים קרובות הודות לנקודות עיגון מרובות או על ידי שימוש בחומר צפיפות כגון מתילצלולוז, יכולה לשנות את התנהגותם (למשל, לגרום להפסקות בפילמור ובדה-פולימריזציה שלהם2). מעקב אחר קווי המתאר של כל נימה יכול להיות מאתגר, במיוחד אם חוטים חדשים או שברי חוטים מצטברים בשדה הראייה לאורך זמן. התגובות מתרחשות בנפח סופי שבו הריכוז של מונומרים של אקטין ו-ABPs יכול להשתנות עם הזמן, מה שעלול להקשות על הפקת קבועי קצב מדויקים. לבסוף, קשה להשיג חידוש או שינוי של הפתרון של ABPs בפחות מ-30 שניות ולעתים קרובות יוביל לתכולת חלבון לא הומוגנית במדגם.
לפני קצת יותר מ-10 שנים, בהשראת מה שכבר נעשה כדי לחקור גדילים בודדים של חומצה דאוקסיריבונוקלאית (DNA)3, הצגנו טכניקה חדשה המבוססת על מיקרופלואידיקה כדי לבחון ולתפעל חוטי אקטין בודדים4. זה מאפשר לעקוף את המגבלות הנ"ל של טכניקות קלאסיות של נימה אחת. במבחני מיקרופלואידיקה אלה, חוטי אקטין גדלים מזרעי ספקטרין-אקטין הנספגים על הכיסוי. החוטים מעוגנים אפוא בקצה אחד בלבד לתחתית התא המיקרופלואידי ונעים מעל פני השטח מבלי להידבק. חוטים מתיישרים עם זרימת הפתרונות הנכנסים, ובכך מקלים על ניטור אורך קווי המתאר שלהם ושומרים עליהם באזור רדוד מעל הכיסוי שבו ניתן להשתמש ב- TIRF. פתרונות שונים זורמים בו זמנית לתוך התא ללא ערבוב, ואת החוטים ניתן לחשוף אותם ברצף ובמהירות.
כאן אנו מציעים סדרה של פרוטוקולים בסיסיים להקמת מבחני מיקרופלואידיקה חד-אקטיים במעבדה. ניתן להכין מראש כיסויים ותאי מיקרופלואידיקה (תוך חצי יום), והניסוי עצמו, שבו ניתן לבחון מספר מצבים ביוכימיים, נעשה תוך פחות מיום.
Protocol
1. הכנת תא מיקרופלואידי
- בחר תבנית אב SU-8 עם מספר תבניות תא. תאים טיפוסיים הם בצורת צלב עם שלושה כניסות ושקע אחד, 20 מיקרומטר גובה ו-800 מיקרומטר רוחב (איור 1). תבניות מאסטר כאלה ניתן לרכוש מחברות חיצוניות או לעשות במעבדות אקדמיות (למשל, Gicquel, Y. et al.5).
- מניחים סרט הדבקה סביב קצה התבנית.
- שים כ 50 ס"מ אורך, 19 מ"מ רוחב, סרט משרדי שקוף סטנדרטי (ראה טבלת חומרים) על ספסל, צד דביק למעלה. מניחים את התבנית אנכית בקצה אחד ולאורך קו האמצע של הקלטת.
- מגלגלים את התבנית לקצה השני של הקלטת כדי ליצור גבול של 1 ס"מ סביב התבנית. קפלו מטה את הקלטת מעל תחתית התבנית.
- הכן תמיסת פולידימתילסילוקסן (PDMS).
- בצלחת שקילה חד פעמית, יוצקים ישירות 25-30 גרם של בסיס PDMS (טבלת חומרים). הוסיפו 10% חומר ריפוי PDMS במשקל/משקל (טבלת חומרים) עם פיפטת פסטר פלסטית חד פעמית.
- יש לערבב באופן ידני ויסודי עם מקל פלסטיק. ודאו שחומר הריפוי משולב היטב בבסיס ה-PDMS, גם אם הערבוב יוצר הרבה בועות.
- דגה את תמיסת ה-PDMS במייבש ואקום (טבלת חומרים) למשך 5 דקות לפחות בטמפרטורת החדר (RT). בועות יתרחבו, יעלו אל פני השטח ויתפוצצו כאשר הוואקום נשבר.
- שפכו את תמיסת ה-PDMS על תבנית SU-8. השתמשו במקל פלסטיק כדי לגרד ולהעביר כמה שיותר מהתערובת.
- Degas PDMS בפעם השנייה (5 דקות במייבש הוואקום). הקפידו להיפטר מרוב הבועות (כמה בועות קטנות במשטח העליון הן בסדר).
- מכניסים את התבנית לתנור בטמפרטורה של 70 מעלות צלזיוס למשך 5 שעות לפחות כדי שה-PDMS יטעה ויתמצק.
- הסר תאי PDMS מוצקים מהתבנית.
אזהרה: פרוסות סיליקון לתבניות SU-8 הן שבריריות ביותר, ולכן יש לנקוט בזהירות נרחבת בעת הפרדת ה- PDMS מהופלים. עבדו על משטח קשיח ושטוח ושמרו על הוופל שטוח על פני השטח.- עם סכין גילוח, לעשות חתך עגול ב PDMS, כ 1 ס"מ משם קצה התבנית. כל התבניות חייבות להיות לפחות 0.5 ס"מ בתוך החתך. קלפו בעדינות את בלוק ה-PDMS המרכזי בעזרת משיכה עדינה.
אזהרה: בעת קילוף, שמור על תבנית SU-8 שטוחה על הספסל כדי למנוע שבירתו. - הניחו את PDMS על רדיד אלומיניום נקי, המשטח המעוצב הפונה לרדיד האלומיניום, כדי להגן על פני השטח שלו מפני אבק ולהפוך את התבניות לגלויות יותר.
- עם סכין גילוח, לעשות חתך עגול ב PDMS, כ 1 ס"מ משם קצה התבנית. כל התבניות חייבות להיות לפחות 0.5 ס"מ בתוך החתך. קלפו בעדינות את בלוק ה-PDMS המרכזי בעזרת משיכה עדינה.
- בחרו וחתכו תא עם סכין גילוח במרחק של 0.5 ס"מ לפחות מהתבנית. גובהו של בלוק ה-PDMS שנוצר הוא כ-0.5 ס"מ, רוחבו 1.5 ס"מ ואורכו 3 ס"מ. פירס שלושה מפרצונים ושקע אחד עם אגרוף ביופסיה 0.75 מ"מ מזהה (טבלת חומרים).
- נקו את תא ה-PDMS בעזרת אתנול אולטרה-פורה (טבלת חומרים) וייבוש באוויר באמצעות אקדח מפוצץ בטיחות (טבלת חומרים). מניחים את ה-PDMS כשהדפוס פונה כלפי מעלה בצלחת פטרי נקייה, וסוגרים את המנה עם המכסה שלה.
2. ניקוי כיסויי זכוכית
הערה: כאן מפורט הליך ניקוי כיסוי סטנדרטי, המבוסס על סדרה של שלבי סאונדציה. פרוצדורות אחרות לניקוי כיסויי זכוכית תוארו בפרסומים רבים אחרים שיכולים להשיג תוצאות מספקות דומות 6,7,8,9.
- יש למקם 10-20 כיסויים (באורך 40 מ"מ) על מחזיק Polytetratrafluoroethylene (PTFE) (טבלת חומרים). נקו את הכיסויים ב-0.5 ליטר של תמיסת ניקוי זכוכית של 2% (טבלת חומרים) בכוס זכוכית 1 ליטר (35 מעלות צלזיוס, 30 דקות).
- השליכו את תמיסת ניקוי הזכוכית ושטפו את הכיסויים באופן נרחב עם dH2O בשלוש אמבטיות רצופות של 0.5 ליטר לפחות.
- הכן 0.5 ליטר של 2 M KOH בכוס זכוכית 1 L. סוניק את הכיסויים ב- KOH (RT, 30 דקות). השליכו את KOH ושטפו את הכיסויים עם dH2O בשלוש אמבטיות 0.5 ליטר לפחות.
אזהרה: השתמש בציוד מתאים להגנה על בטיחות המעבדה (כפפות, משקפיים ומעיל מעבדה). - מעבירים וסוניקים את הכיסויים ב-0.5 ליטר של אתנול אולטרה-אפור (RT, 30 דקות). ניתן לשמור כיסויים באתנול עד שבועיים. סגור את הכוס עם סרט תרמופלסטי (טבלת חומרים) כדי למנוע אידוי. לפני השימוש, יש לייבש את הכיסוי עם זרימת האוויר.
3. הרכבה של תא PDMS
- מחממים מראש את הצלחת החמה ל-100 מעלות צלזיוס. הניחו עד שלושה תאי PDMS מנוקים וכיסויי זכוכית בצלחת פטרי נקייה. מניחים את צלחת הפטרי הפתוחה בחומר ניקוי אולטרה סגול (UV) עמוק (λ = 185 ננומטר, ראו טבלת חומרים) וחושפים אותה לאור UV למשך 3-5 דקות.
הערה: לחלופין, תאי PDMS וכיסויים יכולים להיחשף לפלזמת אוויר או חמצן במשך 30 שניות. - מקם בעדינות את תא ה- PDMS מעל הכיסוי. וודאו ששני המשטחים שהוכנסו במגע נחשפו ישירות ל-UV. ה- PDMS נדבק באופן אוטומטי לזכוכית והתא הופך גלוי בבירור.
- כדי להסיר כל אוויר הלכוד בממשק PDMS-coverlip, לחץ בעדינות רבה על המשטח באצבע. לקבלת חיבור הדוק יותר, לחץ חזק יותר על פני פינות וצדדים. יש לוודא כי תקרת החדר אינה באה במגע עם משטח הזכוכית.
- הניחו את החדר עם תחתית הזכוכית הפונה לצלחת החמה בטמפרטורה של 100 מעלות צלזיוס למשך 5 דקות. לאחר שלב זה, קשרי הזכוכית-PDMS הופכים לקבועים, וניתן להשתמש בתאים רק פעם אחת. השתמשו בתא באופן מיידי או אחסנו אותו בצלחת פטרי נקייה למשך עד שבוע.
4. [אופציונלי] פסיביזציה ותפקוד ישירים
הערה: בהתאם ליישום, ניתן להעביר תאים ולתפקד לאחר שהם מחוברים להתקן השליטה המיקרופלואידי (ראה טבלת חומרים) או על ידי הזרקה ידנית של פתרונות ישירות לתוך התא עם פיפטה לפני חיבורו להתקן המיקרופלואידי. זה האחרון מציע את היתרון של צריכת פחות ריאגנטים והימנעות מזיהום פוטנציאלי על ידי זרימת התמיסה דרך צינורות אתר הפוליאתר קטון (PEEK) של המכשיר המיקרופלואידי. בכל השלבים הבאים, תמיסות מוזרקות על ידי הדבקה ישירה של קצה הפיפטה לתוך השקע. על מנת להימנע מיצירת בועות בתוך התא, הקפידו על טיפה זעירה שבולטת מתוך קצה הפיפטה בעת חיבור הקצה לשקע של תא ה-PDMS. כמו כן, הסר את קצה הפיפטה לפני הזרקת כל הנפח.
- הזריקו 20 μL של PLL-PEG (1 מ"ג/מ"ל במי מלח עם מאגר פוספט (PBS)). דגירה למשך שעה אחת לפחות (או לילה) ב- RT. כדי למנוע אידוי, הניחו את תא ה-PDMS בקופסה לחה (לדוגמה, תיבת קצה ריקה עם מים בתא התחתון ותא ה-PDMS בפלטפורמת החזקת הקצה).
- הזריקו 20 μL של 100 זרעי ספקטרין-אקטין pM (במאגר F, ראו טבלה 1 וטבלה 2). המתן לא יותר מדקה אחת. התאימו את ריכוז הזרעים ותזמוןם כדי לכוונן את צפיפות פני השטח של הזרעים, גבוהה מספיק לסטטיסטיקה גדולה ונמוכה מספיק כדי שהחוטים לא יחפפו.
הערה: לחלופין, אם זרעי ספקטרין-אקטין אינם זמינים, השתמש בקטעי נימה קצרים פונקציונליים ביולוגית שישתקו על כיסוי מצופה סטרפטווידין 9,10. - [אופציונלי] הזריקו 20 μL של 5% אלבומין בסרום בקר (BSA) ב-F-buffer. השאירו ב-RT למשך 10 דקות.
- [אופציונלי] הזריקו 20 μL של 1 מ"ג/מ"ל β-קזאין ב-F-buffer. השאירו ב-RT למשך 10 דקות.
הערה: בצע את שלבים 4.3 ו/או 4.4 כדי להעביר עוד יותר את החדר. הבחירה של פסיביזציה תלויה בחלבונים המשמשים ואינה פועלת באותה מידה על כל ABPs. בעת שימוש באקטין בלבד, PLL-PEG או BSA מספיקים.
5. חבר התקן מיקרופלואידי
הערה: השתמש במערכת מיקרופלואידית מבוססת לחץ עם עד ארבעה ערוצים כדי לשלוט בזרימות בתא המיקרופלואידי (איור 1A, ראו טבלת חומרים). כדי למנוע היווצרות בועות בצינורות המיקרופלואידיים והפרעות ליציבות הזרימה, דגה את כל הפתרונות. מקם 5 מ"ל של dH20 ו- 10 מ"ל של מלאי F-buffer במתייבש ואקום המחובר למשאבת ואקום (ואקום אולטימטיבי <250 mbar) ודגה למשך שעה אחת לפחות ב- RT.
- יש לשטוף פתחי כניסה + צינורות מוצא עם dH2O (500 μL, 300 mbar).
- מלאו את כל צינורות המאגר של 2 מ"ל (ראו טבלת חומרים) ב-300 מיקרול' של מאגר F. הגדר לחץ ל-300 mbar ותן לחמש עד שמונה טיפות לרדת לטמיון. חזור על הפעולה עבור כל ערוץ והגדר לחץ ל- 0.
- חברו את השקע ושטפו את החדר באופן נרחב.
- הגדר את הלחץ עבור צינור המאגר 4 (מוצא) עד 50 mbar. ברגע שיוצאת טיפה מקצה הצינורות, חברו את הצינורות לשקע של תא ה-PDMS. הנוזל מתמלא בתא ויוצא מכל הכניסות.
- [אופציונלי] אם התא עבר ישירות (סעיף 4), הגדר לחץ ל-100 mbar כדי לשטוף את התא ב-50-100 μL של F-buffer (3-5 דקות). הסר את הנוזל העודף בכניסות עם רקמת ניקוי.
- הגדר את הלחץ ל 20 mbar.
- חבר מפרצונים.
- הגדר את הלחץ עבור צינור המאגר 1 עד 50 mbar. כדי להימנע מהחדרת בועות אוויר, ודאו שהטיפה יוצאת מהצינורות ומכניסת ה-PDMS.
- חברו את הצינורות לכניסה 1 (שתי הטיפות מתמזגות בעת החיבור). הגדר את הלחץ ל 30 mbar.
- חזור על שלבים 5.4.1-5.4.2 כדי לחבר כניסות 2 ו- 3.
- הגדר את הלחץ של כל הכניסות ל-20 mbar ואת לחץ היציאה ל-0 mbar. ודא שקצבי הזרימה בכניסות שווים בערך (ראה סעיף פתרון בעיות).
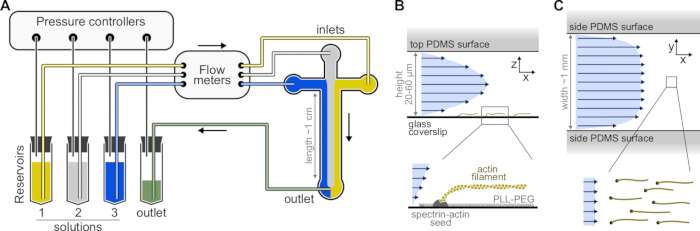
איור 1: הזרקת תמיסות דרך תא מיקרופלואידי. תמיסות חלבון, הממוקמות במאגרים 1-3, נדחפות לתוך התא על ידי התאמת הלחץ בשלב הגז. קצבי הזרימה הנוצרים נמדדים על ידי מדי זרימה. בתוך התאים המיקרופלואידיים, התמיסות אינן מתערבבות ותופסות מקום בהתאם ללחצים היחסיים המופעלים (כאן, לחץ שווה על כל הכניסות). מידות אופייניות: צינורות מאגר מכילים עד 2 מ"ל של תמיסה. צינורות PEEK (קוטר פנימי של 0.25 מ"מ) מחברים את המאגרים למדי הזרימה (לאחר 10 ס"מ של צינורות) ולאחר מכן לתא PDMS (לאחר עוד 70 ס"מ). צינורות סיליקון ומצמדי צינורות נירוסטה משמשים לחיבור צינורות PEEK לכניסות PDMS. הערוץ המיקרופלואידי הראשי הוא בגובה 20-60 מיקרומטר, כ-1 מ"מ רוחב ואורך של 1 ס"מ. (ב,ג) פרופילי זרימה בתוך התא המיקרופלואידי. (B) הנוזל יוצר פרופיל פרבולי על פני גובה התא: v(z) = 6z(h-z)R/h3w, כאשר h ו-w הם גובה ורוחב התא, ו-R הוא קצב הזרימה הכולל. למטה: חוט אקטין יחיד פולימרי מזרעי ספקטרין-אקטין מעוגנים בפני השטח. (C) כאשר רוחב התא גדול משמעותית מגובהו, הזרימה כמעט אחידה לרוחב התא, למעט במשטחי ה-PDMS, שם היא מגיעה לאפס. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
6. הגדרת ההגדרה עם קצבי זרימה סטנדרטיים
הערה: מערכת הלחץ הנשלטת על-ידי מחשב מאפשרת התאמה קלה ומדויקת של הלחצים של כל הכניסות/שקעים המחוברים לתא ה-PDMS, ומכאן השליטה בקצבי הזרימה הנכנסים והיוצאים. ניתן לשמור ולהפעיל/לכבות תצורות מוגדרות מראש בלחיצת עכבר אחת. להלן התצורות המומלצות (אלא אם כן צוין אחרת, לחץ היציאה מוגדר ל-0 mbar). ראה טבלה 3 עבור קצבי זרימה צפויים עבור תצורות מוגדרות מראש אלה. הלחצים המצוינים כאן חייבים להיות מותאמים בהתאם לגיאומטריה של התא ולתצורת המערכת.
-
שינוי: השתמש בקביעה מוגדרת מראש זו בעת שינוי מאגר אחד או יותר. זה יוצר זרימה לאחור קלה בצינורות המעניינים כדי למנוע החדרת בועות.
- הגדר את כל לחצי הכניסה ל-12 mbar ואת לחץ היציאה ל-5 mbar (איור 2B).
-
זרימה גבוהה 'הכל': השתמש בקביעה מוגדרת מראש זו כדי להזריק במהירות שלושה פתרונות במקביל. הם יגיעו לחדר תוך 4 דקות.
- הגדר את כל לחצי הכניסה ל-150 mbar.
-
זרימה גבוהה 'x': השתמש בקביעה מוגדרת מראש זו כדי להזריק במהירות תמיסה. הוא יגיע לתא תוך 3 דקות (איור 3A-C).
- הגדר את לחץ הכניסה 'x' ל-150 mbar (~15 μL/min). הלחץ בכניסות האחרות מותאם לכ-100 mbar, כך שקצב הזרימה המתקבל בכניסות אלה הוא ~500 nL/min.
-
Mid Flow 'All': השתמש בקביעה מוגדרת מראש זו כדי להשהות את המערכת.
- הגדר את כל הכניסות ל-20 mbar (איור 2A).
-
Mid Flow 'x': השתמש בקביעה מוגדרת מראש זו כדי לאפשר לפתרון 'x' למלא את רוב רוחב הערוצים הראשי (ראו איור 2C,D), תוך הגבלת פתרונות הכניסה האחרים לדפנות התעלה. חוטי אקטין בתא ייחשפו אפוא למצב הביוכימי המוטל על ידי תמיסה 'x' בלבד.
- הגדר את לחץ הכניסה 'x' ל- 12 mbar. הגדר את הלחץ בכניסות האחרות והתכוונן ל~ 9 mbar, כך שקצבי הזרימה המתאימים שלהם הם ~ 150 nL / min.
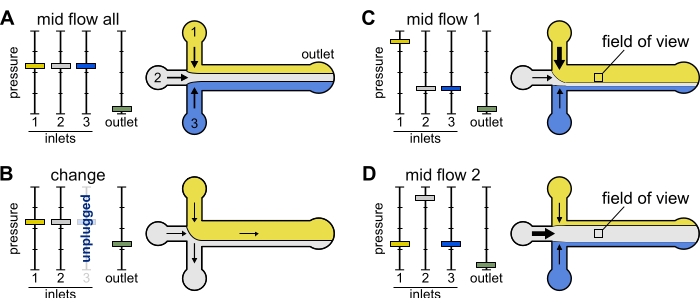
איור 2: הלחץ המופעל על כל מאגר שולט בחלוקה/התפלגות מרחבית של תמיסות בתוך התא המיקרופלואידי. (B) בעת שינוי צינור מאגר (כאן מאגר 3), הלחץ האפקטיבי יורד לאפס, ויוצר זרימה לאחור. (ג,ד) הגברת הלחץ היחסי על אחד המאגרים מאפשרת חשיפה של משטח הזכוכית לתמיסה אחת. ניתן לחשוף את שדה הראייה במרכז התא ברצף לפתרונות 1 ו-2 על ידי החלפה בין תצורה של Mid Flow 1 (C) ו-Mid Flow 2 (D). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
7. שינוי פתרון 'x'
הערה: כפי שמוצג באיור 3A-C, חשוב לזכור שלתמיסות לוקח דקות לזרום מצינור מאגר לערוץ הראשי של התא. הזמן ה'מת' המינימלי הזה נכפה על ידי נפח הנוזל הכלול בצינורות ופרופיל הזרימה בתוך הצינורות (איור 3A-C).
- הכן 200-300 μL של פתרון בצינור מאגר חדש. הגדר לחץ לשינוי הגדרה (ראה סעיף 6).
- שחררו את צינור המאגר של המפרצון 'x'. הפתרון בצינורות יזרום באיטיות לאחור, מהתא לקצה הצינורות החופשיים. קצב הזרימה הנמדד הופך לשלילי (איור 2B).
- לאחר שנוצרה טיפה זעירה בקצה הצינור, הברג את הצינור החדש עם הפתרון הטרי. ברגע שהצינור מהודק כראוי למערכת הלחץ, קצב הזרימה של הכניסה חוזר לחיובי.
- הגדר את הגדרת הלחץ ל -'x' של זרימה גבוהה.
- בהתאם לתצורה המיקרופלואידית ולגיאומטריה של התא, המתן 3-5 דקות עד שהתמיסה תמלא את הצינורות במלואה ותגיע לתא.
- [אופציונלי] עקבו אחר התהליך הזה על ידי מדידת העלייה בפלואורסצנציה לאורך זמן (איור 3C).
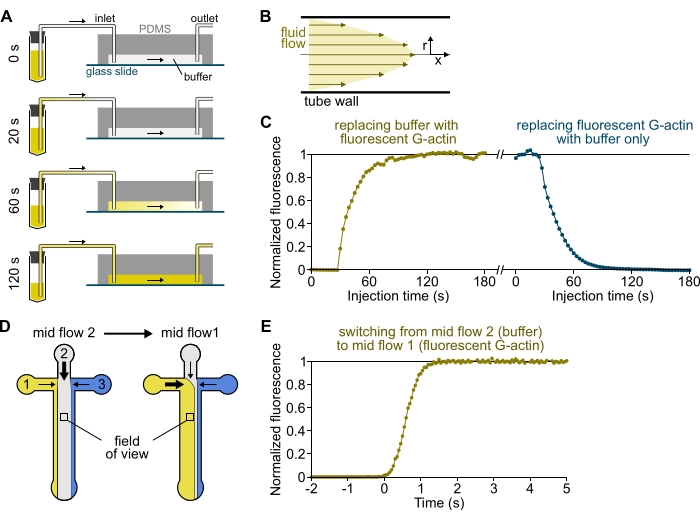
איור 3: עיכוב בהגעה של פתרונות מהמאגרים לתא ה-PDMS ושינוי מהיר של התנאים הביוכימיים. (א-ג) עיכוב בהגעה של פתרונות מהמאגרים לתא PDMS. (A) בהתאם לגאומטריית התא, אורך הצינור והלחץ המופעל בכניסה(ים), החלפתה של תמיסה אחת באחרת אינה מיידית. לאחר שינוי צינור המאגר לכזה המכיל תמיסה פלואורסצנטית (0 דקות), התמיסה ממלאת בהדרגה את הצינורות (0.4 דקות) ואת תא PDMS (1-2 דקות). תזמון אינדיקטיבי ניתן עבור לחץ המופעל על ידי 150 mbar, צינורות PEEK בגודל 80 ס"מ ותא PDMS ברוחב 1600 מיקרומטר ובגובה 20 מיקרומטר. (B) פרופיל הזרימה הפרבולית בתוך צינורות PEEK יוצר גרדיאנט יעיל של פלואורסצנציה לאורך הפרופיל הרדיאלי של הצינורות ובתוך התא (ראו גם איור 1B). (C) ניתן לכמת הגעה מאוחרת של פתרונות על ידי מדידת אות האפיפלואורסצנציה ברקע בתא כפונקציה של הזמן. תנאי ניסוי: 0.5 μM 10% Alexa-568-מסומן G-actin מוזרק עם 150 mbar דרך מד זרימה וצינורות PEEK 80 ס"מ. (D,E) שינוי מהיר של מצבים ביוכימיים. (D) תבנית של פתרונות נכנסים בשני תנאי זרימה בינונית. (E) עלייה בפלואורסצנציה ברקע כקריאה של ריכוז האקטין. הזמן t = 0 מוגדר כתחילת העלייה הפלואורסצנטית. פתרון 1: 0.5 μM 10% Alexa-488-labeled G-actin, פתרון 2: F-buffer. (ג,ה) תא PDMS: גובה 20 מיקרומטר ורוחב 1600 מיקרומטר. עוצמת האפיפלואורסצנציה, כ-2 מיקרומטר מעל פני השטח, כומתה על ידי ממוצע האות על פני שדה הראייה המלא, מנורמל ל-0 בהיעדר פלואורופור ו-1 בעוצמה מקסימלית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
8. ניסוי בסיסי של נימה בודדת: אדנוזין דיפוספט (ADP)-דקטין דוקרני סוף דה-פולימריזציה של קצה תיל אקטין
הערה: סעיף זה מניח תא שאינו פונקציונלי (סעיף 5 בלבד). אם התא תפקד ישירות (סעיף 4), התחל בשלב 8.4.
- פונקציונליזציה של פני השטח עם זרעי נימה של אקטין:
- שנה את הפתרון 3 עד 200 μL של 50 pM spectrin-actin זרעים11 ב- F-buffer (ראה סעיף 7).
הערה: לחלופין, אם זרעי ספקטרין-אקטין אינם זמינים, ניתן להשתמש במקטעי נימה קצרים פונקציונליים ביולוגית שיהיו משותקים על כיסוי מצופה סטרפטווידין (עייןב-9,10 לפרטים). - להזריק במשך 2 דקות עם זרימה גבוהה 3.
הערה: התאם את הריכוז והזמן בהתאם לצפיפות הזרעים הסופית.
- שנה את הפתרון 3 עד 200 μL של 50 pM spectrin-actin זרעים11 ב- F-buffer (ראה סעיף 7).
- פסיבציה על פני השטח:
- החלף שפופרת 3 עם 300 μL של 5% BSA ב- F-buffer.
- הזריקו למשך 5 דקות ב-High Flow 3, ולאחר מכן 5 דקות ב-Mid Flow 3. במהלך שלב שני זה, הפחיתו את הלחץ בערוצים 1 ו-2 עד 7-8 mbar כדי לקבל זרימה נגדית ~-100 nL/min, כך שכל משטחי התא יהיו פסיבציה BSA.
הערה: מכיוון שפתרון BSA צמיג יותר, יש להתאים את הלחצים בהתאם.
- החלף צינור 3 ל- F-buffer ושטפו את התעלה (5 דקות, זרימה גבוהה 3).
- הכן את הפתרונות הבאים של 200-300 μL, שכל החלבונים מדוללים במאגר F:
כניסה 1, פתרון פילמור: 1 μM 10% Alexa-488 עם התווית G-actin, 1 μM פרופילין (טבלה 1).
כניסה 2, פתרון הזדקנות: 0.15 μM 10% Alexa-488 מסומן G-actin.
כניסה 3, פתרון דה-פולימריזציה: F-buffer בלבד.
הערה: פרופילין משמש כאן כדי למנוע נוקלאציה ספונטנית ולשמור על ריכוז קבוע של G-actin. - שינוי צינורות 1 עד 3 (סעיף 7). הזריקו באמצעות ההגדרה הקבועה מראש של High Flow All למשך 3-4 דקות. שלושת הפתרונות מילאו כעת את צינורות ה-PEEK והגיעו לתא (איור 3A). משטח הזכוכית יכול להיחשף לכל תמיסת כניסה ללא זמן מת (<1 שניות, איור 3D,E).
- הפעילו את המיקרוסקופ. הגדר את ההגדרות: 150 mW 488 ננומטר לייזר עירור ב 10%-20% הספק, 100-200 ms זמן חשיפה למצלמה, 200-300 ננומטר TIRF עומק חדירה, 60x מטרה. הגדרות אלה משמשות לאורך כל כתב היד.
- פילמור נימה (איור 4A):
- הגדר את הגדרת הלחץ ל - Mid Flow 1 למשך כ- 10 דקות.
- [אופציונלי] פילמור רשומות (1 מסגרת/20 שניות, TIRF). חוטים צריכים להתפלמר בסביבות 10 תת-יחידות לשנייה (תת/שנייה)1,12.
- הזדקנות נימה: הגדר את הגדרת הלחץ ל - Mid Flow 2 למשך 15 דקות. בריכוז הקריטי, 0.15 μM G-actin, אורך החוטים יישאר קבוע, והחוטים יפנו >99% ADP-F-actin4.
- דה-פולימריזציה (איור 4A):
- התחל רכישה ב- 1 פריים /5 שניות, במצב אפיפלואורסצנציה. מכיוון שיש רקע פלואורסצנטי נמוך מאוד בערוצים 2 ו -3, אין צורך להשתמש ב- TIRF.
- לאחר פריים אחד או שניים, עבור אל Mid Flow 3. חוטים צריכים לעשות דה-פולימריזציה בסביבות 10 תת-שניות (הפניה12).
- כדי לאפס את הניסוי, שברו את כל החוטים המסומנים באופן פלואורסצנטי על ידי חשיפה רציפה שלהם ללייזר בהספק מרבי למשך כ-2 דקות. כדי לבדוק תנאים שונים, החליפו תמיסות 1, 2 או 3 והזיקו אותם (זרימה גבוהה, 3-4 דקות). חזור על שלבים 8.7-8.9.
9. ניסויים אחרים של נימה אחת
- בדיקת האינטראקציות של ABPs עם F-אקטין
הערה: מיקרופלואידיקה שימשה בהצלחה לכימות הפעילות של מספר ABPs קושרי צד, כגון קופילין, טרופיוזין ו-Arp2/3. להלן הפרוטוקול בסעיף 8:- שנה את ערוץ 3 ל- ABP הפלואורסצנטי המעניין ב- F-buffer. הזרקה (זרימה גבוהה 3, 3 דקות).
- פילמור נימה: הגדר את הגדרת הלחץ ל - Mid Flow 1 למשך 10 דקות.
- איגוד ABP: התחל רכישה עם TIRF. התאם את קצב הפריימים בהתאם לריכוז ה-ABP. לאחר 1-2 מסגרות, עבור אל Mid Flow 3.
הערה: בהתאם ל-ABP, ניתן גם לעבור במהירות (למשל, עבור פחות מ-5 שניות) ל-Mid Flow 2 כדי להפחית עוד יותר את הפלואורסצנציה ברקע בעת צילום תמונה. - ABP לא מחייב: תוך כדי המשך הרכישה, עברו ל-Mid Flow 2.
- פילמור עם פורמין בקצה התיל החופשי
הערה: פורמינים הוכחו כמשפיעים על פילמור קצה נימה. Microfluidics מותאם במיוחד למדידת קצבי קשירת פורמין ובלתי מחייבים והשפעתם על התארכות החוטים.- הכן את הפתרונות הבאים:
ערוץ 1: 10 ננומטר פורמין ב- F-buffer (טבלה 1).
ערוץ 2: 1 μM 10% Alexa-488 מסומן G-actin, 4 μM profilin.
ערוץ 3: F-buffer. - שינוי צינורות 1, 2 ו-3 (סעיף 7). הזריקו באמצעות ההגדרה הקבועה מראש של High Flow All למשך 3-4 דקות.
- התחל פילמור נימה: הגדר את הגדרת הלחץ ל - Mid Flow 2 למשך 2 דקות.
- קשירת פורמין לקצה תיל נימה: הגדר את הגדרות הלחץ ל - Mid Flow 1 למשך 30 שניות.
- פילמור בתיווך פורמין: הגדר את הגדרת הלחץ ל- Mid Flow 2. עם פורמין mDia1 בקצה התיל שלהם, חוטים צריכים להיות פולימריים בסביבות 50 sub/s 13,14,15.
- הכן את הפתרונות הבאים:
- פילמריזציה/דה-פולימריזציה מפורמין מעוגן פני השטח
הערה: שיעורי הפילמור והדה-פולימריזציה של קצוות תיל המעוטרים בפורמין הוכחו כתלויים במתח המופעל על החוט. במיקרופלואידיקה, החיכוך של זרימת הנוזל לאורך צד החוטים יוצר מתח פרופורציונלי לאורך החוט ולקצב הזרימה14,16.- השתמש בשיטה בסעיף 8 המתואר לעיל, והחלף את שלבים 8.1, 8.2 ו- 8.3 עבור פסיבציה של פני השטח ב:
- שנה צינור 3 ל 1 מיקרוגרם / מ"ל נוגדן נגדו ב- F-buffer. להזריק במשך 2 דקות עם זרימה גבוהה 3.
- החלף צינור 3 עם 5% BSA ב- F-buffer. הזריקו למשך 5 דקות ב-High Flow 3, ולאחר מכן 5 דקות ב-Mid Flow 3. במהלך שלב שני זה, הפחיתו את הלחץ בערוצים 1 ו-2 עד 7-8 mbar כדי לקבל זרימה נגדית ~-100 nL/min כך שכל משטחי התא יהיו פסיבציה BSA.
- שנה שפופרת 3 עד 100 ננומטר פורמין המתויג שלו ב- F-buffer. להזריק במשך 5 דקות עם זרימה גבוהה 3. החלף צינור 3 עם F-buffer. הזריקו במשך 5 דקות עם High Flow 3 כדי להבטיח שלא יישארו פורמינים בצינורות.
- הכן והזריק את הפתרונות הבאים (200-300 μL כל אחד, ב- F-buffer):
ערוץ 1: 1 μM 10% Alexa-488 מסומן G-actin.
ערוץ 2: 1 μM ללא תווית G-actin, 4 μM profilin.
ערוץ 3: מאגר F בלבד. - נוקלאציה של נימה: חשוף את הפורמינים המעוגנים בפני השטח ל-G-אקטין (הגדרת Mid Flow 1).
- פילמור נימה: חשוף את התא לפרופילין-אקטין באמצעות Mid Flow 2.
- התחלת רכישה: 1 מסגרת/2 שניות, אפיפלואורסצנציה. עם פורמין mDia1, חוטים צריכים להתפלמר ב 50-80 sub/s, בהתאם לאורך החוטים וקצב הזרימה14.
- דה-פולימריזציה של נימה: התחלת רכישה (1 מסגרת/4 שניות, אפיפלואורסצנציה). לאחר 1-2 מסגרות, חשוף את החוטים למאגר F, Mid Flow 3. עם פורמין mDia1, החוטים צריכים לעשות דה-פולימריזציה ב-5-15 תת-שניות, בהתאם לאורך החוטים ולקצב הזרימה14.
- השתמש בשיטה בסעיף 8 המתואר לעיל, והחלף את שלבים 8.1, 8.2 ו- 8.3 עבור פסיבציה של פני השטח ב:
- חוטי אקטין עם מקטעים ללא תווית
הערה: תיוג פלואורסצנטי של אקטין יוצר מספר ממצאים, כגון הפסקות במהלך דה-פולימריזציה17 וקשירת tropomyosin18 שונה. פתרון עוקף עבור ממצאים אלה הוא להשתמש במיקרופלואידיקה כדי להרכיב חוטים המציגים מקטעים ללא תווית.- הכן והזריק את הפתרונות הבאים (200-300 μL ב- F-buffer):
ערוץ 1: 1 μM ללא תווית G-actin, 1 μM profilin.
ערוץ 2: 0.3 μM 10% Alexa-488 מסומן G-actin. - ברצף חושפים את פני השטח לערוץ 2 (5 דקות), ערוץ 1 (10 דקות) וערוץ 2 (15 דקות) כדי ליצור מקטעים ללא תווית ADP-אקטין עם מקטעים מסומנים באופן פלואורסצנטי בכל קצה.
- הכן והזריק את הפתרונות הבאים (200-300 μL ב- F-buffer):
- חוטים מעוגנים קצה עם גלסולין
הערה: עם זרעי ספקטרין-אקטין, חוטים מתפלמרים בקצה התיל החופשי שלהם בעוד הקצה המחודד מיוצב על ידי זרע הספקטרין-אקטין. אלטרנטיבה היא לעגן חוטים עם קופר קצה תיל כגון גלסולין.- הכן תמיסת F-אקטין של 4 μM 10% Alexa-488 עם התווית G-actin ב-20 μL של מאגר F. תנו לאקטין לגרום ולפולימר באופן ספונטני ב-RT למשך 30 דקות לפחות על הספסל. עוטפים את הצינור בנייר אלומיניום כדי להגן עליו מפני אור.
- בינתיים, הכינו את התא המיקרופלואידי והעבירו את פני השטח בתערובת של 5% BSA ו-1% ביוטין-BSA (ראו שלב 8.2).
- יש לשטוף את ערוץ 3 עם F-buffer (2 דקות ב-High Flow 3). הזריקו 10 מיקרוגרם/מ"ל נויטרוודין ב-F-buffer (4 דקות ב-High Flow 3).
- שנה את הצינורות ל:
ערוץ 1: 10 ננומטר ביוטין-גלסולין (טבלה 1).
ערוץ 2: F-buffer.
ערוץ 3: 0.4 μM מראש F-actin. - הזריקו את כל הפתרונות יחד באמצעות ההגדרה High Flow All למשך 3 דקות.
- חשוף את כל החדר לג'לסולין (Mid Flow 1, 30 s).
- חברו חוטים לפני השטח (זרימה נמוכה 3: ערוץ 3 ב-3 mbar, ערוצים 1 ו-2 ב-~2 mbar, למשך כ-2 דקות).
- [אופציונלי] אם צפיפות החוטים נמוכה מדי, חזור על שלבים 9.5.6 ו- 9.5.7.
- דה-פולימריזציה סופית מחודדת: התחלת רכישה (1 מסגרת/30 שניות, אפיפלואורסצנציה). לאחר 1-2 מסגרות, יש לחשוף את החוטים למאגר בלבד, Mid Flow 2. חוטים צריכים לעבור דה-פולימריזציה בסביבות 0.2 תת-שנייה.
10. היווצרות ופירוק צרור חוטים המושרה על ידי Fascin על ידי ADF/cofilin
הערה: כדי ליצור צרורות חוטי אקטין, ודא שיש לך צפיפות זרע נימה גבוהה מספיק על פני השטח של החדר. כאשר נחשפים לחלבון קסין, חוטים שכנים המשתנים לרוחב יהיו מקושרים באופן דינמי על ידי חלבוני קסין. מכיוון שהקסם מתנתק במהירות מצד החוט19, הקסם צריך להיות נוכח כל הזמן בתמיסה הזורמת העיקרית על מנת לשמור על חיבור נימה.
- בצע את השלבים 8.1-8.3.
- הכן את הפתרונות הבאים (200-300 μL ב- F-buffer):
ערוץ 1, פתרון פולימריזציה: 1 μM 10% Alexa-488 מסומן G-actin, 1 μM profilin.
ערוץ 2, תמיסת מאגד: 200 ננומטר פאסין (טבלה 1), 0.15 μM 10% Alexa-488 עם תווית G-actin.
ערוץ 3, פתרון פירוק: 200 ננומטר ADF/קופילין (טבלה 1), 100 ננומטר fascin, 0.15 μM 10% Alexa-488 עם תווית G-actin. - שינוי צינורות 1 עד 3 (סעיף 7). הזריקו באמצעות ההגדרה הקבועה מראש של High Flow All , למשך 3-4 דקות.
- פילמור נימה: הגדר את הגדרת הלחץ ל - Mid Flow 1 למשך כ- 10 דקות. ניתן לצלם פילמור באמצעות TIRF.
- צירוף נימה (איור 4C): התחלת רכישת תמונה (1 פריים/5 שניות, אפיפלואורסצנציה). לאחר 1-2 מסגרות, הגדר את הגדרת הלחץ ל - Mid Flow 2 וצפה בהצמד נימה.
- פיצול צרור: התחלת רכישת תמונה (1 פריים/5 שניות, אפיפלואורסצנציה). לאחר 1-2 מסגרות, הגדר את הגדרת הלחץ ל- Mid Flow 3 והתבונן בפירוק המושרה על ידי קופילין של חוטים בודדים וצרורות.
11. הליך ניקוי מכשירים מיקרופלואידיים
הערה: כדי למנוע כל זיהום מניסוי אחד למשנהו, חיוני לנקות באופן נרחב ולייבש לחלוטין את כל הצינורות ומדי הזרימה לאחר כל ניסוי.
- נתקו את כל הצינורות מתא ה-PDMS והשליכו את התא.
- כדי לנקות צינורות PEEK ומדי זרימה, להדביק את הצינורות מסתיים בצינור פלסטיק ריק 15 מ"ל ולהזריק את התמיסות הבאות בלחץ מקסימלי עד שהמאגר כמעט ריק:
400 μL של F-buffer.
400 μL של 0.5 M NaOH.
400 μL של מים טהורים.
200 μL של איזופרופנול. - מחליפים במאגר ריק ומפוצצים אוויר עד שהצינורות מתייבשים לחלוטין (~2-4 דקות, לחץ מקסימלי).
12. ניתוח תמונות
הערה: בעוד שכתב יד זה מתמקד בשיטה להרכיב, לתפעל ולדמיין חוטי אקטין בודדים במיקרופלואידיקה, שיטה קצרה לניתוח סרטים שנרכשו מסופקת כאן. הניתוח מתבצע על תמונות של 16 סיביות, באמצעות ImageJ, להלן סעיף 8.
- הטיפול בתמונות הוא מינימלי:
- ייבא את ערימת התמונות של פילמור או דה-פולימריזציה.
- [אופציונלי] הומוגניזציה של עוצמת התמונה באמצעות פונקציה חיסור רקע (הגדרות ברירת מחדל (כלומר 'רדיוס כדור מתגלגל' = 50 פיקסלים)). זה שימושי במיוחד אם הפלואורסצנציה ברקע משתנה במהלך סרט או אם התאורה הפלואורסצנטית אינה הומוגנית על פני שדה הראייה.
- כוונו את הבהירות והניגודיות (רקע קרוב לאפס, חוטים קרובים למקסימום).
- צור קימוגרפיה של נימה:
- בחר נימה שאינה משתהה, נשברת או מתנתקת. אל תבחר על סמך התנהגות אחרת. צייר קו 1-2 פיקסלים למעלה (כלי קו ישר). שמור את מספר החוטים (הוסף מנהל ROI).
- החל את הפונקציה Reslice (ספירת פרוסות: 5 פיקסלים). חשב את העוצמה המרבית (פונקציה Zprojection).
- מדוד את קצב הפילמור/דה-פולימריזציה:
- על הקימוגרף, ציירו קו לאורך הקצה של תיל החוטים (כלי קו ישר , איור 4A). מדוד את רוחב הקו וגובהו (פונקציה מדידת מידה).
- חזור על שלבים 12.2-12.3 מעל חוטים מרובים. חישוב שיעורי הפילמור/דה-פולימריזציה (איור 4A):
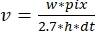 כאשר v הוא הקצב (בתת/ים), w רוחב הקו (פיקסלים), pix גודל הפיקסל (nm), h גובה הקו (מסגרות) ו - dt את הזמן בין מסגרות (בשנייה)., כאן, 2.7 ננומטר מתאים לתרומה האפקטיבית של תת-יחידה של אקטין לאורך החוט.
כאשר v הוא הקצב (בתת/ים), w רוחב הקו (פיקסלים), pix גודל הפיקסל (nm), h גובה הקו (מסגרות) ו - dt את הזמן בין מסגרות (בשנייה)., כאן, 2.7 ננומטר מתאים לתרומה האפקטיבית של תת-יחידה של אקטין לאורך החוט.
תוצאות
עבור כל הניסויים שתוארו לעיל, חוטי אקטין המסומנים באופן פלואורסצנטי צריכים להיות גלויים בבירור, עם ניגודיות טובה, המעידים על פלואורסצנציה נמוכה ברקע מפני השטח (איור 4, ראו קובץ משלים 1 לפתרון בעיות נפוצות). חוטי אקטין גם לא צריכים להיצמד לפני השטח: כאשר קצב הזרימה ה?...
Discussion
בהשוואה לשיטות סטנדרטיות של נימה יחידה שבהן חוטי אקטין מעוגנים לפני השטח על ידי נקודות מרובות לאורכם או נשמרים קרוב אליו על ידי חומר צפיפות כגון מתילצלולוז, מיקרופלואידיקה מציעה מספר יתרונות. מכיוון שהאינטראקציות עם פני השטח הן מינימליות, נמנעות ההפסקות המלאכותיות שאינטראקציות אלה יכול...
Disclosures
המחברים מצהירים על היעדר ניגודי עניינים.
Acknowledgements
אנו אסירי תודה לב' לאדו ולר'-מ'. מעבדת Mège לשימוש בציוד מנקה ה-UV שלהם, ו-J. Heuvingh ו-0. du Roure עבור האימון הראשוני שקיבלנו על הכנת תבניות על פרוסות סיליקון ומתן טיפים על microfluidics. אנו מכירים במימון מענק StG-679116 של מועצת המחקר האירופית (ל-A.J.) ומ-Agence Nationale de la Recherche מעניקים מוסקטין וקונפומין (ל-G.R.-L.).
Materials
| Name | Company | Catalog Number | Comments |
| β-Casein | Merck | C6905 | Used at 8 mg/mL |
| Biopsy punch (with plunger) | Ted Pella | 15115-2 | ID 0.75 mm, OD 1.07 mm |
| Biotin-BSA | Merck | A8549 | Used at 1 mg/mL |
| BSA | Merck | A8022 | Used at 50 mg/mL |
| Coverslip Mini-Rack Teflon holder | Invitrogen | C14784 | for 8 coverslips |
| Coverslips 22x40mm Thickness #1.5 | Menzel Gläser | 631-1370 | |
| DABCO | Merck | D27802 | component in f-buffer |
| DTT | Euromedex | EU0006-D | component in f-buffer |
| Ester NHS Alexa Fluor 488 | Invitrogen | A20000 | Fluorophore for actin labeling on Lys328. |
| EZ-Link Sulfo-NHS-Biotin | Thermo Scientific | 21338 | To biotinylate actin on Lys328 |
| Hellmanex III | Hellma | 9-307-011-4-507 | Glass cleaning detergent |
| ImageJ | NIH | N/A | open source software |
| Laboport | KNF | 811kn.18 | vacuum pump (ultimate vacuum: 240 mbar) |
| Magic invisible tape | Scotch | 7100024666 | standard transparent office tape |
| Micrewtube | Simport | T341-6T | 2 mL microfluidic reservoir tubes |
| Microfluidic device Part 1: Flow Unit S | Fluigent | FLU-S-D-PCKB | Flowmeter |
| Microfluidic device Part 2: Fluiwell-4C-2 mL | Fluigent | 14002001PCK | Reservoir holder |
| Microfluidic device Part 3: MFCS-EZ | Fluigent | EZ-11000001 EZ-00345001 | Pressure controller |
| Model 42 - UVO-Cleaner | Jelight Inc. | 42-220 | Ultraviolet cleaner |
| N6-(6-Aminohexyl)-ATP-ATTO-488 | Jena Bioscience | NU-805-488 | ATP-ATTO used to label actin |
| neutravidin | Thermo Scientific | 31000 | |
| PLL-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | Use at 1 mg/mL in PBS. |
| Polydimethylsiloxane (PDMS) Sylgard 184 Silicon Elastomer | Dow Corning | 1673921 | Contains PDMS base and curing agent |
| Polyetheretherketone (PEEK) tubing | Merck | Z226661 | “Blue” : I.D. = 0.25 mm |
| Safety blow gun | Coilhose Pneumatics | 700-S | filtered air |
| Silicon tubing | VWR | 228-0701P | connect PEEK to coupler |
| Stainless steel catheter coupler | Prime Bioscience | SC22/15 | Inserted into PDMS inlets and outlet to connect to PEEK tubing |
| Thermoplastic film | Sigma Aldrich | PM996 | Standard "parafilm" |
| Ultrapure ethanol | VWR | 64-17-5 | |
| Ultrasonic cleaning bath | VWR | USC200TH | To accomodate 1 L beakers |
| Vacuum dessicator | SP Bel-Art | F42022-0000 | to degas the PDMS or solutions |
References
- Wioland, H., Jégou, A., Romet-Lemonne, G. Celebrating 20 years of live single-actin-filament studies with five golden rules. Proceedings of the National Academy of Sciences of the United States of America. 119 (3), 2109506119 (2022).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophysical Journal. 88 (2), 1387-1402 (2005).
- Brewer, L. R., Bianco, P. R. Laminar flow cells for single-molecule studies of DNA-protein interactions. Nature Methods. 5 (6), 517-525 (2008).
- Jégou, A., et al. Individual actin filaments in a microfluidic flow reveal the mechanism of ATP hydrolysis and give insight into the properties of profilin. PLoS Biology. 9 (9), 1001161 (2011).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal x-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133 (2018).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments: JoVE. (86), e50549 (2014).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Zimmermann, D., Morganthaler, A. N., Kovar, D. R., Suarez, C. In vitro biochemical characterization of cytokinesis actin-binding proteins. Methods in Molecular Biology. 1369, 151-179 (2016).
- Funk, J., et al. Profilin and formin constitute a pacemaker system for robust actin filament growth. eLife. 8, 50963 (2019).
- Pandit, N. G., et al. Force and phosphate release from Arp2/3 complex promote dissociation of actin filament branches. Proceedings of the National Academy of Sciences of the United States of America. 117 (24), 13519-13528 (2020).
- Wioland, H., et al. ADF/Cofilin accelerates actin dynamics by severing filaments and promoting their depolymerization at both ends. Current Biology: CB. 27 (13), 1956-1967 (2017).
- Pollard, T. D., Mooseker, M. S. Direct measurement of actin polymerization rate constants by electron microscopy of actin filaments nucleated by isolated microvillus cores. The Journal of Cell Biology. 88 (3), 654-659 (1981).
- Kovar, D. R., Harris, E. S., Mahaffy, R., Higgs, H. N., Pollard, T. D. Control of the assembly of ATP- and ADP-actin by formins and profilin. Cell. 124 (2), 423-435 (2006).
- Jégou, A., Carlier, M. -. F., Romet-Lemonne, G. Formin mDia1 senses and generates mechanical forces on actin filaments. Nature Communications. 4, 1883 (2013).
- Breitsprecher, D., et al. Rocket launcher mechanism of collaborative actin assembly defined by single-molecule imaging. Science. 336 (6085), 1164-1168 (2012).
- Courtemanche, N., Lee, J. Y., Pollard, T. D., Greene, E. C. Tension modulates actin filament polymerization mediated by formin and profilin. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9752-9757 (2013).
- Niedermayer, T., et al. Intermittent depolymerization of actin filaments is caused by photo-induced dimerization of actin protomers. Proceedings of the National Academy of Sciences. 109 (27), 10769-10774 (2012).
- Gateva, G., et al. Tropomyosin isoforms specify functionally distinct actin filament populations in vitro. Current Biology: CB. 27 (5), 705-713 (2017).
- Aratyn, Y. S., Schaus, T. E., Taylor, E. W., Borisy, G. G. Intrinsic dynamic behavior of fascin in filopodia. Molecular Biology of the Cell. 18 (10), 3928-3940 (2007).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. The Journal of Cell Biology. 103, 2747-2754 (1986).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Torsional stress generated by ADF/cofilin on cross-linked actin filaments boosts their severing. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2595-2602 (2019).
- Colombo, J., et al. A functional family of fluorescent nucleotide analogues to investigate actin dynamics and energetics. Nature Communications. 12 (1), 548 (2021).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. The Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Romet-Lemonne, G., Guichard, B., Jégou, A. Using microfluidics single filament assay to study formin control of actin assembly. Methods in Molecular Biology. 1805, 75-92 (2018).
- Gieselmann, R., Kwiatkowski, D. J., Janmey, P. A., Witke, W. Distinct biochemical characteristics of the two human profilin isoforms. European Journal of Biochemistry. 229 (3), 621-628 (1995).
- Lin, D. C., Lin, S. Actin polymerization induced by a motility-related high-affinity cytochalasin binding complex from human erythrocyte membrane. Proceedings of the National Academy of Sciences of the United States of America. 76 (5), 2345-2349 (1979).
- Casella, J. F., Maack, D. J., Lin, S. Purification and initial characterization of a protein from skeletal muscle that caps the barbed ends of actin filaments. The Journal of Biological Chemistry. 261 (23), 10915-10921 (1986).
- Kremneva, E., et al. Cofilin-2 controls actin filament length in muscle sarcomeres. Developmental Cell. 31 (2), 215-226 (2014).
- Le Clainche, C., Carlier, M. -. F. Actin-based motility assay. Current Protocols in Cell Biology. , 1-20 (2004).
- Vignjevic, D., et al. Formation of filopodia-like bundles in vitro from a dendritic network. The Journal of Cell Biology. 160 (6), 951-962 (2003).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. eLife. 5, 13470 (2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Molecular Biology of the Cell. 27 (22), 3563-3573 (2016).
- Suzuki, E. L., et al. Geometrical constraints greatly hinder formin mDia1 activity. Nano Letters. 20 (1), 22-32 (2020).
- Wioland, H., Suzuki, E., Cao, L., Romet-Lemonne, G., Jegou, A. The advantages of microfluidics to study actin biochemistry and biomechanics. Journal of Muscle Research and Cell Motility. 41 (1), 175-188 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved