Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek Aktin Filamentlerin ve Demetlerin Montaj Dinamiğini İncelemek için Mikroakışkanlar ve Floresan Mikroskobu Kullanma
Bu Makalede
Özet
Basit aktin filament mikroakışkan tahlilleri için, floresan mikroskobu ile birlikte, bireysel aktin filamentlerini gerçek zamanlı olarak doğru bir şekilde izlemeyi ve sırayla farklı protein çözeltilerine maruz bırakmayı sağlayan protokoller sunuyoruz.
Özet
Aktin filamentlerinin montajını ve sökülmesini düzenleyen karmaşık moleküler mekanizmaları deşifre etmek için, iyi kontrol edilen koşullarda yaşayan bireysel reaksiyonları izlemek büyük bir varlıktır. Bunu yapmak için, son 20 yılda, çoğunlukla toplam iç yansıma floresan (TIRF) mikroskobu kullanılarak canlı tek filament deneyleri ortaya çıkmış ve bir dizi önemli sonuç sağlamıştır. 2011 yılında, bu deneylerin olanaklarını daha da genişletmek ve tekrarlayan sorunlu eserlerden kaçınmak için, bu testlere basit mikroakışkanlar getirdik. Bu çalışma, bireysel aktin filamentlerinin pasifleştirilmiş örtü kayma yüzeyine bir ucuyla tutturulduğu, akışla hizalandığı ve farklı protein çözeltilerine art arda maruz bırakılabildiği temel protokolümüzü detaylandırmaktadır. Ayrıca belirli uygulamalar için protokolleri sunuyoruz ve akan çözeltinin viskoz sürtünmesi sayesinde kontrollü mekanik kuvvetlerin nasıl uygulanabileceğini açıklıyoruz. Bu deneylerin teknik uyarılarını vurguluyoruz ve bu tekniğe dayanan olası gelişmeleri kısaca sunuyoruz. Bu protokoller ve açıklamalar, günümüzde kullanımı kolay mikroakışkan ekipmanlarının mevcudiyeti ile birlikte, uzman olmayanların bu testi laboratuvarlarında uygulamalarına izin vermelidir.
Giriş
Aktin filamentlerinin ve aktin filament ağlarının montajı ve sökülmesi, çeşitli biyokimyasal reaksiyonlarla kontrol edilir ve mekanik bağlama bağlıdır. Bu karmaşık mekanizmalar hakkında fikir edinmek için, bireysel filamentler üzerindeki bireysel reaksiyonları (yeterince büyük sayılarda) gözlemleyebilmek paha biçilmezdir. Son yıllarda, dinamik aktin filamentlerinin gerçek zamanlı olarak, çoğunlukla toplam iç yansıma floresan (TIRF) mikroskobu kullanılarak gözlemlenmesi, anahtar bir teknik olarak ortaya çıkmış ve toplu çözelti biyokimyasal tahlilleri ile elde edilemeyen sonuçların etkileyici bir listesini sağlamıştır1.
Bunu başarmak için, floresan olarak etiketlenmiş aktin filamentlerini mikroskop kapağının yüzeyine yakın tutmak ve bunları floresan olarak etiketlenebilen aktin bağlayıcı proteinlerin (ABP'ler) çözeltilerine maruz bırakmak gerekir. Bunu yapmak, iyi kontrol edilen biyokimyasal koşullarda bireysel filamentlerde meydana gelen olayları izlemek ve böylece reaksiyon hızlarını ölçmek için bir araç sağlar. Bununla birlikte, bir dizi özel sınırlama dikkate alınmalıdır. Filamentlerin yüzeye yakın yapay olarak korunması, genellikle birden fazla sabitleme noktası sayesinde veya metilselüloz gibi bir kalabalık ajan kullanarak, davranışlarını değiştirebilir (örneğin, polimerizasyon ve depolimerizasyonda duraklamalara neden olabilir2). Her bir filamentin konturunu izlemek, özellikle de zaman içinde görüş alanında yeni filamentler veya filament parçaları birikirse, zor olabilir. Reaksiyonlar, aktin monomerlerinin ve ABP'lerin konsantrasyonunun zamanla değişebileceği sonlu bir hacimde gerçekleşir ve potansiyel olarak doğru hız sabitlerinin elde edilmesini zorlaştırır. Son olarak, ABP'lerin çözeltisinin yenilenmesi veya değiştirilmesi 30 saniyeden daha kısa sürede elde etmek zordur ve genellikle numunede homojen olmayan protein içeriğine yol açacaktır.
10 yıldan biraz daha uzun bir süre önce, bireysel Deoksiribonükleik Asit (DNA) iplikçikleri3'ü incelemek için zaten yapılanlardan esinlenerek, bireysel aktin filamentlerini gözlemlemek ve manipüle etmek için mikroakışkanlara dayanan yeni bir teknik sunduk4. Klasik tek filament tekniklerinin yukarıda belirtilen sınırlamalarını aşmaya izin verir. Bu mikroakışkan tahlillerinde, aktin filamentleri, kapak kayması üzerine adsorbe edilen spektrin-aktin tohumlarından yetiştirilir. Filamentler böylece bir uçtan sadece mikroakışkan odanın dibine sabitlenir ve yapışmadan yüzeyin üzerinde dalgalanır. Filamentler, gelen çözeltilerin akışıyla aynı hizadadır, böylece kontur uzunluklarının izlenmesini kolaylaştırır ve bunları TIRF'nin kullanılabileceği kapak kaymasının üzerindeki sığ bir bölgede tutar. Farklı çözeltiler aynı anda karıştırmadan odaya akar ve filamentler bunlara sırayla ve hızlı bir şekilde maruz bırakılabilir.
Burada, laboratuvarda tek aktin-filament mikroakışkan testleri oluşturmak için bir dizi temel protokol öneriyoruz. Kapaklar ve mikroakışkan odaları önceden hazırlanabilir (yarım gün içinde) ve birkaç biyokimyasal koşulun test edilebileceği deneyin kendisi bir günden daha kısa sürede yapılır.
Protokol
1. Mikroakışkan oda hazırlığı
- Birkaç hazne desenine sahip bir SU-8 ana kalıp seçin. Tipik odalar, 20 μm yüksekliğinde ve 800 μm genişliğinde üç giriş ve bir çıkış ile çapraz şekillidir (Şekil 1). Bu tür ana kalıplar harici şirketlerden satın alınabilir veya akademik laboratuvarlarda yapılabilir (örneğin, Gicquel, Y. ve ark.5).
- Bandı kalıbın kenarına yerleştirin.
- ~50 cm uzunluğunda, 19 mm genişliğinde, standart şeffaf ofis bandını (bkz. Malzeme Tablosu) yapışkan tarafı yukarı doğru bir tezgahın üzerine koyun. Kalıbı dikey olarak bir uca ve bandın orta çizgisi boyunca yerleştirin.
- Kalıbın etrafında 1 cm'lik bir kenarlık oluşturmak için kalıbı bandın diğer ucuna yuvarlayın. Bandı kalıbın dibine katlayın.
- Polidimetilsiloksan (PDMS) çözeltisi hazırlayın.
- Tek kullanımlık bir tartım kabında, doğrudan 25-30 g PDMS tabanı dökün (Malzeme Tablosu). Tek kullanımlık plastik Pasteur pipetle %10 ağırlık/ağırlık PDMS kürleme maddesi (Malzeme Tablosu) ekleyin.
- Plastik bir çubukla manuel ve iyice karıştırın. Kürleme maddesinin, karıştırma çok sayıda kabarcık oluştursa bile, PDMS tabanına iyi bir şekilde dahil edildiğinden emin olun.
- PDMS çözeltisini oda sıcaklığında (RT) en az 5 dakika boyunca vakumlu bir kurutucuda (Malzeme Tablosu) gazdan arındırın. Kabarcıklar genişleyecek, yüzeye çıkacak ve vakum kırıldığında patlayacaktır.
- PDMS çözeltisini SU-8 kalıbının üzerine dökün. Karışımın mümkün olduğunca çoğunu kazımak ve aktarmak için plastik bir çubuk kullanın.
- PDMS'yi ikinci kez gazdan arındırın (vakumlu kurutucuda 5 dakika). Çoğu kabarcıktan kurtulduğunuzdan emin olun (üst yüzeydeki birkaç küçük kabarcık iyidir).
- PDMS'nin retiküle olması ve katılaşması için kalıbı 70 °C'de en az 5 saat boyunca bir fırına yerleştirin.
- Katı PDMS odalarını kalıptan çıkarın.
DİKKAT: SU-8 kalıpları için silikon gofretler son derece kırılgandır, bu nedenle PDMS'yi gofretlerden ayırırken kapsamlı özen gösterilmelidir. Sert, düz bir yüzey üzerinde çalışın ve gofreti yüzeyde düz tutun.- Bir tıraş bıçağı ile, PDMS'de, kalıbın kenarından yaklaşık 1 cm uzakta dairesel bir kesim yapın. Tüm desenler kesimin içinde en az 0,5 cm olmalıdır. Merkezi PDMS bloğunu nazik römorkörlerle yavaşça soyun.
DİKKAT: Soyulurken, kırılmasını önlemek için SU-8 kalıbını tezgahın üzerinde düz tutun. - PDMS'yi, yüzeyini tozdan korumak ve desenleri daha görünür hale getirmek için alüminyum folyoya bakan kalıplanmış yüzey olan temiz alüminyum folyo üzerine yerleştirin.
- Bir tıraş bıçağı ile, PDMS'de, kalıbın kenarından yaklaşık 1 cm uzakta dairesel bir kesim yapın. Tüm desenler kesimin içinde en az 0,5 cm olmalıdır. Merkezi PDMS bloğunu nazik römorkörlerle yavaşça soyun.
- Desenden en az 0,5 cm uzakta jilet bıçağı olan bir oda seçin ve kesin. Ortaya çıkan PDMS bloğu yaklaşık 0,5 cm yüksekliğinde, 1,5 cm genişliğinde ve 3 cm uzunluğundadır. Biyopsi zımba 0.75 mm ID (Malzeme Tablosu) ile üç giriş ve bir çıkış delin.
- PDMS odasını ultra saf etanol (Malzeme Tablosu) ile temizleyin ve güvenli bir üfleme tabancası (Malzeme Tablosu) kullanarak hava ile kurutun. PDMS'yi deseni yukarı bakacak şekilde temiz bir Petri kabına yerleştirin ve kabı kapağıyla kapatın.
2. Cam kapak kapağı temizliği
NOT: Burada, bir dizi sonikasyon adımına dayanan standart bir kapak kapağı temizleme prosedürü detaylandırılmıştır. Diğer cam kapak temizleme prosedürleri, benzer tatmin edici sonuçlar elde edebilecek diğer birçok yayında tanımlanmıştır 6,7,8,9.
- Bir Politetrafloroetilen (PTFE) tutucu üzerine 10-20 kapak kapağı (40 mm uzunluğunda) yerleştirin (Malzeme Tablosu). Kapakları 1 L cam beherde (35 ° C, 30 dakika) 0,5 L% 2 cam temizleme çözeltisinde (Malzeme Tablosu) sonikleştirin.
- Cam temizleme solüsyonunu atın ve kapakları dH2O ile en az üç ardışık 0,5 L banyoda yoğun bir şekilde durulayın.
- 1 L'lik bir cam beherde 0,5 L 2 M KOH hazırlayın. Kapak fişlerini KOH olarak sonikleştirin (RT, 30 dk). KOH'yi atın ve kapakları dH2O ile en az üç 0,5 L banyoda durulayın.
DİKKAT: Uygun laboratuvar güvenliği koruma ekipmanlarını (eldivenler, gözlükler ve laboratuvar önlüğü) kullanın. - Kapakları 0,5 L ultra saf etanol (RT, 30 dakika) içinde aktarın ve sonikleştirin. Kapaklar 2 haftaya kadar etanolde tutulabilir. Buharlaşmayı önlemek için beheri termoplastik filmle (Malzeme Tablosu) kapatın. Kullanmadan önce, kapak kaymasını hava akımı ile kurulayın.
3. PDMS oda montajı
- Sıcak plakayı önceden 100 °C'ye ısıtın. Üç adede kadar temizlenmiş PDMS haznesini ve cam kapakları temiz bir Petri kabına yerleştirin. Açık Petri kabını derin bir Ultraviyole (UV) temizleyiciye (λ = 185 nm, Malzeme Tablosuna bakınız) yerleştirin ve 3-5 dakika boyunca UV ışığına maruz bırakın.
NOT: Alternatif olarak, PDMS odaları ve kapakları 30 saniye boyunca havaya veya oksijen plazmasına maruz kalabilir. - PDMS odasını yavaşça kapak kapağının üzerine yerleştirin. Temas eden iki yüzeyin doğrudan UV'ye maruz kaldığından emin olun. PDMS otomatik olarak cama yapışır ve hazne açıkça görünür hale gelir.
- PDMS-coverslip arayüzünde sıkışan havayı gidermek için, yüzeye parmağınızla çok nazikçe bastırın. Daha sıkı bir yapıştırma için, köşelere ve kenarlara daha güçlü bir şekilde bastırın. Odanın tavanının cam yüzeyle temas etmediğinden emin olun.
- Odayı, cam tabanı sıcak plakaya bakacak şekilde 5 dakika boyunca 100 °C'ye yerleştirin. Bu adımdan sonra, cam-PDMS bağları kalıcı hale gelir ve odalar sadece bir kez kullanılabilir. Odayı hemen kullanın veya bir haftaya kadar temiz bir Petri kabında saklayın.
4. [İSTEĞE BAĞLI] Doğrudan pasivasyon ve işlevselleştirme
NOT: Uygulamaya bağlı olarak, hazneler mikroakışkan kontrol cihazına bağlandıktan sonra ( Malzeme Tablosuna bakınız) veya mikroakışkan cihaza bağlanmadan önce çözeltileri doğrudan bir pipetle birlikte odaya manuel olarak enjekte ederek pasifleştirilebilir ve işlevselleştirilebilir. İkincisi, daha az reaktif tüketme ve çözeltiyi mikroakışkan cihazın polieter eter keton (PEEK) borusundan geçirerek potansiyel kontaminasyonu önleme avantajı sunar. Aşağıdaki tüm adımlarda, pipet ucu doğrudan prize yapıştırılarak çözeltiler enjekte edilir. Haznenin içinde kabarcıklar oluşmasını önlemek için, ucu PDMS haznesinin çıkışına takarken pipet ucundan küçük bir damlacık yapıştığından emin olun. Aynı şekilde, tüm hacim enjekte edilmeden önce pipet ucunu çıkarın.
- 20 μL PLL-PEG enjekte edin (Fosfat tamponlu salin (PBS) içinde 1 mg/mL). RT'de en az 1 saat (veya bir gecede) inkübe edin. Buharlaşmayı önlemek için, PDMS haznesini nemli bir kutuya yerleştirin (örneğin, alt bölmede su bulunan boş bir uç kutusu ve uç tutma platformundaki PDMS haznesi).
- 20 μL 100 pM spektrin-aktin tohumu enjekte edin (F-tamponunda, bakınız Tablo 1 ve Tablo 2). En fazla 1 dakika bekleyin. Tohum yüzey yoğunluğunu, büyük istatistikler için yeterince yüksek ve filamentlerin üst üste binmemesi için yeterince düşük olacak şekilde ayarlamak için tohum konsantrasyonunu ve zamanlamasını ayarlayın.
NOT: Alternatif olarak, spektrin-aktin tohumları mevcut değilse, streptavidin kaplı bir kapak parçası 9,10 üzerinde hareketsiz hale getirilecek biyotin işlevselleştirilmiş kısa filament segmentleri kullanın. - [İSTEĞE BAĞLI] F-tamponuna 20 μL %5 sığır serum albümini (BSA) enjekte edin. RT'de 10 dakika bekletin.
- [İSTEĞE BAĞLI] F-tamponuna 20 μL 1 mg/mL β-kazein enjekte edin. RT'de 10 dakika bekletin.
NOT: Odayı daha fazla pasifleştirmek için 4.3 ve/veya 4.4 adımlarını izleyin. Pasivasyon seçimi kullanılan proteinlere bağlıdır ve tüm ABP'lerde eşit derecede iyi çalışmaz. Tek başına aktin kullanıldığında, PLL-PEG veya BSA yeterlidir.
5. Mikroakışkan cihazı bağlayın
NOT: Mikroakışkan odasındaki akışları kontrol etmek için dört kanala kadar basınca dayalı bir mikroakışkan sistem kullanın (Şekil 1A, bkz. Mikroakışkan borularda kabarcıkların oluşmasını ve akış stabilitesini bozmasını önlemek için, tüm çözeltilerin gazını çözün. 5 mL dH20 ve 10 mL F-tampon stoğunu bir vakum pompasına bağlı bir vakum kurutucusuna yerleştirin (nihai vakum <250 mbar) ve RT'de en az 1 saat boyunca gazdan arındırın.
- Giriş ve çıkış borularını dH2O (500 μL, 300 mbar) ile durulayın.
- Tüm 2 mL rezervuar tüplerini (Malzeme Tablosuna bakınız) 300 μL F-tamponu ile doldurun. Basıncı 300 mbar'a ayarlayın ve beş ila sekiz damlanın boşa gitmesine izin verin. Her kanal için tekrarlayın ve basıncı 0 olarak ayarlayın.
- Prizi bağlayın ve odayı iyice durulayın.
- Rezervuar borusu 4 (çıkış) basıncını 50 mbar'a ayarlayın. Boru ucundan bir damlacık çıktığında, boruyu PDMS odasının çıkışına bağlayın. Sıvı hazneyi doldurur ve tüm girişlerden çıkar.
- [İSTEĞE BAĞLI] Oda doğrudan pasifleştirilmişse (bölüm 4), odayı 50-100 μL F-tamponu (3-5 dakika) ile durulamak için basıncı 100 mbar'a ayarlayın. Girişlerdeki fazla sıvıyı bir temizleme mendili ile çıkarın.
- Basıncı 20 mbar'a ayarlayın.
- Girişleri bağlayın.
- Rezervuar borusunun basıncını 1 ila 50 mbar olarak ayarlayın. Hava kabarcıklarının ortaya çıkmasını önlemek için, borudan ve PDMS girişinden bir damlacık çıktığından emin olun.
- Boruyu giriş 1'e bağlayın (bağlanırken birleşen iki damlacık). Basıncı 30 mbar'a ayarlayın.
- Giriş 2 ve 3'ü bağlamak için 5.4.1-5.4.2 arasındaki adımları yineleyin.
- Tüm girişlerin basıncını 20 mbar'a ve çıkış basıncını 0 mbar'a ayarlayın. Girişlerdeki akış hızlarının kabaca eşit olduğundan emin olun (Sorun Giderme bölümüne bakın).
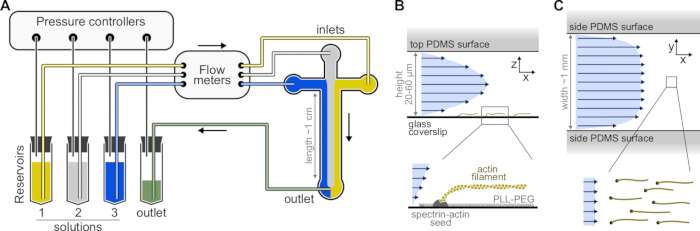
Şekil 1: Bir mikroakışkan odasından çözeltilerin enjekte edilmesi . (A) Tek aktin filament deneyleri için standart mikroakışkan kurulumu. 1-3 rezervuarlarına yerleştirilen protein çözeltileri, gaz fazındaki basıncı ayarlayarak odaya itilir. Üretilen akış hızları debimetrelerle ölçülür. Mikroakışkan odaların içinde, çözeltiler uygulanan bağıl basınçlara bağlı olarak karışmaz ve yer kaplamaz (burada, tüm girişlerde eşit basınç). Tipik boyutlar: rezervuar tüpleri 2 mL'ye kadar çözelti içerir. PEEK borusu (0,25 mm iç çap) rezervuarları debimetrelere (10 cm borudan sonra) ve ardından PDMS odasına (70 cm sonra) bağlar. PEEK borusunu PDMS girişlerine bağlamak için silikon boru ve paslanmaz çelik boru bağlayıcılar kullanılır. Ana mikroakışkan kanal 20-60 μm yüksekliğinde, yaklaşık 1 mm genişliğinde ve 1 cm uzunluğundadır. (B,C) Mikroakışkan haznenin içindeki akış profilleri. (B) Sıvı, oda yüksekliği boyunca parabolik bir profil oluşturur: v(z) = 6z(h-z)R/h3w, burada h ve w oda yüksekliği ve genişliğidir ve R toplam akış hızıdır. Alt: Yüzeye implante spektrin-aktin tohumlarından polimerize edilmiş tek aktin filament. (C) Hazne genişliği yüksekliğinden önemli ölçüde daha büyük olduğunda, akış, sıfıra indiği PDMS yüzeyleri hariç, oda boyunca neredeyse homojendir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. Kurulumu standart akış hızlarıyla yapılandırma
NOT: Bilgisayar kontrollü basınç sistemi, PDMS odasına bağlı tüm girişlerin/çıkışların basınçlarının kolay ve hassas bir şekilde ayarlanmasını sağlar, böylece gelen ve çıkan akış hızlarının kontrolünü sağlar. Önceden ayarlanmış yapılandırmalar kaydedilebilir ve tek bir fare tıklamasıyla açılıp kapatılabilir. Aşağıda önerilen konfigürasyonlar verilmiştir (aksi belirtilmedikçe, çıkış basıncı 0 mbar olarak ayarlanmıştır). Bu önceden ayarlanmış yapılandırmalar için beklenen akış hızları için Tablo 3'e bakın. Burada belirtilen basınçlar, oda geometrisine ve sistem konfigürasyonuna bağlı olarak ayarlanmalıdır.
-
Değiştir: Bir veya daha fazla rezervuarı değiştirirken bu hazır ayarı kullanın. Kabarcıkların ortaya çıkmasını önlemek için ilgilenilen boruda hafif bir geriye doğru akış oluşturur.
- Tüm giriş basınçlarını 12 mbar'a ve çıkış basıncını 5 mbar'a ayarlayın (Şekil 2B).
-
Yüksek Akışlı 'Tümü': Üç çözümü paralel olarak hızla enjekte etmek için bu ön ayarı kullanın. 4 dakika içinde odaya ulaşacaklar.
- Tüm giriş basınçlarını 150 mbar'a ayarlayın.
-
Yüksek Akışlı 'x': Bir çözeltiyi hızlı bir şekilde enjekte etmek için bu ön ayarı kullanın. 3 dakika içinde odaya ulaşacaktır (Şekil 3A-C).
- Giriş 'x' basıncını 150 mbar'a (~15 μL/dak) ayarlayın. Diğer girişlerdeki basınç yaklaşık 100 mbar'a ayarlanır, böylece bu girişlerde ortaya çıkan akış hızı ~ 500 nL / dak'dır.
-
Orta Akış 'Tümü': Sistemi duraklatmak için bu hazır ayarı kullanın.
- Tüm girişleri 20 mbar'a ayarlayın (Şekil 2A).
-
Orta Akış 'x': Diğer giriş çözümlerini kanal taraflarıyla kısıtlarken 'x' çözümünün ana kanal genişliğinin çoğunu doldurmasına izin vermek için bu hazır ayarı kullanın (bkz. Şekil 2C, D). Böylece odadaki aktin filamentleri sadece 'x' çözeltisi tarafından dayatılan biyokimyasal duruma maruz kalacaktır.
- Giriş 'x' basıncını 12 mbar'a ayarlayın. Diğer girişlerdeki basıncı ayarlayın ve ilgili akış hızları ~ 150 nL / dak olacak şekilde ~ 9 mbar'a ayarlayın.
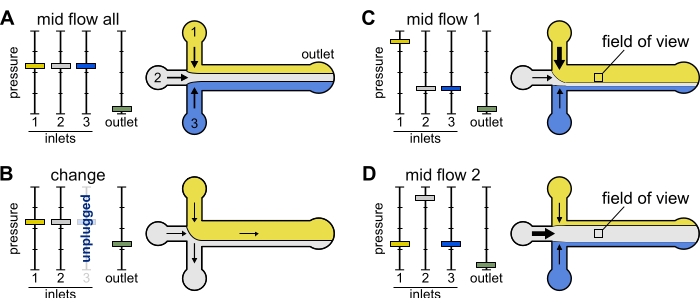
Şekil 2: Her rezervuara uygulanan basınç, mikroakışkan oda içindeki çözeltilerin bölünmesini/mekansal dağılımını kontrol eder. (A) Rezervuarlara uygulanan eşit basınçla, her çözelti odanın üçte birini kaplar. (B) Bir rezervuar tüpünü değiştirirken (burada rezervuar 3), etkin basınç sıfıra düşer ve geriye doğru bir akış oluşturur. (C,D) Rezervuarlardan birindeki bağıl basıncın arttırılması, cam yüzeyin tek bir çözeltiye maruz kalmasını sağlar. Odanın ortasındaki görüş alanı, Orta Akış 1 (C) ve Orta Akış 2 (D) konfigürasyonları arasında geçiş yaparak sırasıyla çözüm 1 ve 2'ye maruz bırakılabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
7. 'x' çözümünü değiştirme
NOT: Şekil 3A-C'de gösterildiği gibi, çözeltilerin bir rezervuar tüpünden odanın ana kanalına akmasının dakikalar sürdüğünü akılda tutmak önemlidir. Bu minimum 'ölü' süre, boruda bulunan sıvı hacmi ve boru içindeki akış profili tarafından uygulanır (Şekil 3A-C).
- Yeni bir rezervuar tüpünde 200-300 μL çözelti hazırlayın. Basıncı Ayarı değiştir olarak ayarlayın (bkz. bölüm 6).
- Giriş 'x' rezervuar tüpünü sökün. Borudaki çözelti, odadan serbest boru ucuna yavaşça geriye doğru akacaktır. Ölçülen akış hızı negatif olur (Şekil 2B).
- Boru ucunda küçük bir damlacık oluştuğunda, yeni tüpü taze çözelti ile vidalayın. Tüp basınç sistemine doğru şekilde sıkıldıktan sonra, girişin akış hızı pozitife döner.
- Basınç ayarını Yüksek Akış 'x' olarak ayarlayın.
- Mikroakışkan konfigürasyona ve oda geometrisine bağlı olarak, çözeltinin boruyu tamamen doldurması ve odaya ulaşması için 3-5 dakika bekleyin.
- [İSTEĞE BAĞLI] Zaman içinde floresandaki artışı ölçerek bu işlemi izleyin (Şekil 3C).
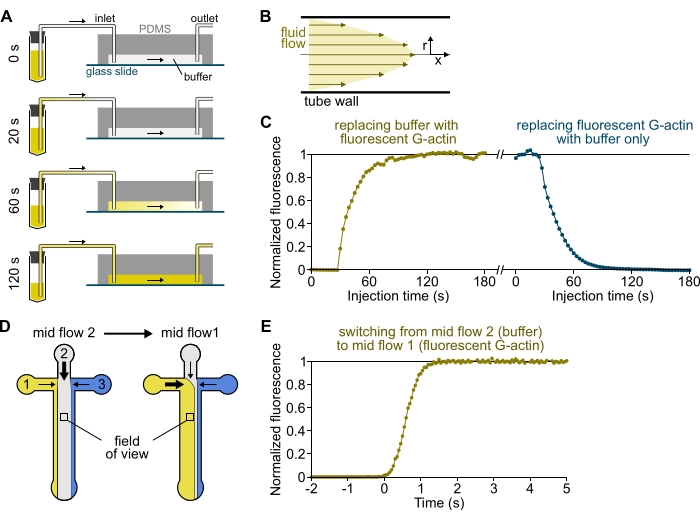
Şekil 3: Çözeltilerin rezervuarlardan PDMS odasına gecikmeli olarak ulaşması ve biyokimyasal koşulların hızlı değişimi. (A-C) Çözeltilerin rezervuarlardan PDMS odasına gecikmeli olarak gelmesi. (A) Oda geometrisine, boru uzunluğuna ve giriş(ler)de uygulanan basınca bağlı olarak, bir çözeltinin bir başkasıyla değiştirilmesi anlık değildir. Rezervuar tüpünü floresan çözeltisi (0 dakika) içeren bir tüpe değiştirdikten sonra, çözelti boruyu (0,4 dakika) ve PDMS odasını (1-2 dakika) kademeli olarak doldurur. 150 mbar uygulanan basınç, 80 cm PEEK boru ve 1600 μm genişliğinde, 20 μm yüksekliğinde PDMS odası için gösterge zamanlaması verilmiştir. (B) PEEK borusunun içindeki parabolik akış profili, boru radyal profili boyunca ve odanın içinde etkili bir floresan gradyanı oluşturur (ayrıca bakınız Şekil 1B). (C) Çözeltilerin gecikmeli gelişi, odanın arka plan epifloresan sinyalinin zamanın bir fonksiyonu olarak ölçülmesiyle ölçülebilir. Deneysel koşullar: 0.5 μM %10 Alexa-568 etiketli G-actin, bir debimetre ve 80 cm PEEK boru ile 150 mbar enjekte edilir. (D,E) Biyokimyasal koşulların hızlı değişimi. (D) İki Orta Akış koşulunda gelen çözümlerin modeli. (E) Aktin konsantrasyonunun okunması olarak arka plan floresansında artış. Zaman t = 0, floresan artışı başlangıcı olarak ayarlanır. Çözüm 1: 0,5 μM %10 Alexa-488 etiketli G-aktin, çözelti 2: F-tamponu. (C,E) PDMS odası: 20 μm yüksekliğinde ve 1600 μm genişliğinde. Yüzeyin ~ 2 μm yukarısındaki epifloresan yoğunluğu, sinyalin tam görüş alanı üzerindeki ortalaması alınarak ölçüldü, florofor yokluğunda 0'a ve maksimum yoğunlukta 1'e normalleştirildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
8. Temel tek filament deneyi: Adenozin difosfat (ADP)-aktin dikenli uç depolimerizasyonu
NOT: Bu bölüm, işlevselleştirilmemiş bir bölme varsayar (yalnızca bölüm 5). Oda doğrudan işlevselleştirilmişse (bölüm 4), adım 8.4'ten başlayın.
- Aktin filament tohumları ile yüzey fonksiyonelleştirme:
- F-tamponunda 50 pM spektrin-aktin tohumu11'in 3 ila 200 μL çözeltisini değiştirin (bkz. bölüm 7).
NOT: Alternatif olarak, spektrin-aktin tohumları mevcut değilse, streptavidin kaplı bir kapak parçası üzerinde hareketsiz hale getirilecek biyotin işlevselleştirilmiş kısa filament segmentleri kullanılabilir (ayrıntılar için 9,10'a bakınız). - Yüksek Akışlı 3 ile 2 dakika boyunca enjekte edin.
NOT: Son tohum yoğunluğuna bağlı olarak konsantrasyonu ve zamanı ayarlayın.
- F-tamponunda 50 pM spektrin-aktin tohumu11'in 3 ila 200 μL çözeltisini değiştirin (bkz. bölüm 7).
- Yüzey pasivasyonu:
- F tamponunda 300 μL %5 BSA ile tüp 3'ü değiştirin.
- Yüksek Akış 3'te 5 dakika, ardından Orta Akış 3'te 5 dakika boyunca enjekte edin. Bu ikinci adım sırasında, bir karşı akış ~-100 nL / dak elde etmek için kanal 1 ve 2'deki basıncı 7-8 mbar'a düşürün, böylece tüm oda yüzeyleri BSA pasifleştirilir.
NOT: BSA çözeltisi daha viskoz olduğundan, basınçların buna göre ayarlanması gerekir.
- Tüp 3'ü F-tamponuna değiştirin ve kanalı durulayın (5 dakika, Yüksek Akış 3).
- Tüm proteinler F-tamponunda seyreltilen aşağıdaki 200-300 μL çözeltileri hazırlayın:
Giriş 1, polimerizasyon çözeltisi: 1 μM %10 Alexa-488 etiketli G-aktin, 1 μM profilin (Tablo 1).
Giriş 2, yaşlanma çözeltisi: 0.15 μM %10 Alexa-488 etiketli G-aktin.
Giriş 3, depolimerizasyon çözeltisi: Sadece F-tamponu.
NOT: Profilin burada spontan çekirdeklenmeyi önlemek ve sabit bir G-aktin konsantrasyonunu korumak için kullanılır. - Tüpleri 1'den 3'e değiştirin (bölüm 7). Yüksek Akışlı Tümü ön ayarını kullanarak 3-4 dakika boyunca enjekte edin. Üç çözüm şimdi PEEK borusunu doldurdu ve odaya ulaştı (Şekil 3A). Cam yüzey, ölü zaman olmadan herhangi bir giriş çözeltisine maruz bırakılabilir (<1 s, Şekil 3D, E).
- Mikroskobu açın. Ayarları yapın: %10-%20 güçte 150 mW 488 nm uyarma lazeri, 100-200 ms kamera pozlama süresi, 200-300 nm TIRF penetrasyon derinliği, 60x hedef. Bu ayarlar makale boyunca kullanılmıştır.
- Filament polimerizasyonu (Şekil 4A):
- Basınç ayarını ~ 10 dakika boyunca Orta Akış 1 olarak ayarlayın.
- [İSTEĞE BAĞLI] Kayıt polimerizasyonu (1 çerçeve/20 sn, TIRF). Filamentler yaklaşık 10 alt birim / saniyede (alt / s) 1,12'de polimerize olmalıdır.
- Filament eskitme: Basınç ayarını 15 dakika boyunca Orta Akış 2 olarak ayarlayın. Kritik konsantrasyonda, 0.15 μM G-aktin, filament uzunluğu sabit kalacak ve filamentler% >99 ADP-F-aktin4'e dönüşecektir.
- Depolimerizasyon (Şekil 4A):
- Epifloresan modunda 1 kare/5 sn'de edinime başlayın. Kanal 2 ve 3'te çok düşük bir floresan arka plan olduğundan, TIRF kullanmak gerekli değildir.
- Bir ila iki kare sonra Orta Akış 3'e geçin. Filamentler yaklaşık 10 sub/s'de depolimerize olmalıdır (referans12).
- Deneyi sıfırlamak için, floresan olarak etiketlenmiş tüm filamentleri, ~ 2 dakika boyunca maksimum güçte sürekli olarak lazere maruz bırakarak kırın. Farklı koşulları test etmek için, çözelti 1, 2 veya 3'ü değiştirin ve bunları enjekte edin (Yüksek Akış, 3-4 dakika). 8.7-8.9 arasındaki adımları yineleyin.
9. Diğer tek filament deneyleri
- ABP'lerin F-aktin ile etkileşimlerinin test edilmesi
NOT: Mikroakışkanlar, kofilin, tropomiyozin ve Arp2/3 gibi birkaç yan bağlayıcı ABP'nin aktivitesini ölçmek için başarıyla kullanılmıştır. Bölüm 8'deki protokolü izleyerek:- Kanal 3'ü F-tamponunda ilgilenilen floresan ABP'ye değiştirin. Enjekte et (Yüksek Akış 3, 3 dk).
- Filament polimerizasyonu: Basınç ayarını 10 dakika boyunca Orta Akış 1 olarak ayarlayın.
- ABP bağlama: TIRF ile satın almaya başlayın. ABP konsantrasyonuna bağlı olarak kare hızını ayarlayın. 1-2 kare sonra Orta Akış 3'e geçin.
NOT: ABP'ye bağlı olarak, görüntü çekerken arka plan floresansını daha da azaltmak için hızlı bir şekilde (örneğin, 5 saniyeden daha kısa sürede) Orta Akış 2'ye geçmek de mümkündür. - ABP untiding: Satın almaya devam ederken Mid Flow 2'ye geçin.
- Serbest dikenli uçta formin ile polimerizasyon
NOT: Forminlerin filament dikenli uç polimerizasyonunu etkilediği gösterilmiştir. Mikroakışkanlar özellikle formin bağlanma ve bağlanmama oranlarını ve bunların filament uzaması üzerindeki etkilerini ölçmek için uyarlanmıştır.- Aşağıdaki çözümleri hazırlayın:
Kanal 1: F-tamponunda 10 nM formin (Tablo 1).
Kanal 2: 1 μM %10 Alexa-488 etiketli G-aktin, 4 μM profilin.
Kanal 3: F-tamponu. - 1, 2 ve 3 numaralı tüpleri değiştirin (bölüm 7). Yüksek Akışlı Tümü ön ayarını kullanarak 3-4 dakika boyunca enjekte edin.
- Filament polimerizasyonunu başlatın: Basınç ayarını 2 dakika boyunca Orta Akış 2 olarak ayarlayın.
- Filament dikenli uca formin bağlama: Basınç ayarlarını 30 sn için Orta Akış 1 olarak ayarlayın.
- Formin aracılı polimerizasyon: Basınç ayarını Orta Akış 2 olarak ayarlayın. Dikenli uçlarında formin mDia1 ile, filamentler yaklaşık 50 alt / s13,14,15'te polimerize olmalıdır.
- Aşağıdaki çözümleri hazırlayın:
- Yüzeye ankrajlı forminden polimerizasyon/depolimerizasyon
NOT: Formin süslü dikenli uçların polimerizasyon ve depolimerizasyon oranlarının, filamente uygulanan gerilime bağlı olduğu gösterilmiştir. Mikroakışkanlarda, sıvı akışının filament tarafı boyunca sürtünmesi, filament uzunluğu veakış hızı 14,16 ile orantılı bir gerilim oluşturur.- Yukarıda açıklanan bölüm 8'deki yöntemi kullanarak, yüzey pasivasyonu için 8.1, 8.2 ve 8.3 numaralı adımları aşağıdakilerle değiştirin:
- F-tamponunda tüp 3'ü 1 μg / mL anti-His antikoruna değiştirin. Yüksek Akışlı 3 ile 2 dakika boyunca enjekte edin.
- F tamponunda tüp 3'ü %5 BSA ile değiştirin. Yüksek Akış 3'te 5 dakika, ardından Orta Akış 3'te 5 dakika boyunca enjekte edin. Bu ikinci adım sırasında, tüm oda yüzeylerinin BSA pasifleştirilmesi için ~-100 nL / dak'lık bir karşı akış elde etmek için kanal 1 ve 2'deki basıncı 7-8 mbar'a düşürün.
- Tüp 3'ü 100 nM olarak değiştirin F-tamponunda Onun etiketli formin. Yüksek Akışlı 3 ile 5 dakika boyunca enjekte edin. F tamponu ile tüp 3'ü değiştirin. Boruda formin kalmadığından emin olmak için Yüksek Akış 3 ile 5 dakika boyunca enjekte edin.
- Aşağıdaki çözeltileri hazırlayın ve enjekte edin (her biri 200-300 μL, F-tamponunda):
Kanal 1: 1 μM %10 Alexa-488 etiketli G-aktin.
Kanal 2: 1 μM etiketsiz G-aktin, 4 μM profilin.
Kanal 3: Yalnızca F arabelleği. - Filament nükleasyonu: Yüzeye tutturulmuş forminleri G-aktin'e maruz bırakın ( Orta Akış 1'i ayarlayın).
- Filament polimerizasyonu: Orta Akış 2 kullanarak odayı profilin-aktin'e maruz bırakın.
- Edinime başla: 1 kare/2 s, epifloresan. Formin mDia1 ile filamentler, filament uzunluğuna ve akış hızı14'e bağlı olarak 50-80 alt / s'de polimerize edilmelidir.
- Filament depolimerizasyonu: Edinime başlayın (1 kare / 4 s, epifloresan). 1-2 kare sonra, filamentleri F-tamponu, Orta Akış 3'e maruz bırakın. Formin mDia1 ile filamentler, filament uzunluğuna ve akış hızı14'e bağlı olarak 5-15 alt / s'de depolimerize edilmelidir.
- Yukarıda açıklanan bölüm 8'deki yöntemi kullanarak, yüzey pasivasyonu için 8.1, 8.2 ve 8.3 numaralı adımları aşağıdakilerle değiştirin:
- Etiketsiz segmentlere sahip aktin filamentleri
NOT: Aktin floresan etiketleme, depolimerizasyon17 sırasında duraklamalar ve değiştirilmiş tropomiyozin bağlama18 gibi çeşitli artefaktlar oluşturur. Bu yapılar için geçici bir çözüm, etiketlenmemiş segmentleri görüntüleyen filamentleri birleştirmek için mikroakışkanlar kullanmaktır.- Aşağıdaki çözeltileri hazırlayın ve enjekte edin (F-tamponunda 200-300 μL):
Kanal 1: 1 μM etiketsiz G-aktin, 1 μM profilin.
Kanal 2: 0.3 μM 10% Alexa-488 etiketli G-aktin. - Her iki ucunda floresan etiketli segmentler bulunan ADP-aktin etiketsiz segmentler oluşturmak için yüzeyi sırayla kanal 2 (5 dakika), kanal 1 (10 dakika) ve kanal 2'ye (15 dakika) maruz bırakın.
- Aşağıdaki çözeltileri hazırlayın ve enjekte edin (F-tamponunda 200-300 μL):
- Gelsolinli dikenli uçtan ankrajlı filamentler
NOT: Spektrin-aktin tohumlarında, filamentler serbest dikenli uçlarında polimerize olurken, sivri uç spektrin-aktin tohumu tarafından stabilize edilir. Bir alternatif, filamentleri jelsolin gibi dikenli bir uç kapakla sabitlemektir.- 20 μL F-tamponunda 4 μM %10 Alexa-488 etiketli G-aktin içeren bir F-aktin çözeltisi hazırlayın. Aktinin RT'de kendiliğinden çekirdeklenmesine ve polimerize olmasına izin verin, tezgahta en az 30 dakika boyunca. Işıktan korumak için tüpü alüminyum folyoya sarın.
- Bu arada, mikroakışkan odayı hazırlayın ve yüzeyi% 5 BSA ve% 1 biotin-BSA karışımı ile pasifleştirin (bkz. adım 8.2).
- Kanal 3'ü F tamponu ile durulayın ( Yüksek Akış 3'te 2 dakika). F tamponuna 10 μg/mL nötravidin enjekte edin ( Yüksek Akış 3'te 4 dakika).
- Tüpleri şu şekilde değiştirin:
Kanal 1: 10 nM biotin-jelsolin (Tablo 1).
Kanal 2: F-tamponu.
Kanal 3: 0.4 μM prepolimerize F-aktin. - Yüksek Akışlı Tümü ayarını kullanarak tüm çözeltileri 3 dakika boyunca birlikte enjekte edin.
- Tüm odayı jelsoline maruz bırakın (Orta Akış 1, 30 s).
- Filamentleri yüzeye takın (Düşük Akışlı 3: 3 mbar'da Kanal 3, ~2 mbar'da Kanal 1 ve 2, yaklaşık 2 dakika boyunca).
- [İSTEĞE BAĞLI] Filament yoğunluğu çok düşükse, adım 9.5.6 ve 9.5.7'yi tekrarlayın.
- Sivri uçlu depolimerizasyon: Edinime başlayın (1 kare/30 sn, epifloresan). 1-2 kare sonra, filamentleri yalnızca arabelleğe maruz bırakın, Orta Akış 2. Filamentler yaklaşık 0.2 sub / s'de depolimerize olmalıdır.
10. ADF / kofilin ile büyüleyici kaynaklı filament demeti oluşumu ve sökülmesi
NOT: Aktin filament demetleri oluşturmak için, odanın yüzeyinde yeterince yüksek bir filament tohumu yoğunluğuna sahip olduğunuzdan emin olun. Büyüleyici proteine maruz kaldığında, yanal olarak dalgalanan komşu filamentler, büyüleyici proteinler tarafından dinamik olarak çapraz bağlanacaktır. Büyüleyici, filament tarafı19'dan hızla ayrıldığından, filament demetlenmesini sürdürmek için ana akan çözeltide sürekli olarak mevcut olmalıdır.
- 8.1-8.3 arasındaki adımları izleyin.
- Aşağıdaki çözeltileri hazırlayın (F-tamponunda 200-300 μL):
Kanal 1, polimerizasyon çözeltisi: 1 μM %10 Alexa-488 etiketli G-aktin, 1 μM profilin.
Kanal 2, Paketleme çözümü: 200 nM büyüleyici (Tablo 1), 0.15 μM 10% Alexa-488 etiketli G-aktin.
Kanal 3, Sökme çözümü: 200 nM ADF / cofilin (Tablo 1), 100 nM büyüleyici, 0.15 μM% 10 Alexa-488 etiketli G-aktin. - Tüpleri 1'den 3'e değiştirin (bölüm 7). Yüksek Akışlı Tümü ön ayarını kullanarak 3-4 dakika boyunca enjekte edin.
- Filament polimerizasyonu: Basınç ayarını ~ 10 dakika boyunca Orta Akış 1 olarak ayarlayın. Polimerizasyon TIRF ile görüntülenebilir.
- Filament paketleme (Şekil 4C): Görüntü yakalamayı başlatın (1 kare/5 sn, epifloresan). 1-2 kare sonra, basınç ayarını Orta Akış 2'ye ayarlayın ve filament demetlenmesini gözlemleyin.
- Demet parçalanması: Görüntü yakalamayı başlatın (1 kare/5 sn, epifloresan). 1-2 kare sonra, basınç ayarını Orta Akış 3'e ayarlayın ve hem tek filamentlerin hem de demetlerin kofilin kaynaklı sökülmesini gözlemleyin.
11. Mikroakışkan cihaz temizleme prosedürü
NOT: Bir deneyden diğerine herhangi bir kontaminasyonu önlemek için, her deneyden sonra tüm tüpleri ve debimetreleri kapsamlı bir şekilde temizlemek ve tamamen kurutmak çok önemlidir.
- Tüm boruları PDMS odasından ayırın ve odayı atın.
- PEEK borularını ve debimetreleri temizlemek için, boru uçlarını boş bir 15 mL plastik tüp içinde bantlayın ve rezervuar neredeyse boşalana kadar aşağıdaki çözeltileri maksimum basınçta enjekte edin:
400 μL F-tamponu.
400 μL 0,5 M NaOH.
400 μL saf su.
200 μL izopropanol. - Boş bir rezervuarla değiştirin ve borular tamamen kuruyana kadar (~ 2-4 dakika, maksimum basınç) havayı üfleyin.
12. Görüntü analizi
NOT: Bu makale, mikroakışkanlarda tek aktin filamentlerini birleştirme, manipüle etme ve görselleştirme yöntemine odaklanırken, edinilen filmleri analiz etmek için kısa bir yöntem burada verilmiştir. Analiz, bölüm 8'i takip eden ImageJ kullanılarak 16 bit görüntüler üzerinde gerçekleştirilir.
- Görüntü işleme minimumdur:
- Polimerizasyon veya depolimerizasyon görüntü yığınını içe aktarın.
- [İSTEĞE BAĞLI] Arka Plan Çıkar işleviyle görüntü yoğunluğunu homojenleştirin (varsayılan ayarlar (ör. 'Yuvarlanan top yarıçapı' = 50 piksel)). Bu, özellikle bir film sırasında arka plan floresansı değişiyorsa veya floresan aydınlatması görüş alanı üzerinde homojen değilse kullanışlıdır.
- Parlaklığı ve kontrastı ayarlayın (sıfıra yakın arka plan, maksimuma yakın filamentler).
- Filament kymograph oluşturun:
- Duraklatmayan, kopmayan veya ayrılmayan bir filament seçin. Aksi takdirde davranışa göre seçim yapmayın. 1-2 piksel yukarıda bir çizgi çizin (Düz Çizgi aracı). Filament numarasını kaydedin (YG Yöneticisi'ne ekleyin).
- Reslice (Dilim sayısı: 5 piksel) işlevini uygulayın. Maksimum yoğunluğu hesaplayın (Zprojection fonksiyonu).
- Polimerizasyon/depolimerizasyon hızını ölçün:
- Kimografta, filament dikenli uç boyunca bir çizgi çizin (Düz Çizgi aracı, Şekil 4A). Çizgi genişliğini ve yüksekliğini ölçün ( Hesaplama işlevi).
- 12.2-12.3 arasındaki adımları birden çok filament üzerinde yineleyin. Polimerizasyon/depolimerizasyon oranlarını hesaplayın (Şekil 4A):
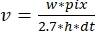 , burada v hızı (alt/s cinsinden), w çizgi genişliğini (piksel), pikseli piksel boyutunu (nm), h çizgi yüksekliğini (kareler) ve dt kareler arasındaki süreyi (saniye cinsinden) belirtir. Burada, 2.7 nm, bir aktin alt biriminin filament uzunluğuna etkili katkısına karşılık gelir.
, burada v hızı (alt/s cinsinden), w çizgi genişliğini (piksel), pikseli piksel boyutunu (nm), h çizgi yüksekliğini (kareler) ve dt kareler arasındaki süreyi (saniye cinsinden) belirtir. Burada, 2.7 nm, bir aktin alt biriminin filament uzunluğuna etkili katkısına karşılık gelir.
Sonuçlar
Yukarıda açıklanan tüm deneyler için, floresan olarak etiketlenmiş aktin filamentleri, yüzeyden düşük arka plan floresansının göstergesi olan iyi kontrastla açıkça görülebilmelidir (Şekil 4, yaygın sorunların giderilmesi için Ek Dosya 1'e bakınız). Aktin filamentleri de yüzeye yapışmamalıdır: baskın akış hızı düşük olduğunda, aktin filamentlerinin yanal dalgalanmaları, onları canlı olarak gözlemlerken algılanabilir olmalı ve birini...
Tartışmalar
Aktin filamentlerinin uzunlukları boyunca birden fazla nokta ile yüzeye tutturulduğu veya metilselüloz gibi bir kalabalık ajan tarafından yüzeye yakın tutulduğu standart tek filament yöntemleriyle karşılaştırıldığında, mikroakışkanlar bir dizi avantaj sunar. Yüzeyle etkileşimler minimum olduğundan, bu etkileşimlerin hem uzama hem de depolimerizasyon sırasında neden olabileceği yapay duraklamalardan kaçınılır. Filamentler, birbirlerine paralel olarak akış tarafından hizalanır, izlenmeler...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
B. Ladoux ve R.-M.'ye minnettarız. UV temizleyici ekipmanlarının kullanımı için Mège laboratuvarı ve J. Heuvingh ve 0. du Roure, silikon gofretler üzerinde kalıp hazırlama ve mikroakışkanlar hakkında ipuçları sağlama konusunda aldığımız ilk eğitim için. Avrupa Araştırma Konseyi Grant StG-679116 (A.J.'ye) ve Agence Nationale de la Recherche Grants Muscactin and Conformin'den (G.R.-L.) gelen fonları kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| β-Casein | Merck | C6905 | Used at 8 mg/mL |
| Biopsy punch (with plunger) | Ted Pella | 15115-2 | ID 0.75 mm, OD 1.07 mm |
| Biotin-BSA | Merck | A8549 | Used at 1 mg/mL |
| BSA | Merck | A8022 | Used at 50 mg/mL |
| Coverslip Mini-Rack Teflon holder | Invitrogen | C14784 | for 8 coverslips |
| Coverslips 22x40mm Thickness #1.5 | Menzel Gläser | 631-1370 | |
| DABCO | Merck | D27802 | component in f-buffer |
| DTT | Euromedex | EU0006-D | component in f-buffer |
| Ester NHS Alexa Fluor 488 | Invitrogen | A20000 | Fluorophore for actin labeling on Lys328. |
| EZ-Link Sulfo-NHS-Biotin | Thermo Scientific | 21338 | To biotinylate actin on Lys328 |
| Hellmanex III | Hellma | 9-307-011-4-507 | Glass cleaning detergent |
| ImageJ | NIH | N/A | open source software |
| Laboport | KNF | 811kn.18 | vacuum pump (ultimate vacuum: 240 mbar) |
| Magic invisible tape | Scotch | 7100024666 | standard transparent office tape |
| Micrewtube | Simport | T341-6T | 2 mL microfluidic reservoir tubes |
| Microfluidic device Part 1: Flow Unit S | Fluigent | FLU-S-D-PCKB | Flowmeter |
| Microfluidic device Part 2: Fluiwell-4C-2 mL | Fluigent | 14002001PCK | Reservoir holder |
| Microfluidic device Part 3: MFCS-EZ | Fluigent | EZ-11000001 EZ-00345001 | Pressure controller |
| Model 42 - UVO-Cleaner | Jelight Inc. | 42-220 | Ultraviolet cleaner |
| N6-(6-Aminohexyl)-ATP-ATTO-488 | Jena Bioscience | NU-805-488 | ATP-ATTO used to label actin |
| neutravidin | Thermo Scientific | 31000 | |
| PLL-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | Use at 1 mg/mL in PBS. |
| Polydimethylsiloxane (PDMS) Sylgard 184 Silicon Elastomer | Dow Corning | 1673921 | Contains PDMS base and curing agent |
| Polyetheretherketone (PEEK) tubing | Merck | Z226661 | “Blue” : I.D. = 0.25 mm |
| Safety blow gun | Coilhose Pneumatics | 700-S | filtered air |
| Silicon tubing | VWR | 228-0701P | connect PEEK to coupler |
| Stainless steel catheter coupler | Prime Bioscience | SC22/15 | Inserted into PDMS inlets and outlet to connect to PEEK tubing |
| Thermoplastic film | Sigma Aldrich | PM996 | Standard "parafilm" |
| Ultrapure ethanol | VWR | 64-17-5 | |
| Ultrasonic cleaning bath | VWR | USC200TH | To accomodate 1 L beakers |
| Vacuum dessicator | SP Bel-Art | F42022-0000 | to degas the PDMS or solutions |
Referanslar
- Wioland, H., Jégou, A., Romet-Lemonne, G. Celebrating 20 years of live single-actin-filament studies with five golden rules. Proceedings of the National Academy of Sciences of the United States of America. 119 (3), 2109506119 (2022).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophysical Journal. 88 (2), 1387-1402 (2005).
- Brewer, L. R., Bianco, P. R. Laminar flow cells for single-molecule studies of DNA-protein interactions. Nature Methods. 5 (6), 517-525 (2008).
- Jégou, A., et al. Individual actin filaments in a microfluidic flow reveal the mechanism of ATP hydrolysis and give insight into the properties of profilin. PLoS Biology. 9 (9), 1001161 (2011).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal x-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133 (2018).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments: JoVE. (86), e50549 (2014).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Zimmermann, D., Morganthaler, A. N., Kovar, D. R., Suarez, C. In vitro biochemical characterization of cytokinesis actin-binding proteins. Methods in Molecular Biology. 1369, 151-179 (2016).
- Funk, J., et al. Profilin and formin constitute a pacemaker system for robust actin filament growth. eLife. 8, 50963 (2019).
- Pandit, N. G., et al. Force and phosphate release from Arp2/3 complex promote dissociation of actin filament branches. Proceedings of the National Academy of Sciences of the United States of America. 117 (24), 13519-13528 (2020).
- Wioland, H., et al. ADF/Cofilin accelerates actin dynamics by severing filaments and promoting their depolymerization at both ends. Current Biology: CB. 27 (13), 1956-1967 (2017).
- Pollard, T. D., Mooseker, M. S. Direct measurement of actin polymerization rate constants by electron microscopy of actin filaments nucleated by isolated microvillus cores. The Journal of Cell Biology. 88 (3), 654-659 (1981).
- Kovar, D. R., Harris, E. S., Mahaffy, R., Higgs, H. N., Pollard, T. D. Control of the assembly of ATP- and ADP-actin by formins and profilin. Cell. 124 (2), 423-435 (2006).
- Jégou, A., Carlier, M. -. F., Romet-Lemonne, G. Formin mDia1 senses and generates mechanical forces on actin filaments. Nature Communications. 4, 1883 (2013).
- Breitsprecher, D., et al. Rocket launcher mechanism of collaborative actin assembly defined by single-molecule imaging. Science. 336 (6085), 1164-1168 (2012).
- Courtemanche, N., Lee, J. Y., Pollard, T. D., Greene, E. C. Tension modulates actin filament polymerization mediated by formin and profilin. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9752-9757 (2013).
- Niedermayer, T., et al. Intermittent depolymerization of actin filaments is caused by photo-induced dimerization of actin protomers. Proceedings of the National Academy of Sciences. 109 (27), 10769-10774 (2012).
- Gateva, G., et al. Tropomyosin isoforms specify functionally distinct actin filament populations in vitro. Current Biology: CB. 27 (5), 705-713 (2017).
- Aratyn, Y. S., Schaus, T. E., Taylor, E. W., Borisy, G. G. Intrinsic dynamic behavior of fascin in filopodia. Molecular Biology of the Cell. 18 (10), 3928-3940 (2007).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. The Journal of Cell Biology. 103, 2747-2754 (1986).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Torsional stress generated by ADF/cofilin on cross-linked actin filaments boosts their severing. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2595-2602 (2019).
- Colombo, J., et al. A functional family of fluorescent nucleotide analogues to investigate actin dynamics and energetics. Nature Communications. 12 (1), 548 (2021).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. The Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Romet-Lemonne, G., Guichard, B., Jégou, A. Using microfluidics single filament assay to study formin control of actin assembly. Methods in Molecular Biology. 1805, 75-92 (2018).
- Gieselmann, R., Kwiatkowski, D. J., Janmey, P. A., Witke, W. Distinct biochemical characteristics of the two human profilin isoforms. European Journal of Biochemistry. 229 (3), 621-628 (1995).
- Lin, D. C., Lin, S. Actin polymerization induced by a motility-related high-affinity cytochalasin binding complex from human erythrocyte membrane. Proceedings of the National Academy of Sciences of the United States of America. 76 (5), 2345-2349 (1979).
- Casella, J. F., Maack, D. J., Lin, S. Purification and initial characterization of a protein from skeletal muscle that caps the barbed ends of actin filaments. The Journal of Biological Chemistry. 261 (23), 10915-10921 (1986).
- Kremneva, E., et al. Cofilin-2 controls actin filament length in muscle sarcomeres. Developmental Cell. 31 (2), 215-226 (2014).
- Le Clainche, C., Carlier, M. -. F. Actin-based motility assay. Current Protocols in Cell Biology. , 1-20 (2004).
- Vignjevic, D., et al. Formation of filopodia-like bundles in vitro from a dendritic network. The Journal of Cell Biology. 160 (6), 951-962 (2003).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. eLife. 5, 13470 (2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Molecular Biology of the Cell. 27 (22), 3563-3573 (2016).
- Suzuki, E. L., et al. Geometrical constraints greatly hinder formin mDia1 activity. Nano Letters. 20 (1), 22-32 (2020).
- Wioland, H., Suzuki, E., Cao, L., Romet-Lemonne, G., Jegou, A. The advantages of microfluidics to study actin biochemistry and biomechanics. Journal of Muscle Research and Cell Motility. 41 (1), 175-188 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır