É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Usando Microfluidos e Microscopia de Fluorescência para Estudar a Dinâmica de Montagem de Filamentos e Pacotes de Actin Único
Neste Artigo
Resumo
Apresentamos protocolos para ensaios microfluidos de filamento de actina simples, em combinação com microscopia de fluorescência, que permitem monitorar com precisão filamentos de actina individuais em tempo real, expondo-os sequencialmente a diferentes soluções proteicas.
Resumo
A fim de decifrar os complexos mecanismos moleculares que regulam a montagem e desmontagem de filamentos actin, é um grande trunfo monitorar reações individuais que vivem em condições bem controladas. Para isso, experimentos de filamento único ao vivo surgiram nos últimos 20 anos, principalmente usando microscopia total de fluorescência interna (TIRF) e forneceram uma série de resultados-chave. Em 2011, a fim de ampliar ainda mais as possibilidades desses experimentos e evitar artefatos problemáticos recorrentes, introduzimos microfluidos simples nesses ensaios. Este estudo detalha nosso protocolo básico, onde filamentos de actina individuais são ancorados por uma extremidade à superfície passivated de deslizamento de cobertura, alinhados com o fluxo, e podem ser sucessivamente expostos a diferentes soluções proteicas. Também apresentamos os protocolos para aplicações específicas e explicamos como forças mecânicas controladas podem ser aplicadas, graças ao arrasto viscoso da solução de fluxo. Destacamos as ressalvas técnicas desses experimentos e apresentamos brevemente possíveis desenvolvimentos com base nessa técnica. Esses protocolos e explicações, juntamente com a disponibilidade atual de equipamentos de microfluidos fáceis de usar, devem permitir que não especialistas implementem este ensaio em seus laboratórios.
Introdução
A montagem e desmontagem de filamentos de actin e redes de filamentos de actin são controladas por diversas reações bioquímicas e dependem do contexto mecânico. Para obter uma visão desses mecanismos complexos, é inestimável ser capaz de observar reações individuais em filamentos individuais (em números suficientemente grandes). Ao longo das últimas décadas, a observação de filamentos dinâmicos de actina em tempo real, principalmente usando microscopia total de fluorescência interna (TIRF), emergiu como uma técnica-chave e forneceu uma lista impressionante de resultados que não poderiam ter sido obtidos com ensaios bioquímicos de solução em massa1.
Para isso, é preciso manter filamentos de actina fluorescente rotulados perto da superfície do microscópio, ao mesmo tempo em que os expõe a soluções de proteínas de ligação de actina (ABPs), que também podem ser rotuladas fluorescentemente. Isso fornece um meio de monitorar eventos que ocorrem em filamentos individuais em condições bioquímicas bem controladas e, assim, quantificar as taxas de reação. No entanto, uma série de limitações específicas devem ser consideradas. Manter artificialmente filamentos próximos à superfície, muitas vezes graças a múltiplos pontos de ancoragem ou usando um agente de aglomeração como metilcelulose, pode alterar seu comportamento (por exemplo, causando pausas em sua polimerização e despomerização2). Rastrear o contorno de cada filamento pode ser desafiador, especialmente se novos filamentos ou fragmentos de filamento se acumularem no campo de visão ao longo do tempo. As reações ocorrem em um volume finito onde a concentração de monômeros e ABPs actina pode variar ao longo do tempo, potencialmente dificultando a derivação de constantes de taxa precisa. Por fim, renovar ou mudar a solução de ABPs é difícil de alcançar em menos de 30 anos e muitas vezes levará ao conteúdo proteico inhomogêneo na amostra.
Há pouco mais de 10 anos, inspirados pelo que já foi feito para estudar as cadeias individuais de ácido desoxiribonucleico (DNA)3, introduzimos uma nova técnica baseada em microfluidos para observar e manipular filamentos individuais de actin4. Permite contornar as limitações acima mencionadas das técnicas clássicas de filamento único. Nestes ensaios de microfluidos, os filamentos de actina são cultivados a partir de sementes de espectrin-actin adsorvidas no deslizamento de cobertura. Os filamentos são, portanto, ancorados por uma extremidade apenas na parte inferior da câmara microfluida e flutuam acima da superfície sem furar. Os filamentos se alinham com o fluxo de soluções de entrada, facilitando assim o monitoramento do comprimento do contorno e mantendo-os em uma região rasa acima do deslizamento de cobertura onde a TIRF pode ser usada. Diferentes soluções são simultaneamente fluídas para a câmara sem misturar, e os filamentos podem ser expostos a eles sequencialmente e rapidamente.
Aqui, propomos uma série de protocolos básicos para configurar ensaios de microfluidos de filamento único no laboratório. Tampas e câmaras de microfluidos podem ser preparadas com antecedência (em meio dia), e o experimento em si, onde várias condições bioquímicas podem ser testadas, é feito em menos de um dia.
Protocolo
1. Preparação da câmara microfluídica
- Selecione um molde mestre SU-8 com vários padrões de câmara. As câmaras típicas são em forma de cruz com três entradas e uma tomada, 20 μm de altura e 800 μm de largura (Figura 1). Tais moldes mestres podem ser adquiridos de empresas externas ou feitos em laboratórios acadêmicos (por exemplo, Gicquel, Y. et al.5).
- Coloque fita adesiva ao redor da borda do molde.
- Coloque ~50 cm de comprimento, 19 mm de largura, fita de escritório transparente padrão (ver Tabela de Materiais) em um banco, lado pegajoso para cima. Coloque o molde verticalmente em uma extremidade e ao longo da linha média da fita.
- Role o molde para a outra extremidade da fita para criar uma borda de 1 cm ao redor do molde. Dobre a fita sobre a parte inferior do molde.
- Prepare a solução polidimetilsiloxana (PDMS).
- Em um prato de pesagem descartável, despeje diretamente 25-30 g de base PDMS (Tabela de Materiais). Adicione 10% de peso/peso agente de cura PDMS (Tabela de Materiais) com uma pipeta pasteur de plástico descartável.
- Misture manualmente e bem com uma vara de plástico. Certifique-se de que o agente de cura esteja bem incorporado à base do PDMS, mesmo que a agitação crie muitas bolhas.
- Degas a solução PDMS em um dessecator a vácuo (Tabela de Materiais) por pelo menos 5 min a temperatura ambiente (RT). Bolhas se expandirão, subirão à superfície e estourarão quando o vácuo for quebrado.
- Despeje a solução PDMS sobre o molde SU-8. Use uma vara de plástico para raspar e transferir o máximo possível da mistura.
- Degas PDMS pela segunda vez (5 min no desiccator de vácuo). Certifique-se de se livrar da maioria das bolhas (algumas pequenas bolhas na superfície superior estão bem).
- Coloque o molde em forno a 70 °C por pelo menos 5 h para que o PDMS quilule e solidifique.
- Remova as câmaras PDMS sólidas do molde.
ATENÇÃO: Os wafers de silício para moldes SU-8 são extremamente frágeis, por isso deve-se tomar cuidado extensivo ao separar o PDMS dos wafers. Trabalhe em uma superfície dura e plana e mantenha o wafer plano na superfície.- Com uma lâmina de barbear, faça um corte circular no PDMS, a cerca de 1 cm de distância da borda do molde. Todos os padrões devem estar pelo menos 0,5 cm dentro do corte. Retire suavemente o bloco PDMS central com puxões suaves.
ATENÇÃO: Ao descascar, mantenha o molde SU-8 liso no banco para evitar quebrá-lo. - Coloque PDMS em papel alumínio limpo, a superfície moldada voltada para a folha de alumínio, para proteger sua superfície contra a poeira e tornar os padrões mais visíveis.
- Com uma lâmina de barbear, faça um corte circular no PDMS, a cerca de 1 cm de distância da borda do molde. Todos os padrões devem estar pelo menos 0,5 cm dentro do corte. Retire suavemente o bloco PDMS central com puxões suaves.
- Escolha e corte uma câmara com uma lâmina de barbear a pelo menos 0,5 cm de distância do padrão. O bloco PDMS resultante tem cerca de 0,5 cm de altura, 1,5 cm de largura e 3 cm de comprimento. Furar três entradas e uma tomada com um soco de biópsia de 0,75 mm de identidade (Tabela de Materiais).
- Limpe a câmara PDMS com etanol ultrauso (Tabela de Materiais) e a seco a ar usando uma pistola de segurança (Tabela de Materiais). Coloque o PDMS com o padrão voltado para cima em uma placa de Petri limpa, e feche a placa com sua tampa.
2. Limpeza de tampas de vidro
NOTA: Aqui, um procedimento padrão de limpeza de tampas, baseado em uma série de etapas de sônicação, é detalhado. Outros procedimentos de limpeza de tampas de vidro foram descritos em muitas outras publicações que podem alcançar resultados satisfatórios semelhantes 6,7,8,9.
- Coloque 10-20 tampas (40 mm de comprimento) em um suporte politetrafluoroetileno (PTFE) (Tabela de Materiais). Sonicate as tampas em 0,5 L de 2% de solução de limpeza de vidro (Tabela de Materiais) em um béquer de vidro de 1 L (35 °C, 30 min).
- Descarte a solução de limpeza de vidro e enxágue extensivamente as tampas com dH2O em pelo menos três banhos sucessivos de 0,5 L.
- Prepare 0,5 L de 2 M KOH em um copo de vidro 1 L. Sonicate as tampas em KOH (RT, 30 min). Descarte koh e enxágue as tampas com dH2O em pelo menos três banhos de 0,5 L.
ATENÇÃO: Utilize equipamentos de proteção de segurança de laboratório apropriados (luvas, óculos e jaleco). - Transfira e sonicar as tampas em 0,5 L de etanol ultrauso (RT, 30 min). As tampas podem ser mantidas no etanol por até 2 semanas. Feche o béquer com película termoplástica (Tabela de Materiais) para evitar a evaporação. Antes de usar, seque a tampa com o fluxo de ar.
3. Montagem da câmara do PDMS
- Pré-aqueça a placa quente a 100 °C. Coloque até três câmaras PDMS limpas e tampas de vidro em uma placa de Petri limpa. Coloque a placa de Petri aberta em um limpador ultravioleta profundo (UV) (λ = 185 nm, ver Tabela de Materiais) e exponha-a à luz UV por 3-5 min.
NOTA: Alternativamente, as câmaras e as tampas do PDMS podem ser expostas ao ar ou plasma de oxigênio para os 30 anos. - Posicione suavemente a câmara PDMS sobre o deslizamento de tampas. Certifique-se de que as duas superfícies colocadas em contato foram diretamente expostas à UV. O PDMS gruda automaticamente no vidro e a câmara se torna claramente visível.
- Para remover qualquer ar preso na interface de deslizamento de tampas PDMS, pressione suavemente a superfície com um dedo. Para uma ligação mais apertada, pressione mais fortemente sobre cantos e laterais. Certifique-se de que o teto da câmara não entre em contato com a superfície de vidro.
- Coloque a câmara com o fundo de vidro voltado para a placa quente a 100 °C por 5 min. Após esta etapa, as ligações glass-PDMS tornam-se permanentes, e as câmaras só podem ser usadas uma vez. Use a câmara imediatamente ou armazene-a em uma placa de Petri limpa por até uma semana.
4. [OPCIONAL] Passivação direta e funcionalização
NOTA: Dependendo da aplicação, as câmaras podem ser passivadas e funcionalizadas uma vez conectadas ao dispositivo de controle microfluido (ver Tabela de Materiais) ou injetando manualmente soluções diretamente na câmara com uma pipeta antes de sua conexão com o dispositivo microfluido. Este último oferece a vantagem de consumir menos reagente e evitar contaminação potencial, fluindo a solução através da tubulação de cetona de éter poliether (PEEK) do dispositivo microfluido. Em todas as etapas a seguir, as soluções são injetadas colocando diretamente a ponta da pipeta na tomada. Para evitar a criação de bolhas dentro da câmara, certifique-se de ter uma pequena gota saindo da ponta da pipeta ao conectar a ponta na saída da câmara PDMS. Da mesma forma, remova a ponta da pipeta antes que todo o volume tenha sido injetado.
- Injete 20 μL de PLL-PEG (1 mg/mL em soro fisiológico tamponado por fosfato (PBS) ). Incubar por um mínimo de 1h (ou durante a noite) na RT. Para evitar a evaporação, coloque a câmara PDMS em uma caixa úmida (por exemplo, uma caixa de ponta vazia com água no compartimento inferior e a câmara PDMS na plataforma de retenção de ponta).
- Injete 20 μL de sementes de espectro-actina de 100 pM (em F-buffer, consulte Tabela 1 e Tabela 2). Espere por não mais do que 1 min. Ajuste a concentração e o tempo das sementes para ajustar a densidade da superfície das sementes, alto o suficiente para grandes estatísticas e baixo o suficiente para filamentos não se sobreporem.
NOTA: Alternativamente, se as sementes de espectrin-actin não estiverem disponíveis, utilize segmentos de filamento curto funcionalizado por biotina que serão imobilizados em um deslizamento de cobertura revestido de streptavidin 9,10. - [OPCIONAL] Injete 20 μL de 5% de albumina de soro bovino (BSA) no F-buffer. Deixe na RT por 10 minutos.
- [OPCIONAL] Injete 20 μL de 1 mg/mL β-caseína no F-buffer. Deixe na RT por 10 minutos.
NOTA: Siga os passos 4.3 e/ou 4.4 para passar ainda mais a câmara. A escolha da passivação depende das proteínas utilizadas e não funciona igualmente bem em todos os ABPs. Ao usar actin sozinho, PLL-PEG ou BSA é suficiente.
5. Conecte dispositivo microfluido
NOTA: Utilize um sistema microfluido baseado em pressão com até quatro canais para controlar os fluxos na câmara microfluida (Figura 1A, ver Tabela de Materiais). Para evitar que bolhas se formem na tubulação microfluidica e perturbando a estabilidade do fluxo, desgas todas as soluções. Coloque 5 mL de dH20 e 10 mL de caldo F-buffer em um dessecador de vácuo conectado a uma bomba de vácuo (vácuo final <250 mbar) e degas por pelo menos 1 h no RT.
- Enxágüe entradas + tubos de saída com dH2O (500 μL, 300 mbar).
- Encha todos os tubos de reservatório de 2 mL (ver Tabela de Materiais) com 300 μL de F-buffer. Defina pressão para 300 mbar e deixe de cinco a oito gotas ir para o lixo. Repita para cada canal e defina a pressão para 0.
- Conecte a tomada e enxágue extensivamente a câmara.
- Coloque a pressão do tubo do reservatório 4 (saída) para 50 mbar. Uma vez que uma gota saia da extremidade do tubo, conecte a tubulação à saída da câmara PDMS. O líquido preenche a câmara e sai de todas as entradas.
- [OPCIONAL] Se a câmara tiver sido diretamente passivada (seção 4), defina pressão de 100 mbar para enxaguar a câmara com 50-100 μL de F-buffer (3-5 min). Remova o excesso de líquido nas entradas com um tecido de limpeza.
- Coloque pressão em 20 mbar.
- Conecte entradas.
- Coloque a pressão para o tubo do reservatório de 1 a 50 mbar. Para evitar a introdução de bolhas de ar, certifique-se de que uma gota saia da tubulação e da entrada PDMS.
- Conecte a tubulação à entrada 1 (as duas gotículas se fundindo ao conectar). Coloque a pressão em 30 mbar.
- Repetir as etapas 5.4.1-5.4.2 para conectar as entradas 2 e 3.
- Coloque a pressão de todas as entradas para 20 mbar e a pressão de saída para 0 mbar. Certifique-se de que as taxas de fluxo nas entradas são aproximadamente iguais (ver seção Solução de problemas).
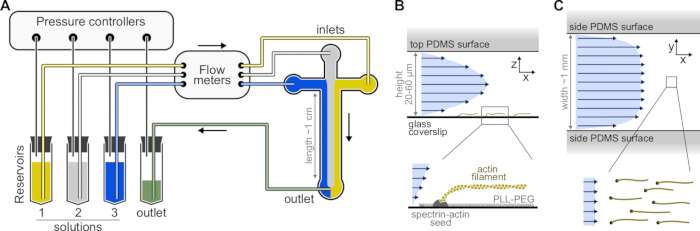
Figura 1: Injetar soluções através de uma câmara microfluidica. (A) Configuração microfluidica padrão para experimentos de filamentos de actina única. As soluções proteicas, colocadas nos reservatórios 1-3, são empurradas para dentro da câmara, ajustando a pressão na fase gasosa. As vazões geradas são medidas por medidores de fluxo. Dentro das câmaras microfluídicas, as soluções não se misturam e ocupam espaço dependendo das pressões relativas aplicadas (aqui, pressão igual sobre todas as entradas). Dimensões típicas: os tubos de reservatório contêm até 2 mL de solução. O tubo PEEK (0,25 mm de diâmetro interno) conecta os reservatórios aos medidores de vazão (após 10 cm de tubulação) e, em seguida, à câmara PDMS (depois de mais 70 cm). Os acoplamentos de tubos de silício e tubos de aço inoxidável são usados para conectar a tubulação PEEK às entradas PDMS. O principal canal microfluido tem 20-60 μm de altura, cerca de 1 mm de largura e 1 cm de comprimento. (B,C) Perfis de fluxo dentro da câmara microfluidica. (B) O fluido gera um perfil parabólico em toda a altura da câmara: v(z) = 6z(h-z)R/h3w, onde h e w são a altura e largura da câmara, e R é a taxa de fluxo total. Inferior: Filamento de actina único polimerizado a partir de sementes de espectro ancorado na superfície. (C) Quando a largura da câmara é consideravelmente maior que sua altura, o fluxo é quase uniforme em toda a câmara, exceto nas superfícies do PDMS, onde vai para zero. Clique aqui para ver uma versão maior desta figura.
6. Configurando a configuração com taxas de fluxo padrão
NOTA: O sistema de pressão controlado pelo computador permite um ajuste fácil e preciso das pressões de todas as entradas/saídas conectadas à câmara PDMS, portanto o controle das taxas de fluxo de entrada e saída. As configurações predefinidas podem ser salvas e ligadas/desligadas com um único clique do mouse. Abaixo estão as configurações recomendadas (salvo o contrário indicado, a pressão de saída é definida como 0 mbar). Consulte a Tabela 3 para obter as taxas de fluxo esperadas para essas configurações predefinidas. As pressões aqui indicadas devem ser ajustadas dependendo da geometria da câmara e da configuração do sistema.
-
Mudança: Use esta predefinição ao alterar um ou mais reservatórios. Cria um leve fluxo para trás na tubulação de interesse para evitar a introdução de bolhas.
- Coloque todas as pressões de entrada em 12 mbar e pressão de saída para 5 mbar (Figura 2B).
-
Alto Fluxo 'Todos': Use esta predefinição para injetar rapidamente três soluções em paralelo. Eles chegarão à câmara dentro de 4 minutos.
- Coloque todas as pressões de entrada para 150 mbar.
-
Alto Fluxo 'x': Use esta predefinição para injetar rapidamente uma solução. Chegará à câmara dentro de 3 min (Figura 3A-C).
- Coloque a pressão 'x' da entrada a 150 mbar (~15 μL/min). A pressão nas outras entradas é ajustada para cerca de 100 mbar, de tal forma que a taxa de fluxo resultante nessas entradas é de ~500 nL/min.
-
Mid Flow 'All': Use este predefinido para pausar o sistema.
- Coloque todas as entradas em 20 mbar (Figura 2A).
-
Mid Flow 'x': Use esta predefinição para permitir que a solução 'x' preencha a maior parte da largura principal do canal (ver Figura 2C,D), enquanto restringe as outras soluções de entrada para os lados do canal. Os filamentos actinas na câmara serão, portanto, expostos à condição bioquímica imposta apenas pela solução 'x'.
- Coloque a pressão 'x' da entrada a 12 mbar. Defina a pressão nas outras entradas e ajuste-se a ~9 mbar, de modo que suas respectivas taxas de fluxo sejam ~ 150 nL/min.
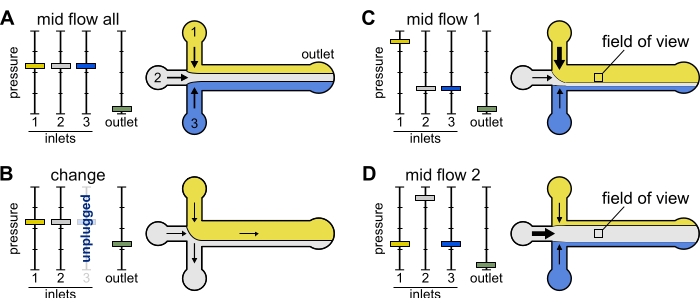
Figura 2: A pressão aplicada a cada reservatório controla a partição/distribuição espacial das soluções dentro da câmara microfluídica. (A) Com igual pressão aplicada aos reservatórios, cada solução ocupa um terço da câmara. (B) Ao trocar um tubo de reservatório (aqui reservatório 3), a pressão efetiva cai para zero, criando um fluxo para trás. (C,D) O aumento da pressão relativa em um dos reservatórios permite a exposição da superfície de vidro a uma única solução. O campo de visão no meio da câmara pode ser sequencialmente exposto às soluções 1 e 2 alternando entre a configuração Mid Flow 1 (C) e Mid Flow 2 (D). Clique aqui para ver uma versão maior desta figura.
7. Mudar a solução 'x'
NOTA: Como mostrado na Figura 3A-C, é importante ter em mente que as soluções levam minutos para fluir de um tubo de reservatório para o canal principal da câmara. Este tempo mínimo de "morto" é imposto pelo volume líquido contido na tubulação e pelo perfil de fluxo dentro da tubulação (Figura 3A-C).
- Prepare 200-300 μL de solução em um novo tubo de reservatório. Defina a pressão para a configuração de alteração (ver seção 6).
- Desaparafusar o tubo do reservatório da entrada 'x'. A solução na tubulação fluirá lentamente para trás, da câmara para a ponta de tubulação livre. A taxa de fluxo medida torna-se negativa (Figura 2B).
- Uma vez que uma pequena gota tenha se formado na ponta do tubo, aparar o novo tubo com a solução fresca. Uma vez que o tubo é corretamente apertado para o sistema de pressão, a taxa de fluxo da entrada retorna a positivo.
- Defina a configuração de pressão como "x" de alto fluxo.
- Dependendo da configuração microfluidica e da geometria da câmara, aguarde 3-5 min para que a solução preencha totalmente a tubulação e chegue à câmara.
- [OPCIONAL] Siga este processo medindo o aumento da fluorescência ao longo do tempo (Figura 3C).
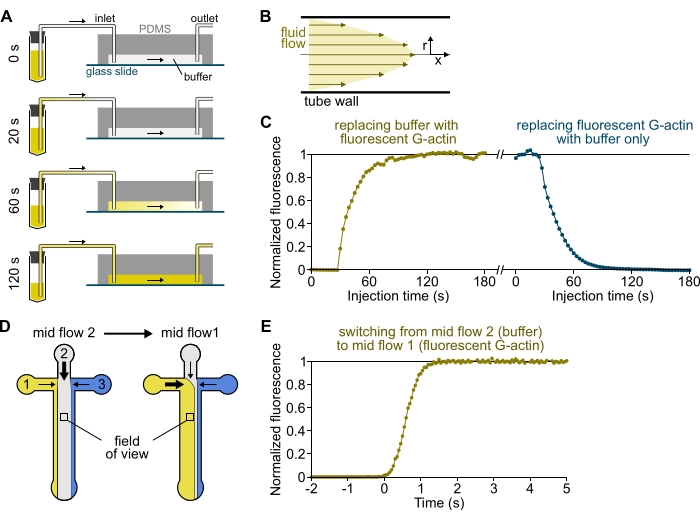
Figura 3: Atraso na chegada de soluções dos reservatórios à câmara PDMS e rápida mudança das condições bioquímicas. (A-C) Atrasou a chegada de soluções dos reservatórios para a câmara do PDMS. (A) Dependendo da geometria da câmara, do comprimento do tubo e da pressão aplicada nas entradas( s), a substituição de uma solução por outra não é instantânea. Depois de mudar o tubo do reservatório para um contendo uma solução fluorescente (0 min), a solução preenche progressivamente a tubulação (0,4 min) e a câmara PDMS (1-2 min). O tempo indicativo é dado para uma pressão aplicada de 150 mbar, tubo PEEK de 80 cm e uma câmara PDMS de 1600 μm de largura e 20 μm de altura. (B) O perfil de fluxo parabólico dentro da tubulação PEEK gera um gradiente eficaz de fluorescência ao longo do perfil radial de tubulação e dentro da câmara (ver também Figura 1B). (C) A chegada atrasada das soluções pode ser quantificada medindo o sinal de epifluorescência de fundo na câmara em função do tempo. Condições experimentais: 0,5 μM 10% Alexa-568-label g-actin é injetado com 150 mbar através de um medidor de fluxo e tubo PEEK de 80 cm. (D,E) Rápida mudança das condições bioquímicas. (D) Padrão de soluções de entrada em duas condições de Fluxo Médio. (E) Aumento da fluorescência de fundo como leitura da concentração de actina. O tempo t = 0 é definido à medida que o aparecimento da fluorescência aumenta. Solução 1: 0,5 μM 10% Alexa-488-rotulado G-actin, solução 2: F-buffer. (C,E) Câmara PDMS: 20 μm de altura e 1600 μm de largura. A intensidade de epifluorescência, ~2 μm acima da superfície, foi quantificada pela média do sinal sobre o campo de visão completo, normalizada para 0 na ausência de fluoróforo e 1 em intensidade máxima. Clique aqui para ver uma versão maior desta figura.
8. Experimento básico de filamento único: difosfato de adenosina (ADP)-actin barbed end despomerization
NOTA: Esta seção assume uma câmara não funcionalizada (somente seção 5). Se a câmara tiver sido diretamente funcionalizada (seção 4), comece na etapa 8.4.
- Funcionalização superficial com sementes de filamento de actina:
- Alterar a solução 3 a 200 μL de sementes de espectro-actina de 50 pM11 em F-buffer (ver seção 7).
NOTA: Alternativamente, se as sementes de espectrin-actin não estiverem disponíveis, pode-se usar segmentos de filamento curto biotina funcionalizado que serão imobilizados em um deslizamento revestido de streptavidin (consulte 9,10 para detalhes). - Injete por 2 min com Alto Fluxo 3.
NOTA: Ajuste a concentração e o tempo dependendo da densidade final das sementes.
- Alterar a solução 3 a 200 μL de sementes de espectro-actina de 50 pM11 em F-buffer (ver seção 7).
- Passivação superficial:
- Troque o tubo 3 com 300 μL de 5% de BSA no F-buffer.
- Injete por 5 min em High Flow 3, seguido por 5 min no Mid Flow 3. Durante esta segunda etapa, reduza a pressão nos canais 1 e 2 a 7-8 mbar para obter um fluxo de contador ~-100 nL/min, de modo que todas as superfícies da câmara sejam passivadas.
NOTA: Como a solução BSA é mais viscosa, as pressões precisam ser ajustadas em conformidade.
- Mude o tubo 3 para f-tampão e enxágue o canal (5 min, Alto Fluxo 3).
- Prepare as seguintes soluções 200-300 μL, todas as proteínas sendo diluídas no F-buffer:
Entrada 1, solução de polimerização: 1 μM 10% Alexa-488 rotulado G-actin, 1 μM profilin (Tabela 1).
Entrada 2, solução de envelhecimento: 0,15 μM 10% Alexa-488 rotulado G-actin.
Entrada 3, solução de despolimerização: somente f-buffer.
NOTA: A profilina é usada aqui para prevenir a nucleação espontânea e para manter uma concentração constante de G-actin. - Alterar tubos 1 a 3 (seção 7). Injete usando a predefinição de Alto Fluxo por 3-4 min. As três soluções já encheram o tubo PEEK e chegaram à câmara (Figura 3A). A superfície de vidro pode ser exposta a qualquer solução de entrada sem tempo de inatividade (<1 s, Figura 3D,E).
- Ligue o microscópio. Ajuste as configurações: laser de excitação de 150 mW 488 nm a 10%-20% de potência, tempo de exposição da câmera de 100-200 ms, profundidade de penetração de 200-300 nm TIRF, objetivo de 60x. Essas configurações são usadas em todo o manuscrito.
- Polimerização de filamentos (Figura 4A):
- Ajuste a configuração de pressão para Mid Flow 1 por ~10 min.
- [OPCIONAL] Polymerização de registro (1 quadro/20 s, TIRF). Os filamentos devem polimerizar em torno de 10 subunidades/segundo (sub/s)1,12.
- Envelhecimento do filamento: Ajuste a configuração de pressão para Mid Flow 2 por 15 min. Na concentração crítica, 0,15 μM G-actin, o comprimento do filamento permanecerá constante, e os filamentos se voltarão para >99% ADP-F-actin4.
- Despolimerização (Figura 4A):
- Iniciar a aquisição em 1 frame/5 s, no modo de epifluorescência. Como há um fundo de fluorescência muito baixo nos canais 2 e 3, não é necessário usar TIRF.
- Depois de um a dois quadros, mude para Mid Flow 3. Filamentos devem despolimerizar em torno de 10 sub/s (referência12).
- Para redefinir o experimento, quebre todos os filamentos rotulados fluorescente, expondo-os continuamente ao laser em potência máxima por ~2 min. Para testar condições diferentes, altere as soluções 1, 2 ou 3 e injete-as (Alto Fluxo, 3-4 min). Repetir as etapas 8.7-8.9.
9. Outros experimentos de filamento único
- Testando as interações de ABPs com F-actin
NOTA: Os microfluidos foram usados com sucesso para quantificar a atividade de vários ABPs de ligação lateral, como cofilina, tropomyosina e Arp2/3. Seguindo o protocolo na seção 8:- Mude o canal 3 para o ABP fluorescente de interesse em F-buffer. Injeção (Alto Fluxo 3, 3 min).
- Polimerização de filamentos: Ajuste a configuração de pressão para Mid Flow 1 por 10 min.
- Vinculação ABP: Iniciar a aquisição com a TIRF. Ajuste a taxa de quadros dependendo da concentração de ABP. Após 1-2 quadros, mude para Mid Flow 3.
NOTA: Dependendo da ABP, também pode ser possível mudar rapidamente (por exemplo, por menos de 5 s) para Mid Flow 2 para reduzir ainda mais a fluorescência de fundo ao tirar uma imagem. - ABP desvinculação: Enquanto continua a aquisição, mude para Mid Flow 2.
- Polimerização com formin na extremidade farpada grátis
NOTA: Os formins têm sido mostrados para afetar a polimerização final de filamentos. Os microfluidos são particularmente adaptados para medir taxas de ligação e desvinculação e seu impacto no alongamento do filamento.- Prepare as seguintes soluções:
Canal 1: 10 nM formin em F-buffer (Tabela 1).
Canal 2: 1 μM 10% Alexa-488 rotulado G-actin, 4 μM profilin.
Canal 3: F-buffer. - Alterar os tubos 1, 2 e 3 (seção 7). Injete usando a predefinição de Alto Fluxo por 3-4 min.
- Inicie a polimerização do filamento: Ajuste a configuração de pressão para Mid Flow 2 por 2 min.
- Formin vinculando ao fim farpado de filamento: Ajuste as configurações de pressão para Mid Flow 1 para 30 s.
- Polimerização mediada por formin: Ajuste a configuração de pressão para Mid Flow 2. Com formin mDia1 em seu final farpado, os filamentos devem polimerizar em torno de 50 sub/s 13,14,15.
- Prepare as seguintes soluções:
- Polimerização/despolimerização a partir de formin ancorado na superfície
NOTA: As taxas de polimerização e despomerização das extremidades farpadas decoradas por formin têm sido mostradas dependendo da tensão aplicada ao filamento. Nos microfluidos, o atrito do fluxo de fluidos ao longo do lado do filamento gera uma tensão proporcional ao comprimento do filamento e à vazão14,16.- Use o método na seção 8 descrita acima, substituindo as etapas 8.1, 8.2 e 8.3 para a passivação da superfície com:
- Alterar tubo de 3 a 1 μg/mL anticorpo em F-buffer. Injete por 2 min com Alto Fluxo 3.
- Troque o tubo 3 com 5% de BSA no tampão F. Injete por 5 min em High Flow 3, seguido por 5 min no Mid Flow 3. Durante esta segunda etapa, reduza a pressão nos canais 1 e 2 a 7-8 mbar para obter um fluxo de contador ~-100 nL/min para que todas as superfícies da câmara sejam passivadas.
- Alterar tubo de 3 a 100 nM Seu formin marcado em F-buffer. Injete por 5 minutos com Alto Fluxo 3. Troque o tubo 3 com tampão F. Injete por 5 minutos com Alto Fluxo 3 para garantir que não permaneçam os formins na tubulação.
- Prepare e injete as seguintes soluções (200-300 μL cada, em F-buffer):
Canal 1: 1 μM 10% Alexa-488 rotulado G-actin.
Canal 2: 1 μM G-actin descrente, 4 μM profilin.
Canal 3: Somente f-buffer. - Nucleação de filamento: Exponha os formins ancorados na superfície ao G-actin (configurando o fluxo médio 1).
- Polimerização de filamentos: Exponha a câmara à profilina-actina usando Mid Flow 2.
- Aquisição inicial: 1 quadro/2 s, epifluorescência. Com formin mDia1, os filamentos devem polimerizar a 50-80 sub/s, dependendo do comprimento do filamento e da taxa de fluxo14.
- Despomerização de filamentos: Iniciar a aquisição (1 quadro/4 s, epifluorescência). Após 1-2 quadros, exponha os filamentos ao F-buffer, Mid Flow 3. Com formin mDia1, os filamentos devem despomerizar a 5-15 sub/s, dependendo do comprimento do filamento e da taxa de fluxo14.
- Use o método na seção 8 descrita acima, substituindo as etapas 8.1, 8.2 e 8.3 para a passivação da superfície com:
- Filamentos actin com segmentos não rotulados
NOTA: A rotulagem fluorescente actina cria vários artefatos, como pausas durante a despolimerização17 e a ligação de tropomyosina alterada18. Uma solução alternativa para esses artefatos é usar microfluidos para montar filamentos exibindo segmentos não rotulados.- Prepare e injete as seguintes soluções (200-300 μL em F-buffer):
Canal 1: 1 μM G-actin descrente, 1 μM profilin.
Canal 2: 0,3 μM 10% Alexa-488 rotulado G-actin. - Expor sequencialmente a superfície ao canal 2 (5 min), canal 1 (10 min) e canal 2 (15 min) para gerar segmentos não rotulados com rótulos fluorescentes em cada extremidade.
- Prepare e injete as seguintes soluções (200-300 μL em F-buffer):
- Filamentos ancorados no final com gelsolina
NOTA: Com sementes de espectrina-actina, os filamentos polimerizam em sua extremidade farpada livre enquanto a extremidade pontiaguda é estabilizada pela semente spectrin-actin. Uma alternativa é ancorar filamentos com um capper de extremidade farpado, como gelsolin.- Prepare uma solução F-actin de 4 μM 10% Alexa-488 rotulada G-actin em 20 μL de F-buffer. Deixe a actina espontaneamente nuclear e polimerizar na RT por pelo menos 30 minutos no banco. Enrole o tubo em papel alumínio para protegê-lo da luz.
- Enquanto isso, prepare a câmara microfluidica e passee a superfície com uma mistura de 5% de BSA e 1% biotina-BSA (ver passo 8.2).
- Enxágüe o canal 3 com f-buffer (2 min em Alto Fluxo 3). Injete 10 μg/mL neutravidin em F-buffer (4 min no Alto Fluxo 3).
- Alterar tubos para:
Canal 1: 10 nM biotina-gelsolina (Tabela 1).
Canal 2: F-buffer.
Canal 3: 0,4 μM prepolymerizado F-actin. - Injete todas as soluções em conjunto usando a configuração High Flow All por 3 minutos.
- Exponha toda a câmara à gelsolina (Mid Flow 1, 30 s).
- Anexar filamentos à superfície (Baixo Fluxo 3: Canal 3 a 3 mbar, Canais 1 e 2 a ~2 mbar, por cerca de 2 min).
- [OPCIONAL] Se a densidade do filamento for muito baixa, repita a etapa 9.5.6 e 9.5.7.
- Despolimerização final pontuda: Iniciar a aquisição (1 quadro/30 s, epifluorescência). Após 1-2 quadros, exponha filamentos apenas para buffer, Mid Flow 2. Filamentos devem despolimerizar em torno de 0,2 sub/s.
10. Formação e desmontagem do feixe de filamento induzido por Fascin por ADF/cofilin
NOTA: Para formar pacotes de filamentos de actina, certifique-se de ter uma densidade de sementes de filamento suficientemente alta na superfície da câmara. Quando expostos à proteína da fascina, os filamentos vizinhos que flutuam lateralmente serão dinamicamente intercambiados por proteínas de fascina. Como a fascina se desvincula rapidamente do lado do filamento19, a fascin deve estar constantemente presente na solução principal de fluxo para manter o agrupamento de filamentos.
- Siga os passos 8.1-8.3.
- Preparar as seguintes soluções (200-300 μL em F-buffer):
Canal 1, solução de polimerização: 1 μM 10% Alexa-488 rotulado G-actin, 1 μM profilin.
Canal 2, solução de bundling: 200 nM fascin (Tabela 1), 0,15 μM 10% Alexa-488 rotulado G-actin.
Canal 3, solução de desmontagem: 200 nM ADF/cofilin (Tabela 1), 100 nM fascin, 0,15 μM 10% Alexa-488 rotulado G-actin. - Alterar tubos 1 a 3 (seção 7). Injete usando a predefinição de Alto Fluxo , por 3-4 min.
- Polimerização de filamentos: Ajuste a configuração de pressão para Mid Flow 1 por ~10 min. A polimerização pode ser imageda com TIRF.
- Agrupamento de filamentos (Figura 4C): Iniciar a aquisição de imagem (1 quadro/5 s, epifluorescência). Após 1-2 quadros, ajuste a configuração de pressão para Mid Flow 2 e observe o agrupamento de filamentos.
- Fragmentação do feixe: Iniciar a aquisição de imagens (1 quadro/5 s, epifluorescência). Após 1-2 quadros, ajuste a configuração de pressão para Mid Flow 3 e observe a desmontagem induzida por cofilina de filamentos e feixes únicos.
11. Procedimento de limpeza de dispositivos microfluidos
NOTA: Para evitar qualquer contaminação de um experimento para outro, é fundamental limpar extensivamente e secar completamente todos os tubos e medidores de fluxo após cada experimento.
- Desconecte todos os tubos da câmara PDMS e descarte a câmara.
- Para limpar os medidores de tubos e fluxo peek, fita o tubo termina em um tubo plástico vazio de 15 mL e injete as seguintes soluções em pressão máxima até que o reservatório esteja quase vazio:
400 μL de F-buffer.
400 μL de 0,5 M NaOH.
400 μL de água pura.
200 μL de isopropanol. - Substitua por um reservatório vazio e assopre ar até que as tubulações estejam totalmente secas (~2-4 min, pressão máxima).
12. Análise de imagem
NOTA: Enquanto este manuscrito se concentra no método de montar, manipular e visualizar filamentos de actina única em microfluidos, um breve método para analisar filmes adquiridos é fornecido aqui. A análise é realizada em imagens de 16 bits, utilizando ImageJ, seguindo a seção 8.
- O tratamento de imagem é mínimo:
- Importe a pilha de imagens de polimerização ou despomerização.
- [OPCIONAL] Homogeneize a intensidade da imagem com função Subtrair fundo (configurações padrão (ou seja, 'Raio de bola rolando' = 50 pixels)). Isso é particularmente útil se a fluorescência de fundo mudar durante o curso de um filme ou se a iluminação da fluorescência não for homogênea sobre o campo de visão.
- Ajuste o brilho e o contraste (fundo perto de zero, filamentos perto do máximo).
- Criar kymograma de filamento:
- Selecione um filamento que não faça pausa, quebre ou desprende. Não selecione com base no comportamento de outra forma. Desenhe uma linha 1-2 pixels acima (ferramenta Linha Reta ). Salve o número de filamento (Adicionar no GERENCIADOr de ROI).
- Aplique a função Reslice (Contagem de fatias: 5 pixels). Calcule a intensidade máxima (função Zprojection).
- Meça a taxa de polimerização/despolimerização:
- No kymograph, desenhe uma linha ao longo da extremidade farpada do filamento (ferramenta Straight Line , Figura 4A). Meça a largura e a altura da linha ( função Medida).
- Repita as etapas 12.2-12.3 sobre vários filamentos. Calcular as taxas de polimerização/despolimerização (Figura 4A):
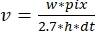 , onde v é a taxa (em sub/s), w a largura da linha (pixels), pix o tamanho do pixel (nm), h a altura da linha (quadros) e dt o tempo entre os quadros (em segundo). Aqui, 2,7 nm corresponde à contribuição efetiva de uma subunidade actina ao comprimento do filamento.
, onde v é a taxa (em sub/s), w a largura da linha (pixels), pix o tamanho do pixel (nm), h a altura da linha (quadros) e dt o tempo entre os quadros (em segundo). Aqui, 2,7 nm corresponde à contribuição efetiva de uma subunidade actina ao comprimento do filamento.
Resultados
Para todos os experimentos descritos acima, filamentos de actina fluorescentemente rotulados devem ser claramente visíveis, com bom contraste, indicativo de baixa fluorescência de fundo da superfície (Figura 4, ver Arquivo Suplementar 1 para solução de problemas comuns). Os filamentos actinados também não devem ficar na superfície: quando a taxa de fluxo dominante é baixa, as flutuações laterais dos filamentos actina devem ser perceptíveis ao observá-las ao vivo...
Discussão
Comparado aos métodos padrão de filamento único, onde filamentos de actina são ancorados na superfície por vários pontos ao longo de seu comprimento ou mantidos perto dele por um agente de aglomeração como metilcelulose, os microfluidos oferecem uma série de vantagens. Como as interações com a superfície são mínimas, as pausas artificiais que essas interações podem induzir durante o alongamento e a despomerização são evitadas. Os filamentos são alinhados pelo fluxo, paralelos uns aos outros, facilitan...
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Somos gratos ao B. Ladoux e R.-M. Laboratório Mège para o uso de seus equipamentos de limpeza UV, e J. Heuvingh e 0. du Roure para o treinamento inicial que recebemos na preparação de moldes em wafers de silício e fornecendo dicas sobre microfluidos. Reconhecemos o financiamento do Conselho Europeu de Pesquisa Grant StG-679116 (para A.J.) e Agence Nationale de la Recherche Grants Muscactin and Conformin (para G.R.-L.).
Materiais
| Name | Company | Catalog Number | Comments |
| β-Casein | Merck | C6905 | Used at 8 mg/mL |
| Biopsy punch (with plunger) | Ted Pella | 15115-2 | ID 0.75 mm, OD 1.07 mm |
| Biotin-BSA | Merck | A8549 | Used at 1 mg/mL |
| BSA | Merck | A8022 | Used at 50 mg/mL |
| Coverslip Mini-Rack Teflon holder | Invitrogen | C14784 | for 8 coverslips |
| Coverslips 22x40mm Thickness #1.5 | Menzel Gläser | 631-1370 | |
| DABCO | Merck | D27802 | component in f-buffer |
| DTT | Euromedex | EU0006-D | component in f-buffer |
| Ester NHS Alexa Fluor 488 | Invitrogen | A20000 | Fluorophore for actin labeling on Lys328. |
| EZ-Link Sulfo-NHS-Biotin | Thermo Scientific | 21338 | To biotinylate actin on Lys328 |
| Hellmanex III | Hellma | 9-307-011-4-507 | Glass cleaning detergent |
| ImageJ | NIH | N/A | open source software |
| Laboport | KNF | 811kn.18 | vacuum pump (ultimate vacuum: 240 mbar) |
| Magic invisible tape | Scotch | 7100024666 | standard transparent office tape |
| Micrewtube | Simport | T341-6T | 2 mL microfluidic reservoir tubes |
| Microfluidic device Part 1: Flow Unit S | Fluigent | FLU-S-D-PCKB | Flowmeter |
| Microfluidic device Part 2: Fluiwell-4C-2 mL | Fluigent | 14002001PCK | Reservoir holder |
| Microfluidic device Part 3: MFCS-EZ | Fluigent | EZ-11000001 EZ-00345001 | Pressure controller |
| Model 42 - UVO-Cleaner | Jelight Inc. | 42-220 | Ultraviolet cleaner |
| N6-(6-Aminohexyl)-ATP-ATTO-488 | Jena Bioscience | NU-805-488 | ATP-ATTO used to label actin |
| neutravidin | Thermo Scientific | 31000 | |
| PLL-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | Use at 1 mg/mL in PBS. |
| Polydimethylsiloxane (PDMS) Sylgard 184 Silicon Elastomer | Dow Corning | 1673921 | Contains PDMS base and curing agent |
| Polyetheretherketone (PEEK) tubing | Merck | Z226661 | “Blue” : I.D. = 0.25 mm |
| Safety blow gun | Coilhose Pneumatics | 700-S | filtered air |
| Silicon tubing | VWR | 228-0701P | connect PEEK to coupler |
| Stainless steel catheter coupler | Prime Bioscience | SC22/15 | Inserted into PDMS inlets and outlet to connect to PEEK tubing |
| Thermoplastic film | Sigma Aldrich | PM996 | Standard "parafilm" |
| Ultrapure ethanol | VWR | 64-17-5 | |
| Ultrasonic cleaning bath | VWR | USC200TH | To accomodate 1 L beakers |
| Vacuum dessicator | SP Bel-Art | F42022-0000 | to degas the PDMS or solutions |
Referências
- Wioland, H., Jégou, A., Romet-Lemonne, G. Celebrating 20 years of live single-actin-filament studies with five golden rules. Proceedings of the National Academy of Sciences of the United States of America. 119 (3), 2109506119 (2022).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophysical Journal. 88 (2), 1387-1402 (2005).
- Brewer, L. R., Bianco, P. R. Laminar flow cells for single-molecule studies of DNA-protein interactions. Nature Methods. 5 (6), 517-525 (2008).
- Jégou, A., et al. Individual actin filaments in a microfluidic flow reveal the mechanism of ATP hydrolysis and give insight into the properties of profilin. PLoS Biology. 9 (9), 1001161 (2011).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal x-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133 (2018).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments: JoVE. (86), e50549 (2014).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Zimmermann, D., Morganthaler, A. N., Kovar, D. R., Suarez, C. In vitro biochemical characterization of cytokinesis actin-binding proteins. Methods in Molecular Biology. 1369, 151-179 (2016).
- Funk, J., et al. Profilin and formin constitute a pacemaker system for robust actin filament growth. eLife. 8, 50963 (2019).
- Pandit, N. G., et al. Force and phosphate release from Arp2/3 complex promote dissociation of actin filament branches. Proceedings of the National Academy of Sciences of the United States of America. 117 (24), 13519-13528 (2020).
- Wioland, H., et al. ADF/Cofilin accelerates actin dynamics by severing filaments and promoting their depolymerization at both ends. Current Biology: CB. 27 (13), 1956-1967 (2017).
- Pollard, T. D., Mooseker, M. S. Direct measurement of actin polymerization rate constants by electron microscopy of actin filaments nucleated by isolated microvillus cores. The Journal of Cell Biology. 88 (3), 654-659 (1981).
- Kovar, D. R., Harris, E. S., Mahaffy, R., Higgs, H. N., Pollard, T. D. Control of the assembly of ATP- and ADP-actin by formins and profilin. Cell. 124 (2), 423-435 (2006).
- Jégou, A., Carlier, M. -. F., Romet-Lemonne, G. Formin mDia1 senses and generates mechanical forces on actin filaments. Nature Communications. 4, 1883 (2013).
- Breitsprecher, D., et al. Rocket launcher mechanism of collaborative actin assembly defined by single-molecule imaging. Science. 336 (6085), 1164-1168 (2012).
- Courtemanche, N., Lee, J. Y., Pollard, T. D., Greene, E. C. Tension modulates actin filament polymerization mediated by formin and profilin. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9752-9757 (2013).
- Niedermayer, T., et al. Intermittent depolymerization of actin filaments is caused by photo-induced dimerization of actin protomers. Proceedings of the National Academy of Sciences. 109 (27), 10769-10774 (2012).
- Gateva, G., et al. Tropomyosin isoforms specify functionally distinct actin filament populations in vitro. Current Biology: CB. 27 (5), 705-713 (2017).
- Aratyn, Y. S., Schaus, T. E., Taylor, E. W., Borisy, G. G. Intrinsic dynamic behavior of fascin in filopodia. Molecular Biology of the Cell. 18 (10), 3928-3940 (2007).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. The Journal of Cell Biology. 103, 2747-2754 (1986).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Torsional stress generated by ADF/cofilin on cross-linked actin filaments boosts their severing. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2595-2602 (2019).
- Colombo, J., et al. A functional family of fluorescent nucleotide analogues to investigate actin dynamics and energetics. Nature Communications. 12 (1), 548 (2021).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. The Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Romet-Lemonne, G., Guichard, B., Jégou, A. Using microfluidics single filament assay to study formin control of actin assembly. Methods in Molecular Biology. 1805, 75-92 (2018).
- Gieselmann, R., Kwiatkowski, D. J., Janmey, P. A., Witke, W. Distinct biochemical characteristics of the two human profilin isoforms. European Journal of Biochemistry. 229 (3), 621-628 (1995).
- Lin, D. C., Lin, S. Actin polymerization induced by a motility-related high-affinity cytochalasin binding complex from human erythrocyte membrane. Proceedings of the National Academy of Sciences of the United States of America. 76 (5), 2345-2349 (1979).
- Casella, J. F., Maack, D. J., Lin, S. Purification and initial characterization of a protein from skeletal muscle that caps the barbed ends of actin filaments. The Journal of Biological Chemistry. 261 (23), 10915-10921 (1986).
- Kremneva, E., et al. Cofilin-2 controls actin filament length in muscle sarcomeres. Developmental Cell. 31 (2), 215-226 (2014).
- Le Clainche, C., Carlier, M. -. F. Actin-based motility assay. Current Protocols in Cell Biology. , 1-20 (2004).
- Vignjevic, D., et al. Formation of filopodia-like bundles in vitro from a dendritic network. The Journal of Cell Biology. 160 (6), 951-962 (2003).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. eLife. 5, 13470 (2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Molecular Biology of the Cell. 27 (22), 3563-3573 (2016).
- Suzuki, E. L., et al. Geometrical constraints greatly hinder formin mDia1 activity. Nano Letters. 20 (1), 22-32 (2020).
- Wioland, H., Suzuki, E., Cao, L., Romet-Lemonne, G., Jegou, A. The advantages of microfluidics to study actin biochemistry and biomechanics. Journal of Muscle Research and Cell Motility. 41 (1), 175-188 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados