このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マイクロフルイディクスと蛍光顕微鏡を使用して、単一アクチンフィラメントおよびバンドルのアセンブリダイナミクスを研究する
要約
我々は、蛍光顕微鏡法と組み合わせて、個々のアクチンフィラメントをリアルタイムで正確に監視しながら、異なるタンパク質溶液に順次曝露することを可能にする、単純なアクチンフィラメントマイクロ流体アッセイのプロトコルを提示する。
要約
アクチンフィラメントの組み立てと分解を調節する複雑な分子メカニズムを解読するために、よく制御された条件下で個々の反応を監視することは大きな資産です。そのために、過去20年間に全反射蛍光(TIRF)顕微鏡を用いた生きたシングルフィラメント実験が登場し、重要な結果をもたらしました。2011年には、これらの実験の可能性をさらに広げ、繰り返し発生する問題のあるアーティファクトを回避するために、これらのアッセイに単純なマイクロフルイディクスを導入しました。この研究は、個々のアクチンフィラメントが不動態化されたカバースリップ表面に一端で固定され、流れに整列し、異なるタンパク質溶液に連続的に曝露され得るという、我々の基本的なプロトコルを詳述する。また、特定のアプリケーション向けのプロトコルを提示し、流れる溶液の粘性抗力のおかげで、制御された機械的力を適用する方法について説明します。我々は、これらの実験の技術的注意点を強調し、この技術に基づいて可能な開発を簡単に提示する。これらのプロトコルと説明は、使いやすいマイクロフルイディクス装置の今日の可用性とともに、非専門家がラボでこのアッセイを実施できるはずです。
概要
アクチンフィラメントおよびアクチンフィラメントネットワークの組み立ておよび分解は、いくつかの生化学反応によって制御され、機械的文脈に依存する。これらの複雑なメカニズムについての洞察を得るためには、個々のフィラメント上の個々の反応を(十分に多数で)観察できることは非常に貴重です。過去数十年にわたり、主に全内部反射蛍光(TIRF)顕微鏡法を用いた動的アクチンフィラメントのリアルタイム観察は、重要な技術として浮上し、バルク溶液生化学的アッセイ1では得られなかった結果の印象的なリストを提供してきました。
これを達成するには、蛍光標識されたアクチンフィラメントを顕微鏡カバースリップの表面近くに維持し、蛍光標識も可能なアクチン結合タンパク質(ABP)の溶液にさらす必要があります。そうすることで、適切に制御された生化学的条件下で個々のフィラメントで起こっている事象を監視し、反応速度を定量化する手段が提供されます。ただし、いくつかの特定の制限を考慮する必要があります。フィラメントを表面近くに人為的に維持することは、しばしば複数のアンカーポイントのおかげで、またはメチルセルロースなどのクラウディング剤を使用することによって、それらの挙動を変えることができる(例えば、それらの重合および解重合の一時停止を引き起こす2)。各フィラメントの輪郭を追跡することは、特に新しいフィラメントまたはフィラメントの断片が時間の経過とともに視野に蓄積する場合、困難な場合があります。反応は有限の体積で起こり、アクチンモノマーおよびABPの濃度は時間の経過とともに変化する可能性があり、正確な速度定数を導出することが困難になる可能性があります。最後に、ABPの溶液を更新または変更することは、30秒未満で達成することは困難であり、しばしばサンプル中の不均一なタンパク質含有量につながる。
10年以上前、個々のデオキシリボ核酸(DNA)鎖3を研究するためにすでに行われたことに触発されて、個々のアクチンフィラメント4を観察および操作するためのマイクロフルイディクスに基づく新しい技術を導入しました。これにより、古典的なシングルフィラメント技術の前述の制限を回避することができます。これらのマイクロフルイディクスアッセイでは、アクチンフィラメントは、カバースリップに吸着されたスペクトリンアクチン種子から成長させる。したがって、フィラメントは、マイクロ流体チャンバの底部にのみ一端によって固定され、固着することなく表面上で変動する。フィラメントは入ってくる溶液の流れと整合するため、輪郭の長さの監視が容易になり、TIRFを使用できるカバースリップの上の浅い領域に維持されます。異なる溶液は混合することなく同時にチャンバに流され、フィラメントは逐次的かつ迅速にそれらに曝され得る。
ここでは、ラボでシングルアクチンフィラメントマイクロフルイディクスアッセイを設定するための一連の基本的なプロトコルを提案します。カバースリップとマイクロフルイディクスチャンバーは事前に(半日で)準備することができ、いくつかの生化学的条件をテストできる実験自体は1日未満で行われます。
プロトコル
1. マイクロ流体チャンバー調製
- 複数のチャンバーパターンを持つSU-8マスターモールドを選択します。典型的なチャンバは、高さ20μm、幅800μmの3つの入口と1つの出口を備えた十字型です(図1)。このようなマスターモールドは、外部企業から購入することも、学術研究所で製造することもできます(例えば、Gicquel、Y. et al.5)。
- 金型の端にテープを貼ります。
- 長さ約50 cm、幅19 mmの標準的な透明なオフィステープ( 材料表を参照)をベンチに置き、粘着性のある面を上にします。金型を一端に垂直に置き、テープの正中線に沿って配置します。
- 金型をテープのもう一方の端までロールして、金型の周りに 1 cm の境界線を作成します。テープを金型の底に折り重ねます。
- ポリジメチルシロキサン(PDMS)溶液を調製する。
- 使い捨ての計量皿に、25〜30gのPDMSベース(材料表)を直接注ぎます。使い捨てプラスチックパスツールピペットで10%重量/重量PDMS硬化剤(材料表)を追加します。
- プラスチックスティックで手作業で徹底的に混ぜる。硬化剤がPDMSベースによく組み込まれていることを確認してください、たとえ攪拌が多くの気泡を作り出したとしても。
- PDMS溶液を真空デシケータ(材料表)中で室温(RT)で少なくとも5分間脱気します。気泡は膨張し、表面に上昇し、真空が破られると破裂します。
- PDMS溶液をSU-8金型に注ぎます。プラスチックスティックを使用して、できるだけ多くの混合物をこすり取って移します。
- PDMSを2回目(真空デシケーターで5分間)脱気します。ほとんどの泡を取り除くようにしてください(上面にあるいくつかの小さな泡は問題ありません)。
- 金型を70°Cのオーブンに少なくとも5時間置き、PDMSが網目状に凝固します。
- 固体PDMSチャンバを金型から取り外します。
警告: SU-8 金型用のシリコンウェーハは非常に壊れやすいため、PDMS をウェーハから分離する際には細心の注意が必要です。硬くて平らな表面で作業し、ウェーハを表面上で平らに保ちます。- カミソリの刃で、金型の端から約1cm離れたPDMSに円形の切り込みを入れます。すべてのパターンは、カットの内側に少なくとも0.5cmでなければなりません。中央のPDMSブロックを緩やかな牽引で静かに剥がします。
警告: SU-8 金型をはがすときは、破損しないように、SU-8 金型をベンチトップに平らに保ってください。 - PDMSをアルミ箔に面した成形面であるきれいなアルミ箔の上に置き、その表面をほこりから保護し、パターンをより目立たせます。
- カミソリの刃で、金型の端から約1cm離れたPDMSに円形の切り込みを入れます。すべてのパターンは、カットの内側に少なくとも0.5cmでなければなりません。中央のPDMSブロックを緩やかな牽引で静かに剥がします。
- パターンから少なくとも0.5cm離れたカミソリの刃でチャンバーを選択して切断します。結果として得られるPDMSブロックは、高さ約0.5cm、幅1.5cm、長さ3cmである。3つの入口と1つの出口を生検パンチで突き刺し、内径0.75mm(材料表)。
- PDMSチャンバを超高純度エタノール(材料表)で洗浄し、安全ブローガン(材料表)を使用して空気乾燥します。パターンを上に向けたPDMSを清潔なペトリ皿に入れ、蓋をして皿を閉じます。
2. ガラスカバースリップクリーニング
注:ここでは、一連の超音波処理ステップに基づく標準的なカバースリップクリーニング手順が詳述されています。他のガラスカバースリップ洗浄手順は、同様の満足のいく結果を達成することができる他の多くの刊行物に記載されている6、7、8、9。
- 10 ~ 20 枚のカバースリップ (長さ 40 mm) をポリテトラフルオロエチレン (PTFE) ホルダーに置きます (材料表)。カバースリップを0.5 Lの2%ガラス洗浄液(材料表)に1 Lガラスビーカー(35°C、30分)で超音波処理します。
- ガラス洗浄液を処分し、カバースリップを少なくとも3つの連続した0.5L浴中でdH2Oで広範囲にすすいでください。
- 1 Lのガラスビーカーに0.5 Lの2 M KOHを準備します。カバースリップをKOH(RT、30分)で超音波処理します。KOHを処分し、カバースリップを少なくとも3つの0.5L浴でdH2Oですすいでください。
警告: 適切なラボ用安全保護装置(手袋、メガネ、およびラボコート)を使用してください。 - カバースリップを0.5Lの超高純度エタノール(RT、30分)に移して超音波処理する。カバースリップは、エタノール中に最大2週間保管することができます。ビーカーを熱可塑性フィルム(材料表)で閉じて、蒸発を防ぎます。使用前に、カバースリップを空気の流れで乾かしてください。
3. PDMSチャンバーアセンブリ
- ホットプレートを100°Cに予熱する。 洗浄されたPDMSチャンバーとガラスカバースリップを最大3つまで清潔なペトリ皿に入れます。開いたシャーレを深紫外線(UV)クリーナー(λ=185nm、 材料表参照)に入れ、UV光に3〜5分間さらします。
メモ:PDMSチャンバとカバースリップは、空気または酸素プラズマに30秒間さらすことができます。 - PDMSチャンバーをカバースリップの上にそっと置きます。接触している 2 つの表面が UV に直接さらされていることを確認します。PDMSは自動的にガラスにくっつき、チャンバがはっきりと見えるようになります。
- PDMSカバースリップ界面に閉じ込められた空気を取り除くには、表面を指で非常に穏やかに押します。より強固な接合を行うには、角と側面をより強く押します。チャンバーの天井がガラス表面に接触していないことを確認してください。
- ガラス底部をホットプレートに向け、100°Cで5分間チャンバーを置きます。このステップの後、ガラス-PDMS結合は永久的になり、チャンバは一度しか使用できません。チャンバーをすぐに使用するか、清潔なペトリ皿に最大1週間保管してください。
4. [オプション] 直接パッシベーションと関数化
注:用途に応じて、チャンバは、マイクロ流体制御装置( 材料表を参照)に一度接続するか、マイクロ流体装置に接続する前にピペットを使用してチャンバに直接溶液を手動で注入することによって、不動態化および機能化することができます。後者は、より少ない試薬を消費し、マイクロ流体デバイスのポリエーテルエーテルケトン(PEEK)チューブを通して溶液を流すことによって潜在的な汚染を回避するという利点を提供する。以下のすべてのステップにおいて、溶液は、ピペットチップを出口に直接突き刺すことによって注入される。チャンバ内に気泡が出ないようにするには、PDMSチャンバの出口にチップを差し込むときに、ピペットチップから小さな液滴が突き出ていることを確認してください。同様に、ボリューム全体を注入する前にピペットチップを取り外します。
- 20 μL の PLL-PEG (リン酸緩衝生理食塩水 (PBS) に 1 mg/mL) を注入します。RTで最低1時間(または一晩)インキュベートします。蒸発を防ぐために、PDMSチャンバを湿気の多いボックス(例えば、下部コンパートメントに水を入れた空のチップボックス、および先端保持プラットフォーム上のPDMSチャンバ)に入れます。
- 20 μLの100 pMスペクトリンアクチン種子を注入する(Fバッファー中、 表1 および 表2を参照のこと)。1分以内にお待ちください。種子の濃度とタイミングを調整して、種子の表面密度を、大きな統計情報には十分高く、フィラメントが重ならないように十分に低く調整します。
注:または、スペクトリンアクチン種子が入手できない場合は、ストレプトアビジンコーティングされたカバースリップ9,10に固定化されるビオチン官能化ショートフィラメントセグメントを使用してください。 - [オプション]20 μLの5%ウシ血清アルブミン(BSA)をFバッファーに注入する。RTで10分間放置します。
- [オプション]Fバッファーに1 mg/mLのβカゼイン20 μLを注入する。RTで10分間放置します。
メモ: 手順 4.3 および/または 4.4 に従って、チャンバーをさらに不動態化します。パッシベーションの選択は、使用されるタンパク質に依存し、すべてのABPで等しくうまく機能するわけではない。アクチンを単独で使用する場合、PLL−PEGまたはBSAで十分である。
5. マイクロ流体デバイスの接続
メモ:マイクロ流体チャンバ内の流れを制御するには、最大4つのチャネルを備えた圧力ベースのマイクロ流体システムを使用します(図1A、 材料表を参照)。マイクロ流体チューブ内で気泡が形成され、流れの安定性を乱すのを避けるために、すべての溶液を脱気します。5 mL の dH20 および 10 mL の F バッファーストックを真空ポンプ (究極の真空<250 mbar) に接続された真空デシケータに入れ、RT で少なくとも 1 時間脱気します。
- 入口 + 出口チューブを dH2O (500 μL、300 mbar) ですすいでください。
- すべての 2 mL リザーバーチューブ( 材料表を参照)に 300 μL の F バッファーを満たします。圧力を300 mbarに設定し、5〜8滴を無駄にします。チャンネルごとに繰り返し、圧力を0に設定します。
- コンセントを接続し、チャンバーを広範囲にすすいでください。
- 貯留管4(流出口)の圧力を50mbarに設定する。チューブの端から液滴が出たら、チューブをPDMSチャンバの出口に接続します。液体はチャンバ内に充填され、すべての入口から出てくる。
- [オプション]チャンバーが直接不動態化されている場合(セクション4)、圧力を100 mbarに設定して、チャンバーを50〜100 μLのFバッファーですすぎます(3〜5分)。洗浄組織で入口の余分な液体を取り除きます。
- 圧力を 20 mbar に設定します。
- インレットを接続します。
- リザーバ管1の圧力を50mbarに設定する。気泡が入らないようにするには、チューブとPDMS入口から液滴が出ていることを確認してください。
- チューブをインレット 1 に接続します(接続時に 2 つの液滴が合流します)。圧力を 30 mbar に設定します。
- 手順 5.4.1 ~ 5.4.2 を繰り返して、インレット 2 と 3 を接続します。
- すべての入口の圧力を 20 mbar に設定し、出口の圧力を 0 mbar に設定します。入口の流量がほぼ同じであることを確認します(トラブルシューティングのセクションを参照)。
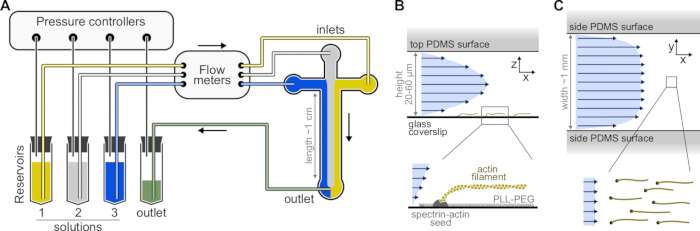
図1:マイクロ流体チャンバを通して溶液を注入する(A)単一アクチンフィラメント実験のための標準的なマイクロ流体セットアップ。リザーバ1〜3に入れられたタンパク質溶液は、気相の圧力を調整することによってチャンバ内に押し込まれる。生成された流量は、流量計によって測定されます。マイクロ流体チャンバ内では、加えられた相対圧力(ここでは、すべての入口に等しい圧力)に応じて、溶液が混合して空間を占有しない。典型的な寸法:リザーバチューブには最大2mLの溶液が含まれています。PEEKチューブ(内径0.25 mm)は、リザーバを流量計(チューブの10 cm後)に接続し、次にPDMSチャンバ(さらに70 cm後)に接続します。シリコンチューブとステンレススチールチューブカプラは、PEEKチューブをPDMSインレットに接続するために使用されます。メインのマイクロ流体チャネルは高さ20〜60μm、幅約1mm、長さ1cmです。(B,C)マイクロ流体チャンバ内のフロープロファイル。(B) 流体はチャンバの高さ全体に放物線プロファイルを生成します: v(z) = 6z(h-z)R/h3w(ここで、h と w はチャンバの高さと幅、R は総流量)。下:表面固定スペクトリンアクチン種子から重合された単一のアクチンフィラメント。(C)チャンバの幅がその高さよりもかなり大きい場合、流れは、ゼロになるPDMS表面を除いて、チャンバ全体でほぼ均一である。この図の拡大版を表示するには、ここをクリックしてください。
6. 標準流量でのセットアップの設定
メモ:コンピュータ制御の圧力システムにより、PDMSチャンバに接続されているすべての入口/出口の圧力を簡単かつ正確に調整できるため、入出力流量を制御できます。プリセット構成は、マウスを1回クリックするだけで保存およびオン/オフを切り替えることができます。以下は推奨される構成です(特に明記されていない限り、出口圧力は0 mbarに設定されています)。これらのプリセット構成の予想流量については、 表 3 を参照してください。ここに示す圧力は、チャンバの形状とシステム構成に応じて調整する必要があります。
-
変更: このプリセットは、1 つ以上のリザーバを変更するときに使用します。これは、気泡の導入を防ぐために、目的のチューブに穏やかな逆流を作り出します。
- すべての入口圧力を12 mbar、出口圧力を5 mbarに設定します(図2B)。
-
ハイフロー「すべて」:このプリセットを使用して、3つのソリューションを並列に迅速に注入します。彼らは4分以内に部屋に到着します。
- すべての入口圧力を 150 mbar に設定します。
-
ハイフロー 'x': このプリセットを使用して、ソリューションを迅速に注入します。それは3分以内にチャンバーに到達します(図3A-C)。
- 流入口 'x' 圧力を 150 mbar (~15 μL/分) に設定します。他の入口の圧力は約100 mbarに調整され、これらの入口の流量は約500 nL/minになります。
-
ミッドフロー「すべて」: このプリセットを使用してシステムを一時停止します。
- すべてのインレットを20 mbarに設定します(図2A)。
-
ミッドフロー 'x': このプリセットを使用して、ソリューション 'x' がメインチャンネル幅のほとんどを埋め、他の入口ソリューションをチャンネル側に制限できるようにします(図 2C,D を参照)。したがって、チャンバ内のアクチンフィラメントは、溶液「x」によってのみ課せられる生化学的条件にさらされる。
- インレット 'x' 圧力を 12 mbar に設定します。他の入口の圧力を設定し、それぞれの流量が〜150nL/分になるように〜9mbarに調整します。
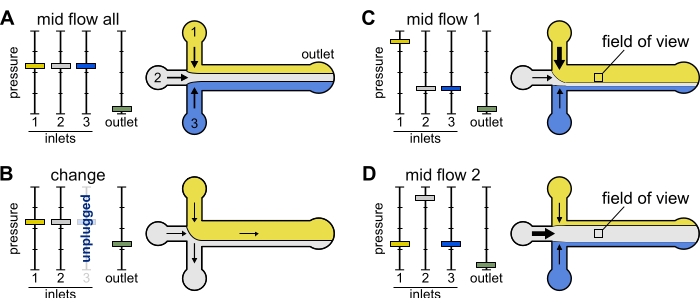
図2:各リザーバに加えられる圧力は、マイクロ流体チャンバ内の溶液の仕切り/空間分布を制御する。(A)リザーバに等しい圧力が加わると、各溶液はチャンバの3分の1を占める。(B)貯留管(ここでは貯留槽3)を交換すると、実効圧力がゼロに低下し、逆流が生じる。(C,D)リザーバの1つに対する相対圧力を増加させると、ガラス表面を単一の溶液に曝露することができる。チャンバの中央の視野は、構成ミッドフロー1(C)とミッドフロー2(D)を交互に行うことによって、溶液1および2に順次露光することができる。この図の拡大版を表示するには、ここをクリックしてください。
7. ソリューション 'x' の変更
メモ:図3A-Cに示すように、溶液がリザーバ管からチャンバの主流路に流れるのに数分かかることに留意することが重要です。この最小の「デッド」時間は、チューブに含まれる液体量とチューブ内の流量プロファイルによって課せられます(図3A-C)。
- 新しいリザーバチューブに200〜300μLの溶液を調製する。設定 を変更する ために圧力を設定します(セクション6を参照)。
- 入口 'x' のリザーバチューブのネジを外します。チューブ内の溶液は、チャンバからフリーチューブ先端までゆっくりと逆流します。測定された流量は負になります(図2B)。
- チューブ先端に小さな液滴が形成されたら、新しいチューブを新鮮な溶液でねじ込みます。チューブが圧力システムに正しく締め付けられると、入口の流量は正に戻ります。
- 圧力設定を 高流量「x」に設定します。
- マイクロ流体構成とチャンバー形状に応じて、溶液がチューブに完全に充填され、チャンバーに到達するまで3〜5分間待ちます。
- [オプション]このプロセスに従って、経時的な蛍光の増加を測定します(図3C)。
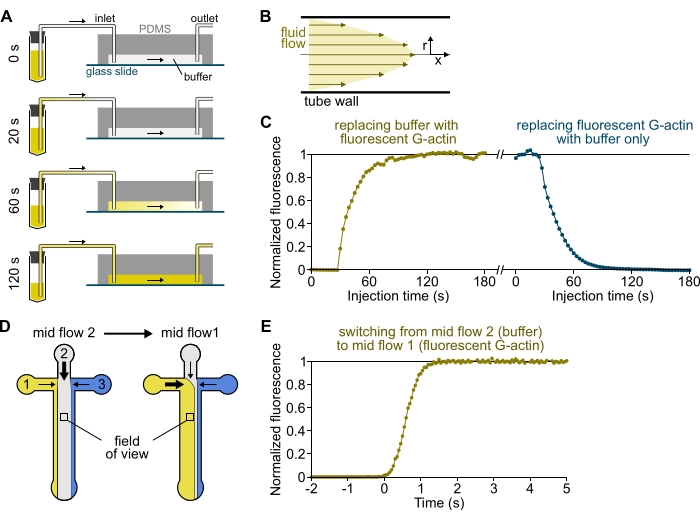
図3:リザーバからPDMSチャンバへの溶液の遅延到着および生化学的条件の急速な変化。 (A-C)リザーバからPDMSチャンバへの溶液の到着遅延。(A)チャンバの形状、チューブの長さ、および入口で加えられた圧力に応じて、ある溶液を別の溶液に置き換えても瞬時ではありません。リザーバ管を蛍光溶液を含むものに変えた後(0分)、溶液をチューブ(0.4分)およびPDMSチャンバー(1〜2分)に徐々に充填する。150 mbar の印加圧力、80 cm の PEEK チューブ、および幅 1600 μm、高さ 20 μm の PDMS チャンバについて、指示的なタイミングが示されます。 (B)PEEKチューブ内の放物線流プロファイルは、チューブの放射状プロファイルに沿ってチャンバ内の蛍光の効果的な勾配を生成します(図1Bも参照)。 (c)溶液の遅延到着は、チャンバ内のバックグラウンド落射蛍光シグナルを時間の関数として測定することによって定量化することができる。実験条件:0.5μM 10% Alexa-568標識Gアクチンを、流量計および80cmPEEKチューブを通して150mbarで注入する。 (D,E)生化学的条件の急速な変化。 (D) 2 つの中間フロー条件における入ってくるソリューションのパターン。 (e)アクチン濃度の読み出しとしてのバックグラウンド蛍光の増加。時間t=0は、蛍光の発症が増加するにつれて設定される。溶液1:0.5μM 10%Alexa-488標識G-アクチン、溶液2:F-バッファー。(C,E)PDMSチャンバー:高さ20μm、幅1600μm。落射蛍光強度を、表面から約2μm上方に、全視野にわたってシグナルを平均化することによって定量化し、フルオロフォアの非存在下では0、最大強度では1に正規化した。この図の拡大版を表示するには、ここをクリックしてください。
8.基本的なシングルフィラメント実験:アデノシン二リン酸(ADP)-アクチン有刺鉄末端解重合
注: このセクションは、機能化されていないチャンバーを想定しています(セクション 5 のみ)。チャンバーが直接機能化されている場合(セクション4)、ステップ8.4から開始します。
- アクチンフィラメント種子による表面官能化:
- 溶液3をF緩衝液中の50pMスペクトリンアクチン種子11の200μL に変更する(セクション7参照)。
注:あるいは、スペクトリンアクチン種子が入手できない場合は、ストレプトアビジンコーティングされたカバースリップに固定されるビオチン官能化ショートフィラメントセグメントを使用することができます(詳細については9,10を参照)。 - ハイフロー3で2分間注入します。
注:最終的な種子密度に応じて濃度と時間を調整します。
- 溶液3をF緩衝液中の50pMスペクトリンアクチン種子11の200μL に変更する(セクション7参照)。
- 表面パッシベーション:
- チューブ3をFバッファー中の5%BSAを300μLで交換する。
- ハイフロー3で5分間注入し、続いてミッドフロー3で5分間注入します。この第2ステップでは、チャンバ表面全体がBSA不動態化されるように、チャネル1および2の圧力を7〜8mbarに下げて、対向流〜-100nL/minを得る。
注:BSA溶液はより粘性が高いため、それに応じて圧力を調整する必要があります。
- チューブ3をFバッファーに変更し、チャネルをすすぎます(5分、 ハイフロー3)。
- 以下の200-300 μL溶液を調製し、すべてのタンパク質をFバッファーで希釈する:
注入口1、重合溶液:1 μM 10%Alexa-488標識G-アクチン、1 μM プロフィリン(表1)。
導入口2、熟成溶液:0.15 μM 10%Alexa-488標識G-アクチン。
導入口3は、解重合液:F緩衝液のみ。
注:プロフィリンは、自発的な核生成を防止し、G-アクチンの一定の濃度を維持するためにここで使用されます。 - チューブ 1 を 3 に変更します (セクション 7)。 「高流量すべて」 プリセットを使用して 3 ~ 4 分間注入します。これで、3つのソリューションがPEEKチューブに充填され、チャンバに到達しました(図3A)。ガラス表面は、デッドタイムなしで任意の入口溶液にさらすことができます(<1秒、 図3D、E)。
- 顕微鏡のスイッチを入れます。設定を設定します:10%-20%のパワーで150 mW 488 nm励起レーザー、100-200 msのカメラ露出時間、200-300 nm TIRF貫通深さ、60倍の対物レンズ。これらの設定は原稿全体を通して使用されます。
- フィラメント重合(図4A):
- 圧力設定を Mid Flow 1 に設定して、約 10 分間待ちます。
- [オプション]レコード重合(1フレーム/ 20秒、TIRF)。フィラメントは、約10サブユニット/秒(サブ/秒)1,12で重合するはずです。
- フィラメントエージング:圧力設定を Mid Flow 2 に15分間設定します。臨界濃度である0.15μM Gアクチンでは、フィラメントの長さは一定のままであり、フィラメントは>99%ADP-F-アクチン4に変わります。
- 解重合(図4A):
- エピ蛍光モードで1フレーム/5秒で集録を開始します。チャネル2および3には非常に低い蛍光バックグラウンドが存在するため、TIRFを使用する必要はありません。
- 1 ~ 2 フレーム後、 ミッド フロー 3 に切り替えます。フィラメントは約10 sub/sで解重合するはずです(参考文献12)。
- 実験をリセットするには、蛍光標識されたすべてのフィラメントを最大出力でレーザーに約2分間連続的に露光して切断します。異なる条件をテストするには、溶液1、2、または3を交換して注入します(ハイフロー、3〜4分)。手順 8.7 ~ 8.9 を繰り返します。
9. その他のシングルフィラメント実験
- ABPとF-アクチンの相互作用の試験
注:マイクロフルイディクスは、コフィリン、トロポミオシン、Arp2/3などのいくつかの側結合ABPの活性を定量するために首尾よく使用されています。セクション 8 のプロトコルに従います。- チャネル3をFバッファー中の目的の蛍光ABPに変更する。注入(ハイフロー3、3分)。
- フィラメント重合:圧力設定を Mid Flow 1に10 分間設定します。
- ABPバインディング:TIRFで取得を開始します。ABP濃度に応じてフレームレートを調整します。1 ~ 2 フレーム後、 ミッド フロー 3 に切り替えます。
注:ABPによっては、画像を撮影する際のバックグラウンド蛍光をさらに低減するために 、Mid Flow 2 にすばやく(例えば、5秒未満の場合)切り替えることもできます。 - ABP のバインド解除: 集録を続行しながら、 ミッドフロー 2 に切り替えます。
- 遊離有刺鉄線端でのホルミンによる重合
注:ホルミンは、フィラメント有刺鉄線末端重合に影響を及ぼすことが示されている。マイクロフルイディクスは、ホルミン結合速度および非結合率、およびフィラメントの伸びに対するそれらの影響を測定するために特に適合されています。- 次の解決策を準備します。
チャネル1:Fバッファ中の10nMホルミン(表1)。
チャンネル2:1 μM 10% Alexa-488標識G-アクチン、4 μMプロフィリン。
チャネル 3: F バッファー。 - チューブ 1、2、および 3 を交換します (セクション 7)。 「高流量すべて」 プリセットを使用して 3 ~ 4 分間注入します。
- フィラメント重合を開始する: 圧力設定を 「ミッドフロー 2」に 2 分間設定します。
- フィラメント有刺鉄線端へのホルミン結合: 圧力設定を 30 秒間 Mid Flow 1 に設定します。
- フォーミン媒介重合: 圧力設定を「中流 2」に設定します。有刺鉄線端にホルミンmDia1がある場合、フィラメントは約50サブ/ s 13,14,15で重合するはずです。
- 次の解決策を準備します。
- 表面固定ホルミンからの重合/解重合
注:ホルミン装飾有刺鉄線末端の重合および解重合速度は、フィラメントに適用される張力に依存することが示されている。マイクロ流体学では、フィラメント側に沿った流体流の摩擦は、フィラメント長さおよび流速14,16に比例した張力を生成する。- 上記のセクション 8 の方法を使用し、サーフェスパッシベーションのステップ 8.1、8.2、および 8.3 を次のように置き換えます。
- チューブ3をFバッファー中の1 μg/mL抗His抗体に変更します。 ハイフロー3で2分間注入します。
- チューブ3をFバッファー内の5%BSAで交換します。 ハイフロー3で5分間注入し、続いて ミッドフロー3で5分間注入します。この第2ステップでは、チャンバ表面全体がBSA不動態化されるように、チャネル1および2の圧力を7〜8mbarに下げて、〜-100nL/minのカウンターフローを得る。
- チューブ3をFバッファー中の100nM Hisタグ付きホルミンに変更する。 ハイフロー3で5分間注入します。チューブ3をFバッファで交換してください。 ハイフロー3 で5分間注入し、チューブにホルミンが残っていないことを確認します。
- 以下の溶液を調製し、注入する(それぞれ200〜300μL、Fバッファー中):
チャンネル1:1μM 10%Alexa-488標識G-アクチン。
チャネル2:1 μM非標識G-アクチン、4 μMプロフィリン。
チャネル 3: F バッファーのみ。 - フィラメント核生成:表面固定ホルミンをGアクチンに露出させます( Mid Flow 1を設定)。
- フィラメント重合: Mid Flow 2を使用してチャンバーをプロフィリン - アクチンにさらします。
- 取得開始:1フレーム/ 2秒、エピ蛍光。ホルミンmDia1では、フィラメントは、フィラメントの長さと流量14に応じて、50〜80サブ/ sで重合する必要があります。
- フィラメント解重合:取得を開始します(1フレーム/ 4秒、エピ蛍光)。1 ~ 2 フレーム後、フィラメントを F バッファー Mid フロー 3 にさらします。ホルミンmDia1では、フィラメントは、フィラメントの長さおよび流速14に応じて、5〜15サブ/ sで解重合するはずである。
- 上記のセクション 8 の方法を使用し、サーフェスパッシベーションのステップ 8.1、8.2、および 8.3 を次のように置き換えます。
- ラベル化されていないセグメントを有するアクチンフィラメント
注:アクチン蛍光標識は、解重合中の一時停止17 やトロポミオシン結合の変化18など、いくつかのアーチファクトを作成します。これらのアーティファクトの回避策は、マイクロフルイディクスを使用して、ラベル付けされていないセグメントを表示するフィラメントを組み立てることです。- 以下の溶液(Fバッファー中200-300 μL)を調製し、注入する:
チャネル1:1 μM非標識G-アクチン、1 μMプロフィリン。
チャンネル2:0.3μM 10%Alexa-488標識Gアクチン。 - 表面をチャネル 2 (5 分)、チャネル 1 (10 分)、およびチャネル 2 (15 分) に順次露出させて、両端に蛍光標識セグメントを持つ ADP-アクチン非標識セグメントを生成します。
- 以下の溶液(Fバッファー中200-300 μL)を調製し、注入する:
- ゲルソリンを含む有刺鉄線エンドアンカーフィラメント
注:スペクトリンアクチンシードでは、フィラメントは遊離有刺鉄線端で重合し、尖った端はスペクトリンアクチンシードによって安定化されます。別の方法として、ゲルソリンなどの有刺鉄線エンドキャッパーでフィラメントを固定する方法があります。- 20 μLのFバッファー中に4 μM 10% Alexa-488標識GアクチンのFアクチン溶液を調製する。アクチンを自発的に核生成させ、ベンチ上で少なくとも30分間RTで重合させる。チューブをアルミホイルで包み、光から保護します。
- 一方、マイクロ流体チャンバーを調製し、5%BSAおよび1%ビオチン-BSAの混合物で表面を不動態化する(ステップ8.2を参照のこと)。
- 流路3をFバッファーですすぎます( ハイフロー3で2分)。10 μg/mL のニュートラビジンを F バッファーに注入します ( ハイフロー 3 で 4 分間)。
- チューブを次のように変更します。
チャネル1:10nMビオチンゲルソリン(表1)。
チャネル 2: F バッファー。
チャンネル3:0.4μM予備重合F-アクチン。 - 「高流量すべて」設定を使用して、すべての溶液を一緒に注入します。
- チャンバー全体をゲルソリンにさらします(ミッドフロー1、30秒)。
- フィラメントを表面に取り付けます(ローフロー3:チャンネル3を3 mbarで、チャンネル1とチャンネル2を約2 mbarで約2分間)。
- [オプション]フィラメント密度が低すぎる場合は、ステップ 9.5.6 と 9.5.7 を繰り返します。
- 尖った端の解重合:取得を開始します(1フレーム/ 30秒、エピ蛍光)。1 ~ 2 フレーム後、フィラメントをバッファー (Mid Flow 2) のみにさらします。フィラメントは約0.2 sub/sで解重合するはずです。
10. ADF/コフィリンによるファスチン誘発フィラメントバンドルの形成と分解
注:アクチンフィラメントバンドルを形成するには、チャンバの表面でフィラメントシード密度が十分に高いことを確認してください。ファスキンタンパク質に曝露されると、横方向に変動する隣接するフィラメントは、ファスチンタンパク質によって動的に架橋される。ファシンはフィラメント側19から素早く結合解除されるため、ファシンはフィラメントの束ねを維持するために、主流動溶液中に常に存在する必要がある。
- ステップ 8.1-8.3 に従います。
- 以下の溶液(Fバッファー中200-300 μL)を調製する:
チャネル1、重合溶液:1 μM 10% Alexa-488標識G-アクチン、1 μM プロフィリン。
チャネル2、バンドル溶液:200nMファスキン(表1)、0.15μM 10%Alexa-488標識Gアクチン。
チャンネル3、分解溶液:200 nM ADF/コフィリン(表1)、100 nMファスシン、0.15 μM 10% Alexa-488標識Gアクチン。 - チューブ 1 を 3 に変更します (セクション 7)。 「高流量すべて」 プリセットを使用して 3 ~ 4 分間注入します。
- フィラメント重合:圧力設定を Mid Flow 1 に設定して約10分間。重合はTIRFでイメージングすることができる。
- フィラメントバンドル(図4C):画像取得を開始します(1フレーム/5秒、エピ蛍光)。1 ~ 2 フレーム後、圧力設定を Mid Flow 2 に設定し、フィラメントの束ねを観察します。
- バンドルの断片化:画像取得を開始します(1フレーム/5秒、エピ蛍光)。1~2フレーム後、圧力設定を Mid Flow 3 に設定し、単一フィラメントとバンドルの両方のコフィリン誘発分解を観察します。
11. マイクロ流体デバイスの洗浄手順
注:ある実験から別の実験への汚染を避けるためには、各実験後にすべてのチューブと流量計を広範囲に清掃し、完全に乾燥させることが重要です。
- PDMSチャンバからすべてのチューブを取り外し、チャンバを廃棄します。
- PEEKチューブと流量計を清掃するには、チューブの端を空の15 mLプラスチックチューブにテープで固定し、リザーバがほとんど空になるまで最大圧力で次の溶液を注入します。
400 μL の F バッファー。
400 μL の 0.5 M NaOH.
400μLの純水。
200μLのイソプロパノール。 - 空のリザーバと交換し、チューブが完全に乾くまで空気を吹き込みます(〜2〜4分、最大圧力)。
12. 画像解析
注:この原稿は、マイクロ流体学における単一のアクチンフィラメントを組み立て、操作し、視覚化する方法に焦点を当てていますが、ここでは、獲得した映画を分析するための簡単な方法を提供します。分析は、セクション 8 に続く ImageJ を使用して、16 ビット イメージに対して実行されます。
- 画像処理は最小限です:
- 重合または解重合の画像スタックをインポートします。
- [オプション] [背景の減算] 機能(デフォルト設定(「ローリングボール半径」= 50ピクセル))で画像強度を均質化します。これは、映画の進行中にバックグラウンド蛍光が変化する場合や、蛍光照明が視野上で均質でない場合に特に便利です。
- 明るさとコントラストを調整します(背景はゼロ近く、フィラメントは最大近く)。
- フィラメントキモグラフを作成します。
- 一時停止、破損、または剥離しないフィラメントを選択します。それ以外の場合は、動作に基づいて選択しないでください。1 ~ 2 ピクセル上に線を描画します(直線ツール)。フィラメント番号を保存します(ROIマネージャで追加)。
- 再スライス関数を適用します ( スライス 数: 5 ピクセル)。最大強度を計算します(関数 Zprojection)。
- 重合/解重合速度を測定する:
- キモグラフで、フィラメント有刺鉄線の端に沿って線を引きます(直線 ツール、 図4A)。線の幅と高さを測定します (関数 測定)。
- 複数のフィラメントに対して手順12.2~12.3を繰り返します。重合/解重合速度を計算します(図4A)。
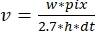 ここで、 v はレート (sub/s 単位)、 w は線幅 (ピクセル)、 pix はピクセル サイズ (nm)、 h は行の高さ (フレーム)、 dt は フレーム間の時間 (秒単位) です。ここで、2.7nmは、フィラメント長に対するアクチンサブユニットの有効寄与に相当する。
ここで、 v はレート (sub/s 単位)、 w は線幅 (ピクセル)、 pix はピクセル サイズ (nm)、 h は行の高さ (フレーム)、 dt は フレーム間の時間 (秒単位) です。ここで、2.7nmは、フィラメント長に対するアクチンサブユニットの有効寄与に相当する。
結果
上記のすべての実験において、蛍光標識されたアクチンフィラメントは、表面からのバックグラウンド蛍光が低いことを示す良好なコントラストで、はっきりと見えるはずです(図4、一般的な問題のトラブルシューティングについては、 補足ファイル1 を参照してください)。アクチンフィラメントはまた、表面にくっついてはならない:支配的な流速が低い?...
ディスカッション
アクチンフィラメントが長さに沿って複数の点によって表面に固定されるか、またはメチルセルロースなどのクラウディング剤によって表面の近くに維持される標準的なシングルフィラメント法と比較して、マイクロフルイディクスは多くの利点を提供する。表面との相互作用は最小限であるため、これらの相互作用が伸長および解重合の両方の間に誘発し得る人工的な一時停止は回避され?...
開示事項
著者は利益相反がないと宣言しています。
謝辞
B.ラドゥーとR.-M.に感謝しています。彼らのUVクリーナー装置の使用のためのMègeラボ、およびJ. Heuvinghと0。デュ・ルーレは、シリコンウェーハ上の金型の準備とマイクロ流体学のヒントの提供について受けた初期トレーニングを受けました。我々は、欧州研究評議会グラントStG-679116(A.J.へ)及びAgence Nationale de la Recherche Grants Muscactin and Conformin(G.R.-L.)からの資金提供を認める。
資料
| Name | Company | Catalog Number | Comments |
| β-Casein | Merck | C6905 | Used at 8 mg/mL |
| Biopsy punch (with plunger) | Ted Pella | 15115-2 | ID 0.75 mm, OD 1.07 mm |
| Biotin-BSA | Merck | A8549 | Used at 1 mg/mL |
| BSA | Merck | A8022 | Used at 50 mg/mL |
| Coverslip Mini-Rack Teflon holder | Invitrogen | C14784 | for 8 coverslips |
| Coverslips 22x40mm Thickness #1.5 | Menzel Gläser | 631-1370 | |
| DABCO | Merck | D27802 | component in f-buffer |
| DTT | Euromedex | EU0006-D | component in f-buffer |
| Ester NHS Alexa Fluor 488 | Invitrogen | A20000 | Fluorophore for actin labeling on Lys328. |
| EZ-Link Sulfo-NHS-Biotin | Thermo Scientific | 21338 | To biotinylate actin on Lys328 |
| Hellmanex III | Hellma | 9-307-011-4-507 | Glass cleaning detergent |
| ImageJ | NIH | N/A | open source software |
| Laboport | KNF | 811kn.18 | vacuum pump (ultimate vacuum: 240 mbar) |
| Magic invisible tape | Scotch | 7100024666 | standard transparent office tape |
| Micrewtube | Simport | T341-6T | 2 mL microfluidic reservoir tubes |
| Microfluidic device Part 1: Flow Unit S | Fluigent | FLU-S-D-PCKB | Flowmeter |
| Microfluidic device Part 2: Fluiwell-4C-2 mL | Fluigent | 14002001PCK | Reservoir holder |
| Microfluidic device Part 3: MFCS-EZ | Fluigent | EZ-11000001 EZ-00345001 | Pressure controller |
| Model 42 - UVO-Cleaner | Jelight Inc. | 42-220 | Ultraviolet cleaner |
| N6-(6-Aminohexyl)-ATP-ATTO-488 | Jena Bioscience | NU-805-488 | ATP-ATTO used to label actin |
| neutravidin | Thermo Scientific | 31000 | |
| PLL-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | Use at 1 mg/mL in PBS. |
| Polydimethylsiloxane (PDMS) Sylgard 184 Silicon Elastomer | Dow Corning | 1673921 | Contains PDMS base and curing agent |
| Polyetheretherketone (PEEK) tubing | Merck | Z226661 | “Blue” : I.D. = 0.25 mm |
| Safety blow gun | Coilhose Pneumatics | 700-S | filtered air |
| Silicon tubing | VWR | 228-0701P | connect PEEK to coupler |
| Stainless steel catheter coupler | Prime Bioscience | SC22/15 | Inserted into PDMS inlets and outlet to connect to PEEK tubing |
| Thermoplastic film | Sigma Aldrich | PM996 | Standard "parafilm" |
| Ultrapure ethanol | VWR | 64-17-5 | |
| Ultrasonic cleaning bath | VWR | USC200TH | To accomodate 1 L beakers |
| Vacuum dessicator | SP Bel-Art | F42022-0000 | to degas the PDMS or solutions |
参考文献
- Wioland, H., Jégou, A., Romet-Lemonne, G. Celebrating 20 years of live single-actin-filament studies with five golden rules. Proceedings of the National Academy of Sciences of the United States of America. 119 (3), 2109506119 (2022).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophysical Journal. 88 (2), 1387-1402 (2005).
- Brewer, L. R., Bianco, P. R. Laminar flow cells for single-molecule studies of DNA-protein interactions. Nature Methods. 5 (6), 517-525 (2008).
- Jégou, A., et al. Individual actin filaments in a microfluidic flow reveal the mechanism of ATP hydrolysis and give insight into the properties of profilin. PLoS Biology. 9 (9), 1001161 (2011).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal x-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133 (2018).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments: JoVE. (86), e50549 (2014).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Zimmermann, D., Morganthaler, A. N., Kovar, D. R., Suarez, C. In vitro biochemical characterization of cytokinesis actin-binding proteins. Methods in Molecular Biology. 1369, 151-179 (2016).
- Funk, J., et al. Profilin and formin constitute a pacemaker system for robust actin filament growth. eLife. 8, 50963 (2019).
- Pandit, N. G., et al. Force and phosphate release from Arp2/3 complex promote dissociation of actin filament branches. Proceedings of the National Academy of Sciences of the United States of America. 117 (24), 13519-13528 (2020).
- Wioland, H., et al. ADF/Cofilin accelerates actin dynamics by severing filaments and promoting their depolymerization at both ends. Current Biology: CB. 27 (13), 1956-1967 (2017).
- Pollard, T. D., Mooseker, M. S. Direct measurement of actin polymerization rate constants by electron microscopy of actin filaments nucleated by isolated microvillus cores. The Journal of Cell Biology. 88 (3), 654-659 (1981).
- Kovar, D. R., Harris, E. S., Mahaffy, R., Higgs, H. N., Pollard, T. D. Control of the assembly of ATP- and ADP-actin by formins and profilin. Cell. 124 (2), 423-435 (2006).
- Jégou, A., Carlier, M. -. F., Romet-Lemonne, G. Formin mDia1 senses and generates mechanical forces on actin filaments. Nature Communications. 4, 1883 (2013).
- Breitsprecher, D., et al. Rocket launcher mechanism of collaborative actin assembly defined by single-molecule imaging. Science. 336 (6085), 1164-1168 (2012).
- Courtemanche, N., Lee, J. Y., Pollard, T. D., Greene, E. C. Tension modulates actin filament polymerization mediated by formin and profilin. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9752-9757 (2013).
- Niedermayer, T., et al. Intermittent depolymerization of actin filaments is caused by photo-induced dimerization of actin protomers. Proceedings of the National Academy of Sciences. 109 (27), 10769-10774 (2012).
- Gateva, G., et al. Tropomyosin isoforms specify functionally distinct actin filament populations in vitro. Current Biology: CB. 27 (5), 705-713 (2017).
- Aratyn, Y. S., Schaus, T. E., Taylor, E. W., Borisy, G. G. Intrinsic dynamic behavior of fascin in filopodia. Molecular Biology of the Cell. 18 (10), 3928-3940 (2007).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. The Journal of Cell Biology. 103, 2747-2754 (1986).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Torsional stress generated by ADF/cofilin on cross-linked actin filaments boosts their severing. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2595-2602 (2019).
- Colombo, J., et al. A functional family of fluorescent nucleotide analogues to investigate actin dynamics and energetics. Nature Communications. 12 (1), 548 (2021).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. The Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Romet-Lemonne, G., Guichard, B., Jégou, A. Using microfluidics single filament assay to study formin control of actin assembly. Methods in Molecular Biology. 1805, 75-92 (2018).
- Gieselmann, R., Kwiatkowski, D. J., Janmey, P. A., Witke, W. Distinct biochemical characteristics of the two human profilin isoforms. European Journal of Biochemistry. 229 (3), 621-628 (1995).
- Lin, D. C., Lin, S. Actin polymerization induced by a motility-related high-affinity cytochalasin binding complex from human erythrocyte membrane. Proceedings of the National Academy of Sciences of the United States of America. 76 (5), 2345-2349 (1979).
- Casella, J. F., Maack, D. J., Lin, S. Purification and initial characterization of a protein from skeletal muscle that caps the barbed ends of actin filaments. The Journal of Biological Chemistry. 261 (23), 10915-10921 (1986).
- Kremneva, E., et al. Cofilin-2 controls actin filament length in muscle sarcomeres. Developmental Cell. 31 (2), 215-226 (2014).
- Le Clainche, C., Carlier, M. -. F. Actin-based motility assay. Current Protocols in Cell Biology. , 1-20 (2004).
- Vignjevic, D., et al. Formation of filopodia-like bundles in vitro from a dendritic network. The Journal of Cell Biology. 160 (6), 951-962 (2003).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. eLife. 5, 13470 (2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Molecular Biology of the Cell. 27 (22), 3563-3573 (2016).
- Suzuki, E. L., et al. Geometrical constraints greatly hinder formin mDia1 activity. Nano Letters. 20 (1), 22-32 (2020).
- Wioland, H., Suzuki, E., Cao, L., Romet-Lemonne, G., Jegou, A. The advantages of microfluidics to study actin biochemistry and biomechanics. Journal of Muscle Research and Cell Motility. 41 (1), 175-188 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved