A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحضير البيسازيريدين المتجاورين لتفاعلات فتح الحلقة الانتقائية
In This Article
Summary
تم تصنيع البيسازيريدين المتجاورة التي تحتوي على أزيريدينات غير نشطة ومنشطة بواسطة أزيريدينات محفزة عضوية غير متماثلة ثم تعرضت لتفاعلات فتح حلقة كيميائية انتقائية في ظل ظروف حمضية أو أساسية. تفتح حلقة الأزيريدين غير المنشطة مع نيوكليوفيلات أقل تفاعلا في ظل الظروف الحمضية ، في حين تفتح حلقة الأزيريدين المنشطة مع نيوكليوفيلات أكثر تفاعلا في ظل الظروف الأساسية.
Abstract
الأزيريدين ، وهي فئة من الجزيئات العضوية التفاعلية التي تحتوي على حلقة من ثلاثة أعضاء ، هي تركيبات مهمة لتخليق مجموعة كبيرة ومتنوعة من المركبات المستهدفة المحتوية على النيتروجين من خلال فتح الحلقة المعاد التحكم فيها للأزيريدين البديلين C. على الرغم من التقدم الهائل في توليف الأزيريدين على مدى العقد الماضي، إلا أن الوصول إلى البيسازيريدين المتجاورة بكفاءة لا يزال صعبا. لذلك ، كنا مهتمين بتوليف البيسازيريدين المتجاورة التي تحمل مجموعة متنوعة إلكترونيا من بدائل N خارج العمود الفقري الأزيريدين الفردي لتفاعلات فتح الحلقة الانتقائية مع النيوكليوفيلات المتنوعة. في هذه الدراسة ، تم تحضير البيسازيريدين المتجاورة الدائرية عن طريق أزيريدين غير متماثل عضوي من chiral (E)-3-(S)-1-(R)-1-phenylethyl)aziridin-2-yl)acrylaldehyde مع N-Ts-O-tosyl أو N-Boc-O-tosyl hydroxylamine كمصدر للنيتروجين في وجود (2 S)-[ثنائي الفينيل (trimethylsilyloxy)methyl] pyrrolidine كمحفز عضوي دائري. كما تظهر هنا أمثلة تمثيلية لتفاعلات فتح الحلقة الانتقائية للبيسازيريدين المتجاورة مع مجموعة متنوعة من النيوكليوفيلات مثل الكبريت والنيتروجين والكربون والأكسجين ، وتطبيق البيسازيريدين المتجاورة على تخليق البيروليدين الدائري متعدد البدائل بواسطة الهدرجة المحفزة ب Pd.
Introduction
التصميم العقلاني للجزيئات العضوية الصغيرة ذات المواقع التفاعلية المتنوعة التي تتحكم بدقة في انتقائية المنتج هو هدف رئيسي في التوليف العضوي الحديث والكيمياء الخضراء1،2،3،4،5،6،7،8. لتحقيق هذا الهدف ، كنا مهتمين بالتوليف المعياري للأزيريدين. تعتبر الأزيريدين ذات أهمية لمعظم الكيميائيين العضويين ، نظرا لإطارها المهم هيكليا9 مع مجموعة متنوعة إلكترونيا من بدائل N التي يمكن أن تؤدي إلى تفاعلات فتح حلقة انتقائية مع العديد من النيوكليوفيلات 10,11,12,13,14,15,16,17,18, 19 ، والأنشطة الدوائية المتنوعة مثل خصائص مضادة للأورام ومضادات الميكروبات ومضادة للبكتيريا. على الرغم من التقدم في كيمياء الأزيريدين ، فإن الأزيريدين غير المنشط والأزيريدين المنشط لهما توليفات مستقلة وتفاعلات فتح الحلقة في الأدبيات20.
لذلك ، كنا نهدف إلى توليف البيسازيريدين المتجاورة التي تضم كلا من الأزيريدين غير المنشط والمنشط. يمكن استخدام هذه البيسازيريدين المتجاورة لترشيد نمط فتح الحلقة الانتقائية الكيميائية بشكل منهجي استنادا إلى الخصائص الإلكترونية التالية للأزيريدين المختلفين وتفاعلهما مع النيوكليوفيلات20،21،22،23،24: أ) الأزيريدين المنشط، حيث تعمل البدائل المسحوبة للإلكترون على تثبيت الشحنة السالبة على النيتروجين بشكل متزامن، وتتفاعل بسهولة مع العديد من النيوكليوفيلات إلى السماح بالمنتجات المفتوحة الحلقة ؛ ب) الأزيريدين غير المنشط، الذي يرتبط فيه النيتروجين ببدائل التبرع بالإلكترونات، خاملة إلى حد كبير تجاه النيوكليوفيلات؛ وبالتالي ، هناك حاجة إلى خطوة ما قبل التنشيط مع منشط مناسب (بشكل رئيسي أحماض Brønsted أو Lewis) لتوفير المنتجات المفتوحة للحلقة في غلات عالية20،21،25،26.
تصف هذه الدراسة التصميم العقلاني للبيسازيريدين المتجاورة كلبنات بناء دائرية عن طريق التحفيز العضوي الخالي من المعادن الانتقالية وتخليق جزيئات متنوعة غنية بالنيتروجين باستخدام أدوات النمذجة التنبؤية لتفاعلات فتح الحلقة من البيسازيريدين. تهدف هذه الدراسة إلى تحفيز تطوير الأساليب العملية لبناء المركبات النشطة بيولوجيا الغنية بالنيتروجين والمنتجات الطبيعية وبلمرة الأزيريدين.
Protocol
وترد تفاصيل جميع المنتجات المركبة (1-5)، بما في ذلك الهيكل، وأطياف الرنين المغناطيسي النووي الكاملة، والنقاء البصري، وبيانات نظام إدارة الموارد البشرية-MALDI، في الملف التكميلي 1.
1. توليف 3-(أزيريدين-2-يل) ألدهيد أكريل (1أ)
- جفف اللهب قارورة مستديرة القاع سعة 50 مل مجهزة بقضيب تحريك وحاجز تحت ظروف التفريغ. قم بتبريده إلى درجة حرارة الغرفة أثناء ملئه بغاز الأرجون.
- أضف التولوين اللامائي (19 مل) و (R)-1-(R)-1-فينيل إيثيل)أزيريدين-2-كربالديهيد (1.00 جم، 5.71 ملليمول) (انظر جدول المواد) إلى القارورة. ثم حرك المحلول لمدة 1 دقيقة.
- أضف (ثلاثي فينيل فوسفورانيليدين) الأسيتالديهيد (2.08 جم ، 6.85 ملليمول) (انظر جدول المواد) إلى المحلول المقلوب.
- سخني خليط التفاعل على حرارة 60 درجة مئوية لمدة 18 ساعة. ثم ، قم بتبريد خليط التفاعل إلى درجة حرارة الغرفة وإزالة المذيبات المتطايرة من خليط التفاعل تحت ضغط منخفض.
- راقب تقدم التفاعل بواسطة TLC باستخدام خلات الإيثيل: الهكسانات (1:6 v/v، Rf = 0.25) كمفسوخ.
- قم بتنقية المنتج الخام بواسطة كروماتوغرافيا فلاش هلام السيليكا باستخدام خلات الإيثيل: الهكسانات (1: 6 v / v) كمادة لعزل المنتج النقي 1a (انظر الملف التكميلي 1) كسائل أصفر.
- قم بتأكيد المنتج بواسطة قياسات الرنين المغناطيسي النووي ومقياس الاستقطاب (انظر الخطوتين 8 و9 للحصول على طرق القياس).
2. توليف بيسازيريدين المتجاورة (2 أ)
- جفف اللهب قارورة مستديرة القاع سعة 50 مل مع قضيب تحريك وحاجز تحت ظروف التفريغ. قم بتبريده إلى درجة حرارة الغرفة أثناء ملئه بغاز الأرجون.
- أضف خلات الإيثيل اللامائية (3 مل) و 1a (الخطوة 1.6 ، 201 ملغ ، 1.0 ملليمول) إلى القارورة ، ثم حرك المحلول لمدة دقيقة واحدة.
- يضاف المحفز (S)-2-(ثنائي الفينيل ((ثلاثي ميثيل سيليل)أوكسي)ميثيل)البيروليدين (B S، انظر جدول المواد) (0.02 مل، 7 مول٪) إلى الخليط ويحرك في درجة حرارة الغرفة لمدة 30 دقيقة.
- أضف 316 ملغ ، 1.10 مليمول من تيرت-بوتيل توسيلوكسيكاربامات (BocNHOTs ، انظر جدول المواد) و 123 ملغ ، 1.50 مليمول من خلات الصوديوم إلى خليط التفاعل وحرك لمدة 24 ساعة.
- راقب تقدم التفاعل بواسطة TLC باستخدام ثنائي إيثيل الأثير: الهكسانات (1:4 v/v، Rf = 0.27) كمفسرة.
- استخراج خليط التفاعل مع خلات الإيثيل (3 × 50 مل) في قمع منفصل.
- جفف الطبقة العضوية المدمجة فوق Na2SO4 اللامائية ، وقم بالتصفية ، وركز في الفجوة.
- قم بتنقية المنتج الخام الناتج عن طريق كروماتوغرافيا فلاش على هلام السيليكا باستخدام ثنائي إيثيل الأثير: الهكسانات (1:4 v/v) كمادة مكافئة لعزل المنتج النقي 2a (انظر الملف التكميلي 1) كسائل أصفر.
- قم بتأكيد المنتج بواسطة قياسات الرنين المغناطيسي النووي ومقياس الاستقطاب (انظر الخطوتين 8 و9).
3. تخليق المركب 3
- جفف اللهب قارورة مستديرة القاع سعة 50 مل مع قضيب تحريك وحاجز تحت ظروف التفريغ. قم بتبريده إلى درجة حرارة الغرفة أثناء ملئه بغاز الأرجون.
- أضف الميثانول اللامائي (11 مل) والألدهيد 2a (الخطوة 2.8 ، 1.00 جم ، 3.16 ملليمول) [أو 2b (1.17 جم ، 3.16 مليمول ، انظر الملف التكميلي 1)] إلى القارورة ، ثم حرك المحلول لمدة دقيقة.
- أضف NaBH4 (95 مجم ، 2.53 ملليمول) إلى المحلول المقلوب.
- حرك خليط التفاعل عند 0 درجة مئوية لمدة 1 ساعة.
- راقب تقدم التفاعل بواسطة TLC باستخدام خلات الإيثيل: الهكسانات (1:4 v/v، Rf = 0.27) كمفسوخ.
- بعد 1 ساعة ، قم بإخماد خليط التفاعل بالماء المقطر واستخلصه بأسيتات الإيثيل (3 × 50 مل) في قمع منفصل.
- جفف الطبقة العضوية المدمجة فوق Na2SO4 اللامائية ، وقم بالتصفية ، وركز في الفجوة.
- قم بتنقية البقايا الخام بواسطة كروماتوغرافيا فلاش هلام السيليكا باستخدام خلات الإيثيل: الهكسانات (1:4 v/v) كمادة لعزل المنتجات النقية 3a [أو 3b] (انظر الملف التكميلي 1) كسائل أصفر.
- قم بتأكيد المنتج بواسطة قياسات الرنين المغناطيسي النووي ومقياس الاستقطاب (انظر الخطوتين 8 و9).
4. تخليق المركب 4
- جفف اللهب قارورة مستديرة القاع سعة 50 مل مع قضيب تحريك وحاجز تحت ظروف التفريغ. قم بتبريده إلى درجة حرارة الغرفة أثناء ملئه بغاز الأرجون.
- أضف ثنائي كلورو الميثان اللامائي (11 مل) والكحول 3a (الخطوة 3.8 ، 1.00 جم ، 3.14 ملليمول) [أو 3b (1.17 جم ، 3.14 ملليمول)] إلى القارورة ، ثم حرك المحلول لمدة دقيقة.
- أضف كلوريد تيرت بوتيل ثنائي ميثيل سيليل (TBSCl ، 520 ملغ ، 3.45 ملليمول) وإيميدازول (427 ملغ ، 6.28 ملليمول) (انظر جدول المواد) إلى المحلول المقلوب.
- حرك خليط التفاعل على درجة حرارة 0 درجة مئوية لمدة 18 ساعة.
- راقب تقدم التفاعل بواسطة TLC باستخدام خلات الإيثيل: الهكسانات (1:4 v/v، Rf = 0.26) كمظهر.
- بعد 18 ساعة ، قم بإخماد خليط التفاعل بالماء منزوع الأيونات واستخراجه بكلوريد الميثيلين (3 × 50 مل) في قمع منفصل.
- جفف الطبقة العضوية المدمجة فوق كبريتات الصوديوم اللامائية ، وقم بالتصفية ، ثم ركز تحت ضغط منخفض.
- قم بتنقية البقايا الخام بواسطة كروماتوغرافيا فلاش هلام السيليكا باستخدام خلات الإيثيل: الهكسانات (1: 4 v / v) كمادة لعزل المنتجات النقية 4a [أو 4b] (انظر الملف التكميلي 1) كسائل أصفر.
- قم بتأكيد المنتج عن طريق قياسات الرنين المغناطيسي النووي ومقياس الاستقطاب.
5. فتح حلقة انتقائية من أزيريدين غير نشطة: توليف 5D
- جفف اللهب قارورة مستديرة القاع سعة 50 مل مع قضيب تحريك وحاجز تحت ظروف التفريغ. قم بتبريده إلى درجة حرارة الغرفة أثناء ملئه بغاز الأرجون.
- أضف 3b (الخطوة 4.2 ، 100 ملغ ، 0.27 ملليمول) وحمض الخليك (0.12 مل ، 2.14 ملليمول) إلى القارورة ، ثم حرك الخليط في درجة حرارة الغرفة لمدة 5 ساعات.
- راقب تقدم التفاعل بواسطة TLC باستخدام خلات الإيثيل: الهكسانات (2: 3 v / v ، Rf = 0.28) كمكافئ.
- بعد 5 ساعات ، قم بإزالة حمض الخليك في الفجوة.
- قم بتنقية البقايا الخام بواسطة كروماتوغرافيا فلاش هلام السيليكا باستخدام خلات الإيثيل: الهكسانات (2: 3 v / v) كمادة لعزل المنتج النقي 5D (انظر الملف التكميلي 1) كسائل أصفر.
- قم بتأكيد المنتج عن طريق قياسات الرنين المغناطيسي النووي ومقياس الاستقطاب.
6. فتح حلقة انتقائية من الأزيريدين المنشطة: توليف 5f
- جفف اللهب قارورة مستديرة القاع سعة 50 مل مع قضيب تحريك وحاجز تحت ظروف التفريغ. قم بتبريده إلى درجة حرارة الغرفة أثناء ملئه بغاز الأرجون.
- أضف الميثانول اللامائي (8 مل) و 4b (الخطوة 4.8 ، 100 ملغ ، 0.21 ملليمول) إلى القارورة ، ثم حرك المحلول لمدة 1 دقيقة.
- أضف NaN3 (39 مجم ، 0.6 ملليمول) و NH4Cl (21 مجم ، 0.41 ملليمول) في H2O (1 mL) إلى المحلول أعلاه.
- حرك خليط التفاعل على درجة حرارة 0 درجة مئوية لمدة 4 ساعات.
- راقب تقدم التفاعل بواسطة TLC باستخدام خلات الإيثيل: الهكسانات (1:4 v/v، Rf = 0.30) كمفسرة.
- بعد 4 ساعات ، قم بإخماد خليط التفاعل باستخدام H2O واستخلصه بأسيتات الإيثيل (3 × 50 مل) في قمع منفصل.
- جفف الطبقة العضوية المدمجة فوق Na2SO4 اللامائية ، وقم بالتصفية ، وركز في الفجوة.
- قم بتنقية البقايا الخام بواسطة كروماتوغرافيا فلاش هلام السيليكا باستخدام خلات الإيثيل: الهكسانات (1:4 v/v) كمادة لعزل المنتج النقي 5f (انظر الملف التكميلي 1) كسائل أصفر.
- قم بتأكيد المنتج عن طريق قياسات الرنين المغناطيسي النووي ومقياس الاستقطاب.
7. الهدرجة المحفزة Pd للأزيريدين المتجاورة: تخليق 5h
- جفف اللهب قارورة مستديرة القاع سعة 50 مل مع قضيب تحريك وحاجز تحت ظروف التفريغ. قم بتبريده إلى درجة حرارة الغرفة أثناء ملئه بغاز الأرجون.
- أضف الميثانول اللامائي (5 مل) ، 2b (الخطوة 3.2 ، 100 ملغ ، 0.27 ملليمول) ، Boc 2O (70 ملغ ، 0.32 ملليمول) ، و 20٪ Pd (OH) 2 / C (37 ملغ) إلى القارورة.
- حرك الخليط تحت الغلاف الجوي H2 (بالون ، 1 جهاز الصراف الآلي) في درجة حرارة الغرفة لمدة 12 ساعة.
- راقب تقدم التفاعل بواسطة TLC باستخدام خلات الإيثيل: الهكسانات (2: 3 v / v ، Rf = 0.29) كمظهر.
- قم بتصفية خليط التفاعل من خلال وسادة سيليت متاحة تجاريا (انظر جدول المواد) واغسلها بالميثانول.
- تبخر في فراغ الترشيح وتنقية البقايا بواسطة كروماتوغرافيا فلاش هلام السيليكا مع خلات الإيثيل: الهكسانات (2: 3 v / v) كعامل لعزل المنتج النقي 5h (انظر الملف التكميلي 1) كسائل عديم اللون.
- قم بتأكيد المنتج عن طريق قياسات الرنين المغناطيسي النووي ومقياس الاستقطاب.
8. تحليل مقياس الاستقطاب
- تحضير كمية مناسبة من العينة (~ 100 ملغ) ليتم قياسها.
- قم بإذابة العينة المحضرة في CHCl3 (c 0.05-1.00).
- انقل محلول العينة إلى غرفة العينة ، مما يضمن عدم وجود فقاعات هواء
[ø = 1.8 مم ، l = 10-1 m]. - قم بتحميل غرفة العينة في أداة مقياس الاستقطاب (انظر جدول المواد) وتحقق من اتجاه الغرفة.
- تعيين 0 كما انقر فوق صفر مسح في قسم "التحكم".
- قم بقياس الدوران المحدد ل CHCl3 للفراغ.
ملاحظة: مصدر الضوء: Na; λ = 589 نانومتر; D.I.T: 5 S; أوقات الدورة: 5 ؛ الفاصل الزمني للدورة: 5 ثوان ؛ درجة الحرارة: 20 درجة مئوية. - قم بقياس الدوران المحدد لمحلول العينة عند درجة حرارة ثابتة.
ملاحظة: مصدر الضوء: Na; λ = 589 نانومتر; D.I.T: 5 S; أوقات الدورة: 5 ؛ الفاصل الزمني للدورة: 5 ثوان ؛ درجة الحرارة: 20 درجة مئوية. - قم بقياس الدوران المحدد لمحلول العينة ثلاث مرات بنفس الطريقة للحصول على متوسط القيمة.
- احسب الدوران المحدد باستخدام المعادلة27 التالية:
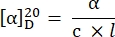
α = الدوران المرصود (الدرجات)، c = التركيز (g/mL)، l = طول المسار (10-1 م).
9. 1H و 13C تحليل الرنين المغناطيسي النووي
- تحضير ما يقرب من 0.6-1.0 مل من مذيب الرنين المغناطيسي النووي (CDCl3).
- قم بإذابة ~ 50 ملغ من العينة في المذيب بتركيز 0.02 M ل 1H NMR و 0.05 M لقياسات NMR 13C.
- انقل محلول العينة إلى أنبوب الرنين المغناطيسي النووي باستخدام ماصة باستور.
- قم بتحميل الأنبوب في أداة الرنين المغناطيسي النووي (انظر جدول المواد).
ملاحظة: أجريت قياسات الرنين المغناطيسي النووي باستخدام مطياف 400 ميغاهرتز أو 500 ميغاهرتز. رقم الدوران: 16 (1H NMR) ، 256 أو 512 (13C NMR) ؛ وقت القياس: 10 دقائق (1H NMR) ، 20 أو 30 دقيقة (13C NMR)]. - تسجيل أطياف الرنين المغناطيسي النووي وتحليل البيانات.
ملاحظة: يرجى الرجوع إلى التحول الكيميائي للطيف إلى إشارة CDCl3 [δ (طيفالرنين المغناطيسي النووي H 1) = 7.26 جزء في المليون؛ δ (طيف الرنين المغناطيسي النووي 13درجة مئوية) = 77.0 جزء في المليون)].
النتائج
للتحقيق في إمكانية تحضير بيسازيريدين متجاورة، تم تصنيع (E)-3-(S)-1-(R)-1-phenylethyl)aziridin-2-yl)acrylaldehyde (1a) لأول مرة كركيزة نموذجية وفقا للإجراء المذكور في الخطوة 1 (الشكل 1)28.
Discussion
وقد لوحظ أحيانا تكوين خليط لا ينفصل من الدياستيريومات أثناء فترة أزيريدين التحفيز العضوي للكيارال 3-[1-(1-فينيل إيثيل)أزيريدين-2-يل)]أكريلالدهيد، عندما تم استخدام N-Boc-O-tosyl أو N-Ts-O-tosyl hydroxylamine كمصدر للنيتروجين. علاوة على ذلك ، انخفض محصول منتج بيسازيريدين المجاور عندما زادت ك...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا البحث من خلال منحة المعهد الكوري للعلوم الأساسية (المركز الوطني لمرافق ومعدات البحوث) الممولة من وزارة التعليم (2022R1A6C101A751). تم دعم هذا العمل أيضا من خلال منح المؤسسة الوطنية للبحوث في كوريا (NRF) (2020R1A2C1007102 و 2021R1A5A6002803).
Materials
| Name | Company | Catalog Number | Comments |
| (R)-(+)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677191 | reagent |
| (R)-1-((R)-1-phenylethyl)aziridine-2-carbaldehyde | Imagene Co.,Ltd. | reagent | |
| (S)-(–)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677183 | reagent |
| (S)-2-(diphenyl((trim ethylsilyl)oxy)methyl)pyrrolidine | Sigma-Aldrich | 677183 | reagent |
| (Triphenylphosphoranylidene) acetaldehyde | Sigma-Aldrich | 280933 | reagent |
| 1,2-Dichloroethane | Sigma-Aldrich | 284505 | solvent |
| AB Sciex 4800 Plus MALDI TOFTM (2,5-dihydroxybenzoic acid (DHB) matrix | Sciex | High resolution mass spectra | |
| Acetic acid | Sigma-Aldrich | A6283 | reagent |
| Ammonium chloride | Sigma-Aldrich | 254134 | reagent |
| aniline | Sigma-Aldrich | 132934 | reagent |
| Autopol III digital polarimeter | Rudolph Research Analytical | polarimeter | |
| AVANCE III HD (400 MHz) spectrometer | Bruker | NMR spectrometer | |
| Bruker Ascend 500 (500 MHz) | Bruker | NMR spectrometer | |
| Celite 535 | Sigma-Aldrich | 22138 | For Celite pad |
| Dichloromethane | Sigma-Aldrich | 270997 | solvent |
| Di-tert-butyl dicarbonate | Sigma-Aldrich | 361941 | reagent |
| Ethyl Acetate | Sigma-Aldrich | 270989 | solvent |
| Ethyl nitroacetate | Sigma-Aldrich | 192333 | reagent |
| Imidazole | Sigma-Aldrich | I2399 | reagent |
| INOVA 400WB (400 MHz) | Varian | NMR spectrometer | |
| JMS-700 | JEOL | High resolution mass spectra | |
| Methanol | Sigma-Aldrich | 322415 | solvent |
| N-Boc-O-tosylhydroxylamine | Sigma-Aldrich | 775037 | reagent |
| P-2000 | JASCO | polarimeter | |
| Palladium hydroxide on carbon | Sigma-Aldrich | 212911 | reagent |
| Phenyl-1H-tetrazole-5-thiol | TCI | P0640 | reagent |
| Silica gel | Sigma-Aldrich | 227196 | For flash clromatography |
| Silica gel on TLC plates | Merck | 60768 | TLC plate |
| Sodium acetate | Sigma-Aldrich | S8750 | reagent |
| Sodium azide | Sigma-Aldrich | S2002 | reagent |
| Sodium borohydride | Sigma-Aldrich | 452882 | reagent |
| Sodium carbonate | Sigma-Aldrich | S2127 | reagent |
| tert-Butyldimethylsilyl chloride | Sigma-Aldrich | 190500 | reagent |
| Tetrahydrofuran | Sigma-Aldrich | 401757 | solvent |
| Toluene | Sigma-Aldrich | 244511 | solvent |
| Zinc bromide | Sigma-Aldrich | 230022 | reagent |
| Zinc chloride | Sigma-Aldrich | 429430 | reagent |
References
- Anastas, P. T., Warner, J. C. Principles of green chemistry. Green Chemistry: Theory and Practice. 29, (1998).
- Sheldon, R. A., Arends, I. W. C. E., Hanefeld, U. . Green Chemistry and Catalysis. , (2007).
- Trost, B. M. The atom economy-a search for synthetic efficiency. Science. 254 (5037), 1471-1477 (1991).
- Sheldon, R. A. The E factor: fifteen years on. Green Chemistry. 9 (12), 1273-1283 (2007).
- Li, C. J., Trost, B. M. Green chemistry for chemical synthesis. Proceedings of the National Academy of Sciences. 105 (36), 13197-13202 (2008).
- Sheldon, R. A. Fundamentals of green chemistry: efficiency in reaction design. Chemical Society Reviews. 41 (4), 1437-1451 (2012).
- Marion, P., et al. Sustainable chemistry: how to produce better and more from less. Green Chemistry. 19 (21), 4973-4989 (2017).
- Sheldon, R. A. The E factor 25 years on: the rise of green chemistry and sustainability. Green Chemistry. 19 (1), 18-43 (2017).
- Dembitsky, V. M., Terent'ev, A. O., Levitsky, D. O. Aziridine alkaloids: origin, chemistry and activity. Natural Products. , 977-1006 (2013).
- Ham, G. E. Activated aziridines. I. Reaction of anilines with O-ethyl-N,N-ethyleneurethane. mechanism and Hammett ρ-constant. Journal of Organic Chemistry. 29 (10), 3052-3055 (1964).
- Tanner, D. Chiral aziridine-their synthesis and use in stereoselective transformations. Angewandte Chemie International Edition. 33 (6), 599-619 (1994).
- Atkinson, R. S. 3-Acetoxyaminoquinazolinones (QNHOAc) as aziridinating agents: ring-opening of N-(Q)-substituted aziridines. Tetrahedron. 55 (6), 1519-1559 (1999).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Lu, P. Recent developments in regioselective ring opening of aziridines. Tetrahedron. 14 (66), 2549-2560 (2010).
- Ohno, H. Synthesis and applications of vinylaziridines and ethynylaziridines. Chemical Reviews. 114 (16), 7784-7814 (2014).
- Callebaut, G., Meiresonne, T., De Kimpe, N., Mangelinckx, S. Synthesis and reactivity of 2-(carboxymethyl) aziridine derivatives. Chemical Reviews. 114 (16), 7954-8015 (2014).
- Ghosal, N. C., et al. Organocatalysis by an aprotic imidazolium zwitterion: Regioselective ring-opening of aziridines and applicable to gram scale synthesis. Green Chemistry. 18 (2), 565-574 (2016).
- Rai, V. K., Rai, P. K., Bajaj, S., Kumar, A. An unprecedented synthesis of γ-lactams via mercaptoacetylation of aziridines in water. Green Chemistry. 13 (5), 1217-1223 (2011).
- Srivastava, V. P., Yadav, L. D. S. The first example of ring expansion of N-tosylaziridines to 2-aroyl-N-tosylazetidines with nitrogen ylides in an aqueous medium. Green Chemistry. 12 (8), 1460-1465 (2010).
- Stanković, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Ha, H. J., Jung, J. H., Lee, W. K. Application of regio-and stereoselective functional group transformations of chiral aziridine-2-carboxylates. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- D'hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-membered Heterocycles by Ring Expansion: Aza-, Oxa- and Thiaheterocyclic Small-Ring Systems. 1st ed. , (2016).
- Macha, L., Ha, H. -. J. Total synthesis and absolute stereochemical assignment of microgrewiapine A and its stereoisomers. Journal of Organic Chemistry. 84 (1), 94-103 (2019).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Głowacka, I. E., Trocha, A., Wróblewski, A. E., Piotrowska, D. G. N-(1-Phenylethyl) aziridine-2-carboxylate esters in the synthesis of biologically relevant compounds. Beilstein Journal of Organic Chemistry. 15 (1), 1722-1757 (2019).
- JoVE. Organic Chemistry II. Polarimeter. JoVE Science Education Database. , (2022).
- Mao, H., et al. Preparation of chiral contiguous epoxyaziridines and their regioselective ring-opening for drug syntheses. Chemistry-A European Journal. 24 (10), 2370-2374 (2018).
- Vesely, J., Ibrahem, I., Zhao, G. L., Rios, R., Córdova, A. Organocatalytic enantioselective aziridination of α,β-unsaturated aldehydes. Angewandte Chemie International Edition. 11 (46), 778-781 (2007).
- Arai, H., et al. Enantioselective aziridination reaction of α,β-unsaturated aldehydes using an organocatalyst and tert-butyl N-arenesulfonyloxycarbamates. Tetrahedron Letters. 50 (26), 3329-3332 (2009).
- Desmarchelier, A., et al. Organocatalyzed aziridination of α-branched enals: enantioselective synthesis of aziridines with a quaternary stereocenter. European Journal of Organic Chemistry. 20 (2011), 4046-4052 (2011).
- Jiang, H., Halskov, K. S., Johansen, T. K., Jørgensen, K. A. Deracemization of axially chiral α,β-unsaturated aldehydes through an amino-catalyzed symmetry-making-symmetry-breaking cascade. Chemistry-A European Journal. 17 (14), 3842-3846 (2011).
- Deiana, L., et al. Catalytic asymmetric aziridination of α,β-unsaturated aldehydes. Chemistry-A European Journal. 17 (28), 7904-7917 (2011).
- Molnár, I. G., Tanzer, E. M., Daniliuc, C., Gilmour, R. Enantioselective aziridination of cyclic enals facilitated by the fluorine-iminium Ion gauche effect. Chemistry-A European Journal. 20 (3), 794-800 (2014).
- Nemoto, T., et al. Enantioselective synthesis of (R)-Sumanirole using organocatalytic asymmetric aziridination of an α,β-unsaturated aldehyde. Tetrahedron: Asymmetry. 25 (15), 1133-1137 (2014).
- Sim, T. B., et al. A novel synthesis of 5-functionalized oxazolidin-2-ones from enantiomerically pure 2-substituted N-[(R)-(+)-α-methylbenzyl] aziridines. Journal of Organic Chemistry. 68 (1), 104-108 (2003).
- Silva, M. A., Goodman, J. M. Aziridinium ring opening: a simple ionic reaction pathway with sequential transition states. Tetrahedron Letters. 46 (12), 2067-2069 (2005).
- Yun, S. Y., et al. Nucleophile-dependent regioselective ring opening of 2-substituted N,N-dibenzylaziridinium ions: bromide versus hydride. Chemical Communications. (18), 2508-2510 (2009).
- Dolfen, J., et al. Bicyclic aziridinium ions in azaheterocyclic chemistry-preparation and synthetic application of 1-azoniabicyclo [n. 1.0] alkanes. Advanced Synthesis & Catalysis. 358 (22), 3485-3511 (2016).
- D'hooghe, M., et al. Systematic study of halide-induced ring opening of 2-substituted aziridinium salts and theoretical rationalization of the reaction pathways. European Journal of Organic Chemistry. 2010 (25), 4920-4931 (2010).
- Boydas, E. B., et al. Theoretical insight into the regioselective ring-expansions of bicyclic aziridinium ions. Organic & Biomolecular Chemistry. 16 (5), 796-806 (2018).
- Lee, B. K., et al. An efficient synthesis of chiral terminal 1, 2-diamines using an enantiomerically pure [1-(1′ R)-methylbenzyl] aziridine-2-yl] methanol. Tetrahedron. 62 (35), 8393-8397 (2006).
- Ha, H. J., et al. Addition of 1-Boc-2-tert-butyldimethylsilyloxypyrrole to N-methyleneamine equivalents: synthesis of 1-Boc-5-aminomehtyl-2,5-dihydropyrrole-2-ones and 1-Boc-2-oxo-1,7,9-triazaspiro[4,5]-dec-3-ene. Heterocycles. 50 (1), 203-214 (1999).
- Laughlin, R. G. The basicity of aliphatic sulfonamides. Journal of the American Chemical Society. 89 (17), 4268-4271 (1967).
- Moreira, J. A., Rosa da Costa, A. M., García-Río, L., Pessêgo, M. Equilibrium constants and protonation site for N-methylbenzenesulfonamides. Beilstein Journal of Organic Chemistry. 7 (1), 1732-1738 (2011).
- Song, K., et al. Highly active ruthenium metathesis catalysts enabling ring-opening metathesis polymerization of cyclopentadiene at low temperatures. Nature Communications. 10, 3860 (2019).
- Fukuta, Y., et al. De novo synthesis of Tamiflu via a catalytic asymmetric ring-opening of meso-aziridines with TMSN3. Journal of the American Chemical Society. 128 (19), 6312-6313 (2006).
- Jiang, H., et al. Intramolecular radical aziridination of allylic sulfamoyl azides by cobalt (II)-based metalloradical catalysis: effective construction of strained heterobicyclic structures. Angewandte Chemie International Edition. 55 (38), 11604-11608 (2016).
- Righi, G., Bovicelli, P., Barontini, M., Tirotta, I. Dimethyl carbonate in the regio-and stereocontrolled opening of three-membered heterocyclic rings. Green Chemistry. 14 (2), 495-502 (2012).
- Righi, P., et al. Solution- and solid-phase synthesis of 4-hydroxy-4,5-dihydroisoxazole derivatives from enantiomerically pure N-tosyl-2,3-aziridine alcohols. Organic Letters. 4 (4), 497-500 (2002).
- Yadav, N. N., Choi, J., Ha, H. -. J. One-pot multiple reactions: asymmetric synthesis of 2, 6-cis-disubstituted piperidine alkaloids from chiral aziridine. Organic & Biomolecular Chemistry. 14 (27), 6426-6434 (2016).
- Rhee, H. J., et al. Preparation and utilization of contiguous bisaziridines as chiral building blocks. Advanced Synthesis & Catalysis. 363 (13), 3250-3257 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved