JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
위치 선택적 개환 반응을위한 연속 비사 지리딘의 제조
요약
비활성화 및 활성화된 아지리딘을 함유하는 인접한 비사지리딘을 비대칭 유기 분석적 아지리디네이션에 의해 합성한 후, 산성 또는 염기성 조건 하에서 화학선택성 개환 반응을 실시하였다. 활성화되지 않은 아지리딘 고리는 산성 조건에서 반응성이 적은 친핵체로 열리는 반면, 활성화된 아지리딘 고리는 염기성 조건에서 더 반응성이 높은 친핵체로 열립니다.
초록
3원 고리를 포함하는 반응성 유기 분자의 한 종류인 아지리딘은 C-치환된 아지리딘의 위치 제어 개환을 통해 다양한 기능화된 질소 함유 표적 화합물의 합성을 위한 중요한 합성입니다. 지난 10년 동안 아지리딘 합성의 엄청난 발전에도 불구하고 인접한 비사지리딘에 효율적으로 접근하는 것은 여전히 어렵습니다. 따라서 우리는 다양한 친핵체와의 위치선택적 개환 반응을 위해 단일 아지리딘 백본을 넘어 전자적으로 다양한 N-치환기 세트를 갖는 인접한 비사지리딘을 합성하는 데 관심이 있었습니다. 이 연구에서, 키랄 인접 비사지리딘은 키랄 유기 촉매로서 (2S)-[디페닐(트리메틸실릴옥시)메틸]피롤리딘의 존재하에 질소원으로서 N-Ts-O-토실 또는 N-Boc-O-토실 하이드록실아민을 질소원으로 하는 키랄 (E)-3-((S)-1-((R)-1-페닐에틸)아지리딘-2-일)아크릴알데히드의 유기 분석 비대칭 아지리딘에 의해 제조되었습니다. 또한 황, 질소, 탄소 및 산소와 같은 다양한 친핵체와 인접한 비사지리딘의 위치선택적 개환 반응의 대표적인 예와 Pd-촉매 수소화에 의한 다중 치환 키랄 피롤리딘의 합성에 인접한 비사지리딘의 적용이 여기에 입증되었습니다.
서문
생성물 선택성을 정밀하게 제어하는 다양한 반응성 부위를 가진 작은 유기 분자의 합리적인 설계는 현대 유기 합성 및 녹색 화학 1,2,3,4,5,6,7,8의 핵심 목표입니다. 이 목표를 달성하기 위해 우리는 아지리딘의 모듈식 합성에 관심이 있었습니다. Aziridines는 구조적으로 중요한 프레임 워크9로 인해 여러 친 핵체10,11,12,13,14,15,16,17,18, (19) 항종양, 항균 및 항균성과 같은 다양한 약리학적 활성을 갖는다. 아지리딘 화학의 진보에도 불구하고, 비-활성화된 아지리딘 및 활성화된 아지리딘은 문헌20에서 독립적인 합성 및 개환 반응을 갖는다.
따라서 우리는 활성화되지 않은 아지리딘과 활성화된 아지리딘을 모두 포함하는 인접한 비사지리딘을 합성하는 것을 목표로 했습니다. 이러한 인접한 비사지리딘은 2개의 상이한 아지리딘의 다음의 전자적 특성 및 친핵체20,21,22,23,24에 대한 이들의 반응성에 기초하여 화학선택성 개환 패턴을 체계적으로 합리화하는데 사용될 수 있다: a) 전자-인출 치환체가 질소 상의 음전하를 공액적으로 안정화시키는 활성화된 아지리딘은 여러 친핵체와 쉽게 반응하여 고리가 열린 제품을 허용하십시오. b) 질소가 전자 공여 치환체에 결합되는 비활성화된 아지리딘은 친핵체에 대해 상당히 불활성이고; 따라서, 고리 개봉 생성물을 높은 수율20,21,25,26으로 제공하기 위해 적합한 활성화제(주로 브뢴스테드 또는 루이스류)를 사용한 사전 활성화 단계가 필요하다.
본 연구는 전이 금속이없는 유기 촉매 반응을 통한 키랄 빌딩 블록으로서의 인접한 비사 지리 딘의 합리적인 설계와 비사 지리 딘의 개환 반응을위한 예측 모델링 도구를 활용하는 다양한 질소가 풍부한 분자의 합성을 설명합니다. 이 연구는 질소가 풍부한 생리 활성 화합물 및 천연물의 구성과 아지리딘의 중합을 위한 실용적인 방법의 발전을 촉진하는 것을 목표로 합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
구조, 전체 NMR 스펙트럼, 광학 순도 및 HRMS-MALDI 데이터를 포함한 모든 합성 생성물(1-5)의 세부 정보는 보충 파일 1에 제공됩니다.
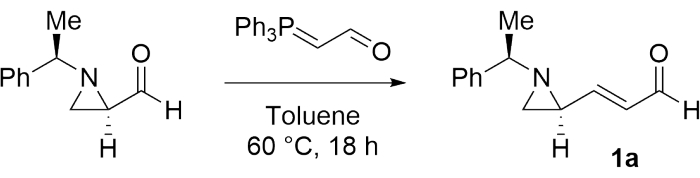
1. 3- (아지리딘 -2- 일) 아크릴 알데히드 (1a)의 합성
- 진공 조건 하에서 교반기 바와 격막이 장착된 50mL 둥근 바닥 플라스크를 화염 건조시킨다. 아르곤 가스로 채우면서 실온으로 식히십시오.
- 무수 톨루엔 (19 mL)과 (R) -1- ((R) -1- 페닐 에틸) 아지리딘 -2- 카르 브알데히드 (1.00 g, 5.71 mmol) (재료 표 참조)를 플라스크에 첨가한다. 그런 다음 용액을 1분 동안 저어줍니다.
- 교반된 용액에 (트리페닐포스포르닐리덴)아세트알데히드(2.08g, 6.85mmol)( 재료 표 참조)를 첨가합니다.
- 반응 혼합물을 60°C에서 18시간 동안 가열한다. 이어서, 반응 혼합물을 실온으로 냉각하고, 감압 하에서 반응 혼합물로부터 휘발성 용매를 제거한다.
- 용리액으로 에틸 아세테이트:헥산(1:6 v/v,Rf =0.25)을 사용하여 TLC에 의한 반응 진행을 모니터링합니다.
- 용리액으로 에틸 아세테이트:헥산(1:6 v/v)을 사용하는 실리카겔 플래시 크로마토그래피로 조 생성물을 정제하여 순수한 생성물 1a ( 보충 파일 1 참조)를 노란색 액체로 분리합니다.
- NMR 및 편광계 측정으로 제품을 확인합니다(측정 방법은 8단계 및 9단계 참조).
2. 인접한 비사지리딘(2a)의 합성
- 진공 조건에서 교반기 막대와 격막을 사용하여 50mL 둥근 바닥 플라스크를 화염 건조시킵니다. 아르곤 가스로 채우면서 실온으로 식히십시오.
- 플라스크에 무수 에틸 아세테이트(3 mL) 및 1a (단계 1.6, 201 mg, 1.0 mmol)를 첨가한 다음, 용액을 1분 동안 교반한다.
- 촉매 (S) -2- (디 페닐 ((트리메틸 실릴) 옥시) 메틸) 피롤리 딘 (BS, 재료 표 참조) (0.02 mL, 7 mol %)을 혼합물에 첨가하고 실온에서 30 분 동안 저어줍니다.
- 316mg, 1.10mmol의 터트-부틸 토실옥시카르바메이트(BocNHOTs, 재료 표 참조) 및 123mg, 1.50mmol의 아세트산나트륨을 반응 혼합물에 첨가하고 24시간 동안 교반합니다.
- 디에틸 에테르:헥산(1:4 v/v,Rf =0.27)을 용리액으로 사용하여 TLC에 의한 반응 진행을 모니터링합니다.
- 반응 혼합물을 분별 깔때기에서 에틸 아세테이트(3 x 50 mL)로 추출한다.
- 합한 유기층을 무수Na2SO4상에서 건조시키고, 여과하고, 진공하에 농축시킨다.
- 생성된 미정제 생성물을 디에틸 에테르:헥산(1:4 v/v)을 용리액으로 사용하여 실리카겔에서 플래시 크로마토그래피로 정제하여 순수한 생성물 2a ( 보충 파일 1 참조)를 노란색 액체로 분리합니다.
- NMR 및 편광계 측정으로 제품을 확인합니다(8단계 및 9단계 참조).
3. 화합물 3의 합성
- 진공 조건에서 교반기 막대와 격막을 사용하여 50mL 둥근 바닥 플라스크를 화염 건조시킵니다. 아르곤 가스로 채우면서 실온으로 식히십시오.
- 무수 메탄올(11 mL) 및 알데히드 2a (단계 2.8, 1.00 g, 3.16 mmol)[또는 2b (1.17 g, 3.16 mmol, 보충 파일 1) 참조]를 플라스크에 첨가하고, 이어서 용액을 1분 동안 교반한다.
- 교반된 용액에NaBH4 (95 mg, 2.53 mmol)를 첨가한다.
- 반응 혼합물을 0°C에서 1시간 동안 교반한다.
- 용리액으로 에틸 아세테이트:헥산(1:4 v/v,Rf =0.27)을 사용하여 TLC에 의한 반응 진행을 모니터링합니다.
- 1시간 후, 반응 혼합물을 증류수로 켄칭하고, 분별 깔때기에서 에틸 아세테이트(3 x 50 mL)로 추출한다.
- 합한 유기층을 무수Na2SO4상에서 건조시키고, 여과하고, 진공하에 농축시킨다.
- 원유 잔류물을 용리액으로 에틸 아세테이트:헥산(1:4 v/v)을 사용하여 실리카겔 플래시 크로마토그래피로 정제하여 순수한 생성물 3a [또는 3b]( 보충 파일 1 참조)를 노란색 액체로 분리합니다.
- NMR 및 편광계 측정으로 제품을 확인합니다(8단계 및 9단계 참조).
4. 화합물 4의 합성
- 진공 조건에서 교반기 막대와 격막을 사용하여 50mL 둥근 바닥 플라스크를 화염 건조시킵니다. 아르곤 가스로 채우면서 실온으로 식히십시오.
- 플라스크에 무수 디클로로메탄(11 mL) 및 알코올 3a (단계 3.8, 1.00 g, 3.14 mmol)[또는 3b (1.17 g, 3.14 mmol)]를 첨가하고, 이어서 용액을 1분 동안 교반한다.
- 교반된 용액에 터셔리-부틸디메틸실릴 클로라이드(TBSCl, 520mg, 3.45mmol) 및 이미다졸(427mg, 6.28mmol)( 재료 표 참조)을 첨가합니다.
- 반응 혼합물을 0°C에서 18시간 동안 교반한다.
- 용리액으로 에틸 아세테이트:헥산(1:4 v/v,Rf =0.26)을 사용하여 TLC에 의한 반응 진행을 모니터링합니다.
- 18시간 후, 반응 혼합물을 탈이온수로 켄칭하고, 분별 깔때기에서 메틸렌 클로라이드(3 x 50 mL)로 추출한다.
- 합한 유기층을 무수 황산나트륨 상에서 건조시키고, 여과한 다음, 감압 하에서 농축한다.
- 용리액으로 에틸 아세테이트:헥산(1:4 v/v)을 사용하는 실리카겔 플래시 크로마토그래피로 미정제하여 순수한 생성물 4a [또는 4b]( 보충 파일 1 참조)를 노란색 액체로 분리합니다.
- NMR 및 편광계 측정으로 제품을 확인하십시오.
5. 활성화되지 않은 아지리딘의 선택적 개환: 5d의 합성
- 진공 조건에서 교반기 막대와 격막을 사용하여 50mL 둥근 바닥 플라스크를 화염 건조시킵니다. 아르곤 가스로 채우면서 실온으로 식히십시오.
- 플라스크에 3b (단계 4.2, 100 mg, 0.27 mmol) 및 아세트산(0.12 mL, 2.14 mmol)을 첨가하고, 혼합물을 실온에서 5시간 동안 교반한다.
- 용리액으로 에틸 아세테이트:헥산(2:3 v/v,Rf =0.28)을 사용하여 TLC에 의한 반응 진행을 모니터링합니다.
- 5 시간 후, 진공에서 아세트산을 제거한다.
- 용리액으로 에틸 아세테이트:헥산(2:3 v/v)을 사용하는 실리카겔 플래시 크로마토그래피로 미정제하여 순수한 생성물 5d ( 보충 파일 1 참조)를 노란색 액체로 분리합니다.
- NMR 및 편광계 측정으로 제품을 확인하십시오.
6. 활성화 된 아지리딘의 선택적 개환 : 5f의 합성
- 진공 조건에서 교반기 막대와 격막을 사용하여 50mL 둥근 바닥 플라스크를 화염 건조시킵니다. 아르곤 가스로 채우면서 실온으로 식히십시오.
- 플라스크에 무수 메탄올(8 mL) 및 4b (단계 4.8, 100 mg, 0.21 mmol)를 첨가하고, 이어서 용액을 1분 동안 교반한다.
- 상기 용액에H2O(1 mL) 중NaN3 (39 mg, 0.6 mmol) 및NH4Cl(21 mg, 0.41 mmol)을 첨가한다.
- 반응 혼합물을 0°C에서 4시간 동안 교반한다.
- 용리액으로 에틸 아세테이트:헥산(1:4 v/v,Rf =0.30)을 사용하여 TLC에 의한 반응 진행을 모니터링합니다.
- 4시간 후, 반응 혼합물을H2O로 켄칭하고, 분별 깔때기에서 에틸 아세테이트(3 x 50 mL)로 추출한다.
- 합한 유기층을 무수Na2SO4상에서 건조시키고, 여과하고, 진공하에 농축시킨다.
- 용리액으로 에틸 아세테이트:헥산(1:4 v/v)을 사용하는 실리카겔 플래시 크로마토그래피로 미정제하여 순수한 생성물 5f ( 보충 파일 1 참조)를 노란색 액체로 분리합니다.
- NMR 및 편광계 측정으로 제품을 확인하십시오.
7. 인접한 아지리딘의 Pd- 촉매 수소화 : 5h의 합성
- 진공 조건에서 교반기 막대와 격막을 사용하여 50mL 둥근 바닥 플라스크를 화염 건조시킵니다. 아르곤 가스로 채우면서 실온으로 식히십시오.
- 플라스크에 무수 메탄올 (5 mL), 2b (단계 3.2, 100 mg, 0.27 mmol), Boc 2 O (70 mg, 0.32 mmol) 및 20 % Pd (OH) 2 / C (37 mg)를 첨가한다.
- 혼합물을 실온에서 H2 분위기(풍선, 1기압)하에서12 시간 동안 교반한다.
- 용리액으로 에틸 아세테이트:헥산(2:3 v/v,Rf =0.29)을 사용하여 TLC에 의한 반응 진행을 모니터링합니다.
- 반응 혼합물을 시판되는 셀라이트 패드( 재료 표 참조)를 통해 여과하고 메탄올로 세척합니다.
- 여과액을 진공 상태에서 증발시키고 용리액으로 에틸 아세테이트:헥산(2:3 v/v)을 사용한 실리카겔 플래시 크로마토그래피로 잔류물을 정제하여 순수한 생성물 5시간 ( 보충 파일 1 참조)을 무색 액체로 분리합니다.
- NMR 및 편광계 측정으로 제품을 확인하십시오.
8. 편광계 분석
- 측정할 적절한 양의 샘플(~100mg)을 준비합니다.
- 준비된 샘플을CHCl3 (c 0.05-1.00)에 용해시킨다.
- 시료 용액을 시료 챔버로 옮겨 기포가 없는지 확인합니다.
[ø = 1.8 mm, l = 10-1 m]. - 샘플 챔버를 편광계 기기( 재료 표 참조)에 로드하고 챔버의 방향을 확인하십시오.
- 0을 '컨트롤'섹션에서 0을 클릭하여 지우기로 설정합니다.
- 블랭크에 대한 CHCl3의 비회전을 측정한다.
참고: 광원: Na; λ = 589 nm; D.I.T: 5초; 주기 시간: 5; 주기 간격: 5초; 온도: 20 °C. - 일정한 온도에서 샘플 용액의 특정 회전을 측정합니다.
참고: 광원: Na; λ = 589 nm; D.I.T: 5초; 주기 시간: 5; 주기 간격: 5초; 온도: 20 °C. - 동일한 방법으로 시료액의 비회전을 3회 측정하여 평균값을 구한다.
- 다음 방정식27을 사용하여 특정 회전을 계산합니다.
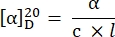
α = 관찰 된 회전 (도), c = 농도 (g / mL), l = 경로 길이 (10-1m ).
9. 1H 및 13CNMR 분석
- 약 0.6-1.0 mL의 NMR 용매(CDCl3)를 준비한다.
- 50 H NMR의 경우 0.02 M, 1C NMR 측정의 경우 0.05 M의 농도로 ~ 13mg의 샘플을 용매에 용해시킵니다.
- 파스퇴르 피펫을 사용하여 샘플 용액을 NMR 튜브로 옮깁니다.
- 튜브를 NMR 기기에 로드합니다( 재료 표 참조).
참고: NMR 측정은 400MHz 또는 500MHz 분광기를 사용하여 수행되었습니다. 스핀수: 16 (1H NMR), 256 또는 512 (13CNMR); 측정 시간 : 10 분 (1H NMR), 20 또는 30 분 (13C NMR)]. - NMR 스펙트럼을 기록하고 데이터를 분석합니다.
참고 : CDCl3 신호에 대한 스펙트럼의 화학적 이동을 참조하십시오 [δ (1H NMR 스펙트럼) = 7.26 ppm; δ (13C NMR 스펙트럼) = 77.0 ppm)].
Access restricted. Please log in or start a trial to view this content.
결과
인접한 비사지리딘을 제조하는 달성 가능성을 조사하기 위해, (E)-3-((S)-1-((R)-1-페닐에틸)아지리딘-2-일)아크릴알데히드 (1a)를 먼저 단계 1(도 1)28에 언급된 절차에 따라 모델 기질로서 합성하였다.
Access restricted. Please log in or start a trial to view this content.
토론
N-Boc-O- 토실 또는 N-Ts-O- 토실 하이드 록실 아민이 질소원으로 사용되었을 때 키랄 3- [1- (1- 페닐 에틸) 아지리딘 -2- 일)] 아크릴 알데히드의 유기 분석 아지 리딘 화 과정에서 부분 입체 이성질체의 분리 할 수없는 혼합물의 형성이 때때로 관찰되었다. 또한, 촉매로서의 디아릴 실릴 에테르 프롤리놀의 양이 7 몰%에서 20 몰%47,48,49로 증가하였을 때 인접한 비사지리딘 생성물...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이번 연구는 교육부(2022R1A6C101A751)가 지원하는 한국기초과학원(국가연구시설시설센터) 지원으로 진행됐다. 이 연구는 한국연구재단(NRF)의 지원금(2020R1A2C1007102 및 2021R1A5A6002803)의 지원도 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| (R)-(+)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677191 | reagent |
| (R)-1-((R)-1-phenylethyl)aziridine-2-carbaldehyde | Imagene Co.,Ltd. | reagent | |
| (S)-(–)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677183 | reagent |
| (S)-2-(diphenyl((trim ethylsilyl)oxy)methyl)pyrrolidine | Sigma-Aldrich | 677183 | reagent |
| (Triphenylphosphoranylidene) acetaldehyde | Sigma-Aldrich | 280933 | reagent |
| 1,2-Dichloroethane | Sigma-Aldrich | 284505 | solvent |
| AB Sciex 4800 Plus MALDI TOFTM (2,5-dihydroxybenzoic acid (DHB) matrix | Sciex | High resolution mass spectra | |
| Acetic acid | Sigma-Aldrich | A6283 | reagent |
| Ammonium chloride | Sigma-Aldrich | 254134 | reagent |
| aniline | Sigma-Aldrich | 132934 | reagent |
| Autopol III digital polarimeter | Rudolph Research Analytical | polarimeter | |
| AVANCE III HD (400 MHz) spectrometer | Bruker | NMR spectrometer | |
| Bruker Ascend 500 (500 MHz) | Bruker | NMR spectrometer | |
| Celite 535 | Sigma-Aldrich | 22138 | For Celite pad |
| Dichloromethane | Sigma-Aldrich | 270997 | solvent |
| Di-tert-butyl dicarbonate | Sigma-Aldrich | 361941 | reagent |
| Ethyl Acetate | Sigma-Aldrich | 270989 | solvent |
| Ethyl nitroacetate | Sigma-Aldrich | 192333 | reagent |
| Imidazole | Sigma-Aldrich | I2399 | reagent |
| INOVA 400WB (400 MHz) | Varian | NMR spectrometer | |
| JMS-700 | JEOL | High resolution mass spectra | |
| Methanol | Sigma-Aldrich | 322415 | solvent |
| N-Boc-O-tosylhydroxylamine | Sigma-Aldrich | 775037 | reagent |
| P-2000 | JASCO | polarimeter | |
| Palladium hydroxide on carbon | Sigma-Aldrich | 212911 | reagent |
| Phenyl-1H-tetrazole-5-thiol | TCI | P0640 | reagent |
| Silica gel | Sigma-Aldrich | 227196 | For flash clromatography |
| Silica gel on TLC plates | Merck | 60768 | TLC plate |
| Sodium acetate | Sigma-Aldrich | S8750 | reagent |
| Sodium azide | Sigma-Aldrich | S2002 | reagent |
| Sodium borohydride | Sigma-Aldrich | 452882 | reagent |
| Sodium carbonate | Sigma-Aldrich | S2127 | reagent |
| tert-Butyldimethylsilyl chloride | Sigma-Aldrich | 190500 | reagent |
| Tetrahydrofuran | Sigma-Aldrich | 401757 | solvent |
| Toluene | Sigma-Aldrich | 244511 | solvent |
| Zinc bromide | Sigma-Aldrich | 230022 | reagent |
| Zinc chloride | Sigma-Aldrich | 429430 | reagent |
참고문헌
- Anastas, P. T., Warner, J. C. Principles of green chemistry. Green Chemistry: Theory and Practice. 29, Oxford University Press. (1998).
- Sheldon, R. A., Arends, I. W. C. E., Hanefeld, U. Green Chemistry and Catalysis. , Wiley. (2007).
- Trost, B. M. The atom economy-a search for synthetic efficiency. Science. 254 (5037), 1471-1477 (1991).
- Sheldon, R. A. The E factor: fifteen years on. Green Chemistry. 9 (12), 1273-1283 (2007).
- Li, C. J., Trost, B. M. Green chemistry for chemical synthesis. Proceedings of the National Academy of Sciences. 105 (36), 13197-13202 (2008).
- Sheldon, R. A. Fundamentals of green chemistry: efficiency in reaction design. Chemical Society Reviews. 41 (4), 1437-1451 (2012).
- Marion, P., et al. Sustainable chemistry: how to produce better and more from less. Green Chemistry. 19 (21), 4973-4989 (2017).
- Sheldon, R. A. The E factor 25 years on: the rise of green chemistry and sustainability. Green Chemistry. 19 (1), 18-43 (2017).
- Dembitsky, V. M., Terent'ev, A. O., Levitsky, D. O. Aziridine alkaloids: origin, chemistry and activity. Natural Products. , 977-1006 (2013).
- Ham, G. E. Activated aziridines. I. Reaction of anilines with O-ethyl-N,N-ethyleneurethane. mechanism and Hammett ρ-constant. Journal of Organic Chemistry. 29 (10), 3052-3055 (1964).
- Tanner, D. Chiral aziridine-their synthesis and use in stereoselective transformations. Angewandte Chemie International Edition. 33 (6), 599-619 (1994).
- Atkinson, R. S. 3-Acetoxyaminoquinazolinones (QNHOAc) as aziridinating agents: ring-opening of N-(Q)-substituted aziridines. Tetrahedron. 55 (6), 1519-1559 (1999).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Lu, P. Recent developments in regioselective ring opening of aziridines. Tetrahedron. 14 (66), 2549-2560 (2010).
- Ohno, H. Synthesis and applications of vinylaziridines and ethynylaziridines. Chemical Reviews. 114 (16), 7784-7814 (2014).
- Callebaut, G., Meiresonne, T., De Kimpe, N., Mangelinckx, S. Synthesis and reactivity of 2-(carboxymethyl) aziridine derivatives. Chemical Reviews. 114 (16), 7954-8015 (2014).
- Ghosal, N. C., et al. Organocatalysis by an aprotic imidazolium zwitterion: Regioselective ring-opening of aziridines and applicable to gram scale synthesis. Green Chemistry. 18 (2), 565-574 (2016).
- Rai, V. K., Rai, P. K., Bajaj, S., Kumar, A. An unprecedented synthesis of γ-lactams via mercaptoacetylation of aziridines in water. Green Chemistry. 13 (5), 1217-1223 (2011).
- Srivastava, V. P., Yadav, L. D. S. The first example of ring expansion of N-tosylaziridines to 2-aroyl-N-tosylazetidines with nitrogen ylides in an aqueous medium. Green Chemistry. 12 (8), 1460-1465 (2010).
- Stanković, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Ha, H. J., Jung, J. H., Lee, W. K. Application of regio-and stereoselective functional group transformations of chiral aziridine-2-carboxylates. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- D'hooghe, M., Ha, H. -J. Synthesis of 4- to 7-membered Heterocycles by Ring Expansion: Aza-, Oxa- and Thiaheterocyclic Small-Ring Systems. 1st ed. , Springer International Publishing. Cham. (2016).
- Macha, L., Ha, H. -J. Total synthesis and absolute stereochemical assignment of microgrewiapine A and its stereoisomers. Journal of Organic Chemistry. 84 (1), 94-103 (2019).
- Srivastava, N., Macha, L., Ha, H. -J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Lee, W. K., Ha, H. -J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Głowacka, I. E., Trocha, A., Wróblewski, A. E., Piotrowska, D. G. N-(1-Phenylethyl) aziridine-2-carboxylate esters in the synthesis of biologically relevant compounds. Beilstein Journal of Organic Chemistry. 15 (1), 1722-1757 (2019).
- JoVE. Organic Chemistry II. Polarimeter. JoVE Science Education Database. , JoVE. Cambridge, MA. (2022).
- Mao, H., et al. Preparation of chiral contiguous epoxyaziridines and their regioselective ring-opening for drug syntheses. Chemistry-A European Journal. 24 (10), 2370-2374 (2018).
- Vesely, J., Ibrahem, I., Zhao, G. L., Rios, R., Córdova, A. Organocatalytic enantioselective aziridination of α,β-unsaturated aldehydes. Angewandte Chemie International Edition. 11 (46), 778-781 (2007).
- Arai, H., et al. Enantioselective aziridination reaction of α,β-unsaturated aldehydes using an organocatalyst and tert-butyl N-arenesulfonyloxycarbamates. Tetrahedron Letters. 50 (26), 3329-3332 (2009).
- Desmarchelier, A., et al. Organocatalyzed aziridination of α-branched enals: enantioselective synthesis of aziridines with a quaternary stereocenter. European Journal of Organic Chemistry. 20 (2011), 4046-4052 (2011).
- Jiang, H., Halskov, K. S., Johansen, T. K., Jørgensen, K. A. Deracemization of axially chiral α,β-unsaturated aldehydes through an amino-catalyzed symmetry-making-symmetry-breaking cascade. Chemistry-A European Journal. 17 (14), 3842-3846 (2011).
- Deiana, L., et al. Catalytic asymmetric aziridination of α,β-unsaturated aldehydes. Chemistry-A European Journal. 17 (28), 7904-7917 (2011).
- Molnár, I. G., Tanzer, E. M., Daniliuc, C., Gilmour, R. Enantioselective aziridination of cyclic enals facilitated by the fluorine-iminium Ion gauche effect. Chemistry-A European Journal. 20 (3), 794-800 (2014).
- Nemoto, T., et al. Enantioselective synthesis of (R)-Sumanirole using organocatalytic asymmetric aziridination of an α,β-unsaturated aldehyde. Tetrahedron: Asymmetry. 25 (15), 1133-1137 (2014).
- Sim, T. B., et al. A novel synthesis of 5-functionalized oxazolidin-2-ones from enantiomerically pure 2-substituted N-[(R)-(+)-α-methylbenzyl] aziridines. Journal of Organic Chemistry. 68 (1), 104-108 (2003).
- Silva, M. A., Goodman, J. M. Aziridinium ring opening: a simple ionic reaction pathway with sequential transition states. Tetrahedron Letters. 46 (12), 2067-2069 (2005).
- Yun, S. Y., et al. Nucleophile-dependent regioselective ring opening of 2-substituted N,N-dibenzylaziridinium ions: bromide versus hydride. Chemical Communications. (18), 2508-2510 (2009).
- Dolfen, J., et al. Bicyclic aziridinium ions in azaheterocyclic chemistry-preparation and synthetic application of 1-azoniabicyclo [n. 1.0] alkanes. Advanced Synthesis & Catalysis. 358 (22), 3485-3511 (2016).
- D'hooghe, M., et al. Systematic study of halide-induced ring opening of 2-substituted aziridinium salts and theoretical rationalization of the reaction pathways. European Journal of Organic Chemistry. 2010 (25), 4920-4931 (2010).
- Boydas, E. B., et al. Theoretical insight into the regioselective ring-expansions of bicyclic aziridinium ions. Organic & Biomolecular Chemistry. 16 (5), 796-806 (2018).
- Lee, B. K., et al. An efficient synthesis of chiral terminal 1, 2-diamines using an enantiomerically pure [1-(1′ R)-methylbenzyl] aziridine-2-yl] methanol. Tetrahedron. 62 (35), 8393-8397 (2006).
- Ha, H. J., et al. Addition of 1-Boc-2-tert-butyldimethylsilyloxypyrrole to N-methyleneamine equivalents: synthesis of 1-Boc-5-aminomehtyl-2,5-dihydropyrrole-2-ones and 1-Boc-2-oxo-1,7,9-triazaspiro[4,5]-dec-3-ene. Heterocycles. 50 (1), 203-214 (1999).
- Laughlin, R. G. The basicity of aliphatic sulfonamides. Journal of the American Chemical Society. 89 (17), 4268-4271 (1967).
- Moreira, J. A., Rosa da Costa, A. M., García-Río, L., Pessêgo, M. Equilibrium constants and protonation site for N-methylbenzenesulfonamides. Beilstein Journal of Organic Chemistry. 7 (1), 1732-1738 (2011).
- Song, K., et al. Highly active ruthenium metathesis catalysts enabling ring-opening metathesis polymerization of cyclopentadiene at low temperatures. Nature Communications. 10, 3860(2019).
- Fukuta, Y., et al. De novo synthesis of Tamiflu via a catalytic asymmetric ring-opening of meso-aziridines with TMSN3. Journal of the American Chemical Society. 128 (19), 6312-6313 (2006).
- Jiang, H., et al. Intramolecular radical aziridination of allylic sulfamoyl azides by cobalt (II)-based metalloradical catalysis: effective construction of strained heterobicyclic structures. Angewandte Chemie International Edition. 55 (38), 11604-11608 (2016).
- Righi, G., Bovicelli, P., Barontini, M., Tirotta, I. Dimethyl carbonate in the regio-and stereocontrolled opening of three-membered heterocyclic rings. Green Chemistry. 14 (2), 495-502 (2012).
- Righi, P., et al. Solution- and solid-phase synthesis of 4-hydroxy-4,5-dihydroisoxazole derivatives from enantiomerically pure N-tosyl-2,3-aziridine alcohols. Organic Letters. 4 (4), 497-500 (2002).
- Yadav, N. N., Choi, J., Ha, H. -J. One-pot multiple reactions: asymmetric synthesis of 2, 6-cis-disubstituted piperidine alkaloids from chiral aziridine. Organic & Biomolecular Chemistry. 14 (27), 6426-6434 (2016).
- Rhee, H. J., et al. Preparation and utilization of contiguous bisaziridines as chiral building blocks. Advanced Synthesis & Catalysis. 363 (13), 3250-3257 (2021).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유