Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation de bisaziridines contiguës pour les réactions régiosélectives d’ouverture de cycle
Dans cet article
Résumé
Des bisaziridines contiguës contenant des aziridines non activées et activées ont été synthétisées par aziridinations organocatalytiques asymétriques, puis soumises à des réactions chimiosélectives d’ouverture de cycle dans des conditions acides ou basiques. Le cycle aziridine non activé s’ouvre avec des nucléophiles moins réactifs dans des conditions acides, tandis que le cycle aziridine activé s’ouvre avec des nucléophiles plus réactifs dans des conditions de base.
Résumé
Les aziridines, une classe de molécules organiques réactives contenant un cycle à trois chaînons, sont des synthons importants pour la synthèse d’une grande variété de composés cibles fonctionnalisés contenant de l’azote par l’ouverture de cycle régiocontrôlée d’aziridines C-substituées. Malgré les énormes progrès réalisés dans la synthèse de l’aziridine au cours de la dernière décennie, l’accès efficace aux bisaziridines contiguës reste difficile. Par conséquent, nous étions intéressés par la synthèse de bisaziridines contiguës portant un ensemble électroniquement diversifié de substituants N au-delà du squelette unique de l’aziridine pour des réactions régiosélectives d’ouverture de cycle avec divers nucléophiles. Dans cette étude, des bisaziridines chirales contiguës ont été préparées par aziridination organocatalytique asymétrique de (E)-3-((S)-1-((R)-1-phényléthyl)aziridine-2-yl)acrylaldéhyde chiral avec du N-Ts-O-tosyl ou de la N-Boc-O-tosylhydroxylamine comme source d’azote en présence de (2S)-[diphényl(triméthylsilyloxy)méthyl]pyrrolidine comme organocatalyseur chiral. Sont également démontrés ici des exemples représentatifs de réactions régiosélectives d’ouverture de cycle de bisaziridines contiguës avec une variété de nucléophiles tels que le soufre, l’azote, le carbone et l’oxygène, et l’application de bisaziridines contiguës à la synthèse de pyrrolidines chirales multi-substituées par hydrogénation catalysée par.
Introduction
La conception rationnelle de petites molécules organiques avec divers sites réactifs qui contrôlent avec précision la sélectivité du produit est un objectif clé de la synthèse organique moderne et de la chimie verte 1,2,3,4,5,6,7,8. Pour atteindre cet objectif, nous nous sommes intéressés à la synthèse modulaire des aziridines. Les aziridines intéressent la plupart des chimistes organiques, en raison de leur cadre structurellement important9 avec un ensemble électroniquement diversifié de N-substituants qui peuvent conduire à des réactions régiosélectives d’ouverture de cycle avec plusieurs nucléophiles 10,11,12,13,14,15,16,17,18, 19, et diverses activités pharmacologiques telles que les propriétés antitumorales, antimicrobiennes et antibactériennes. Malgré les progrès de la chimie de l’aziridine, l’aziridine non activée et l’aziridine activée ont des synthèses indépendantes et des réactions d’ouverture de cycle dans la littérature20.
Par conséquent, nous avons cherché à synthétiser des bisaziridines contiguës comprenant à la fois les aziridines non activées et activées. Ces bisaziridines contiguës peuvent être utilisées pour rationaliser systématiquement un motif chimiosélectif d’ouverture de cycle basé sur les propriétés électroniques suivantes des deux aziridines différentes et leur réactivité aux nucléophiles 20,21,22,23,24: a) aziridines activées, dans lesquelles les substituants retirant des électrons stabilisent conjugativement la charge négative sur l’azote, réagissent facilement avec plusieurs nucléophiles pour autoriser les produits à ouverture annulaire; b) les aziridines non activées, dans lesquelles l’azote est lié aux substituants donneurs d’électrons, sont considérablement inertes envers les nucléophiles; par conséquent, une étape de pré-activation avec un activateur approprié (principalement des acides Brønsted ou Lewis) est nécessaire pour offrir les produits à anneau ouvert à haut rendement20,21,25,26.
La présente étude décrit la conception rationnelle de bisaziridines contiguës en tant que blocs de construction chiraux via l’organocatalyse sans métaux de transition et la synthèse de diverses molécules riches en azote à l’aide d’outils de modélisation prédictive pour les réactions d’ouverture de cycle des bisaziridines. Cette étude vise à stimuler l’avancement de méthodes pratiques pour la construction de composés bioactifs enrichis en azote et de produits naturels et la polymérisation des aziridines.
Access restricted. Please log in or start a trial to view this content.
Protocole
Les détails de tous les produits synthétisés (1-5), y compris la structure, les spectres RMN complets, la pureté optique et les données HRMS-MALDI, sont fournis dans le dossier supplémentaire 1.
1. Synthèse du 3-(aziridine-2-yl)acryl aldéhyde (1a)
- Sécher à la flamme une fiole à fond rond de 50 ml munie d’une barre d’agitation et d’un septum dans des conditions de vide. Refroidissez-le à température ambiante tout en le remplissant de gaz argon.
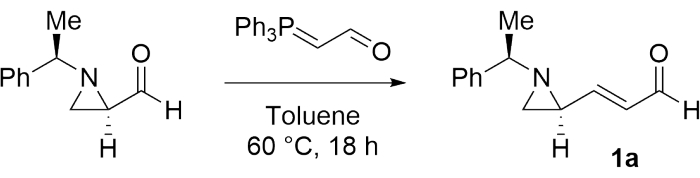
- Ajouter le toluène anhydre (19 mL) et le (R)-1-(R)-1-phényléthyl)aziridine-2-carbaldéhyde (1,00 g, 5,71 mmoles) (voir le tableau des matières) dans la fiole. Ensuite, remuez la solution pendant 1 min.
- Ajouter le (triphénylphosphoranylidène)acétaldéhyde (2,08 g, 6,85 mmoles) (voir le tableau des matières) à la solution agitée.
- Chauffer le mélange réactionnel à 60 °C pendant 18 h. Ensuite, refroidissez le mélange réactionnel à température ambiante et éliminez le solvant volatil du mélange réactionnel sous pression réduite.
- Surveiller la progression de la réaction par CCM en utilisant l’acétate d’éthyle:hexanes (1:6 v/v, Rf = 0,25) comme éluant.
- Purifier le produit brut par chromatographie flash sur gel de silice avec de l’acétate d’éthyle:hexanes (1:6 v/v) comme éluant pour isoler le produit pur 1a (voir le dossier supplémentaire 1) sous forme de liquide jaune.
- Confirmer le produit par RMN et par des mesures polarimétriques (voir les étapes 8 et 9 pour les méthodes de mesure).
2. Synthèse de bisaziridine contiguë (2a)
- Sécher à la flamme une fiole à fond rond de 50 ml munie d’une barre d’agitation et d’un septum dans des conditions de vide. Refroidissez-le à température ambiante tout en le remplissant de gaz argon.
- Ajouter l’acétate d’éthyle anhydre (3 mL) et le 1a (étape 1.6, 201 mg, 1,0 mmole) dans la fiole, puis agiter la solution pendant 1 min.
- Ajouter le catalyseur (S)-2-(diphényl((triméthylsilyl)oxy)méthyl)pyrrolidine (B S, voir le tableau des matières) (0,02 mL, 7 mol%) au mélange et agiter à température ambiante pendant 30 min.
- Ajouter 316 mg, 1,10 mmol de tert-butyl tosyloxycarbamate (BocNHOTs, voir tableau des matières) et 123 mg, 1,50 mmol d’acétate de sodium au mélange réactionnel et agiter pendant 24 h.
- Surveiller la progression de la réaction par CCM en utilisant l’éther diéthylique:hexanes (1:4 v/v, Rf = 0,27) comme éluant.
- Extraire le mélange réactionnel avec de l’acétate d’éthyle (3 x 50 mL) dans un entonnoir de séparation.
- Sécher la couche organique combinée sur Na2SO4 anhydre, filtrer et concentrer sous vide.
- Purifier le produit brut obtenu par chromatographie flash sur gel de silice avec éther diéthylique:hexanes (1:4 v/v) comme éluant pour isoler le produit pur 2a (voir le dossier supplémentaire 1) sous forme de liquide jaune.
- Confirmez le produit par RMN et mesures polarimétriques (voir étapes 8 et 9).
3. Synthèse du composé 3
- Sécher à la flamme une fiole à fond rond de 50 ml munie d’une barre d’agitation et d’un septum dans des conditions de vide. Refroidissez-le à température ambiante tout en le remplissant de gaz argon.
- Ajouter du méthanol anhydre (11 mL) et de l’aldéhyde 2a (étape 2.8, 1,00 g, 3,16 mmoles) [ou 2b (1,17 g, 3,16 mmoles, voir dossier supplémentaire 1)] dans la fiole, puis agiter la solution pendant une minute.
- Ajouter NaBH4 (95 mg, 2,53 mmoles) à la solution agitée.
- Remuer le mélange réactionnel à 0 °C pendant 1 h.
- Surveiller la progression de la réaction par CCM en utilisant l’acétate d’éthyle:hexanes (1:4 v/v, Rf = 0,27) comme éluant.
- Après 1 h, tremper le mélange réactionnel avec de l’eau distillée et extraire avec de l’acétate d’éthyle (3 x 50 mL) dans une ampoule séparatoire.
- Sécher la couche organique combinée sur Na2SO4 anhydre, filtrer et concentrer sous vide.
- Purifier le résidu brut par chromatographie flash sur gel de silice avec de l’acétate d’éthyle:hexanes (1:4 v/v) comme éluant pour isoler les produits purs 3a [ou 3b] (voir dossier supplémentaire 1) sous forme de liquide jaune.
- Confirmez le produit par RMN et mesures polarimétriques (voir étapes 8 et 9).
4. Synthèse du composé 4
- Sécher à la flamme une fiole à fond rond de 50 ml munie d’une barre d’agitation et d’un septum dans des conditions de vide. Refroidissez-le à température ambiante tout en le remplissant de gaz argon.
- Ajouter le dichlorométhane anhydre (11 mL) et l’alcool 3a (étape 3.8, 1,00 g, 3,14 mmoles) [ou 3b (1,17 g, 3,14 mmole)] dans la fiole, puis agiter la solution pendant une minute.
- Ajouter le chlorure de tert-butyldiméthylsilyle (TBSCl, 520 mg, 3,45 mmoles) et l’imidazole (427 mg, 6,28 mmoles) (voir le tableau des matières) à la solution agitée.
- Remuer le mélange réactionnel à 0 °C pendant 18 h.
- Surveiller la progression de la réaction par CCM en utilisant l’acétate d’éthyle:hexanes (1:4 v/v, Rf = 0,26) comme éluant.
- Après 18 h, tremper le mélange réactionnel avec de l’eau désionisée et extraire avec du chlorure de méthylène (3 x 50 mL) dans un entonnoir séparatoire.
- Sécher la couche organique combinée sur le sulfate de sodium anhydre, filtrer, puis concentrer sous pression réduite.
- Purifier le résidu brut par chromatographie flash sur gel de silice avec de l’acétate d’éthyle:hexanes (1:4 v/v) comme éluant pour isoler les produits purs 4a [ou 4b] (voir dossier supplémentaire 1) sous forme de liquide jaune.
- Confirmez le produit par des mesures RMN et polarimétriques.
5. Ouverture sélective du cycle d’aziridines non activées : synthèse de 5d
- Sécher à la flamme une fiole à fond rond de 50 ml munie d’une barre d’agitation et d’un septum dans des conditions de vide. Refroidissez-le à température ambiante tout en le remplissant de gaz argon.
- Ajouter 3b (étape 4.2, 100 mg, 0,27 mmole) et l’acide acétique (0,12 mL, 2,14 mmoles) dans la fiole, puis agiter le mélange à température ambiante pendant 5 h.
- Surveiller la progression de la réaction par CCM en utilisant l’acétate d’éthyle:hexanes (2:3 v/v, Rf = 0,28) comme éluant.
- Après 5 h, retirer l’acide acétique sous vide.
- Purifier le résidu brut par chromatographie flash sur gel de silice avec de l’acétate d’éthyle:hexanes (2:3 v/v) comme éluant pour isoler le produit pur 5d (voir dossier supplémentaire 1) sous forme de liquide jaune.
- Confirmez le produit par des mesures RMN et polarimétriques.
6. Ouverture sélective du cycle des aziridines activées : Synthèse de 5f
- Sécher à la flamme une fiole à fond rond de 50 ml munie d’une barre d’agitation et d’un septum dans des conditions de vide. Refroidissez-le à température ambiante tout en le remplissant de gaz argon.
- Ajouter du méthanol anhydre (8 mL) et 4b (étape 4.8, 100 mg, 0,21 mmole) dans la fiole, puis agiter la solution pendant 1 min.
- AjouterNaN3 (39 mg, 0,6 mmole) etNH4Cl(21 mg, 0,41 mmole) dansH2O(1 mL) à la solution ci-dessus.
- Agiter le mélange réactionnel à 0 °C pendant 4 h.
- Surveiller la progression de la réaction par CCM en utilisant l’acétate d’éthyle:hexanes (1:4 v/v, Rf = 0,30) comme éluant.
- Après 4 h, tremper le mélange réactionnel avecH2Oet extraire avec de l’acétate d’éthyle (3 x 50 mL) dans une ampoule séparatoire.
- Sécher la couche organique combinée sur Na2SO4 anhydre, filtrer et concentrer sous vide.
- Purifier le résidu brut par chromatographie flash sur gel de silice avec de l’acétate d’éthyle:hexanes (1:4 v/v) comme éluant pour isoler le produit pur 5f (voir dossier supplémentaire 1) sous forme de liquide jaune.
- Confirmez le produit par des mesures RMN et polarimétriques.
7. Hydrogénation catalysée par d’aziridines contiguës : Synthèse de 5h
- Sécher à la flamme une fiole à fond rond de 50 ml munie d’une barre d’agitation et d’un septum dans des conditions de vide. Refroidissez-le à température ambiante tout en le remplissant de gaz argon.
- Ajouter du méthanol anhydre (5 mL), 2b (étape 3.2, 100 mg, 0,27 mmole), Boc 2 O (70 mg, 0,32 mmole) et 20 %(OH)2/C (37 mg) dans la fiole.
- Remuer le mélange sous atmosphère H2 (ballon, 1 atm) à température ambiante pendant12 h.
- Surveiller la progression de la réaction par CCM en utilisant l’acétate d’éthyle:hexanes (2:3 v/v, Rf = 0,29) comme éluant.
- Filtrer le mélange réactionnel à travers un tampon de célite disponible dans le commerce (voir le tableau des matériaux) et laver au méthanol.
- Évaporer sous vide le filtrat et purifier le résidu par chromatographie flash sur gel de silice avec de l’acétate d’éthyle:hexanes (2:3 v/v) comme éluant pour isoler le produit pur 5h (voir dossier supplémentaire 1) sous forme de liquide incolore.
- Confirmez le produit par des mesures RMN et polarimétriques.
8. Analyse du polarimètre
- Préparer une quantité appropriée de l’échantillon (~100 mg) à mesurer.
- Dissoudre l’échantillon préparé dans CHCl3 (c 0,05-1,00).
- Transférer la solution d’échantillon dans la chambre d’échantillonnage, en veillant à ce qu’il n’y ait pas de bulles d’air
[ø = 1,8 mm, l = 10-1 m]. - Chargez la chambre d’échantillonnage dans l’instrument polarimétrique (voir Tableau des matériaux) et vérifiez l’orientation de la chambre.
- Définissez 0 comme cliquez sur zéro effacer dans la section 'contrôle'.
- Mesurer la rotation spécifique de CHCl3 pour l’ébauche.
NOTE: Source lumineuse: Na; λ = 589 nm; D.I.T: 5 s; temps de cycle: 5; intervalle de cycle: 5 s; température: 20 °C. - Mesurer la rotation spécifique de la solution échantillon à une température constante.
NOTE: Source lumineuse: Na; λ = 589 nm; D.I.T: 5 s; temps de cycle: 5; intervalle de cycle: 5 s; température: 20 °C. - Mesurer la rotation spécifique de la solution échantillon trois fois de la même manière pour obtenir la valeur moyenne.
- Calculez la rotation spécifique à l’aide de l’équation27 suivante :
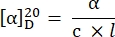
α = rotation observée (degrés), c = concentration (g/mL), l = longueur du trajet (10-1 m).
9. Analyse RMN 1H et 13C
- Préparer environ 0,6 à 1,0 mL du solvant RMN (CDCl3).
- Dissoudre ~50 mg d’échantillon dans le solvant à une concentration de 0,02 M pour 1 H RMN et 0,05 M pour desmesures RMN 13C.
- Transférer la solution échantillon dans un tube RMN à l’aide d’une pipette Pasteur.
- Chargez le tube dans l’instrument RMN (voir le tableau des matériaux).
REMARQUE : Les mesures RMN ont été effectuées à l’aide de spectromètres de 400 MHz ou 500 MHz. Nombre de spin: 16 (RMN 1H), 256 ou 512 (RMN 13C); temps de mesure : 10 min (RMN 1H), 20 ou 30 min (RMN 13C)]. - Enregistrez les spectres RMN et analysez les données.
NOTE: Référencer le déplacement chimique du spectre au signal CDCl3 [δ (spectre RMN 1H) = 7,26 ppm; δ (spectre RMN 13C) = 77,0 ppm)].
Access restricted. Please log in or start a trial to view this content.
Résultats
Pour étudier la faisabilité de la préparation d’une bisaziridine contiguë, le (E)-3-((S)-1-(R)-1-phényléthyl)aziridin-2-yl)acrylaldéhyde (1a) a d’abord été synthétisé comme substrat modèle selon la procédure mentionnée à l’étape 1 (figure 1)28.
Access restricted. Please log in or start a trial to view this content.
Discussion
La formation d’un mélange inséparable de diastéréoisomères a parfois été observée au cours de l’aziridination organocatalytique du 3-[1-(1-phényléthyl)aziridin-2-yl)]acrylaldéhyde chiral, lorsque le N-Boc-O-tosyl ou la N-Ts-O-tosyl hydroxylamine était utilisé comme source d’azote. De plus, le rendement en bisaziridine contigu a diminué lorsque la quantité de diaryl silyléther prolinol comme catalyseur est passée de 7 % mol à 20 % molaire47,48,49.
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par la subvention de l’Institut coréen des sciences fondamentales (Centre national d’installations et d’équipements de recherche) financée par le ministère de l’Éducation (2022R1A6C101A751). Ce travail a également été soutenu par des subventions de la Fondation nationale de la recherche de Corée (NRF) (2020R1A2C1007102 et 2021R1A5A6002803).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| (R)-(+)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677191 | reagent |
| (R)-1-((R)-1-phenylethyl)aziridine-2-carbaldehyde | Imagene Co.,Ltd. | reagent | |
| (S)-(–)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677183 | reagent |
| (S)-2-(diphenyl((trim ethylsilyl)oxy)methyl)pyrrolidine | Sigma-Aldrich | 677183 | reagent |
| (Triphenylphosphoranylidene) acetaldehyde | Sigma-Aldrich | 280933 | reagent |
| 1,2-Dichloroethane | Sigma-Aldrich | 284505 | solvent |
| AB Sciex 4800 Plus MALDI TOFTM (2,5-dihydroxybenzoic acid (DHB) matrix | Sciex | High resolution mass spectra | |
| Acetic acid | Sigma-Aldrich | A6283 | reagent |
| Ammonium chloride | Sigma-Aldrich | 254134 | reagent |
| aniline | Sigma-Aldrich | 132934 | reagent |
| Autopol III digital polarimeter | Rudolph Research Analytical | polarimeter | |
| AVANCE III HD (400 MHz) spectrometer | Bruker | NMR spectrometer | |
| Bruker Ascend 500 (500 MHz) | Bruker | NMR spectrometer | |
| Celite 535 | Sigma-Aldrich | 22138 | For Celite pad |
| Dichloromethane | Sigma-Aldrich | 270997 | solvent |
| Di-tert-butyl dicarbonate | Sigma-Aldrich | 361941 | reagent |
| Ethyl Acetate | Sigma-Aldrich | 270989 | solvent |
| Ethyl nitroacetate | Sigma-Aldrich | 192333 | reagent |
| Imidazole | Sigma-Aldrich | I2399 | reagent |
| INOVA 400WB (400 MHz) | Varian | NMR spectrometer | |
| JMS-700 | JEOL | High resolution mass spectra | |
| Methanol | Sigma-Aldrich | 322415 | solvent |
| N-Boc-O-tosylhydroxylamine | Sigma-Aldrich | 775037 | reagent |
| P-2000 | JASCO | polarimeter | |
| Palladium hydroxide on carbon | Sigma-Aldrich | 212911 | reagent |
| Phenyl-1H-tetrazole-5-thiol | TCI | P0640 | reagent |
| Silica gel | Sigma-Aldrich | 227196 | For flash clromatography |
| Silica gel on TLC plates | Merck | 60768 | TLC plate |
| Sodium acetate | Sigma-Aldrich | S8750 | reagent |
| Sodium azide | Sigma-Aldrich | S2002 | reagent |
| Sodium borohydride | Sigma-Aldrich | 452882 | reagent |
| Sodium carbonate | Sigma-Aldrich | S2127 | reagent |
| tert-Butyldimethylsilyl chloride | Sigma-Aldrich | 190500 | reagent |
| Tetrahydrofuran | Sigma-Aldrich | 401757 | solvent |
| Toluene | Sigma-Aldrich | 244511 | solvent |
| Zinc bromide | Sigma-Aldrich | 230022 | reagent |
| Zinc chloride | Sigma-Aldrich | 429430 | reagent |
Références
- Anastas, P. T., Warner, J. C. Principles of green chemistry. Green Chemistry: Theory and Practice. 29, Oxford University Press. (1998).
- Sheldon, R. A., Arends, I. W. C. E., Hanefeld, U. Green Chemistry and Catalysis. , Wiley. (2007).
- Trost, B. M. The atom economy-a search for synthetic efficiency. Science. 254 (5037), 1471-1477 (1991).
- Sheldon, R. A. The E factor: fifteen years on. Green Chemistry. 9 (12), 1273-1283 (2007).
- Li, C. J., Trost, B. M. Green chemistry for chemical synthesis. Proceedings of the National Academy of Sciences. 105 (36), 13197-13202 (2008).
- Sheldon, R. A. Fundamentals of green chemistry: efficiency in reaction design. Chemical Society Reviews. 41 (4), 1437-1451 (2012).
- Marion, P., et al. Sustainable chemistry: how to produce better and more from less. Green Chemistry. 19 (21), 4973-4989 (2017).
- Sheldon, R. A. The E factor 25 years on: the rise of green chemistry and sustainability. Green Chemistry. 19 (1), 18-43 (2017).
- Dembitsky, V. M., Terent'ev, A. O., Levitsky, D. O. Aziridine alkaloids: origin, chemistry and activity. Natural Products. , 977-1006 (2013).
- Ham, G. E. Activated aziridines. I. Reaction of anilines with O-ethyl-N,N-ethyleneurethane. mechanism and Hammett ρ-constant. Journal of Organic Chemistry. 29 (10), 3052-3055 (1964).
- Tanner, D. Chiral aziridine-their synthesis and use in stereoselective transformations. Angewandte Chemie International Edition. 33 (6), 599-619 (1994).
- Atkinson, R. S. 3-Acetoxyaminoquinazolinones (QNHOAc) as aziridinating agents: ring-opening of N-(Q)-substituted aziridines. Tetrahedron. 55 (6), 1519-1559 (1999).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Lu, P. Recent developments in regioselective ring opening of aziridines. Tetrahedron. 14 (66), 2549-2560 (2010).
- Ohno, H. Synthesis and applications of vinylaziridines and ethynylaziridines. Chemical Reviews. 114 (16), 7784-7814 (2014).
- Callebaut, G., Meiresonne, T., De Kimpe, N., Mangelinckx, S. Synthesis and reactivity of 2-(carboxymethyl) aziridine derivatives. Chemical Reviews. 114 (16), 7954-8015 (2014).
- Ghosal, N. C., et al. Organocatalysis by an aprotic imidazolium zwitterion: Regioselective ring-opening of aziridines and applicable to gram scale synthesis. Green Chemistry. 18 (2), 565-574 (2016).
- Rai, V. K., Rai, P. K., Bajaj, S., Kumar, A. An unprecedented synthesis of γ-lactams via mercaptoacetylation of aziridines in water. Green Chemistry. 13 (5), 1217-1223 (2011).
- Srivastava, V. P., Yadav, L. D. S. The first example of ring expansion of N-tosylaziridines to 2-aroyl-N-tosylazetidines with nitrogen ylides in an aqueous medium. Green Chemistry. 12 (8), 1460-1465 (2010).
- Stanković, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Ha, H. J., Jung, J. H., Lee, W. K. Application of regio-and stereoselective functional group transformations of chiral aziridine-2-carboxylates. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- D'hooghe, M., Ha, H. -J. Synthesis of 4- to 7-membered Heterocycles by Ring Expansion: Aza-, Oxa- and Thiaheterocyclic Small-Ring Systems. 1st ed. , Springer International Publishing. Cham. (2016).
- Macha, L., Ha, H. -J. Total synthesis and absolute stereochemical assignment of microgrewiapine A and its stereoisomers. Journal of Organic Chemistry. 84 (1), 94-103 (2019).
- Srivastava, N., Macha, L., Ha, H. -J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Lee, W. K., Ha, H. -J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Głowacka, I. E., Trocha, A., Wróblewski, A. E., Piotrowska, D. G. N-(1-Phenylethyl) aziridine-2-carboxylate esters in the synthesis of biologically relevant compounds. Beilstein Journal of Organic Chemistry. 15 (1), 1722-1757 (2019).
- JoVE. Organic Chemistry II. Polarimeter. JoVE Science Education Database. , JoVE. Cambridge, MA. (2022).
- Mao, H., et al. Preparation of chiral contiguous epoxyaziridines and their regioselective ring-opening for drug syntheses. Chemistry-A European Journal. 24 (10), 2370-2374 (2018).
- Vesely, J., Ibrahem, I., Zhao, G. L., Rios, R., Córdova, A. Organocatalytic enantioselective aziridination of α,β-unsaturated aldehydes. Angewandte Chemie International Edition. 11 (46), 778-781 (2007).
- Arai, H., et al. Enantioselective aziridination reaction of α,β-unsaturated aldehydes using an organocatalyst and tert-butyl N-arenesulfonyloxycarbamates. Tetrahedron Letters. 50 (26), 3329-3332 (2009).
- Desmarchelier, A., et al. Organocatalyzed aziridination of α-branched enals: enantioselective synthesis of aziridines with a quaternary stereocenter. European Journal of Organic Chemistry. 20 (2011), 4046-4052 (2011).
- Jiang, H., Halskov, K. S., Johansen, T. K., Jørgensen, K. A. Deracemization of axially chiral α,β-unsaturated aldehydes through an amino-catalyzed symmetry-making-symmetry-breaking cascade. Chemistry-A European Journal. 17 (14), 3842-3846 (2011).
- Deiana, L., et al. Catalytic asymmetric aziridination of α,β-unsaturated aldehydes. Chemistry-A European Journal. 17 (28), 7904-7917 (2011).
- Molnár, I. G., Tanzer, E. M., Daniliuc, C., Gilmour, R. Enantioselective aziridination of cyclic enals facilitated by the fluorine-iminium Ion gauche effect. Chemistry-A European Journal. 20 (3), 794-800 (2014).
- Nemoto, T., et al. Enantioselective synthesis of (R)-Sumanirole using organocatalytic asymmetric aziridination of an α,β-unsaturated aldehyde. Tetrahedron: Asymmetry. 25 (15), 1133-1137 (2014).
- Sim, T. B., et al. A novel synthesis of 5-functionalized oxazolidin-2-ones from enantiomerically pure 2-substituted N-[(R)-(+)-α-methylbenzyl] aziridines. Journal of Organic Chemistry. 68 (1), 104-108 (2003).
- Silva, M. A., Goodman, J. M. Aziridinium ring opening: a simple ionic reaction pathway with sequential transition states. Tetrahedron Letters. 46 (12), 2067-2069 (2005).
- Yun, S. Y., et al. Nucleophile-dependent regioselective ring opening of 2-substituted N,N-dibenzylaziridinium ions: bromide versus hydride. Chemical Communications. (18), 2508-2510 (2009).
- Dolfen, J., et al. Bicyclic aziridinium ions in azaheterocyclic chemistry-preparation and synthetic application of 1-azoniabicyclo [n. 1.0] alkanes. Advanced Synthesis & Catalysis. 358 (22), 3485-3511 (2016).
- D'hooghe, M., et al. Systematic study of halide-induced ring opening of 2-substituted aziridinium salts and theoretical rationalization of the reaction pathways. European Journal of Organic Chemistry. 2010 (25), 4920-4931 (2010).
- Boydas, E. B., et al. Theoretical insight into the regioselective ring-expansions of bicyclic aziridinium ions. Organic & Biomolecular Chemistry. 16 (5), 796-806 (2018).
- Lee, B. K., et al. An efficient synthesis of chiral terminal 1, 2-diamines using an enantiomerically pure [1-(1′ R)-methylbenzyl] aziridine-2-yl] methanol. Tetrahedron. 62 (35), 8393-8397 (2006).
- Ha, H. J., et al. Addition of 1-Boc-2-tert-butyldimethylsilyloxypyrrole to N-methyleneamine equivalents: synthesis of 1-Boc-5-aminomehtyl-2,5-dihydropyrrole-2-ones and 1-Boc-2-oxo-1,7,9-triazaspiro[4,5]-dec-3-ene. Heterocycles. 50 (1), 203-214 (1999).
- Laughlin, R. G. The basicity of aliphatic sulfonamides. Journal of the American Chemical Society. 89 (17), 4268-4271 (1967).
- Moreira, J. A., Rosa da Costa, A. M., García-Río, L., Pessêgo, M. Equilibrium constants and protonation site for N-methylbenzenesulfonamides. Beilstein Journal of Organic Chemistry. 7 (1), 1732-1738 (2011).
- Song, K., et al. Highly active ruthenium metathesis catalysts enabling ring-opening metathesis polymerization of cyclopentadiene at low temperatures. Nature Communications. 10, 3860(2019).
- Fukuta, Y., et al. De novo synthesis of Tamiflu via a catalytic asymmetric ring-opening of meso-aziridines with TMSN3. Journal of the American Chemical Society. 128 (19), 6312-6313 (2006).
- Jiang, H., et al. Intramolecular radical aziridination of allylic sulfamoyl azides by cobalt (II)-based metalloradical catalysis: effective construction of strained heterobicyclic structures. Angewandte Chemie International Edition. 55 (38), 11604-11608 (2016).
- Righi, G., Bovicelli, P., Barontini, M., Tirotta, I. Dimethyl carbonate in the regio-and stereocontrolled opening of three-membered heterocyclic rings. Green Chemistry. 14 (2), 495-502 (2012).
- Righi, P., et al. Solution- and solid-phase synthesis of 4-hydroxy-4,5-dihydroisoxazole derivatives from enantiomerically pure N-tosyl-2,3-aziridine alcohols. Organic Letters. 4 (4), 497-500 (2002).
- Yadav, N. N., Choi, J., Ha, H. -J. One-pot multiple reactions: asymmetric synthesis of 2, 6-cis-disubstituted piperidine alkaloids from chiral aziridine. Organic & Biomolecular Chemistry. 14 (27), 6426-6434 (2016).
- Rhee, H. J., et al. Preparation and utilization of contiguous bisaziridines as chiral building blocks. Advanced Synthesis & Catalysis. 363 (13), 3250-3257 (2021).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon