このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
位置選択的開環反応のための連続ビサジリジンの調製
要約
非活性化および活性化アジリジンを含む連続したビサジリジンを不斉有機触媒アジリジン化によって合成し、次いで酸性または塩基性条件下で化学選択的開環反応を行った。非活性化アジリジン環は酸性条件下では反応性の低い求核剤で開環しますが、活性化されたアジリジン環は塩基性条件下でより反応性の高い求核剤で開きます。
要約
アジリジンは、三員環を含む反応性有機分子の一種であり、C-置換アジリジンの位置制御開環を介して多種多様な官能化された窒素含有標的化合物を合成するための重要な合成物です。過去10年間のアジリジン合成の驚異的な進歩にもかかわらず、連続したビサジリジンに効率的にアクセスすることは依然として困難です。そのため、多様な求核剤との位置選択的開環反応のために、単一のアジリジン骨格を超えて電子的に多様なN-置換基のセットを持つ連続したビサジリジンを合成することに興味を持っていました。本研究では、キラル有機触媒として(2S)-[ジフェニル(トリメチルシリルオキシ)メチル]ピロリジン存在下、窒素源としてN-Ts-O-トシルまたはN-Boc-O-トシルヒドロキシルアミンを用いてキラル(E)-3-((S)-1-((R)-1-フェニルエチル)アジリジン-2-イル)アクリルアルデヒドを有機触媒的不斉アジリジン化することにより、キラル連続ビサジリジンを調製した。また、連続したビサジリジンと硫黄、窒素、炭素、酸素などの様々な求核剤との位置選択的開環反応の代表例、およびPd触媒水素化による多置換キラルピロリジンの合成への連続ビサジリジンの適用も示します。
概要
生成物の選択性を正確に制御する多様な反応部位を持つ低分子有機分子の合理的な設計は、現代の有機合成およびグリーンケミストリーにおける重要な目標です1,2,3,4,5,6,7,8。この目標を達成するために、我々はアジリジンのモジュラー合成に興味を持っていました。アジリジンは、複数の求核剤10,11,12,13,14,15,16,17,18との位置選択的開環反応を引き起こす可能性のある電子的に多様なN-置換基のセットを有する構造的に重要なフレームワーク9のために、ほとんどの有機化学者にとって興味深いものです10,11,12,13,14,15,16,17,18、19、および抗腫瘍、抗菌、抗菌特性などのさまざまな薬理学的活性。アジリジン化学の進歩にもかかわらず、非活性化アジリジンおよび活性化アジリジンは、文献20において独立した合成および開環反応を有する。
そこで、非活性化アジリジンと活性化アジリジンの両方からなる連続したビサジリジンの合成を目指しました。これらの連続したビサジリジンは、2つの異なるアジリジンの以下の電子的性質および求核剤に対するそれらの反応性に基づいて化学選択的開環パターンを体系的に合理化するために使用することができる20,21,22,23,24:a)活性化アジリジンは、電子吸引性置換基が窒素上の負電荷を共役的に安定化させ、複数の求核剤と容易に反応して リングオープン製品を許可する。b)窒素が電子供与性置換基に結合している非活性化アジリジンは、求核剤に対してかなり不活性である。したがって、適切な活性化剤(主にブレンステッド酸またはルイス酸)による事前活性化ステップは、高収率で開環生成物を得るのに必要とされる20、21、25、26。
本研究では、遷移金属フリーの有機触媒 作用による キラルビルディングブロックとしての連続ビサジリジンの合理的設計と、ビサジリジンの開環反応の予測モデリングツールを利用した多様な窒素リッチ分子の合成について説明します。この研究は、窒素富化生理活性化合物および天然物の構築およびアジリジンの重合のための実用的な方法の進歩を刺激することを目的としています。
プロトコル
合成したすべての生成物(1-5)の構造、全NMRスペクトル、光学純度、HRMS-MALDIデータなどの詳細は、 補足ファイル1に記載されています。
1. 3-(アジリジン-2-イル)アクリルアルデヒド(1a)の合成
- 攪拌機バーとセプタムを備えた50 mL丸底フラスコを真空条件下でフレームドライします。アルゴンガスを充填しながら室温まで冷却します。
- 無水トルエン(19 mL)と(R)-1-((R)-1-フェニルエチル)アジリジン-2-カルブアルデヒド(1.00 g、5.71 mmol)(材料の表を参照)をフラスコに加えます。次に、溶液を1分間攪拌します。
- 撹拌液に(トリフェニルホスホラニリデン)アセトアルデヒド(2.08 g, 6.85 mmol)( 材料の表を参照)を加える。
- 反応混合物を60°Cで18時間加熱する。次いで、反応混合物を室温まで冷却し、減圧下で反応混合物から揮発性溶媒を除去する。
- 酢酸エチル:ヘキサン(1:6 v/v、Rf = 0.25)を溶離液としてTLCにより反応の進行をモニタリングします。
- 粗生成物を酢酸エチル:ヘキサン(1:6 v/v)を溶離液とするシリカゲルフラッシュクロマトグラフィーで精製し、純粋な生成物 1a ( 補足ファイル1を参照)を黄色の液体として分離します。
- NMR測定と偏光計測定で製品を確認します(測定方法については手順8と9を参照してください)。
2. 連続したビサジリジンの合成(2a)
- 50 mLの丸底フラスコをスターラーバーとセプタムで真空条件下で火炎乾燥します。アルゴンガスを充填しながら室温まで冷却します。
- 無水酢酸エチル(3 mL)および 1a (ステップ1.6、201 mg、1.0 mmol)をフラスコに加え、溶液を1分間攪拌します。
- 混合物に触媒(S)-2-(ジフェニル((トリメチルシリル)オキシ)メチル)ピロリジン(BS、材料表参照)(0.02 mL、7 mol%)を加え、室温で30分間攪拌します。
- 反応混合物に316 mg、1.10 mmolの tert-ブチルトシルオキシカルバメート(BocNHOT、 材料表を参照)および123 mg、1.50 mmolの酢酸ナトリウムを加え、24時間攪拌します。
- ジエチルエーテル:ヘキサン(1:4 v/v、Rf = 0.27)を溶離液としてTLCにより反応の進行をモニタリングします。
- 反応混合物を分液漏斗中の酢酸エチル(3 x 50 mL)で抽出します。
- 合わせた有機層を無水Na2SO4で乾燥し、濾過し、真空中で濃縮する。
- 得られた粗生成物をシリカゲル上のフラッシュクロマトグラフィーにより、ジエチルエーテル:ヘキサン(1:4 v/v)を溶離液として精製し、純粋な生成物 2a ( 補足ファイル1を参照)を黄色液体として分離します。
- NMRと偏光計の測定で製品を確認します(手順8および9を参照)。
3. 化合物3の合成
- 50 mLの丸底フラスコをスターラーバーとセプタムで真空条件下で火炎乾燥します。アルゴンガスを充填しながら室温まで冷却します。
- 無水メタノール(11 mL)とアルデヒド 2a (ステップ2.8、1.00 g、3.16 mmol)[または 2b (1.17 g、3.16 mmol、 補足ファイル1を参照)]をフラスコに加え、溶液を1分間攪拌します。
- NaBH4 (95 mg, 2.53 ミリモル) を撹拌液に加える。
- 反応混合物を0°Cで1時間撹拌する。
- 酢酸エチル:ヘキサン(1:4 v/v、Rf = 0.27)を溶離液としてTLCにより反応の進行をモニタリングします。
- 1時間後、反応混合物を蒸留水でクエンチし、分液漏斗で酢酸エチル(3 x 50 mL)で抽出します。
- 合わせた有機層を無水Na2SO4で乾燥し、濾過し、真空中で濃縮する。
- 粗残渣を酢酸エチル:ヘキサン(1:4 v/v)を溶離液として使用したシリカゲルフラッシュクロマトグラフィーで精製し、純粋な生成物 3a [または 3b]( 補足ファイル1を参照)を黄色の液体として分離します。
- NMRと偏光計の測定で製品を確認します(手順8および9を参照)。
4. 化合物4の合成
- 50 mLの丸底フラスコをスターラーバーとセプタムで真空条件下で火炎乾燥します。アルゴンガスを充填しながら室温まで冷却します。
- 無水ジクロロメタン(11 mL)とアルコール 3a (ステップ3.8、1.00 g、3.14 mmol)[または 3b (1.17 g、3.14 mmol)]をフラスコに加え、溶液を1分間攪拌します。
- tert-ブチルジメチルシリルクロリド (TBSCl, 520 mg, 3.45 ミリモル) とイミダゾール (427 mg, 6.28 ミリモル) (材料表参照) を撹拌液に加えます。
- 反応混合物を0°Cで18時間撹拌する。
- 酢酸エチル:ヘキサン(1:4 v/v、Rf = 0.26)を溶離液としてTLCにより反応の進行をモニタリングします。
- 18時間後、反応混合物を脱イオン水でクエンチし、分液漏斗で塩化メチレン(3 x 50 mL)で抽出します。
- 合わせた有機層を無水硫酸ナトリウムで乾燥させ、ろ過してから減圧濃縮します。
- 粗残渣を酢酸エチル:ヘキサン(1:4 v/v)を溶離液とするシリカゲルフラッシュクロマトグラフィーで精製し、純粋な生成物 4a [または 4b]( 補足ファイル1を参照)を黄色の液体として分離します。
- NMRと偏光計の測定で製品を確認します。
5. 非活性化アジリジンの選択的開環:5dの合成
- 50 mLの丸底フラスコをスターラーバーとセプタムで真空条件下で火炎乾燥します。アルゴンガスを充填しながら室温まで冷却します。
- 3b(ステップ4.2、100 mg、0.27 mmol)および酢酸(0.12 mL、2.14 mmol)をフラスコに加え、室温で5時間攪拌します。
- 酢酸エチル:ヘキサン(2:3 v/v、Rf = 0.28)を溶離液としてTLCにより反応の進行をモニタリングします。
- 5時間後、 真空中で酢酸を除去する。
- 粗残渣を酢酸エチル:ヘキサン(2:3 v/v)を溶離液とするシリカゲルフラッシュクロマトグラフィーで精製し、純粋な生成物 5d ( 補足ファイル1を参照)を黄色の液体として分離します。
- NMRと偏光計の測定で製品を確認します。
6. 活性化アジリジンの選択的開環:5fの合成
- 50 mLの丸底フラスコをスターラーバーとセプタムで真空条件下で火炎乾燥します。アルゴンガスを充填しながら室温まで冷却します。
- 無水メタノール(8 mL)と 4b (ステップ4.8、100 mg、0.21 mmol)をフラスコに加え、溶液を1分間攪拌します。
- 上記の溶液にH2O(1mL)中のNaN3(39mg, 0.6ミリモル)およびNH 4Cl(21mg,0.41ミリモル)を加える。
- 反応混合物を0°Cで4時間撹拌する。
- 酢酸エチル:ヘキサン(1:4 v/v、Rf = 0.30)を溶離液としてTLCにより反応の進行をモニタリングします。
- 4時間後、反応混合物をH2Oでクエンチし、分液漏斗中で酢酸エチル(3 x 50 mL)で抽出します。
- 合わせた有機層を無水Na2SO4で乾燥し、濾過し、真空中で濃縮する。
- 粗残渣を酢酸エチル:ヘキサン(1:4 v/v)を溶離液とするシリカゲルフラッシュクロマトグラフィーで精製し、純粋な生成物 5f ( 補足ファイル1を参照)を黄色の液体として分離します。
- NMRと偏光計の測定で製品を確認します。
7. 連続アジリジンのPd触媒水素化:5hの合成
- 50 mLの丸底フラスコをスターラーバーとセプタムで真空条件下で火炎乾燥します。アルゴンガスを充填しながら室温まで冷却します。
- 無水メタノール(5 mL)、2b(ステップ3.2、100 mg、0.27 mmol)、Boc 2 O(70 mg、0.32 mmol)、および20%Pd(OH)2 / C(37 mg)をフラスコに加えます。
- 混合物をH2 雰囲気下(バルーン、1気圧)下で室温で12時間撹拌する。
- 酢酸エチル:ヘキサン(2:3 v/v、Rf = 0.29)を溶離液としてTLCにより反応の進行をモニターします。
- 反応混合物を市販のセライトパッド( 材料表を参照)でろ過し、メタノールで洗浄します。
- ろ液を 真空中で 蒸発させ、酢酸エチル:ヘキサン(2:3 v/v)を溶離液とするシリカゲルフラッシュクロマトグラフィーで残渣を精製し、純粋な生成物 を5時間 ( 補足ファイル1を参照)を無色の液体として分離します。
- NMRと偏光計の測定で製品を確認します。
8.偏光計分析
- 測定する試料(~100mg)を適量用意してください。
- 調製したサンプルをCHCl3 (c 0.05-1.00)に溶解する。
- サンプル溶液をサンプルチャンバーに移し、気泡がないことを確認します
[ø = 1.8 mm, l = 10-1 m]。 - サンプルチャンバーを偏光計装置( 材料表を参照)にロードし、チャンバーの向きを確認します。
- 「コントロール」セクションでクリックゼロクリアとして0を設定します。
- ブランクのCHCl3 の比回転を測定します。
注:光源:Na;λ = 589 nm;D.I.T: 5 秒;サイクルタイム:5;サイクル間隔:5秒;温度:20°C。 - 一定温度で試料溶液の比旋回を測定します。
注:光源:Na;λ = 589 nm;D.I.T: 5 秒;サイクルタイム:5;サイクル間隔:5秒;温度:20°C。 - 同様の方法で試料溶液の比旋回を3回測定し、平均値を求めた。
- 次の式27を使用して比回転を計算します。
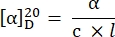
α = 観測された回転 (度), c = 濃度 (g/mL), l = 経路長 (10-1 m).
9. 1H および 13C NMR 分析
- 約0.6〜1.0 mLのNMR溶媒(CDCl3)を準備します。
- ~50 mgのサンプルを、 1H NMR測定の場合は0.02 M、 13C NMR測定の場合は0.05 Mの濃度で溶媒に溶解します。
- パスツールピペットを使用してサンプル溶液をNMRチューブに移します。
- チューブをNMR装置にロードします( 材料表を参照)。
注:NMR測定は、400MHzまたは500MHzの分光計を使用して実行しました。スピン数:16(1HNMR)、256または512(13CNMR);測定時間:10分(1HNMR)、20または30分(13CNMR)]。 - NMRスペクトルを記録し、データを解析します。
注:スペクトルの化学シフトをCDCl3シグナル[δ(1H NMRスペクトル)= 7.26 ppm; δ(13C NMRスペクトル)= 77.0 ppm)]に参照してください。
結果
連続したビサジリジンの調製の達成可能性を調べるために、(E)-3-((S)-1-((R)-1-フェニルエチル)アジリジン-2-イル)アクリルアルデヒド(1a)を、ステップ1(図1)28で述べた手順に従ってモデル基質として合成しました。
ディスカッション
窒素源としてN-Boc-O-トシルまたはN-Ts-O-トシルヒドロキシルアミンを用いた場合、キラル3-[1-(1-フェニルエチル)アジリジン-2-イル)]アクリルアルデヒドの有機触媒アジリジン化の過程で、ジアステレオマーの不可分混合物の形成が観察されることがありました。また,触媒としてのジアリールシリルエーテルプロリノールの添加量を7mol%から20mol%に増加させると連続し?...
開示事項
著者は開示するものは何もありません。
謝辞
本研究は、教育部助成の韓国基礎科学研究院(国立研究施設設備センター)の助成(2022R1A6C101A751)の支援を受けて行われました。この研究は、韓国国立研究財団(NRF)の助成金(2020R1A2C1007102および2021R1A5A6002803)によっても支援されました。
資料
| Name | Company | Catalog Number | Comments |
| (R)-(+)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677191 | reagent |
| (R)-1-((R)-1-phenylethyl)aziridine-2-carbaldehyde | Imagene Co.,Ltd. | reagent | |
| (S)-(–)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677183 | reagent |
| (S)-2-(diphenyl((trim ethylsilyl)oxy)methyl)pyrrolidine | Sigma-Aldrich | 677183 | reagent |
| (Triphenylphosphoranylidene) acetaldehyde | Sigma-Aldrich | 280933 | reagent |
| 1,2-Dichloroethane | Sigma-Aldrich | 284505 | solvent |
| AB Sciex 4800 Plus MALDI TOFTM (2,5-dihydroxybenzoic acid (DHB) matrix | Sciex | High resolution mass spectra | |
| Acetic acid | Sigma-Aldrich | A6283 | reagent |
| Ammonium chloride | Sigma-Aldrich | 254134 | reagent |
| aniline | Sigma-Aldrich | 132934 | reagent |
| Autopol III digital polarimeter | Rudolph Research Analytical | polarimeter | |
| AVANCE III HD (400 MHz) spectrometer | Bruker | NMR spectrometer | |
| Bruker Ascend 500 (500 MHz) | Bruker | NMR spectrometer | |
| Celite 535 | Sigma-Aldrich | 22138 | For Celite pad |
| Dichloromethane | Sigma-Aldrich | 270997 | solvent |
| Di-tert-butyl dicarbonate | Sigma-Aldrich | 361941 | reagent |
| Ethyl Acetate | Sigma-Aldrich | 270989 | solvent |
| Ethyl nitroacetate | Sigma-Aldrich | 192333 | reagent |
| Imidazole | Sigma-Aldrich | I2399 | reagent |
| INOVA 400WB (400 MHz) | Varian | NMR spectrometer | |
| JMS-700 | JEOL | High resolution mass spectra | |
| Methanol | Sigma-Aldrich | 322415 | solvent |
| N-Boc-O-tosylhydroxylamine | Sigma-Aldrich | 775037 | reagent |
| P-2000 | JASCO | polarimeter | |
| Palladium hydroxide on carbon | Sigma-Aldrich | 212911 | reagent |
| Phenyl-1H-tetrazole-5-thiol | TCI | P0640 | reagent |
| Silica gel | Sigma-Aldrich | 227196 | For flash clromatography |
| Silica gel on TLC plates | Merck | 60768 | TLC plate |
| Sodium acetate | Sigma-Aldrich | S8750 | reagent |
| Sodium azide | Sigma-Aldrich | S2002 | reagent |
| Sodium borohydride | Sigma-Aldrich | 452882 | reagent |
| Sodium carbonate | Sigma-Aldrich | S2127 | reagent |
| tert-Butyldimethylsilyl chloride | Sigma-Aldrich | 190500 | reagent |
| Tetrahydrofuran | Sigma-Aldrich | 401757 | solvent |
| Toluene | Sigma-Aldrich | 244511 | solvent |
| Zinc bromide | Sigma-Aldrich | 230022 | reagent |
| Zinc chloride | Sigma-Aldrich | 429430 | reagent |
参考文献
- Anastas, P. T., Warner, J. C. Principles of green chemistry. Green Chemistry: Theory and Practice. 29, (1998).
- Sheldon, R. A., Arends, I. W. C. E., Hanefeld, U. . Green Chemistry and Catalysis. , (2007).
- Trost, B. M. The atom economy-a search for synthetic efficiency. Science. 254 (5037), 1471-1477 (1991).
- Sheldon, R. A. The E factor: fifteen years on. Green Chemistry. 9 (12), 1273-1283 (2007).
- Li, C. J., Trost, B. M. Green chemistry for chemical synthesis. Proceedings of the National Academy of Sciences. 105 (36), 13197-13202 (2008).
- Sheldon, R. A. Fundamentals of green chemistry: efficiency in reaction design. Chemical Society Reviews. 41 (4), 1437-1451 (2012).
- Marion, P., et al. Sustainable chemistry: how to produce better and more from less. Green Chemistry. 19 (21), 4973-4989 (2017).
- Sheldon, R. A. The E factor 25 years on: the rise of green chemistry and sustainability. Green Chemistry. 19 (1), 18-43 (2017).
- Dembitsky, V. M., Terent'ev, A. O., Levitsky, D. O. Aziridine alkaloids: origin, chemistry and activity. Natural Products. , 977-1006 (2013).
- Ham, G. E. Activated aziridines. I. Reaction of anilines with O-ethyl-N,N-ethyleneurethane. mechanism and Hammett ρ-constant. Journal of Organic Chemistry. 29 (10), 3052-3055 (1964).
- Tanner, D. Chiral aziridine-their synthesis and use in stereoselective transformations. Angewandte Chemie International Edition. 33 (6), 599-619 (1994).
- Atkinson, R. S. 3-Acetoxyaminoquinazolinones (QNHOAc) as aziridinating agents: ring-opening of N-(Q)-substituted aziridines. Tetrahedron. 55 (6), 1519-1559 (1999).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Lu, P. Recent developments in regioselective ring opening of aziridines. Tetrahedron. 14 (66), 2549-2560 (2010).
- Ohno, H. Synthesis and applications of vinylaziridines and ethynylaziridines. Chemical Reviews. 114 (16), 7784-7814 (2014).
- Callebaut, G., Meiresonne, T., De Kimpe, N., Mangelinckx, S. Synthesis and reactivity of 2-(carboxymethyl) aziridine derivatives. Chemical Reviews. 114 (16), 7954-8015 (2014).
- Ghosal, N. C., et al. Organocatalysis by an aprotic imidazolium zwitterion: Regioselective ring-opening of aziridines and applicable to gram scale synthesis. Green Chemistry. 18 (2), 565-574 (2016).
- Rai, V. K., Rai, P. K., Bajaj, S., Kumar, A. An unprecedented synthesis of γ-lactams via mercaptoacetylation of aziridines in water. Green Chemistry. 13 (5), 1217-1223 (2011).
- Srivastava, V. P., Yadav, L. D. S. The first example of ring expansion of N-tosylaziridines to 2-aroyl-N-tosylazetidines with nitrogen ylides in an aqueous medium. Green Chemistry. 12 (8), 1460-1465 (2010).
- Stanković, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Ha, H. J., Jung, J. H., Lee, W. K. Application of regio-and stereoselective functional group transformations of chiral aziridine-2-carboxylates. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- D'hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-membered Heterocycles by Ring Expansion: Aza-, Oxa- and Thiaheterocyclic Small-Ring Systems. 1st ed. , (2016).
- Macha, L., Ha, H. -. J. Total synthesis and absolute stereochemical assignment of microgrewiapine A and its stereoisomers. Journal of Organic Chemistry. 84 (1), 94-103 (2019).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Głowacka, I. E., Trocha, A., Wróblewski, A. E., Piotrowska, D. G. N-(1-Phenylethyl) aziridine-2-carboxylate esters in the synthesis of biologically relevant compounds. Beilstein Journal of Organic Chemistry. 15 (1), 1722-1757 (2019).
- JoVE. Organic Chemistry II. Polarimeter. JoVE Science Education Database. , (2022).
- Mao, H., et al. Preparation of chiral contiguous epoxyaziridines and their regioselective ring-opening for drug syntheses. Chemistry-A European Journal. 24 (10), 2370-2374 (2018).
- Vesely, J., Ibrahem, I., Zhao, G. L., Rios, R., Córdova, A. Organocatalytic enantioselective aziridination of α,β-unsaturated aldehydes. Angewandte Chemie International Edition. 11 (46), 778-781 (2007).
- Arai, H., et al. Enantioselective aziridination reaction of α,β-unsaturated aldehydes using an organocatalyst and tert-butyl N-arenesulfonyloxycarbamates. Tetrahedron Letters. 50 (26), 3329-3332 (2009).
- Desmarchelier, A., et al. Organocatalyzed aziridination of α-branched enals: enantioselective synthesis of aziridines with a quaternary stereocenter. European Journal of Organic Chemistry. 20 (2011), 4046-4052 (2011).
- Jiang, H., Halskov, K. S., Johansen, T. K., Jørgensen, K. A. Deracemization of axially chiral α,β-unsaturated aldehydes through an amino-catalyzed symmetry-making-symmetry-breaking cascade. Chemistry-A European Journal. 17 (14), 3842-3846 (2011).
- Deiana, L., et al. Catalytic asymmetric aziridination of α,β-unsaturated aldehydes. Chemistry-A European Journal. 17 (28), 7904-7917 (2011).
- Molnár, I. G., Tanzer, E. M., Daniliuc, C., Gilmour, R. Enantioselective aziridination of cyclic enals facilitated by the fluorine-iminium Ion gauche effect. Chemistry-A European Journal. 20 (3), 794-800 (2014).
- Nemoto, T., et al. Enantioselective synthesis of (R)-Sumanirole using organocatalytic asymmetric aziridination of an α,β-unsaturated aldehyde. Tetrahedron: Asymmetry. 25 (15), 1133-1137 (2014).
- Sim, T. B., et al. A novel synthesis of 5-functionalized oxazolidin-2-ones from enantiomerically pure 2-substituted N-[(R)-(+)-α-methylbenzyl] aziridines. Journal of Organic Chemistry. 68 (1), 104-108 (2003).
- Silva, M. A., Goodman, J. M. Aziridinium ring opening: a simple ionic reaction pathway with sequential transition states. Tetrahedron Letters. 46 (12), 2067-2069 (2005).
- Yun, S. Y., et al. Nucleophile-dependent regioselective ring opening of 2-substituted N,N-dibenzylaziridinium ions: bromide versus hydride. Chemical Communications. (18), 2508-2510 (2009).
- Dolfen, J., et al. Bicyclic aziridinium ions in azaheterocyclic chemistry-preparation and synthetic application of 1-azoniabicyclo [n. 1.0] alkanes. Advanced Synthesis & Catalysis. 358 (22), 3485-3511 (2016).
- D'hooghe, M., et al. Systematic study of halide-induced ring opening of 2-substituted aziridinium salts and theoretical rationalization of the reaction pathways. European Journal of Organic Chemistry. 2010 (25), 4920-4931 (2010).
- Boydas, E. B., et al. Theoretical insight into the regioselective ring-expansions of bicyclic aziridinium ions. Organic & Biomolecular Chemistry. 16 (5), 796-806 (2018).
- Lee, B. K., et al. An efficient synthesis of chiral terminal 1, 2-diamines using an enantiomerically pure [1-(1′ R)-methylbenzyl] aziridine-2-yl] methanol. Tetrahedron. 62 (35), 8393-8397 (2006).
- Ha, H. J., et al. Addition of 1-Boc-2-tert-butyldimethylsilyloxypyrrole to N-methyleneamine equivalents: synthesis of 1-Boc-5-aminomehtyl-2,5-dihydropyrrole-2-ones and 1-Boc-2-oxo-1,7,9-triazaspiro[4,5]-dec-3-ene. Heterocycles. 50 (1), 203-214 (1999).
- Laughlin, R. G. The basicity of aliphatic sulfonamides. Journal of the American Chemical Society. 89 (17), 4268-4271 (1967).
- Moreira, J. A., Rosa da Costa, A. M., García-Río, L., Pessêgo, M. Equilibrium constants and protonation site for N-methylbenzenesulfonamides. Beilstein Journal of Organic Chemistry. 7 (1), 1732-1738 (2011).
- Song, K., et al. Highly active ruthenium metathesis catalysts enabling ring-opening metathesis polymerization of cyclopentadiene at low temperatures. Nature Communications. 10, 3860 (2019).
- Fukuta, Y., et al. De novo synthesis of Tamiflu via a catalytic asymmetric ring-opening of meso-aziridines with TMSN3. Journal of the American Chemical Society. 128 (19), 6312-6313 (2006).
- Jiang, H., et al. Intramolecular radical aziridination of allylic sulfamoyl azides by cobalt (II)-based metalloradical catalysis: effective construction of strained heterobicyclic structures. Angewandte Chemie International Edition. 55 (38), 11604-11608 (2016).
- Righi, G., Bovicelli, P., Barontini, M., Tirotta, I. Dimethyl carbonate in the regio-and stereocontrolled opening of three-membered heterocyclic rings. Green Chemistry. 14 (2), 495-502 (2012).
- Righi, P., et al. Solution- and solid-phase synthesis of 4-hydroxy-4,5-dihydroisoxazole derivatives from enantiomerically pure N-tosyl-2,3-aziridine alcohols. Organic Letters. 4 (4), 497-500 (2002).
- Yadav, N. N., Choi, J., Ha, H. -. J. One-pot multiple reactions: asymmetric synthesis of 2, 6-cis-disubstituted piperidine alkaloids from chiral aziridine. Organic & Biomolecular Chemistry. 14 (27), 6426-6434 (2016).
- Rhee, H. J., et al. Preparation and utilization of contiguous bisaziridines as chiral building blocks. Advanced Synthesis & Catalysis. 363 (13), 3250-3257 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved