Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Regioselektif halka açma reaksiyonları için bitişik bisaziridinlerin hazırlanması
Bu Makalede
Özet
Aktif olmayan ve aktive olmuş aziridinler içeren bitişik bizaziridinler asimetrik organokatalitik aziridinasyonlarla sentezlendi ve daha sonra asidik veya bazik koşullar altında kemoselektif halka açma reaksiyonlarına tabi tutuldu. Aktive edilmemiş aziridin halkası asidik koşullar altında daha az reaktif nükleofil ile açılırken, aktive edilmiş aziridin halkası temel koşullar altında daha reaktif nükleofiller ile açılır.
Özet
Üç üyeli bir halka içeren reaktif organik moleküllerin bir sınıfı olan aziridinler, C-ikame edilmiş aziridinlerin regiokontrollü halka açıklığı yoluyla çok çeşitli işlevselleştirilmiş azot içeren hedef bileşiklerin sentezi için önemli sentezlerdir. Son on yılda aziridin sentezindeki muazzam ilerlemeye rağmen, bitişik bisaziridinlere verimli bir şekilde erişmek zor olmaya devam etmektedir. Bu nedenle, çeşitli nükleofiller ile regioselektif halka açma reaksiyonları için tek aziridin omurgasının ötesinde elektronik olarak farklı bir N-ikame maddesi seti taşıyan bitişik bizaziridinleri sentezlemekle ilgileniyorduk. Bu çalışmada, kiral organokatalizör olarak (2 S)-[difenil(trimetilsililoksi)metil]pirolidinin varlığında azot kaynağı olarak N-Ts-O-tosyl veya N-Boc-O-tosyl hidroksilamin ile kiral (E)-3-((S)-1-(R)-1-feniletil)-1-feniletil)-1-feniletil)-akrililaldehitin organokatalitik asiridinasyonu ile kiral bitişik bisaziridinler hazırlanmıştır. Ayrıca burada gösterilen bitişik bisaziridinlerin kükürt, azot, karbon ve oksijen gibi çeşitli nükleofiller ile regioselektif halka açma reaksiyonlarının temsili örnekleri ve bitişik bisaziridinlerin Pd-katalizörlü hidrojenasyon ile çok ikame edilmiş kiral pirrolidinlerin sentezine uygulanması.
Giriş
Ürün seçiciliğini hassas bir şekilde kontrol eden çeşitli reaktif bölgelere sahip küçük organik moleküllerin rasyonel tasarımı, modern organik sentez ve yeşil kimyada kilit bir hedeftir 1,2,3,4,5,6,7,8. Bu hedefe ulaşmak için, aziridinlerin modüler sentezi ile ilgilendik. Aziridinler, yapısal olarak önemli çerçeve 9 nedeniyle, çoklu nükleofiller 10,11,12,13,14,15,16,17,18 ile regioselektif halka açma reaksiyonlarına yol açabilen elektronik olarak farklı bir N-ikame edici setine sahip yapısal olarak önemli çerçeve9 nedeniyle çoğu organik kimyagerin ilgisini çekmektedir. 19 ve antitümör, antimikrobiyal ve antibakteriyel özellikler gibi çeşitli farmakolojik aktiviteler. Aziridin kimyasındaki ilerlemelere rağmen, aktive edilmemiş aziridin ve aktive edilmiş aziridin literatürde bağımsız sentezlere ve halka açma reaksiyonlarına sahiptir20.
Bu nedenle, hem aktive olmayan hem de aktive olmuş aziridinleri içeren bitişik bisaziridinleri sentezlemeyi amaçladık. Bu bitişik bizaziridinler, iki farklı aziridinin aşağıdaki elektronik özelliklerine ve nükleofillere reaktivitesine dayanan kemoselektif bir halka açma modelini sistematik olarak rasyonelleştirmek için kullanılabilir 20,21,22,23,24: a) elektron çeken ikame maddelerinin azot üzerindeki negatif yükü konjugatif olarak stabilize ettiği, çoklu nükleofiller ile kolayca reaksiyona girdiği aktif aziridinler. halka açılmış ürünlere izin vermek; b) azotun elektron bağışlayan ikame maddelerine bağlandığı aktive edilmemiş aziridinler, nükleofillere karşı oldukça etkisizdir; Bu nedenle, halka açılmış ürünleri yüksek verimde20,21,25,26 oranında karşılamak için uygun bir aktivatör (esas olarak Brønsted veya Lewis asitleri) ile bir ön aktivasyon adımı gereklidir.
Bu çalışma, geçiş metalsiz organokataliz yoluyla kiral yapı taşları olarak bitişik bisaziridinlerin rasyonel tasarımını ve bisaziridinlerin halka açma reaksiyonları için öngörücü modelleme araçları kullanılarak çeşitli azot bakımından zengin moleküllerin sentezini açıklamaktadır. Bu çalışma, azotla zenginleştirilmiş biyoaktif bileşiklerin ve doğal ürünlerin yapımında ve aziridinlerin polimerizasyonunda pratik yöntemlerin geliştirilmesini teşvik etmeyi amaçlamaktadır.
Protokol
Yapı, tam NMR spektrumları, optik saflık ve HRMS-MALDI verileri dahil olmak üzere sentezlenen tüm ürünlerin (1-5) ayrıntıları Ek Dosya 1'de verilmiştir.
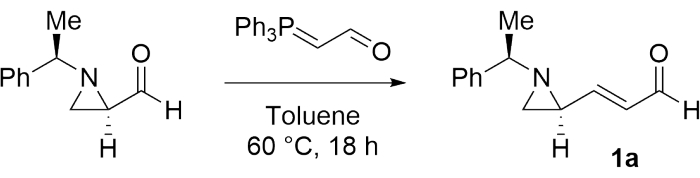
1. 3-(aziridin-2-il)akrilik aldehit sentezi (1a)
- Vakum koşullarında bir karıştırıcı çubuğu ve bir septum ile donatılmış 50 mL yuvarlak tabanlı bir şişeyi alevle kurutun. Argon gazı ile doldururken oda sıcaklığına soğutun.
- Şişeye susuz toluen (19 mL) ve (R)-1-(R)-1-feniletil)aziridin-2-karbaldehit (1.00 g, 5.71 mmol) ekleyin (bkz. Ardından, çözeltiyi 1 dakika karıştırın.
- Karıştırılan çözeltiye (triphenilfosforanyanidene) asetaldehit (2.08 g, 6.85 mmol) ekleyin (bakınız Malzeme Tablosu).
- Reaksiyon karışımını 60 °C'de 18 saat ısıtın. Daha sonra, reaksiyon karışımını oda sıcaklığına soğutun ve uçucu çözücüyü düşük basınç altında reaksiyon karışımından çıkarın.
- Etil asetat:hekzanlar (1:6 v/v, Rf = 0.25) kullanarak TLC ile reaksiyon ilerlemesini izleyin.
- Ham ürünü, saf ürün 1a'yı (bakınız Ek Dosya 1) sarı bir sıvı olarak izole etmek için gerekli olan etil asetat: hekzanlar (1: 6 v / v) ile silika jel flaş kromatografisi ile saflaştırın.
- Ürünü NMR ve polarimetre ölçümleriyle onaylayın (ölçüm yöntemleri için 8. ve 9. adımlara bakın).
2. Bitişik bisaziridin sentezi (2a)
- 50 mL'lik yuvarlak tabanlı bir şişeyi, bir karıştırıcı çubuğu ve bir septum ile vakum koşullarında alevle kurutun. Argon gazı ile doldururken oda sıcaklığına soğutun.
- Şişeye susuz etil asetat (3 mL) ve 1a (adım 1.6, 201 mg, 1.0 mmol) ekleyin ve ardından çözeltiyi 1 dakika karıştırın.
- Katalizör (S)-2-(difenil((trimetilsilil)oksi)metil)pirrolidin (BS, bakınız Malzeme Tablosu) (0.02 mL, 7 mol) karışıma ekleyin ve oda sıcaklığında 30 dakika karıştırın.
- Reaksiyon karışımına 316 mg, 1.10 mmol tert-bütil tosiloksikarbamat (BocNHOT'lar, Malzeme Tablosuna bakınız) ve 123 mg, 1.50 mmol sodyum asetat ekleyin ve 24 saat karıştırın.
- Dietil eter:hekzanlar (1:4 v/v, Rf = 0.27) kullanarak TLC ile reaksiyon ilerlemesini izleyin.
- Reaksiyon karışımını bir ayırma hunisinde etil asetat (3 x 50 mL) ile ekstrakte edin.
- Kombine organik tabakayı susuz Na2SO4 üzerinde kurutun, filtreleyin ve vakumda konsantre edin.
- Elde edilen ham ürünü, saf ürün 2a'yı sarı bir sıvı olarak izole etmek için elüent olarak dietil eter:hekzanlar (1:4 v/v) ile silika jel üzerinde flaş kromatografisi ile saflaştırın (bakınız Ek Dosya 1).
- Ürünü NMR ve polarimetre ölçümleriyle onaylayın (bkz. adım 8 ve 9).
3. Bileşik 3'ün sentezi
- 50 mL'lik yuvarlak tabanlı bir şişeyi, bir karıştırıcı çubuğu ve bir septum ile vakum koşullarında alevle kurutun. Argon gazı ile doldururken oda sıcaklığına soğutun.
- Şişeye susuz metanol (11 mL) ve aldehit 2a (adım 2.8, 1.00 g, 3.16 mmol) [veya 2b (1.17 g, 3.16 mmol, Ek Dosya 1'e bakınız)] ekleyin ve ardından çözeltiyi bir dakika karıştırın.
- Karıştırılmış çözeltiye NaBH4 (95 mg, 2.53 mmol) ekleyin.
- Reaksiyon karışımını 0 °C'de 1 saat boyunca karıştırın.
- Etil asetat:hekzanlar (1:4 v/v, Rf = 0.27) kullanarak TLC ile reaksiyon ilerlemesini izleyin.
- 1 saat sonra, reaksiyon karışımını damıtılmış suyla söndürün ve bir ayırma hunisinde etil asetat (3 x 50 mL) ile ekstrakte edin.
- Kombine organik tabakayı susuz Na2SO4 üzerinde kurutun, filtreleyin ve vakumda konsantre edin.
- Ham kalıntıyı silika jel flaş kromatografisi ile etil asetat:hekzanlar (1:4 v/v) ile saflaştırın ve saf ürünler 3a [veya 3b] (bakınız Ek Dosya 1) sarı bir sıvı olarak izole etmek için gerekli olan etil asetat:hekzanlar (1:4 v/v).
- Ürünü NMR ve polarimetre ölçümleriyle onaylayın (bkz. adım 8 ve 9).
4. Bileşik 4'ün sentezi
- 50 mL'lik yuvarlak tabanlı bir şişeyi, bir karıştırıcı çubuğu ve bir septum ile vakum koşullarında alevle kurutun. Argon gazı ile doldururken oda sıcaklığına soğutun.
- Şişeye susuz diklorometan (11 mL) ve alkol 3a (adım 3.8, 1.00 g, 3.14 mmol) [veya 3b (1.17 g, 3.14 mmol)] ekleyin ve ardından çözeltiyi bir dakika karıştırın.
- Karıştırılmış çözeltiye tert-bütildimetilsilil klorür (TBSCl, 520 mg, 3.45 mmol) ve imidazol (427 mg, 6.28 mmol) ekleyin (bkz.
- Reaksiyon karışımını 0 °C'de 18 saat boyunca karıştırın.
- Bir elüent olarak etil asetat:hekzanlar (1:4 v/v, Rf = 0.26) kullanarak TLC ile reaksiyon ilerlemesini izleyin.
- 18 saat sonra, reaksiyon karışımını deiyonize su ile söndürün ve bir ayırma hunisinde metilen klorür (3 x 50 mL) ile ekstrakte edin.
- Kombine organik tabakayı susuz sodyum sülfat üzerinde kurutun, filtreleyin ve ardından düşük basınç altında konsantre edin.
- Ham kalıntıyı, saf ürünler 4a [veya 4b] 'yi (bakınız Ek Dosya 1) sarı bir sıvı olarak izole etmek için etil asetat: hekzanlar (1: 4 v / v) ile silika jel flaş kromatografisi ile saflaştırın.
- Ürünü NMR ve polarimetre ölçümleri ile onaylayın.
5. Aktif olmayan aziridinlerin seçici halka açılması: 5d'nin sentezi
- 50 mL'lik yuvarlak tabanlı bir şişeyi, bir karıştırıcı çubuğu ve bir septum ile vakum koşullarında alevle kurutun. Argon gazı ile doldururken oda sıcaklığına soğutun.
- Şişeye 3b (adım 4.2, 100 mg, 0.27 mmol) ve asetik asit (0.12 mL, 2.14 mmol) ekleyin ve ardından karışımı oda sıcaklığında 5 saat karıştırın.
- Etil asetat:hekzanlar (2:3 v/v, Rf = 0,28) kullanarak TLC ile reaksiyon ilerlemesini izleyin.
- 5 saat sonra, asetik asidi vakumda çıkarın.
- Ham kalıntıyı silika jel flaş kromatografisi ile etil asetat: hekzanlar (2: 3 v / v) ile saflaştırın, saf ürün 5d'yi izole etmek için gerekli olan olarak ( Ek Dosya 1'e bakınız) sarı bir sıvı olarak.
- Ürünü NMR ve polarimetre ölçümleri ile onaylayın.
6. Aktif aziridinlerin seçici halka açılması: 5f sentezi
- 50 mL'lik yuvarlak tabanlı bir şişeyi, bir karıştırıcı çubuğu ve bir septum ile vakum koşullarında alevle kurutun. Argon gazı ile doldururken oda sıcaklığına soğutun.
- Şişeye susuz metanol (8 mL) ve 4b (adım 4.8, 100 mg, 0.21 mmol) ekleyin ve ardından çözeltiyi 1 dakika karıştırın.
- Yukarıdaki çözeltiye H2 O'da (1 mL) NaN3 (39 mg, 0.6 mmol) ve NH4 Cl (21mg, 0.41 mmol) ekleyin.
- Reaksiyon karışımını 0 °C'de 4 saat boyunca karıştırın.
- Etil asetat:hekzanlar (1:4 v/v, Rf = 0.30) kullanarak TLC ile reaksiyon ilerlemesini izleyin.
- 4 saat sonra, reaksiyon karışımınıH2O ile söndürün ve bir ayırma hunisinde etil asetat (3 x 50 mL) ile ekstrakte edin.
- Kombine organik tabakayı susuz Na2SO4 üzerinde kurutun, filtreleyin ve vakumda konsantre edin.
- Ham kalıntıyı silika jel flaş kromatografisi ile etil asetat: hekzanlar (1: 4 v / v) ile saflaştırın, saf ürün 5f'yi izole etmek için elüent olarak (Ek Dosya 1'e bakınız) sarı bir sıvı olarak.
- Ürünü NMR ve polarimetre ölçümleri ile onaylayın.
7. Bitişik aziridinlerin Pd katalizörlü hidrojenasyonu: 5h sentezi
- 50 mL'lik yuvarlak tabanlı bir şişeyi, bir karıştırıcı çubuğu ve bir septum ile vakum koşullarında alevle kurutun. Argon gazı ile doldururken oda sıcaklığına soğutun.
- Şişeye susuz metanol (5 mL), 2b (adım 3.2, 100 mg, 0.27 mmol), Boc 2 O (70 mg, 0.32 mmol) ve% 20 Pd (OH)2/ C (37 mg) ekleyin.
- Karışımı H2 atmosferi altında (balon, 1 atm) oda sıcaklığında12 saat boyunca karıştırın.
- Etil asetat:hekzanlar (2:3 v/v, Rf = 0.29) kullanarak TLC ile reaksiyon ilerlemesini izleyin.
- Reaksiyon karışımını piyasada bulunan bir kalit pedden süzün (Malzeme Tablosuna bakınız) ve metanol ile yıkayın.
- Filtreyi vakumda buharlaştırın ve saf ürün 5h'yi renksiz bir sıvı olarak izole etmek için etil asetat: hekzanlar (2: 3 v / v) ile silika jel flaş kromatografisi ile kalıntıyı saflaştırın (Ek Dosya 1'e bakınız).
- Ürünü NMR ve polarimetre ölçümleri ile onaylayın.
8. Polarimetre analizi
- Ölçülecek numunenin uygun bir miktarını (~ 100 mg) hazırlayın.
- Hazırlanan numuneyi CHCl3'te (c 0.05-1.00) çözün.
- Numune çözeltisini numune odasına aktararak hava kabarcığı olmadığından emin olun
[ø = 1,8 mm, l = 10-1 m]. - Numune odasını polarimetre cihazına yükleyin ( bkz. Malzeme Tablosu) ve odanın yönünü kontrol edin.
- 'Kontrol' bölümünde 0'ı sıfır net olarak ayarlayın.
- Boşluk için CHCl3'ün spesifik dönüşünü ölçün.
NOT: Işık kaynağı: Na; λ = 589 nm; D.I.T: 5 sn; çevrim süreleri: 5; döngü aralığı: 5 s; sıcaklık: 20 °C. - Numune çözeltisinin spesifik dönüşünü sabit bir sıcaklıkta ölçün.
NOT: Işık kaynağı: Na; λ = 589 nm; D.I.T: 5 sn; çevrim süreleri: 5; döngü aralığı: 5 s; sıcaklık: 20 °C. - Ortalama değeri elde etmek için numune çözeltisinin spesifik dönüşünü aynı şekilde üç kez ölçün.
- Aşağıdaki denklem27'yi kullanarak belirli dönüşü hesaplayın:
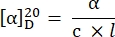
α = gözlenen rotasyon (derece), c = konsantrasyon (g / mL), l = yol uzunluğu (10-1 m).
9. 1H ve 13C NMR analizi
- Yaklaşık 0.6-1.0 mL NMR çözücü (CDCl3) hazırlayın.
- Çözücü içinde ~50 mg numuneyi, 1H NMR için 0,02 M ve 13C NMR ölçümleri için 0,05 M konsantrasyonda çözün.
- Pasteur pipet kullanarak numune solüsyonunu bir NMR tüpüne aktarın.
- Tüpü NMR cihazına yükleyin (bkz.
NOT: NMR ölçümleri 400 MHz veya 500 MHz spektrometreler kullanılarak gerçekleştirilmiştir. Spin numarası: 16 (1H NMR), 256 veya 512 (13C NMR); ölçüm süresi: 10 dakika (1H NMR), 20 veya 30 dakika (13C NMR)]. - NMR spektrumlarını kaydedin ve verileri analiz edin.
NOT: Spektrumun kimyasal kaymasını CDCl3 sinyaline referans alın [δ (1H NMR spektrumu) = 7.26 ppm; δ (13C NMR spektrumu) = 77.0 ppm)].
Sonuçlar
Bitişik bir bisaziridin hazırlamanın elde edilebilirliğini araştırmak için, (E)-3-((S)-1-(R)-1-feniletil)aziridin-2-il)akrilaldehit (1a) ilk olarak adım 1'de belirtilen prosedüre göre bir model substrat olarak sentezlenmiştir (Şekil 1)28.
...
Tartışmalar
Ayrılamaz bir diastereomer karışımının oluşumu, nitrojen kaynağı olarak N-Boc-O-tosyl veya N-Ts-O-tosyl hidroksilamin kullanıldığında, kiral 3-[1-(1-feniletil)aziridin-2-yl)]akrilaldehitin organokatalitik aziridinasyonu sırasında zaman zaman gözlenmiştir. Ayrıca, katalizör olarak diaril silil eter prolinol miktarı %7 mol'den %20 mol'e 47,48,49'a çıkarıldığında bitişik bisaziridin ürünün?...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu araştırma, Eğitim Bakanlığı tarafından finanse edilen Kore Temel Bilim Enstitüsü (Ulusal Araştırma Tesisleri ve Ekipman Merkezi) hibesi (2022R1A6C101A751) tarafından desteklenmiştir. Bu çalışma aynı zamanda Kore Ulusal Araştırma Vakfı (NRF) hibeleri (2020R1A2C1007102 ve 2021R1A5A6002803) tarafından da desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (R)-(+)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677191 | reagent |
| (R)-1-((R)-1-phenylethyl)aziridine-2-carbaldehyde | Imagene Co.,Ltd. | reagent | |
| (S)-(–)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677183 | reagent |
| (S)-2-(diphenyl((trim ethylsilyl)oxy)methyl)pyrrolidine | Sigma-Aldrich | 677183 | reagent |
| (Triphenylphosphoranylidene) acetaldehyde | Sigma-Aldrich | 280933 | reagent |
| 1,2-Dichloroethane | Sigma-Aldrich | 284505 | solvent |
| AB Sciex 4800 Plus MALDI TOFTM (2,5-dihydroxybenzoic acid (DHB) matrix | Sciex | High resolution mass spectra | |
| Acetic acid | Sigma-Aldrich | A6283 | reagent |
| Ammonium chloride | Sigma-Aldrich | 254134 | reagent |
| aniline | Sigma-Aldrich | 132934 | reagent |
| Autopol III digital polarimeter | Rudolph Research Analytical | polarimeter | |
| AVANCE III HD (400 MHz) spectrometer | Bruker | NMR spectrometer | |
| Bruker Ascend 500 (500 MHz) | Bruker | NMR spectrometer | |
| Celite 535 | Sigma-Aldrich | 22138 | For Celite pad |
| Dichloromethane | Sigma-Aldrich | 270997 | solvent |
| Di-tert-butyl dicarbonate | Sigma-Aldrich | 361941 | reagent |
| Ethyl Acetate | Sigma-Aldrich | 270989 | solvent |
| Ethyl nitroacetate | Sigma-Aldrich | 192333 | reagent |
| Imidazole | Sigma-Aldrich | I2399 | reagent |
| INOVA 400WB (400 MHz) | Varian | NMR spectrometer | |
| JMS-700 | JEOL | High resolution mass spectra | |
| Methanol | Sigma-Aldrich | 322415 | solvent |
| N-Boc-O-tosylhydroxylamine | Sigma-Aldrich | 775037 | reagent |
| P-2000 | JASCO | polarimeter | |
| Palladium hydroxide on carbon | Sigma-Aldrich | 212911 | reagent |
| Phenyl-1H-tetrazole-5-thiol | TCI | P0640 | reagent |
| Silica gel | Sigma-Aldrich | 227196 | For flash clromatography |
| Silica gel on TLC plates | Merck | 60768 | TLC plate |
| Sodium acetate | Sigma-Aldrich | S8750 | reagent |
| Sodium azide | Sigma-Aldrich | S2002 | reagent |
| Sodium borohydride | Sigma-Aldrich | 452882 | reagent |
| Sodium carbonate | Sigma-Aldrich | S2127 | reagent |
| tert-Butyldimethylsilyl chloride | Sigma-Aldrich | 190500 | reagent |
| Tetrahydrofuran | Sigma-Aldrich | 401757 | solvent |
| Toluene | Sigma-Aldrich | 244511 | solvent |
| Zinc bromide | Sigma-Aldrich | 230022 | reagent |
| Zinc chloride | Sigma-Aldrich | 429430 | reagent |
Referanslar
- Anastas, P. T., Warner, J. C. Principles of green chemistry. Green Chemistry: Theory and Practice. 29, (1998).
- Sheldon, R. A., Arends, I. W. C. E., Hanefeld, U. . Green Chemistry and Catalysis. , (2007).
- Trost, B. M. The atom economy-a search for synthetic efficiency. Science. 254 (5037), 1471-1477 (1991).
- Sheldon, R. A. The E factor: fifteen years on. Green Chemistry. 9 (12), 1273-1283 (2007).
- Li, C. J., Trost, B. M. Green chemistry for chemical synthesis. Proceedings of the National Academy of Sciences. 105 (36), 13197-13202 (2008).
- Sheldon, R. A. Fundamentals of green chemistry: efficiency in reaction design. Chemical Society Reviews. 41 (4), 1437-1451 (2012).
- Marion, P., et al. Sustainable chemistry: how to produce better and more from less. Green Chemistry. 19 (21), 4973-4989 (2017).
- Sheldon, R. A. The E factor 25 years on: the rise of green chemistry and sustainability. Green Chemistry. 19 (1), 18-43 (2017).
- Dembitsky, V. M., Terent'ev, A. O., Levitsky, D. O. Aziridine alkaloids: origin, chemistry and activity. Natural Products. , 977-1006 (2013).
- Ham, G. E. Activated aziridines. I. Reaction of anilines with O-ethyl-N,N-ethyleneurethane. mechanism and Hammett ρ-constant. Journal of Organic Chemistry. 29 (10), 3052-3055 (1964).
- Tanner, D. Chiral aziridine-their synthesis and use in stereoselective transformations. Angewandte Chemie International Edition. 33 (6), 599-619 (1994).
- Atkinson, R. S. 3-Acetoxyaminoquinazolinones (QNHOAc) as aziridinating agents: ring-opening of N-(Q)-substituted aziridines. Tetrahedron. 55 (6), 1519-1559 (1999).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Lu, P. Recent developments in regioselective ring opening of aziridines. Tetrahedron. 14 (66), 2549-2560 (2010).
- Ohno, H. Synthesis and applications of vinylaziridines and ethynylaziridines. Chemical Reviews. 114 (16), 7784-7814 (2014).
- Callebaut, G., Meiresonne, T., De Kimpe, N., Mangelinckx, S. Synthesis and reactivity of 2-(carboxymethyl) aziridine derivatives. Chemical Reviews. 114 (16), 7954-8015 (2014).
- Ghosal, N. C., et al. Organocatalysis by an aprotic imidazolium zwitterion: Regioselective ring-opening of aziridines and applicable to gram scale synthesis. Green Chemistry. 18 (2), 565-574 (2016).
- Rai, V. K., Rai, P. K., Bajaj, S., Kumar, A. An unprecedented synthesis of γ-lactams via mercaptoacetylation of aziridines in water. Green Chemistry. 13 (5), 1217-1223 (2011).
- Srivastava, V. P., Yadav, L. D. S. The first example of ring expansion of N-tosylaziridines to 2-aroyl-N-tosylazetidines with nitrogen ylides in an aqueous medium. Green Chemistry. 12 (8), 1460-1465 (2010).
- Stanković, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Ha, H. J., Jung, J. H., Lee, W. K. Application of regio-and stereoselective functional group transformations of chiral aziridine-2-carboxylates. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- D'hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-membered Heterocycles by Ring Expansion: Aza-, Oxa- and Thiaheterocyclic Small-Ring Systems. 1st ed. , (2016).
- Macha, L., Ha, H. -. J. Total synthesis and absolute stereochemical assignment of microgrewiapine A and its stereoisomers. Journal of Organic Chemistry. 84 (1), 94-103 (2019).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Głowacka, I. E., Trocha, A., Wróblewski, A. E., Piotrowska, D. G. N-(1-Phenylethyl) aziridine-2-carboxylate esters in the synthesis of biologically relevant compounds. Beilstein Journal of Organic Chemistry. 15 (1), 1722-1757 (2019).
- JoVE. Organic Chemistry II. Polarimeter. JoVE Science Education Database. , (2022).
- Mao, H., et al. Preparation of chiral contiguous epoxyaziridines and their regioselective ring-opening for drug syntheses. Chemistry-A European Journal. 24 (10), 2370-2374 (2018).
- Vesely, J., Ibrahem, I., Zhao, G. L., Rios, R., Córdova, A. Organocatalytic enantioselective aziridination of α,β-unsaturated aldehydes. Angewandte Chemie International Edition. 11 (46), 778-781 (2007).
- Arai, H., et al. Enantioselective aziridination reaction of α,β-unsaturated aldehydes using an organocatalyst and tert-butyl N-arenesulfonyloxycarbamates. Tetrahedron Letters. 50 (26), 3329-3332 (2009).
- Desmarchelier, A., et al. Organocatalyzed aziridination of α-branched enals: enantioselective synthesis of aziridines with a quaternary stereocenter. European Journal of Organic Chemistry. 20 (2011), 4046-4052 (2011).
- Jiang, H., Halskov, K. S., Johansen, T. K., Jørgensen, K. A. Deracemization of axially chiral α,β-unsaturated aldehydes through an amino-catalyzed symmetry-making-symmetry-breaking cascade. Chemistry-A European Journal. 17 (14), 3842-3846 (2011).
- Deiana, L., et al. Catalytic asymmetric aziridination of α,β-unsaturated aldehydes. Chemistry-A European Journal. 17 (28), 7904-7917 (2011).
- Molnár, I. G., Tanzer, E. M., Daniliuc, C., Gilmour, R. Enantioselective aziridination of cyclic enals facilitated by the fluorine-iminium Ion gauche effect. Chemistry-A European Journal. 20 (3), 794-800 (2014).
- Nemoto, T., et al. Enantioselective synthesis of (R)-Sumanirole using organocatalytic asymmetric aziridination of an α,β-unsaturated aldehyde. Tetrahedron: Asymmetry. 25 (15), 1133-1137 (2014).
- Sim, T. B., et al. A novel synthesis of 5-functionalized oxazolidin-2-ones from enantiomerically pure 2-substituted N-[(R)-(+)-α-methylbenzyl] aziridines. Journal of Organic Chemistry. 68 (1), 104-108 (2003).
- Silva, M. A., Goodman, J. M. Aziridinium ring opening: a simple ionic reaction pathway with sequential transition states. Tetrahedron Letters. 46 (12), 2067-2069 (2005).
- Yun, S. Y., et al. Nucleophile-dependent regioselective ring opening of 2-substituted N,N-dibenzylaziridinium ions: bromide versus hydride. Chemical Communications. (18), 2508-2510 (2009).
- Dolfen, J., et al. Bicyclic aziridinium ions in azaheterocyclic chemistry-preparation and synthetic application of 1-azoniabicyclo [n. 1.0] alkanes. Advanced Synthesis & Catalysis. 358 (22), 3485-3511 (2016).
- D'hooghe, M., et al. Systematic study of halide-induced ring opening of 2-substituted aziridinium salts and theoretical rationalization of the reaction pathways. European Journal of Organic Chemistry. 2010 (25), 4920-4931 (2010).
- Boydas, E. B., et al. Theoretical insight into the regioselective ring-expansions of bicyclic aziridinium ions. Organic & Biomolecular Chemistry. 16 (5), 796-806 (2018).
- Lee, B. K., et al. An efficient synthesis of chiral terminal 1, 2-diamines using an enantiomerically pure [1-(1′ R)-methylbenzyl] aziridine-2-yl] methanol. Tetrahedron. 62 (35), 8393-8397 (2006).
- Ha, H. J., et al. Addition of 1-Boc-2-tert-butyldimethylsilyloxypyrrole to N-methyleneamine equivalents: synthesis of 1-Boc-5-aminomehtyl-2,5-dihydropyrrole-2-ones and 1-Boc-2-oxo-1,7,9-triazaspiro[4,5]-dec-3-ene. Heterocycles. 50 (1), 203-214 (1999).
- Laughlin, R. G. The basicity of aliphatic sulfonamides. Journal of the American Chemical Society. 89 (17), 4268-4271 (1967).
- Moreira, J. A., Rosa da Costa, A. M., García-Río, L., Pessêgo, M. Equilibrium constants and protonation site for N-methylbenzenesulfonamides. Beilstein Journal of Organic Chemistry. 7 (1), 1732-1738 (2011).
- Song, K., et al. Highly active ruthenium metathesis catalysts enabling ring-opening metathesis polymerization of cyclopentadiene at low temperatures. Nature Communications. 10, 3860 (2019).
- Fukuta, Y., et al. De novo synthesis of Tamiflu via a catalytic asymmetric ring-opening of meso-aziridines with TMSN3. Journal of the American Chemical Society. 128 (19), 6312-6313 (2006).
- Jiang, H., et al. Intramolecular radical aziridination of allylic sulfamoyl azides by cobalt (II)-based metalloradical catalysis: effective construction of strained heterobicyclic structures. Angewandte Chemie International Edition. 55 (38), 11604-11608 (2016).
- Righi, G., Bovicelli, P., Barontini, M., Tirotta, I. Dimethyl carbonate in the regio-and stereocontrolled opening of three-membered heterocyclic rings. Green Chemistry. 14 (2), 495-502 (2012).
- Righi, P., et al. Solution- and solid-phase synthesis of 4-hydroxy-4,5-dihydroisoxazole derivatives from enantiomerically pure N-tosyl-2,3-aziridine alcohols. Organic Letters. 4 (4), 497-500 (2002).
- Yadav, N. N., Choi, J., Ha, H. -. J. One-pot multiple reactions: asymmetric synthesis of 2, 6-cis-disubstituted piperidine alkaloids from chiral aziridine. Organic & Biomolecular Chemistry. 14 (27), 6426-6434 (2016).
- Rhee, H. J., et al. Preparation and utilization of contiguous bisaziridines as chiral building blocks. Advanced Synthesis & Catalysis. 363 (13), 3250-3257 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır