É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de bisaziridinas contíguas para reações regiosseletivas de abertura de anéis
Neste Artigo
Resumo
As bisaziridinas contíguas contendo aziridinas não ativadas e ativadas foram sintetizadas por aziridinas organocatalíticas assimétricas e, em seguida, submetidas a reações quimiosseletivas de abertura de anéis em condições ácidas ou básicas. O anel de aziridina não ativado se abre com nucleófilos menos reativos sob condições ácidas, enquanto o anel de aziridina ativado se abre com nucleófilos mais reativos em condições básicas.
Resumo
As aziridinas, uma classe de moléculas orgânicas reativas contendo um anel de três membros, são síntons importantes para a síntese de uma grande variedade de compostos alvo funcionalizados contendo nitrogênio através da abertura regiocontrolada do anel de aziriminas substituídas por C. Apesar do tremendo progresso na síntese de aziridina na última década, o acesso eficiente a bisaziridinas contíguas permanece difícil. Portanto, estávamos interessados em sintetizar bisaziridinas contíguas com um conjunto eletronicamente diversificado de N-substituintes além da espinha dorsal única da aziridina para reações regiosseletivas de abertura de anel com diversos nucleófilos. Neste estudo, bisaziridinas quirais contíguas foram preparadas por aziridinação assimétrica organocatalítica de quiraldeído (E)-3-((S)-1-((R)-1-feniletil)aziridina-2-il)acrilaldeído com N-Ts-O-tosyl ou N-Boc-O-tosyl hidroxilamina como fonte de nitrogênio na presença de (2 S)-[difenil(trimetilsililo)metil]pirrolidina como organocatalisador quiral. Também são demonstrados aqui exemplos representativos de reações regiosseletivas de abertura de anéis de bisaziridinas contíguas com uma variedade de nucleófilos, como enxofre, nitrogênio, carbono e oxigênio, e a aplicação de bisaziridinas contíguas à síntese de pirrolidinas quirais multi-substituídas por hidrogenação catalisada por Pd.
Introdução
O projeto racional de pequenas moléculas orgânicas com diversos sítios reativos que controlam com precisão a seletividade do produto é um objetivo fundamental na síntese orgânica moderna e na química verde 1,2,3,4,5,6,7,8. Para atingir esse objetivo, estávamos interessados na síntese modular de aziridinas. As aziridinas são de interesse para a maioria dos químicos orgânicos, devido à sua estrutura estruturalmente importante9 com um conjunto eletronicamente diversificado de N-substituintes que podem levar a reações regiosseletivas de abertura de anel com múltiplos nucleófilos 10,11,12,13,14,15,16,17,18, 19, e atividades farmacológicas variadas, como propriedades antitumorais, antimicrobianas e antibacterianas. Apesar dos avanços na química da aziridina, a aziridina não ativada e a aziridina ativada têm sínteses independentes e reações de abertura de anéis na literatura20.
Portanto, nosso objetivo foi sintetizar bisaziridinas contíguas compreendendo tanto as aziridinas não ativadas quanto as ativadas. Essas bisaziridinas contíguas podem ser usadas para racionalizar sistematicamente um padrão quimiosseletivo de abertura de anel com base nas seguintes propriedades eletrônicas das duas aziridinas diferentes e sua reatividade aos nucleófilos 20,21,22,23,24: a) aziridinas ativadas, nas quais os substituintes retiradores de elétrons estabilizam conjugativamente a carga negativa sobre o nitrogênio, reagem prontamente com múltiplos nucleófilos a permitir produtos abertos por anel; b) aziridinas não ativadas, nas quais o nitrogênio está ligado aos substituintes doadores de elétrons, são consideravelmente inertes em relação aos nucleófilos; portanto, uma etapa de pré-ativação com um ativador adequado (principalmente ácidos de Brønsted ou Lewis) é necessária para fornecer os produtos abertos em anel em altos rendimentos20,21,25,26.
O presente estudo descreve o desenho racional de bisaziridinas contíguas como blocos de construção quirais via organocatálise livre de metais de transição e a síntese de diversas moléculas ricas em nitrogênio utilizando ferramentas de modelagem preditiva para reações de abertura de anéis de bisaziridinas. Este estudo tem como objetivo estimular o avanço de métodos práticos para a construção de compostos bioativos enriquecidos com nitrogênio e produtos naturais e a polimerização de aziridinas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Os detalhes de todos os produtos sintetizados (1-5), incluindo a estrutura, espectros completos de RMN, pureza óptica e dados HRMS-MALDI, são fornecidos no Arquivo Suplementar 1.
1. Síntese de aldeído 3-(aziridina-2-il)acrilo (1a)
- Secar em chamas um balão de fundo redondo de 50 ml equipado com uma barra de agitação e um septo em condições de vácuo. Arrefeça-o à temperatura ambiente enquanto o enche com gás argónio.
- Adicionar tolueno anidro (19 ml) e (R)-1-((R)-1-feniletil)aziridina-2-carbaldeído (1,00 g, 5,71 mmol) (ver Tabela de materiais) ao balão. Em seguida, mexa a solução por 1 min.
- Adicionar (trifenilfosforanidelídeo)acetaldeído (2,08 g, 6,85 mmol) (ver Tabela de Materiais) à solução agitada.
- Aquecer a mistura de reacção a 60 °C durante 18 h. Em seguida, resfrie a mistura de reação à temperatura ambiente e remova o solvente volátil da mistura de reação sob pressão reduzida.
- Monitore o progresso da reação por TLC usando acetato de etila:hexanos (1:6 v/v, Rf = 0,25) como eluente.
- Purificar o produto bruto por cromatografia flash em sílica gel com acetato de etilo:hexanos (1:6 v/v) como o eluente para isolar o produto puro 1a (ver processo suplementar 1) como um líquido amarelo.
- Confirme o produto por medições de RMN e polarímetro (consulte as etapas 8 e 9 para métodos de medição).
2. Síntese de bisaziridina contígua (2a)
- Secar em chamas um balão de fundo redondo de 50 ml com uma barra agitadora e um septo em condições de vácuo. Arrefeça-o à temperatura ambiente enquanto o enche com gás argónio.
- Adicionar acetato de etilo anidro (3 ml) e 1a (passo 1,6, 201 mg, 1,0 mmol) ao balão e, em seguida, agitar a solução durante 1 min.
- Adicionar catalisador (S)-2-(difenil((trimetilsilil)oxi)metil)pirrolidina (BS, ver Tabela de Materiais) (0,02 ml, 7 mol%) à mistura e agitar à temperatura ambiente durante 30 min.
- Adicionar 316 mg, 1,10 mmol de terc-butiloxicarbamato (BocNHOTs, ver Tabela de Materiais) e 123 mg, 1,50 mmol de acetato de sódio à mistura de reacção e agitar durante 24 h.
- Monitore o progresso da reação por TLC usando éter dietílico:hexanos (1:4 v/v, Rf = 0,27) como um eluente.
- Extrair a mistura de reacção com acetato de etilo (3 x 50 ml) num funil separador.
- Seque a camada orgânica combinada sobre a anidra Na2SO4, filtre e concentre-se em vácuo.
- Purificar o produto bruto resultante por cromatografia flash em sílica gel com éter dietílico:hexanos (1:4 v/v) como eluente para isolar o produto puro 2a (ver processo suplementar 1) como um líquido amarelo.
- Confirme o produto por medições de RMN e polarímetro (ver passos 8 e 9).
3. Síntese do composto 3
- Secar em chamas um balão de fundo redondo de 50 ml com uma barra agitadora e um septo em condições de vácuo. Arrefeça-o à temperatura ambiente enquanto o enche com gás argónio.
- Adicionar metanol anidro (11 ml) e aldeído 2a (passo 2,8, 1,00 g, 3,16 mmol) [ou 2b (1,17 g, 3,16 mmol, ver processo suplementar 1)] ao balão e, em seguida, agitar a solução durante um minuto.
- Adicionar NaBH4 (95 mg, 2,53 mmol) à solução agitada.
- Agitar a mistura de reacção a 0 °C durante 1 h.
- Monitore o progresso da reação por TLC usando acetato de etila:hexanos (1:4 v/v, Rf = 0,27) como eluente.
- Após 1 h, extinguir a mistura de reação com água destilada e extrair com acetato de etila (3 x 50 mL) em um funil separador.
- Seque a camada orgânica combinada sobre a anidra Na2SO4, filtre e concentre-se em vácuo.
- Purificar o resíduo bruto por cromatografia flash em sílica gel com acetato de etilo:hexanos (1:4 v/v) como o eluente para isolar produtos puros 3a [ou 3b] (ver processo suplementar 1) como um líquido amarelo.
- Confirme o produto por medições de RMN e polarímetro (ver passos 8 e 9).
4. Síntese do composto 4
- Secar em chamas um balão de fundo redondo de 50 ml com uma barra agitadora e um septo em condições de vácuo. Arrefeça-o à temperatura ambiente enquanto o enche com gás argónio.
- Adicionar diclorometano anidro (11 ml) e álcool 3a (passo 3,8, 1,00 g, 3,14 mmol) [ou 3b (1,17 g, 3,14 mmol)] ao balão e, em seguida, agitar a solução durante um minuto.
- Adicionar cloreto de terc-butildimetilsililo (TBSCl, 520 mg, 3,45 mmol) e imidazol (427 mg, 6,28 mmol) à solução agitada.
- Agitar a mistura de reacção a 0 °C durante 18 h.
- Monitore o progresso da reação por TLC usando acetato de etila:hexanos (1:4 v/v, Rf = 0,26) como eluente.
- Após 18 h, extinguir a mistura de reação com água deionizada e extrair com cloreto de metileno (3 x 50 mL) em um funil separatório.
- Seque a camada orgânica combinada sobre o sulfato de sódio anidro, filtre e concentre sob pressão reduzida.
- Purificar o resíduo bruto por cromatografia flash de sílica gel com acetato de etilo:hexanos (1:4 v/v) como o eluente para isolar produtos puros 4a [ou 4b] (ver processo suplementar 1) como um líquido amarelo.
- Confirme o produto por medições de RMN e polarímetro.
5. Abertura seletiva do anel de aziridinas não ativadas: Síntese de 5d
- Secar em chamas um balão de fundo redondo de 50 ml com uma barra agitadora e um septo em condições de vácuo. Arrefeça-o à temperatura ambiente enquanto o enche com gás argónio.
- Adicionar 3b (passo 4,2, 100 mg, 0,27 mmol) e ácido acético (0,12 ml, 2,14 mmol) ao balão e, em seguida, agitar a mistura à temperatura ambiente durante 5 h.
- Monitore o progresso da reação por TLC usando acetato de etila:hexanos (2:3 v/v, Rf = 0,28) como eluente.
- Após 5 h, retire o ácido acético no vacuo.
- Purificar o resíduo bruto por cromatografia flash de sílica gel com acetato de etilo:hexanos (2:3 v/v) como eluente para isolar o produto puro 5d (ver processo suplementar 1) como um líquido amarelo.
- Confirme o produto por medições de RMN e polarímetro.
6. Abertura seletiva do anel de aziridinas ativadas: Síntese de 5f
- Secar em chamas um balão de fundo redondo de 50 ml com uma barra agitadora e um septo em condições de vácuo. Arrefeça-o à temperatura ambiente enquanto o enche com gás argónio.
- Adicionar metanol anidro (8 ml) e 4b (etapa 4,8, 100 mg, 0,21 mmol) ao balão e, em seguida, agitar a solução durante 1 min.
- Adicionar NaN3 (39 mg, 0,6 mmol) e NH4Cl (21 mg, 0,41 mmol) em H2O (1 mL) à solução acima.
- Agitar a mistura de reacção a 0 °C durante 4 h.
- Monitore o progresso da reação por TLC usando acetato de etila:hexanos (1:4 v/v, Rf = 0,30) como eluente.
- Após 4 h, extinguir a mistura reaccional com H2O e extrair com acetato de etila (3 x 50 ml) num funil separador.
- Seque a camada orgânica combinada sobre a anidra Na2SO4, filtre e concentre-se em vácuo.
- Purificar o resíduo bruto por cromatografia flash em sílica gel com acetato de etilo:hexanos (1:4 v/v) como o eluente para isolar o produto puro 5f (ver processo suplementar 1) como um líquido amarelo.
- Confirme o produto por medições de RMN e polarímetro.
7. Hidrogenação catalisada por PD de aziriminas contíguas: Síntese de 5h
- Secar em chamas um balão de fundo redondo de 50 ml com uma barra agitadora e um septo em condições de vácuo. Arrefeça-o à temperatura ambiente enquanto o enche com gás argónio.
- Adicionar metanol anidro (5 mL), 2b (etapa 3,2, 100 mg, 0,27 mmol), Boc 2 O (70 mg, 0,32 mmol) e 20% de Pd(OH)2/C (37 mg) ao balão.
- Agitar a mistura sob a atmosfera de H2 (balão, 1 atm) à temperatura ambiente durante 12 h.
- Monitore o progresso da reação por TLC usando acetato de etila:hexanos (2:3 v/v, Rf = 0,29) como eluente.
- Filtre a mistura de reação através de uma almofada de celite comercialmente disponível (ver Tabela de Materiais) e lave com metanol.
- Evaporar in vacuo o filtrado e purificar o resíduo por cromatografia flash em sílica gel com acetato de etilo:hexanos (2:3 v/v) como o eluente para isolar o produto puro 5h (ver Ficheiro Suplementar 1) como um líquido incolor.
- Confirme o produto por medições de RMN e polarímetro.
8. Análise do polarímetro
- Preparar uma quantidade adequada da amostra (~100 mg) a medir.
- Dissolver a amostra preparada em CHCl3 (c 0,05-1,00).
- Transfira a solução da amostra para a câmara de amostragem, garantindo que não haja bolhas de ar
[ø = 1,8 mm, l = 10-1 m]. - Carregue a câmara de amostra no instrumento do polarímetro (ver Tabela de Materiais) e verifique a orientação da câmara.
- Defina 0 como clique em zero claro na seção 'controle'.
- Meça a rotação específica de CHCl3 para o espaço em branco.
NOTA: Fonte de luz: Na; λ = 589 nm; D.I.T: 5 s; tempos de ciclo: 5; intervalo de ciclo: 5 s; temperatura: 20 °C. - Medir a rotação específica da solução da amostra a uma temperatura constante.
NOTA: Fonte de luz: Na; λ = 589 nm; D.I.T: 5 s; tempos de ciclo: 5; intervalo de ciclo: 5 s; temperatura: 20 °C. - Medir a rotação específica da solução da amostra três vezes da mesma forma para obter o valor médio.
- Calcule a rotação específica usando a seguinte equação27:
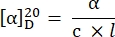
α = rotação observada (graus), c = concentração (g/mL), l = comprimento do caminho (10-1 m).
9. Análise de RMN de 1 H e 13C
- Prepare aproximadamente 0,6-1,0 mL do solvente de RMN (CDCl3).
- Dissolver ~50 mg de amostra no solvente a uma concentração de 0,02 M para RMN de 1H e 0,05 M para medições de RMN de 13C.
- Transfira a solução da amostra para um tubo de RMN utilizando uma pipeta Pasteur.
- Carregue o tubo no instrumento de RMN (ver Tabela de Materiais).
NOTA: As medições de RMN foram realizadas usando espectrômetros de 400 MHz ou 500 MHz. Número de rotação: 16 (1H NMR), 256 ou 512 (13C NMR); tempo de medição: 10 min (RMN 1H), 20 ou 30 min (RMN 13C)]. - Registre os espectros de RMN e analise os dados.
NOTA: Referenciar o deslocamento químico do espectro para o sinal CDCl3 [δ (espectro de RMN de 1H) = 7,26 ppm; δ (espectro de RMN de 13C) = 77,0 ppm)].
Access restricted. Please log in or start a trial to view this content.
Resultados
Para investigar a viabilidade do preparo de uma bisaziridina, a (E)-3-((S)-1-((R)-1-1-feniletil)aziridina-2-il)acrilaldeído (1a) foi primeiramente sintetizada como substrato modelo de acordo com o procedimento mencionado na etapa 1 (Figura 1)28.
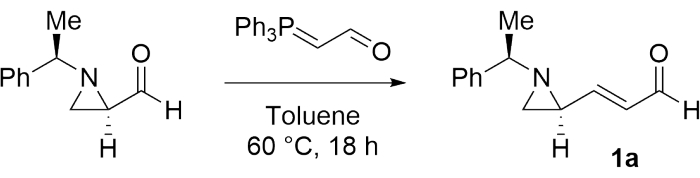
Figu...
Access restricted. Please log in or start a trial to view this content.
Discussão
A formação de uma mistura inseparável de diastereomeros tem sido ocasionalmente observada durante o curso da aziridinação organocatalítica da 3-[1-(1-(1-feniletil)aziridina-2-il)]acrilaldeído, quando N-Boc-O-tosyl ou N-Ts-O-tosyl hidroxilamina foi usada como fonte de nitrogênio. Além disso, o rendimento do produto contíguo de bisaziridina diminuiu quando a quantidade de éter silílico diaril prolinol como catalisador foi aumentada de 7 mol% para 20 mol%47,4...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi apoiada pela bolsa do Instituto de Ciências Básicas da Coreia (Centro Nacional de Instalações e Equipamentos de Pesquisa) financiada pelo Ministério da Educação (2022R1A6C101A751). Este trabalho também foi apoiado pelas bolsas da Fundação Nacional de Pesquisa da Coreia (NRF) (2020R1A2C1007102 e 2021R1A5A6002803).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| (R)-(+)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677191 | reagent |
| (R)-1-((R)-1-phenylethyl)aziridine-2-carbaldehyde | Imagene Co.,Ltd. | reagent | |
| (S)-(–)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677183 | reagent |
| (S)-2-(diphenyl((trim ethylsilyl)oxy)methyl)pyrrolidine | Sigma-Aldrich | 677183 | reagent |
| (Triphenylphosphoranylidene) acetaldehyde | Sigma-Aldrich | 280933 | reagent |
| 1,2-Dichloroethane | Sigma-Aldrich | 284505 | solvent |
| AB Sciex 4800 Plus MALDI TOFTM (2,5-dihydroxybenzoic acid (DHB) matrix | Sciex | High resolution mass spectra | |
| Acetic acid | Sigma-Aldrich | A6283 | reagent |
| Ammonium chloride | Sigma-Aldrich | 254134 | reagent |
| aniline | Sigma-Aldrich | 132934 | reagent |
| Autopol III digital polarimeter | Rudolph Research Analytical | polarimeter | |
| AVANCE III HD (400 MHz) spectrometer | Bruker | NMR spectrometer | |
| Bruker Ascend 500 (500 MHz) | Bruker | NMR spectrometer | |
| Celite 535 | Sigma-Aldrich | 22138 | For Celite pad |
| Dichloromethane | Sigma-Aldrich | 270997 | solvent |
| Di-tert-butyl dicarbonate | Sigma-Aldrich | 361941 | reagent |
| Ethyl Acetate | Sigma-Aldrich | 270989 | solvent |
| Ethyl nitroacetate | Sigma-Aldrich | 192333 | reagent |
| Imidazole | Sigma-Aldrich | I2399 | reagent |
| INOVA 400WB (400 MHz) | Varian | NMR spectrometer | |
| JMS-700 | JEOL | High resolution mass spectra | |
| Methanol | Sigma-Aldrich | 322415 | solvent |
| N-Boc-O-tosylhydroxylamine | Sigma-Aldrich | 775037 | reagent |
| P-2000 | JASCO | polarimeter | |
| Palladium hydroxide on carbon | Sigma-Aldrich | 212911 | reagent |
| Phenyl-1H-tetrazole-5-thiol | TCI | P0640 | reagent |
| Silica gel | Sigma-Aldrich | 227196 | For flash clromatography |
| Silica gel on TLC plates | Merck | 60768 | TLC plate |
| Sodium acetate | Sigma-Aldrich | S8750 | reagent |
| Sodium azide | Sigma-Aldrich | S2002 | reagent |
| Sodium borohydride | Sigma-Aldrich | 452882 | reagent |
| Sodium carbonate | Sigma-Aldrich | S2127 | reagent |
| tert-Butyldimethylsilyl chloride | Sigma-Aldrich | 190500 | reagent |
| Tetrahydrofuran | Sigma-Aldrich | 401757 | solvent |
| Toluene | Sigma-Aldrich | 244511 | solvent |
| Zinc bromide | Sigma-Aldrich | 230022 | reagent |
| Zinc chloride | Sigma-Aldrich | 429430 | reagent |
Referências
- Anastas, P. T., Warner, J. C. Principles of green chemistry. Green Chemistry: Theory and Practice. 29, Oxford University Press. (1998).
- Sheldon, R. A., Arends, I. W. C. E., Hanefeld, U. Green Chemistry and Catalysis. , Wiley. (2007).
- Trost, B. M. The atom economy-a search for synthetic efficiency. Science. 254 (5037), 1471-1477 (1991).
- Sheldon, R. A. The E factor: fifteen years on. Green Chemistry. 9 (12), 1273-1283 (2007).
- Li, C. J., Trost, B. M. Green chemistry for chemical synthesis. Proceedings of the National Academy of Sciences. 105 (36), 13197-13202 (2008).
- Sheldon, R. A. Fundamentals of green chemistry: efficiency in reaction design. Chemical Society Reviews. 41 (4), 1437-1451 (2012).
- Marion, P., et al. Sustainable chemistry: how to produce better and more from less. Green Chemistry. 19 (21), 4973-4989 (2017).
- Sheldon, R. A. The E factor 25 years on: the rise of green chemistry and sustainability. Green Chemistry. 19 (1), 18-43 (2017).
- Dembitsky, V. M., Terent'ev, A. O., Levitsky, D. O. Aziridine alkaloids: origin, chemistry and activity. Natural Products. , 977-1006 (2013).
- Ham, G. E. Activated aziridines. I. Reaction of anilines with O-ethyl-N,N-ethyleneurethane. mechanism and Hammett ρ-constant. Journal of Organic Chemistry. 29 (10), 3052-3055 (1964).
- Tanner, D. Chiral aziridine-their synthesis and use in stereoselective transformations. Angewandte Chemie International Edition. 33 (6), 599-619 (1994).
- Atkinson, R. S. 3-Acetoxyaminoquinazolinones (QNHOAc) as aziridinating agents: ring-opening of N-(Q)-substituted aziridines. Tetrahedron. 55 (6), 1519-1559 (1999).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Lu, P. Recent developments in regioselective ring opening of aziridines. Tetrahedron. 14 (66), 2549-2560 (2010).
- Ohno, H. Synthesis and applications of vinylaziridines and ethynylaziridines. Chemical Reviews. 114 (16), 7784-7814 (2014).
- Callebaut, G., Meiresonne, T., De Kimpe, N., Mangelinckx, S. Synthesis and reactivity of 2-(carboxymethyl) aziridine derivatives. Chemical Reviews. 114 (16), 7954-8015 (2014).
- Ghosal, N. C., et al. Organocatalysis by an aprotic imidazolium zwitterion: Regioselective ring-opening of aziridines and applicable to gram scale synthesis. Green Chemistry. 18 (2), 565-574 (2016).
- Rai, V. K., Rai, P. K., Bajaj, S., Kumar, A. An unprecedented synthesis of γ-lactams via mercaptoacetylation of aziridines in water. Green Chemistry. 13 (5), 1217-1223 (2011).
- Srivastava, V. P., Yadav, L. D. S. The first example of ring expansion of N-tosylaziridines to 2-aroyl-N-tosylazetidines with nitrogen ylides in an aqueous medium. Green Chemistry. 12 (8), 1460-1465 (2010).
- Stanković, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Ha, H. J., Jung, J. H., Lee, W. K. Application of regio-and stereoselective functional group transformations of chiral aziridine-2-carboxylates. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- D'hooghe, M., Ha, H. -J. Synthesis of 4- to 7-membered Heterocycles by Ring Expansion: Aza-, Oxa- and Thiaheterocyclic Small-Ring Systems. 1st ed. , Springer International Publishing. Cham. (2016).
- Macha, L., Ha, H. -J. Total synthesis and absolute stereochemical assignment of microgrewiapine A and its stereoisomers. Journal of Organic Chemistry. 84 (1), 94-103 (2019).
- Srivastava, N., Macha, L., Ha, H. -J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Lee, W. K., Ha, H. -J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Głowacka, I. E., Trocha, A., Wróblewski, A. E., Piotrowska, D. G. N-(1-Phenylethyl) aziridine-2-carboxylate esters in the synthesis of biologically relevant compounds. Beilstein Journal of Organic Chemistry. 15 (1), 1722-1757 (2019).
- JoVE. Organic Chemistry II. Polarimeter. JoVE Science Education Database. , JoVE. Cambridge, MA. (2022).
- Mao, H., et al. Preparation of chiral contiguous epoxyaziridines and their regioselective ring-opening for drug syntheses. Chemistry-A European Journal. 24 (10), 2370-2374 (2018).
- Vesely, J., Ibrahem, I., Zhao, G. L., Rios, R., Córdova, A. Organocatalytic enantioselective aziridination of α,β-unsaturated aldehydes. Angewandte Chemie International Edition. 11 (46), 778-781 (2007).
- Arai, H., et al. Enantioselective aziridination reaction of α,β-unsaturated aldehydes using an organocatalyst and tert-butyl N-arenesulfonyloxycarbamates. Tetrahedron Letters. 50 (26), 3329-3332 (2009).
- Desmarchelier, A., et al. Organocatalyzed aziridination of α-branched enals: enantioselective synthesis of aziridines with a quaternary stereocenter. European Journal of Organic Chemistry. 20 (2011), 4046-4052 (2011).
- Jiang, H., Halskov, K. S., Johansen, T. K., Jørgensen, K. A. Deracemization of axially chiral α,β-unsaturated aldehydes through an amino-catalyzed symmetry-making-symmetry-breaking cascade. Chemistry-A European Journal. 17 (14), 3842-3846 (2011).
- Deiana, L., et al. Catalytic asymmetric aziridination of α,β-unsaturated aldehydes. Chemistry-A European Journal. 17 (28), 7904-7917 (2011).
- Molnár, I. G., Tanzer, E. M., Daniliuc, C., Gilmour, R. Enantioselective aziridination of cyclic enals facilitated by the fluorine-iminium Ion gauche effect. Chemistry-A European Journal. 20 (3), 794-800 (2014).
- Nemoto, T., et al. Enantioselective synthesis of (R)-Sumanirole using organocatalytic asymmetric aziridination of an α,β-unsaturated aldehyde. Tetrahedron: Asymmetry. 25 (15), 1133-1137 (2014).
- Sim, T. B., et al. A novel synthesis of 5-functionalized oxazolidin-2-ones from enantiomerically pure 2-substituted N-[(R)-(+)-α-methylbenzyl] aziridines. Journal of Organic Chemistry. 68 (1), 104-108 (2003).
- Silva, M. A., Goodman, J. M. Aziridinium ring opening: a simple ionic reaction pathway with sequential transition states. Tetrahedron Letters. 46 (12), 2067-2069 (2005).
- Yun, S. Y., et al. Nucleophile-dependent regioselective ring opening of 2-substituted N,N-dibenzylaziridinium ions: bromide versus hydride. Chemical Communications. (18), 2508-2510 (2009).
- Dolfen, J., et al. Bicyclic aziridinium ions in azaheterocyclic chemistry-preparation and synthetic application of 1-azoniabicyclo [n. 1.0] alkanes. Advanced Synthesis & Catalysis. 358 (22), 3485-3511 (2016).
- D'hooghe, M., et al. Systematic study of halide-induced ring opening of 2-substituted aziridinium salts and theoretical rationalization of the reaction pathways. European Journal of Organic Chemistry. 2010 (25), 4920-4931 (2010).
- Boydas, E. B., et al. Theoretical insight into the regioselective ring-expansions of bicyclic aziridinium ions. Organic & Biomolecular Chemistry. 16 (5), 796-806 (2018).
- Lee, B. K., et al. An efficient synthesis of chiral terminal 1, 2-diamines using an enantiomerically pure [1-(1′ R)-methylbenzyl] aziridine-2-yl] methanol. Tetrahedron. 62 (35), 8393-8397 (2006).
- Ha, H. J., et al. Addition of 1-Boc-2-tert-butyldimethylsilyloxypyrrole to N-methyleneamine equivalents: synthesis of 1-Boc-5-aminomehtyl-2,5-dihydropyrrole-2-ones and 1-Boc-2-oxo-1,7,9-triazaspiro[4,5]-dec-3-ene. Heterocycles. 50 (1), 203-214 (1999).
- Laughlin, R. G. The basicity of aliphatic sulfonamides. Journal of the American Chemical Society. 89 (17), 4268-4271 (1967).
- Moreira, J. A., Rosa da Costa, A. M., García-Río, L., Pessêgo, M. Equilibrium constants and protonation site for N-methylbenzenesulfonamides. Beilstein Journal of Organic Chemistry. 7 (1), 1732-1738 (2011).
- Song, K., et al. Highly active ruthenium metathesis catalysts enabling ring-opening metathesis polymerization of cyclopentadiene at low temperatures. Nature Communications. 10, 3860(2019).
- Fukuta, Y., et al. De novo synthesis of Tamiflu via a catalytic asymmetric ring-opening of meso-aziridines with TMSN3. Journal of the American Chemical Society. 128 (19), 6312-6313 (2006).
- Jiang, H., et al. Intramolecular radical aziridination of allylic sulfamoyl azides by cobalt (II)-based metalloradical catalysis: effective construction of strained heterobicyclic structures. Angewandte Chemie International Edition. 55 (38), 11604-11608 (2016).
- Righi, G., Bovicelli, P., Barontini, M., Tirotta, I. Dimethyl carbonate in the regio-and stereocontrolled opening of three-membered heterocyclic rings. Green Chemistry. 14 (2), 495-502 (2012).
- Righi, P., et al. Solution- and solid-phase synthesis of 4-hydroxy-4,5-dihydroisoxazole derivatives from enantiomerically pure N-tosyl-2,3-aziridine alcohols. Organic Letters. 4 (4), 497-500 (2002).
- Yadav, N. N., Choi, J., Ha, H. -J. One-pot multiple reactions: asymmetric synthesis of 2, 6-cis-disubstituted piperidine alkaloids from chiral aziridine. Organic & Biomolecular Chemistry. 14 (27), 6426-6434 (2016).
- Rhee, H. J., et al. Preparation and utilization of contiguous bisaziridines as chiral building blocks. Advanced Synthesis & Catalysis. 363 (13), 3250-3257 (2021).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados