A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת ביסאזירידינים רציפים לתגובות פתיחת טבעת רגיוזלקטיביות
In This Article
Summary
ביסאזירידינים רציפים המכילים אזירידינים לא מופעלים ומופעלים סונתזו על ידי אזירידינציות אורגנוקטליטיות אסימטריות ולאחר מכן היו נתונים לתגובות כימוסלקטיביות של פתיחת טבעת בתנאים חומציים או בסיסיים. טבעת האזירידין הלא מופעלת נפתחת עם פחות נוקלאופילים תגובתיים בתנאים חומציים, ואילו טבעת האזירידין המופעלת נפתחת עם נוקלאופילים תגובתיים יותר בתנאים בסיסיים.
Abstract
Aziridines, קבוצה של מולקולות אורגניות תגובתיות המכילות טבעת בעלת שלושה איברים, הם סינתונים חשובים לסינתזה של מגוון גדול של תרכובות מטרה פונקציונליות המכילות חנקן באמצעות פתיחת טבעת רג'יונטורית של אזירידינים בתחליפי C. למרות ההתקדמות האדירה בסינתזה של אזירידין בעשור האחרון, גישה יעילה לביסאזירידינים רציפים עדיין קשה. לכן, התעניינו בסינתזה של ביסאזירידינים רציפים הנושאים קבוצה מגוונת אלקטרונית של N-תחליפי מעבר לעמוד השדרה האזירידין הבודד לתגובות פתיחת טבעת רג'יוזלקטיביות עם נוקלאופילים מגוונים. במחקר זה, ביסאזירידינים ציראליים רציפים הוכנו על ידי אזירידינציה אסימטרית אורגנוקטליטית של כיראלית (E)-3-((S)-1-((R)-1-פנילתיל)אזירידין-2-yl)אקרילאלדהיד עם N-Ts-O-tosyl או N-Boc-O-tosyl hydroxylamine כמקור החנקן בנוכחות (2 S)-[דיפניל(טרימתיל-סילילוקסי)מתיל]פירולידין כאורגנוקטליסט כיראלי. כמו כן מודגמות כאן דוגמאות מייצגות לתגובות פתיחת טבעת רג'יוסלקטיביות של ביסאזירידינים רציפים עם מגוון נוקלאופילים כגון גופרית, חנקן, פחמן וחמצן, ויישום של ביסאזירידינים רציפים לסינתזה של פירולידינים כיראליים מרובי תחליפים על ידי הידרוגנציה מזורזת של Pd.
Introduction
תכנון רציונלי של מולקולות אורגניות קטנות עם אתרים תגובתיים מגוונים השולטים במדויק בסלקטיביות המוצר הוא מטרה מרכזית בסינתזה אורגנית מודרנית ובכימיה ירוקה 1,2,3,4,5,6,7,8. כדי להשיג מטרה זו, התעניינו בסינתזה מודולרית של אזירידינים. אזירידינים מעניינים את רוב הכימאים האורגניים, בשל המסגרת החשובה מבחינה מבניתשלהם 9 עם קבוצה מגוונת אלקטרונית של N-substituents שיכולה להוביל לתגובות פתיחת טבעת רג'יוסלקטיביות עם מספר נוקלאופילים 10,11,12,13,14,15,16,17,18, 19, ופעילויות פרמקולוגיות מגוונות כגון תכונות אנטי-סרטניות, אנטי-מיקרוביאליות ואנטי-בקטריאליות. למרות ההתקדמות בכימיה של אזירידין, לאזירידין לא פעיל ואזירידין פעיל יש סינתזות עצמאיות ותגובות פתיחת טבעת בספרות20.
לכן, כיוונו לסנתז ביסאזירידינים רציפים הכוללים הן את האזירידים הלא מופעלים והן את האזירידים המופעלים. ניתן להשתמש בביסאזירידינים רציפים אלה כדי לתרץ באופן שיטתי תבנית פתיחת טבעת כימוסלקטיבית המבוססת על התכונות האלקטרוניות הבאות של שני האזירידינים השונים ותגובתיותם לנוקלאופילים 20,21,22,23,24: א) אזירידינים מופעלים, שבהם תחליפי משיכת האלקטרונים מייצבים באופן מצומד את המטען השלילי על החנקן, מגיבים בקלות עם נוקלאופילים מרובים כדי לאפשר מוצרים שנפתחו טבעת; ב) אזירידינים שאינם מופעלים, שבהם החנקן קשור לתחליפים התורמים אלקטרונים, הם אינרטיים במידה ניכרת כלפי נוקלאופילים; לפיכך, נדרש שלב טרום הפעלה עם אקטיבטור מתאים (בעיקר חומצות Brønsted או Lewis) כדי להרשות לעצמו את המוצרים שנפתחו בטבעת בתשואות גבוהות20,21,25,26.
המחקר הנוכחי מתאר את התכנון הרציונלי של ביסאזירידינים רציפים כאבני בניין כיראליות באמצעות אורגנוקטליזה נטולת מתכות מעבר וסינתזה של מולקולות מגוונות עשירות בחנקן תוך שימוש בכלי מודלים מנבאים לתגובות פתיחה טבעתיות של ביסאזירידינים. מחקר זה נועד לעורר את קידומן של שיטות מעשיות לבניית תרכובות ביו-אקטיביות מועשרות בחנקן ומוצרים טבעיים ופולימריזציה של אזירידינים.
Protocol
הפרטים של כל המוצרים המסונתזים (1-5), כולל המבנה, ספקטרום NMR מלא, טוהר אופטי ונתוני HRMS-MALDI, מסופקים בקובץ משלים 1.
1. סינתזה של 3-(aziridin-2-yl)אקריל אלדהיד (1a)
- ייבשו להבה בקבוקון בעל תחתית עגולה של 50 מ"ל המצויד במוט מערבל ומחיצת בתנאי ואקום. מצננים אותו לטמפרטורת החדר תוך כדי מילויו בגז ארגון.
- הוסיפו טולואן נטול מים (19 מ"ל) ו-(R)-1-(R)-1-פנילתיל)אזירידין-2-קרבלדהיד (1.00 גרם, 5.71 מילימול) (ראו טבלת חומרים) לבקבוקון. לאחר מכן, מערבבים את הפתרון במשך דקה אחת.
- מוסיפים (טריפניל-פוספורנילידן) אצטאלדהיד (2.08 גרם, 6.85 מילימול) (ראו טבלת חומרים) לתמיסה המוערבבת.
- מחממים את תערובת התגובה ב-60°C למשך 18 שעות. לאחר מכן, קררו את תערובת התגובה לטמפרטורת החדר והסירו ממס נדיף מתערובת התגובה בלחץ מופחת.
- עקוב אחר התקדמות התגובה על ידי TLC באמצעות אתיל אצטט:הקסאנס (1:6 v/v, Rf = 0.25) כאלואנט.
- לטהר את המוצר הגולמי על ידי כרומטוגרפיית פלאש של ג'ל סיליקה עם אתיל אצטט:הקסאנס (1:6 v/v) כאלואנט לבידוד מוצר טהור 1a (ראה קובץ משלים 1) כנוזל צהוב.
- אשר את המוצר לפי מדידות NMR ופולרימטר (ראה שלבים 8 ו-9 לשיטות המדידה).
2. סינתזה של ביסאזירידין רציף (2a)
- יש לייבש בקבוק 50 מ"ל עם תחתית עגולה עם מוט מערבל ומחיצת בתנאי ואקום. מצננים אותו לטמפרטורת החדר תוך כדי מילויו בגז ארגון.
- מוסיפים אתיל אצטט נטול מים (3 מ"ל) ו-1a (שלב 1.6, 201 מ"ג, 1.0 מ"ל) לבקבוקון, ואז מערבבים את התמיסה למשך דקה אחת.
- מוסיפים זרז (S)-2-(דיפניל((טרימתילסיליל)אוקסי)מתיל)פירולידין (BS, ראו טבלת חומרים) (0.02 מ"ל, 7 מול%) לתערובת ומערבבים בטמפרטורת החדר למשך 30 דקות.
- מוסיפים 316 מ"ג, 1.10 ממול של טרט-בוטיל טוסילוקסיקרבמט (BocNHOTs, ראו טבלת חומרים) ו-123 מ"ג, 1.50 ממול של נתרן אצטט לתערובת התגובה ומערבבים במשך 24 שעות.
- עקוב אחר התקדמות התגובה על-ידי TLC באמצעות אתר דיאתיל:הקסאנס (1:4 v/v, Rf = 0.27) כ-eluent.
- חלץ את תערובת התגובה עם אתיל אצטט (3 x 50 מ"ל) במשפך מפריד.
- יבשו את השכבה האורגנית המשולבת מעל Na2SO4 נטול המים, סננו והתרכזו בוואקוו.
- לטהר את המוצר הגולמי המתקבל על ידי כרומטוגרפיית הבזק על ג'ל סיליקה עם אתר diethyl:hexanes (1:4 v/v) כ-eluent כדי לבודד מוצר טהור 2a (ראה קובץ משלים 1) כנוזל צהוב.
- אשר את המוצר על ידי מדידות NMR ופולרימטר (ראה שלבים 8 ו-9).
3. סינתזה של תרכובת 3
- יש לייבש בקבוק 50 מ"ל עם תחתית עגולה עם מוט מערבל ומחיצת בתנאי ואקום. מצננים אותו לטמפרטורת החדר תוך כדי מילויו בגז ארגון.
- מוסיפים מתנול נטול מים (11 מ"ל) ואלדהיד 2a (שלב 2.8, 1.00 גרם, 3.16 מילימול) [או 2b (1.17 גרם, 3.16 מילימול, ראו קובץ משלים 1)] לבקבוקון, ואז מערבבים את התמיסה במשך דקה.
- מוסיפים את NaBH4 (95 מ"ג, 2.53 מילימול) לתמיסה המוערבבת.
- מערבבים את תערובת התגובה ב-0°C למשך שעה.
- עקוב אחר התקדמות התגובה על ידי TLC באמצעות אתיל אצטט:הקסאנס (1:4 v/v, Rf = 0.27) כאלואנט.
- לאחר שעה אחת, הרוו את תערובת התגובה עם מים מזוקקים והוציאו עם אתיל אצטט (3 x 50 מ"ל) במשפך מפריד.
- יבשו את השכבה האורגנית המשולבת מעל Na2SO4 נטול המים, סננו והתרכזו בוואקוו.
- לטהר את השאריות הגולמיות על ידי כרומטוגרפיית פלאש של ג'ל סיליקה עם אתיל אצטט:הקסאנס (1:4 v/v) כאלואנט לבידוד מוצרים טהורים 3a [או 3b] (ראה קובץ משלים 1) כנוזל צהוב.
- אשר את המוצר על ידי מדידות NMR ופולרימטר (ראה שלבים 8 ו-9).
4. סינתזה של תרכובת 4
- יש לייבש בקבוק 50 מ"ל עם תחתית עגולה עם מוט מערבל ומחיצת בתנאי ואקום. מצננים אותו לטמפרטורת החדר תוך כדי מילויו בגז ארגון.
- מוסיפים דיכלורומתאן נטול מים (11 מ"ל) ואלכוהול 3a (שלב 3.8, 1.00 גרם, 3.14 מילימול) [או 3b (1.17 גרם, 3.14 מילימול)] לבקבוקון, ואז מערבבים את התמיסה במשך דקה.
- הוסיפו טרט-בוטילדית-מתיל-סיליל כלוריד (TBSCl, 520 מ"ג, 3.45 מילימול) ואימידזול (427 מ"ג, 6.28 מילימול) (ראו טבלת חומרים) לתמיסה המעורבבת.
- מערבבים את תערובת התגובה ב-0°C למשך 18 שעות.
- עקוב אחר התקדמות התגובה על ידי TLC באמצעות אתיל אצטט:הקסאנס (1:4 v/v, Rf = 0.26) כאלואנט.
- לאחר 18 שעות, להרוות את תערובת התגובה עם מים deionized ולחלץ עם מתילן כלוריד (3 x 50 מ"ל) במשפך מפריד.
- יבשו את השכבה האורגנית המשולבת מעל נתרן גופרתי נטול מים, סננו, ולאחר מכן התרכזו בלחץ מופחת.
- לטהר את השאריות הגולמיות על ידי כרומטוגרפיית פלאש של ג'ל סיליקה עם אתיל אצטט:הקסאנס (1:4 v/v) כאלואנט לבידוד מוצרים טהורים 4a [או 4b] (ראה קובץ משלים 1) כנוזל צהוב.
- אשר את המוצר על ידי מדידות NMR ופולרימטר.
5. פתיחת טבעת סלקטיבית של אזירידנים שאינם מופעלים: סינתזה של 5d
- יש לייבש בקבוק 50 מ"ל עם תחתית עגולה עם מוט מערבל ומחיצת בתנאי ואקום. מצננים אותו לטמפרטורת החדר תוך כדי מילויו בגז ארגון.
- מוסיפים 3b (שלב 4.2, 100 מ"ג, 0.27 mmol) וחומצה אצטית (0.12 מ"ל, 2.14 mmol) לבקבוקון, ולאחר מכן מערבבים את התערובת בטמפרטורת החדר במשך 5 שעות.
- עקוב אחר התקדמות התגובה על-ידי TLC באמצעות אתיל אצטט:הקסאנס (2:3 v/v, Rf = 0.28) כ-eluent.
- לאחר 5 שעות, להסיר את החומצה האצטית ב vacuo.
- לטהר את השאריות הגולמיות על ידי כרומטוגרפיית הבזק של ג'ל סיליקה עם אתיל אצטט:הקסאנס (2:3 v/v) כאלואנט לבידוד מוצר טהור 5d (ראה קובץ משלים 1) כנוזל צהוב.
- אשר את המוצר על ידי מדידות NMR ופולרימטר.
6. פתיחת טבעת סלקטיבית של אזירידנים מופעלים: סינתזה של 5f
- יש לייבש בקבוק 50 מ"ל עם תחתית עגולה עם מוט מערבל ומחיצת בתנאי ואקום. מצננים אותו לטמפרטורת החדר תוך כדי מילויו בגז ארגון.
- מוסיפים מתנול נטול מים (8 מ"ל) ו-4b (שלב 4.8, 100 מ"ג, 0.21 מ"ל) לבקבוקון, ואז מערבבים את התמיסה למשך דקה אחת.
- הוסף NaN3 (39 מ"ג, 0.6 mmol) ו- NH4Cl (21 מ"ג, 0.41 mmol) ב- H2O (1 מ"ל) לתמיסה לעיל.
- מערבבים את תערובת התגובה ב-0°C למשך 4 שעות.
- עקוב אחר התקדמות התגובה על ידי TLC באמצעות אתיל אצטט:הקסאנס (1:4 v/v, Rf = 0.30) כאלואנט.
- לאחר 4 שעות, להרוות את תערובת התגובה עם H2O ולחלץ עם אתיל אצטט (3 x 50 מ"ל) במשפך מפריד.
- יבשו את השכבה האורגנית המשולבת מעל Na2SO4 נטול המים, סננו והתרכזו בוואקוו.
- לטהר את השאריות הגולמיות על ידי כרומטוגרפיית פלאש של ג'ל סיליקה עם אתיל אצטט:הקסאנס (1:4 v/v) כאלואנט לבידוד מוצר טהור 5f (ראה קובץ משלים 1) כנוזל צהוב.
- אשר את המוצר על ידי מדידות NMR ופולרימטר.
7. הידרוגנציה מזורזת של אזירידינים רציפים: סינתזה של 5h
- יש לייבש בקבוק 50 מ"ל עם תחתית עגולה עם מוט מערבל ומחיצת בתנאי ואקום. מצננים אותו לטמפרטורת החדר תוך כדי מילויו בגז ארגון.
- הוסיפו לבקבוקון מתנול נטול מים (5 מ"ל), 2b (שלב 3.2, 100 מ"ג, 0.27 מילימול), Boc 2 O (70 מ"ג, 0.32 מילימול) ו-20% Pd(OH)2/C (37 מ"ג).
- ערבבו את התערובת תחת אווירת H2 (בלון, 1 atm) בטמפרטורת החדר למשך 12 שעות.
- עקוב אחר התקדמות התגובה על-ידי TLC באמצעות אתיל אצטט:הקסאנס (2:3 v/v, Rf = 0.29) כ-eluent.
- יש לסנן את תערובת התגובה דרך כרית celite הזמינה באופן מסחרי (ראו טבלת חומרים) ולשטוף במתנול.
- יש להתאדות בוואקו את התסנין ולטהר את השאריות על ידי כרומטוגרפיית הבזק של ג'ל סיליקה עם אתיל אצטט:הקסאנס (2:3 v/v) כחומר המבודד למוצר טהור 5 שעות (ראה קובץ משלים 1) כנוזל חסר צבע.
- אשר את המוצר על ידי מדידות NMR ופולרימטר.
8. ניתוח פולרימטר
- הכינו כמות מתאימה של הדגימה (~100 מ"ג) למדידה.
- ממיסים את הדגימה המוכנה ב-CHCl3 (c 0.05-1.00).
- העבר את תמיסת הדגימה לתא הדגימה, תוך הקפדה על כך שאין בועות אוויר
[ø = 1.8 מ"מ, l = 10-1 m]. - טען את תא הדגימה לתוך מכשיר הפולרימטר (ראה טבלת חומרים) ובדוק את כיוון התא.
- הגדר 0 כלחץ על אפס ברור בקטע 'שליטה'.
- מדוד את הסיבוב הספציפי של CHCl3 עבור הריק.
הערה: מקור אור: Na; λ = 589 ננומטר; D.I.T: 5 שניות; זמני מחזור: 5; מרווח מחזור: 5 שניות; טמפרטורה: 20 מעלות צלזיוס. - מדוד את הסיבוב הספציפי של תמיסת הדגימה בטמפרטורה קבועה.
הערה: מקור אור: Na; λ = 589 ננומטר; D.I.T: 5 שניות; זמני מחזור: 5; מרווח מחזור: 5 שניות; טמפרטורה: 20 מעלות צלזיוס. - מדוד את הסיבוב הספציפי של פתרון המדגם שלוש פעמים באותו אופן כדי לקבל את הערך הממוצע.
- חשב את הסיבוב הספציפי באמצעות המשוואה הבאה27:
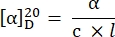
α = סיבוב נצפה (מעלות), c = ריכוז (g/mL), l = אורך נתיב (10-1 מ').
9. 1H ו 13C NMR ניתוח
- הכן כ 0.6-1.0 מ"ל של ממס NMR (CDCl3).
- יש להמיס ~50 מ"ג דגימה בממס בריכוז של 0.02 מ' עבור 1 H NMR ו-0.05 מ ' עבור מדידותNMR של 13C.
- העבר את תמיסת הדגימה לצינור NMR באמצעות פיפטה של פסטר.
- טען את הצינור לתוך מכשיר NMR (ראה טבלת חומרים).
הערה: מדידות NMR בוצעו באמצעות ספקטרומטרים של 400 מגה-הרץ או 500 מגה-הרץ. מספר ספין: 16 (1H NMR), 256 או 512 (13C NMR); זמן מדידה: 10 דקות (1H NMR), 20 או 30 דקות (13C NMR)]. - הקלט את ספקטרום ה- NMR ונתח את הנתונים.
הערה: התייחס למעבר הכימי של הספקטרום לאותCDCl 3 [δ (ספקטרום NMR של 1H) = 7.26 עמודים לדקה; δ (ספקטרום NMR של 13C) = 77.0 עמודים לדקה)].
תוצאות
כדי לחקור את יכולת ההשגה של הכנת ביסאזירידין רציף, (E)-3-((S)-1-(R)-1-פנילאתיל)אזירידין-2-yl)אקרילאלדהיד (1a) סונתז לראשונה כמצע מודל על פי הנוהל המוזכר בשלב 1 (איור 1)28.
Discussion
היווצרותה של תערובת בלתי נפרדת של דיאסטראומרים נצפתה מדי פעם במהלך אזירידינציה אורגנוקטליטית של כיראלית 3-[1-(1-פנילתיל)אזירידין-2-yl)]אקרילאלדהיד, כאשר N-Boc-O-tosyl או N-Ts-O-tosyl hydroxylamine שימש כמקור החנקן. יתר על כן, התשואה של תוצר bisaziridine רציף ירדה כאשר כמות דיריל סיליל אתר פרולינול ...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי מענק המכון הלאומי למדע בסיסי של קוריאה (מתקני מחקר וציוד לאומי) במימון משרד החינוך (2022R1A6C101A751). עבודה זו נתמכה גם על ידי מענקי קרן המחקר הלאומית של קוריאה (NRF) (2020R1A2C1007102 ו- 2021R1A5A6002803).
Materials
| Name | Company | Catalog Number | Comments |
| (R)-(+)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677191 | reagent |
| (R)-1-((R)-1-phenylethyl)aziridine-2-carbaldehyde | Imagene Co.,Ltd. | reagent | |
| (S)-(–)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677183 | reagent |
| (S)-2-(diphenyl((trim ethylsilyl)oxy)methyl)pyrrolidine | Sigma-Aldrich | 677183 | reagent |
| (Triphenylphosphoranylidene) acetaldehyde | Sigma-Aldrich | 280933 | reagent |
| 1,2-Dichloroethane | Sigma-Aldrich | 284505 | solvent |
| AB Sciex 4800 Plus MALDI TOFTM (2,5-dihydroxybenzoic acid (DHB) matrix | Sciex | High resolution mass spectra | |
| Acetic acid | Sigma-Aldrich | A6283 | reagent |
| Ammonium chloride | Sigma-Aldrich | 254134 | reagent |
| aniline | Sigma-Aldrich | 132934 | reagent |
| Autopol III digital polarimeter | Rudolph Research Analytical | polarimeter | |
| AVANCE III HD (400 MHz) spectrometer | Bruker | NMR spectrometer | |
| Bruker Ascend 500 (500 MHz) | Bruker | NMR spectrometer | |
| Celite 535 | Sigma-Aldrich | 22138 | For Celite pad |
| Dichloromethane | Sigma-Aldrich | 270997 | solvent |
| Di-tert-butyl dicarbonate | Sigma-Aldrich | 361941 | reagent |
| Ethyl Acetate | Sigma-Aldrich | 270989 | solvent |
| Ethyl nitroacetate | Sigma-Aldrich | 192333 | reagent |
| Imidazole | Sigma-Aldrich | I2399 | reagent |
| INOVA 400WB (400 MHz) | Varian | NMR spectrometer | |
| JMS-700 | JEOL | High resolution mass spectra | |
| Methanol | Sigma-Aldrich | 322415 | solvent |
| N-Boc-O-tosylhydroxylamine | Sigma-Aldrich | 775037 | reagent |
| P-2000 | JASCO | polarimeter | |
| Palladium hydroxide on carbon | Sigma-Aldrich | 212911 | reagent |
| Phenyl-1H-tetrazole-5-thiol | TCI | P0640 | reagent |
| Silica gel | Sigma-Aldrich | 227196 | For flash clromatography |
| Silica gel on TLC plates | Merck | 60768 | TLC plate |
| Sodium acetate | Sigma-Aldrich | S8750 | reagent |
| Sodium azide | Sigma-Aldrich | S2002 | reagent |
| Sodium borohydride | Sigma-Aldrich | 452882 | reagent |
| Sodium carbonate | Sigma-Aldrich | S2127 | reagent |
| tert-Butyldimethylsilyl chloride | Sigma-Aldrich | 190500 | reagent |
| Tetrahydrofuran | Sigma-Aldrich | 401757 | solvent |
| Toluene | Sigma-Aldrich | 244511 | solvent |
| Zinc bromide | Sigma-Aldrich | 230022 | reagent |
| Zinc chloride | Sigma-Aldrich | 429430 | reagent |
References
- Anastas, P. T., Warner, J. C. Principles of green chemistry. Green Chemistry: Theory and Practice. 29, (1998).
- Sheldon, R. A., Arends, I. W. C. E., Hanefeld, U. . Green Chemistry and Catalysis. , (2007).
- Trost, B. M. The atom economy-a search for synthetic efficiency. Science. 254 (5037), 1471-1477 (1991).
- Sheldon, R. A. The E factor: fifteen years on. Green Chemistry. 9 (12), 1273-1283 (2007).
- Li, C. J., Trost, B. M. Green chemistry for chemical synthesis. Proceedings of the National Academy of Sciences. 105 (36), 13197-13202 (2008).
- Sheldon, R. A. Fundamentals of green chemistry: efficiency in reaction design. Chemical Society Reviews. 41 (4), 1437-1451 (2012).
- Marion, P., et al. Sustainable chemistry: how to produce better and more from less. Green Chemistry. 19 (21), 4973-4989 (2017).
- Sheldon, R. A. The E factor 25 years on: the rise of green chemistry and sustainability. Green Chemistry. 19 (1), 18-43 (2017).
- Dembitsky, V. M., Terent'ev, A. O., Levitsky, D. O. Aziridine alkaloids: origin, chemistry and activity. Natural Products. , 977-1006 (2013).
- Ham, G. E. Activated aziridines. I. Reaction of anilines with O-ethyl-N,N-ethyleneurethane. mechanism and Hammett ρ-constant. Journal of Organic Chemistry. 29 (10), 3052-3055 (1964).
- Tanner, D. Chiral aziridine-their synthesis and use in stereoselective transformations. Angewandte Chemie International Edition. 33 (6), 599-619 (1994).
- Atkinson, R. S. 3-Acetoxyaminoquinazolinones (QNHOAc) as aziridinating agents: ring-opening of N-(Q)-substituted aziridines. Tetrahedron. 55 (6), 1519-1559 (1999).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Lu, P. Recent developments in regioselective ring opening of aziridines. Tetrahedron. 14 (66), 2549-2560 (2010).
- Ohno, H. Synthesis and applications of vinylaziridines and ethynylaziridines. Chemical Reviews. 114 (16), 7784-7814 (2014).
- Callebaut, G., Meiresonne, T., De Kimpe, N., Mangelinckx, S. Synthesis and reactivity of 2-(carboxymethyl) aziridine derivatives. Chemical Reviews. 114 (16), 7954-8015 (2014).
- Ghosal, N. C., et al. Organocatalysis by an aprotic imidazolium zwitterion: Regioselective ring-opening of aziridines and applicable to gram scale synthesis. Green Chemistry. 18 (2), 565-574 (2016).
- Rai, V. K., Rai, P. K., Bajaj, S., Kumar, A. An unprecedented synthesis of γ-lactams via mercaptoacetylation of aziridines in water. Green Chemistry. 13 (5), 1217-1223 (2011).
- Srivastava, V. P., Yadav, L. D. S. The first example of ring expansion of N-tosylaziridines to 2-aroyl-N-tosylazetidines with nitrogen ylides in an aqueous medium. Green Chemistry. 12 (8), 1460-1465 (2010).
- Stanković, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Ha, H. J., Jung, J. H., Lee, W. K. Application of regio-and stereoselective functional group transformations of chiral aziridine-2-carboxylates. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- D'hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-membered Heterocycles by Ring Expansion: Aza-, Oxa- and Thiaheterocyclic Small-Ring Systems. 1st ed. , (2016).
- Macha, L., Ha, H. -. J. Total synthesis and absolute stereochemical assignment of microgrewiapine A and its stereoisomers. Journal of Organic Chemistry. 84 (1), 94-103 (2019).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Głowacka, I. E., Trocha, A., Wróblewski, A. E., Piotrowska, D. G. N-(1-Phenylethyl) aziridine-2-carboxylate esters in the synthesis of biologically relevant compounds. Beilstein Journal of Organic Chemistry. 15 (1), 1722-1757 (2019).
- JoVE. Organic Chemistry II. Polarimeter. JoVE Science Education Database. , (2022).
- Mao, H., et al. Preparation of chiral contiguous epoxyaziridines and their regioselective ring-opening for drug syntheses. Chemistry-A European Journal. 24 (10), 2370-2374 (2018).
- Vesely, J., Ibrahem, I., Zhao, G. L., Rios, R., Córdova, A. Organocatalytic enantioselective aziridination of α,β-unsaturated aldehydes. Angewandte Chemie International Edition. 11 (46), 778-781 (2007).
- Arai, H., et al. Enantioselective aziridination reaction of α,β-unsaturated aldehydes using an organocatalyst and tert-butyl N-arenesulfonyloxycarbamates. Tetrahedron Letters. 50 (26), 3329-3332 (2009).
- Desmarchelier, A., et al. Organocatalyzed aziridination of α-branched enals: enantioselective synthesis of aziridines with a quaternary stereocenter. European Journal of Organic Chemistry. 20 (2011), 4046-4052 (2011).
- Jiang, H., Halskov, K. S., Johansen, T. K., Jørgensen, K. A. Deracemization of axially chiral α,β-unsaturated aldehydes through an amino-catalyzed symmetry-making-symmetry-breaking cascade. Chemistry-A European Journal. 17 (14), 3842-3846 (2011).
- Deiana, L., et al. Catalytic asymmetric aziridination of α,β-unsaturated aldehydes. Chemistry-A European Journal. 17 (28), 7904-7917 (2011).
- Molnár, I. G., Tanzer, E. M., Daniliuc, C., Gilmour, R. Enantioselective aziridination of cyclic enals facilitated by the fluorine-iminium Ion gauche effect. Chemistry-A European Journal. 20 (3), 794-800 (2014).
- Nemoto, T., et al. Enantioselective synthesis of (R)-Sumanirole using organocatalytic asymmetric aziridination of an α,β-unsaturated aldehyde. Tetrahedron: Asymmetry. 25 (15), 1133-1137 (2014).
- Sim, T. B., et al. A novel synthesis of 5-functionalized oxazolidin-2-ones from enantiomerically pure 2-substituted N-[(R)-(+)-α-methylbenzyl] aziridines. Journal of Organic Chemistry. 68 (1), 104-108 (2003).
- Silva, M. A., Goodman, J. M. Aziridinium ring opening: a simple ionic reaction pathway with sequential transition states. Tetrahedron Letters. 46 (12), 2067-2069 (2005).
- Yun, S. Y., et al. Nucleophile-dependent regioselective ring opening of 2-substituted N,N-dibenzylaziridinium ions: bromide versus hydride. Chemical Communications. (18), 2508-2510 (2009).
- Dolfen, J., et al. Bicyclic aziridinium ions in azaheterocyclic chemistry-preparation and synthetic application of 1-azoniabicyclo [n. 1.0] alkanes. Advanced Synthesis & Catalysis. 358 (22), 3485-3511 (2016).
- D'hooghe, M., et al. Systematic study of halide-induced ring opening of 2-substituted aziridinium salts and theoretical rationalization of the reaction pathways. European Journal of Organic Chemistry. 2010 (25), 4920-4931 (2010).
- Boydas, E. B., et al. Theoretical insight into the regioselective ring-expansions of bicyclic aziridinium ions. Organic & Biomolecular Chemistry. 16 (5), 796-806 (2018).
- Lee, B. K., et al. An efficient synthesis of chiral terminal 1, 2-diamines using an enantiomerically pure [1-(1′ R)-methylbenzyl] aziridine-2-yl] methanol. Tetrahedron. 62 (35), 8393-8397 (2006).
- Ha, H. J., et al. Addition of 1-Boc-2-tert-butyldimethylsilyloxypyrrole to N-methyleneamine equivalents: synthesis of 1-Boc-5-aminomehtyl-2,5-dihydropyrrole-2-ones and 1-Boc-2-oxo-1,7,9-triazaspiro[4,5]-dec-3-ene. Heterocycles. 50 (1), 203-214 (1999).
- Laughlin, R. G. The basicity of aliphatic sulfonamides. Journal of the American Chemical Society. 89 (17), 4268-4271 (1967).
- Moreira, J. A., Rosa da Costa, A. M., García-Río, L., Pessêgo, M. Equilibrium constants and protonation site for N-methylbenzenesulfonamides. Beilstein Journal of Organic Chemistry. 7 (1), 1732-1738 (2011).
- Song, K., et al. Highly active ruthenium metathesis catalysts enabling ring-opening metathesis polymerization of cyclopentadiene at low temperatures. Nature Communications. 10, 3860 (2019).
- Fukuta, Y., et al. De novo synthesis of Tamiflu via a catalytic asymmetric ring-opening of meso-aziridines with TMSN3. Journal of the American Chemical Society. 128 (19), 6312-6313 (2006).
- Jiang, H., et al. Intramolecular radical aziridination of allylic sulfamoyl azides by cobalt (II)-based metalloradical catalysis: effective construction of strained heterobicyclic structures. Angewandte Chemie International Edition. 55 (38), 11604-11608 (2016).
- Righi, G., Bovicelli, P., Barontini, M., Tirotta, I. Dimethyl carbonate in the regio-and stereocontrolled opening of three-membered heterocyclic rings. Green Chemistry. 14 (2), 495-502 (2012).
- Righi, P., et al. Solution- and solid-phase synthesis of 4-hydroxy-4,5-dihydroisoxazole derivatives from enantiomerically pure N-tosyl-2,3-aziridine alcohols. Organic Letters. 4 (4), 497-500 (2002).
- Yadav, N. N., Choi, J., Ha, H. -. J. One-pot multiple reactions: asymmetric synthesis of 2, 6-cis-disubstituted piperidine alkaloids from chiral aziridine. Organic & Biomolecular Chemistry. 14 (27), 6426-6434 (2016).
- Rhee, H. J., et al. Preparation and utilization of contiguous bisaziridines as chiral building blocks. Advanced Synthesis & Catalysis. 363 (13), 3250-3257 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved