È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione di bisaziridine contigue per reazioni regioselettive di apertura dell'anello
In questo articolo
Riepilogo
Le bisaziridine contigue contenenti aziridine non attivate e attivate sono state sintetizzate mediante aziridinazioni organocatalitiche asimmetriche e quindi sottoposte a reazioni chemioselettive di apertura dell'anello in condizioni acide o basiche. L'anello aziridinico non attivato si apre con nucleofili meno reattivi in condizioni acide, mentre l'anello aziridinico attivato si apre con nucleofili più reattivi in condizioni basiche.
Abstract
Le aziridine, una classe di molecole organiche reattive contenenti un anello a tre membri, sono importanti sintoni per la sintesi di una grande varietà di composti bersaglio funzionalizzati contenenti azoto attraverso l'apertura ad anello regiocontrollata di aziridine sostituite da C. Nonostante gli enormi progressi nella sintesi dell'aziridina negli ultimi dieci anni, l'accesso efficiente alle bisaziridine contigue rimane difficile. Pertanto, eravamo interessati a sintetizzare bisaziridine contigue contenenti un insieme elettronicamente diversificato di N-sostituenti oltre la singola spina dorsale aziridina per reazioni di apertura dell'anello regioselettivo con diversi nucleofili. In questo studio, bisaziridine contigue chirali sono state preparate mediante aziridinazione organocatalitica asimmetrica di (E)-3-((S)-1-((R)-1-feniletil)aziridina-2-il)acrilaldeide chirale con N-Ts-O-tosyl o N-Boc-O-tosil idrossilammina come fonte di azoto in presenza di (2 S)-[difenil(trimetilsililossi)metil]pirrolidina come organocatalizzatore chirale. Sono anche dimostrati esempi rappresentativi di reazioni di apertura dell'anello regioselettivo di bisaziridine contigue con una varietà di nucleofili come zolfo, azoto, carbonio e ossigeno e l'applicazione di bisaziridine contigue alla sintesi di pirrolidine chirali multi-sostituite mediante idrogenazione catalizzata da Pd.
Introduzione
La progettazione razionale di piccole molecole organiche con diversi siti reattivi che controllano con precisione la selettività del prodotto è un obiettivo chiave nella moderna sintesi organica e nella chimica verde 1,2,3,4,5,6,7,8. Per raggiungere questo obiettivo, eravamo interessati alla sintesi modulare delle aziridine. Le aziridine sono di interesse per la maggior parte dei chimici organici, a causa del loro quadro strutturalmente importante9 con un insieme elettronicamente diversificato di N-sostituenti che possono portare a reazioni di apertura dell'anello regioselettive con nucleofili multipli 10,11,12,13,14,15,16,17,18, 19, e varie attività farmacologiche come proprietà antitumorali, antimicrobiche e antibatteriche. Nonostante i progressi nella chimica dell'aziridina, l'aziridina non attivata e l'aziridina attivata hanno sintesi indipendenti e reazioni di apertura dell'anello in letteratura20.
Pertanto, abbiamo mirato a sintetizzare bisaziridine contigue comprendenti sia le aziridine non attivate che quelle attivate. Queste bisaziridine contigue possono essere utilizzate per razionalizzare sistematicamente un modello chemioselettivo di apertura dell'anello basato sulle seguenti proprietà elettroniche delle due diverse aziridine e sulla loro reattività ai nucleofili 20,21,22,23,24: a) aziridine attivate, in cui i sostituenti che ritirano elettroni stabilizzano coniugativamente la carica negativa sull'azoto, reagiscono prontamente con più nucleofili a consentire prodotti aperti ad anello; b) le aziridine non attivate, in cui l'azoto è legato ai sostituenti donatori di elettroni, sono considerevolmente inerti verso i nucleofili; quindi, è necessaria una fase di pre-attivazione con un attivatore adatto (principalmente acidi di Brønsted o Lewis) per consentire ai prodotti aperti ad anello in alte rese20,21,25,26.
Il presente studio descrive la progettazione razionale delle bisaziridine contigue come elementi costitutivi chirali attraverso l'organocatalisi priva di metalli di transizione e la sintesi di diverse molecole ricche di azoto utilizzando strumenti di modellazione predittiva per le reazioni di apertura dell'anello delle bisaziridine. Questo studio mira a stimolare il progresso di metodi pratici per la costruzione di composti bioattivi arricchiti di azoto e prodotti naturali e la polimerizzazione di aziridine.
Protocollo
I dettagli di tutti i prodotti sintetizzati (1-5), compresa la struttura, gli spettri NMR completi, la purezza ottica e i dati HRMS-MALDI, sono forniti nel file supplementare 1.
1. Sintesi dell'aldeide 3-(aziridina-2-il)acrilico (1a)
- Asciugare a fiamma un matraccio a fondo tondo da 50 mL dotato di una barra dell'agitatore e di un setto in condizioni di vuoto. Raffreddarlo a temperatura ambiente riempiendolo con gas argon.
- Aggiungere al matraccio toluene anidro (19 ml) e (R)-1-((R)-1-feniletil)aziridina-2-carbaldeide (1,00 g, 5,71 mmol) (vedere tabella dei materiali). Quindi, mescolare la soluzione per 1 minuto.
- Aggiungere (trifenilfosforanilidene)acetaldeide (2,08 g, 6,85 mmol) (vedere tabella dei materiali) alla soluzione agitata.
- Riscaldare la miscela di reazione a 60 °C per 18 ore. Quindi, raffreddare la miscela di reazione a temperatura ambiente e rimuovere il solvente volatile dalla miscela di reazione a pressione ridotta.
- Monitorare l'avanzamento della reazione mediante TLC utilizzando come eluente acetato di etile:esano (1:6 v/v, Rf = 0,25).
- Purificare il prodotto grezzo mediante cromatografia flash su gel di silice con acetato di etile:esani (1:6 v/v) come eluente per isolare il prodotto puro 1a (vedere scheda supplementare 1) come liquido giallo.
- Confermare il prodotto mediante misurazioni NMR e polarimetriche (vedere i passaggi 8 e 9 per i metodi di misurazione).
2. Sintesi della bisaziridina contigua (2a)
- Asciugare a fiamma un matraccio a fondo tondo da 50 ml con una barra dell'agitatore e un setto in condizioni di vuoto. Raffreddarlo a temperatura ambiente riempiendolo con gas argon.
- Aggiungere acetato di etile anidro (3 ml) e 1a (fase 1,6, 201 mg, 1,0 mmol) al pallone, quindi mescolare la soluzione per 1 minuto.
- Aggiungere il catalizzatore (S)-2-(difenil((trimetilsilil)ossi)metil)pirrolidina (BS, vedi tabella dei materiali) (0,02 ml, 7 mol%) alla miscela e mescolare a temperatura ambiente per 30 minuti.
- Aggiungere 316 mg, 1,10 mmol di terz-butile tosilossicarbammato (BocNHOTs, vedi tabella dei materiali) e 123 mg, 1,50 mmol di acetato di sodio alla miscela di reazione e mescolare per 24 ore.
- Monitorare l'andamento della reazione mediante TLC utilizzando etere etilico:esano (1:4 v/v, Rf = 0,27) come eluente.
- Estrarre la miscela di reazione con acetato di etile (3 x 50 ml) in un imbuto separatore.
- Asciugare lo strato organico combinato su Na2SO 4 anidro, filtrare e concentrare sotto vuoto.
- Purificare il prodotto grezzo risultante mediante cromatografia flash su gel di silice con etere etilico:esano (1:4 v/v) come eluente per isolare il prodotto puro 2a (vedere il file supplementare 1) come liquido giallo.
- Confermare il prodotto mediante misurazioni NMR e polarimetriche (vedere punti 8 e 9).
3. Sintesi del composto 3
- Asciugare a fiamma un matraccio a fondo tondo da 50 ml con una barra dell'agitatore e un setto in condizioni di vuoto. Raffreddarlo a temperatura ambiente riempiendolo con gas argon.
- Aggiungere metanolo anidro (11 ml) e aldeide 2a (fase 2,8, 1,00 g, 3,16 mmol) [o 2b (1,17 g, 3,16 mmol, vedere il file supplementare 1)] al pallone, quindi agitare la soluzione per un minuto.
- Aggiungere NaBH4 (95 mg, 2,53 mmol) alla soluzione agitata.
- Mescolare la miscela di reazione a 0 °C per 1 ora.
- Monitorare l'andamento della reazione mediante TLC utilizzando come eluente acetato di etile:esano (1:4 v/v, Rf = 0,27).
- Dopo 1 ora, dissetare la miscela di reazione con acqua distillata ed estrarre con acetato di etile (3 x 50 ml) in un imbuto separatore.
- Asciugare lo strato organico combinato su Na2SO 4 anidro, filtrare e concentrare sotto vuoto.
- Purificare il residuo grezzo mediante cromatografia flash su gel di silice con acetato di etile:esani (1:4 v/v) come eluente per isolare i prodotti puri 3a [o 3b] (vedi scheda supplementare 1) come liquido giallo.
- Confermare il prodotto mediante misurazioni NMR e polarimetriche (vedere punti 8 e 9).
4. Sintesi del composto 4
- Asciugare a fiamma un matraccio a fondo tondo da 50 ml con una barra dell'agitatore e un setto in condizioni di vuoto. Raffreddarlo a temperatura ambiente riempiendolo con gas argon.
- Aggiungere diclorometano anidro (11 ml) e alcool 3a (fase 3,8, 1,00 g, 3,14 mmol) [o 3b (1,17 g, 3,14 mmol)] al pallone, quindi agitare la soluzione per un minuto.
- Aggiungere terz-butildimetilsilil cloruro (TBSCl, 520 mg, 3,45 mmol) e imidazolo (427 mg, 6,28 mmol) (vedere tabella dei materiali) alla soluzione agitata.
- Mescolare la miscela di reazione a 0 °C per 18 ore.
- Monitorare l'avanzamento della reazione mediante TLC utilizzando acetato di etile:esani (1:4 v/v, Rf = 0,26) come eluente.
- Dopo 18 ore, spegnere la miscela di reazione con acqua deionizzata ed estrarre con cloruro di metilene (3 x 50 ml) in un imbuto separatore.
- Asciugare lo strato organico combinato sul solfato di sodio anidro, filtrare e quindi concentrarsi a pressione ridotta.
- Purificare il residuo grezzo mediante cromatografia flash su gel di silice con acetato di etile:esani (1:4 v/v) come eluente per isolare i prodotti puri 4a [o 4b] (vedi scheda supplementare 1) come liquido giallo.
- Confermare il prodotto mediante misurazioni NMR e polarimetriche.
5. Apertura selettiva dell'anello di aziridine non attivate: sintesi di 5d
- Asciugare a fiamma un matraccio a fondo tondo da 50 ml con una barra dell'agitatore e un setto in condizioni di vuoto. Raffreddarlo a temperatura ambiente riempiendolo con gas argon.
- Aggiungere 3b (fase 4.2, 100 mg, 0,27 mmol) e acido acetico (0,12 mL, 2,14 mmol) al pallone, quindi mescolare la miscela a temperatura ambiente per 5 ore.
- Monitorare l'avanzamento della reazione mediante TLC utilizzando acetato di etile:esano (2:3 v/v, Rf = 0,28) come eluente.
- Dopo 5 ore, rimuovere l'acido acetico sottovuoto.
- Purificare il residuo grezzo mediante cromatografia flash su gel di silice con acetato di etile:esani (2:3 v/v) come eluente per isolare il prodotto puro 5d (vedere il file supplementare 1) come liquido giallo.
- Confermare il prodotto mediante misurazioni NMR e polarimetriche.
6. Apertura selettiva dell'anello delle aziridine attivate: sintesi di 5f
- Asciugare a fiamma un matraccio a fondo tondo da 50 ml con una barra dell'agitatore e un setto in condizioni di vuoto. Raffreddarlo a temperatura ambiente riempiendolo con gas argon.
- Aggiungere metanolo anidro (8 ml) e 4b (fase 4,8, 100 mg, 0,21 mmol) al pallone, quindi mescolare la soluzione per 1 minuto.
- Aggiungere NaN3 (39 mg, 0,6 mmol) e NH4Cl (21 mg, 0,41 mmol) in H2O (1 mL) alla soluzione di cui sopra.
- Mescolare la miscela di reazione a 0 °C per 4 ore.
- Monitorare l'avanzamento della reazione mediante TLC utilizzando acetato di etile:esani (1:4 v/v, Rf = 0,30) come eluente.
- Dopo 4 ore, estinguere la miscela di reazione con H2O ed estrarre con acetato di etile (3 x 50 ml) in un imbuto separatore.
- Asciugare lo strato organico combinato su Na2SO 4 anidro, filtrare e concentrare sotto vuoto.
- Purificare il residuo grezzo mediante cromatografia flash su gel di silice con acetato di etile:esani (1:4 v/v) come eluente per isolare il prodotto puro 5f (vedere il file supplementare 1) come liquido giallo.
- Confermare il prodotto mediante misurazioni NMR e polarimetriche.
7. Idrogenazione Pd-catalizzata di aziridine contigue: sintesi di 5h
- Asciugare a fiamma un matraccio a fondo tondo da 50 ml con una barra dell'agitatore e un setto in condizioni di vuoto. Raffreddarlo a temperatura ambiente riempiendolo con gas argon.
- Aggiungere metanolo anidro (5 ml), 2b (fase 3,2, 100 mg, 0,27 mmol), Boc 2 O (70 mg, 0,32 mmol) e 20% Pd(OH)2/C (37 mg) al pallone.
- Mescolare la miscela sotto l'atmosfera H2 (palloncino, 1 atm) a temperatura ambiente per 12 ore.
- Monitorare l'avanzamento della reazione mediante TLC utilizzando come eluente acetato di etile:esano (2:3 v/v, Rf = 0,29).
- Filtrare la miscela di reazione attraverso un tampone di celite disponibile in commercio (vedi Tabella dei materiali) e lavare con metanolo.
- Evaporare sotto vuoto il filtrato e purificare il residuo mediante cromatografia flash su gel di silice con acetato di etile:esani (2:3 v/v) come eluente per isolare il prodotto puro 5h (vedi file supplementare 1) come liquido incolore.
- Confermare il prodotto mediante misurazioni NMR e polarimetriche.
8. Analisi polarimetrica
- Preparare una quantità appropriata del campione (~100 mg) da misurare.
- Sciogliere il campione preparato in CHCl3 (c 0,05-1,00).
- Trasferire la soluzione del campione nella camera del campione, assicurandosi che non vi siano bolle d'aria
[ø = 1,8 mm, l = 10-1 m]. - Caricare la camera di campionamento nello strumento polarimetro (vedere Tabella dei materiali) e controllare l'orientamento della camera.
- Imposta 0 come clic zero cancella nella sezione "controllo".
- Misurare la rotazione specifica di CHCl3 per il bianco.
NOTA: Sorgente luminosa: Na; λ = 589 nm; D.I.T: 5 s; Tempi ciclo: 5; intervallo di ciclo: 5 s; temperatura: 20 °C. - Misurare la rotazione specifica della soluzione del campione a temperatura costante.
NOTA: Sorgente luminosa: Na; λ = 589 nm; D.I.T: 5 s; Tempi ciclo: 5; intervallo di ciclo: 5 s; temperatura: 20 °C. - Misurare la rotazione specifica della soluzione campione tre volte nello stesso modo per ottenere il valore medio.
- Calcolare la rotazione specifica utilizzando la seguente equazione27:
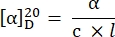
α = rotazione osservata (gradi), c = concentrazione (g/mL), l = lunghezza del percorso (10-1 m).
9. Analisi NMR 1H e 13C
- Preparare circa 0,6-1,0 ml di solvente NMR (CDCl3).
- Sciogliere ~50 mg di campione nel solvente ad una concentrazione di 0,02 M per 1H NMR e 0,05 M per misurazioni NMR 13C.
- Trasferire la soluzione del campione in una provetta NMR utilizzando una pipetta Pasteur.
- Caricare il tubo nello strumento NMR (vedere Tabella dei materiali).
NOTA: le misurazioni NMR sono state eseguite utilizzando spettrometri a 400 MHz o 500 MHz. Numero di spin: 16 (1H NMR), 256 o 512 (13C NMR); tempo di misurazione: 10 min (1H NMR), 20 o 30 min (13C NMR)]. - Registrare gli spettri NMR e analizzare i dati.
NOTA: fare riferimento allo spostamento chimico dello spettro al segnale CDCl3 [δ (spettro NMR 1 H) = 7,26 ppm; δ (spettro NMR 13C) = 77,0 ppm)].
Risultati
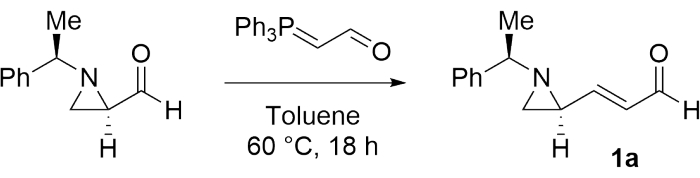
Per studiare la possibilità di preparare una bisaziridina contigua, (E)-3-((S)-1-((R)-1-feniletil)aziridina-2-il)acrilaldeide (1a) è stata sintetizzata per la prima volta come substrato modello secondo la procedura menzionata nella fase 1 (Figura 1)28.
Discussione
La formazione di una miscela inseparabile di diastereomeri è stata occasionalmente osservata nel corso dell'aziridinazione organocatalitica della 3-[1-(1-feniletil)aziridina-2-il)]acrilaldeide chirale, quando N-Boc-O-tosyl o N-Ts-O-tosil idrossilammina è stata utilizzata come fonte di azoto. Inoltre, la resa del prodotto contiguo di bisaziridina è diminuita quando la quantità di diaril-sililetere prolinolo come catalizzatore è stata aumentata da 7 mol% a 20 mol%4...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata sostenuta dalla sovvenzione del Korea Basic Science Institute (National Research Facilities and Equipment Center) finanziata dal Ministero della Pubblica Istruzione (2022R1A6C101A751). Questo lavoro è stato sostenuto anche dalle sovvenzioni della National Research Foundation of Korea (NRF) (2020R1A2C1007102 e 2021R1A5A6002803).
Materiali
| Name | Company | Catalog Number | Comments |
| (R)-(+)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677191 | reagent |
| (R)-1-((R)-1-phenylethyl)aziridine-2-carbaldehyde | Imagene Co.,Ltd. | reagent | |
| (S)-(–)-α,α-Diphenyl-2-pyrrolidinemethanol trimethylsilyl ether | Sigma-Aldrich | 677183 | reagent |
| (S)-2-(diphenyl((trim ethylsilyl)oxy)methyl)pyrrolidine | Sigma-Aldrich | 677183 | reagent |
| (Triphenylphosphoranylidene) acetaldehyde | Sigma-Aldrich | 280933 | reagent |
| 1,2-Dichloroethane | Sigma-Aldrich | 284505 | solvent |
| AB Sciex 4800 Plus MALDI TOFTM (2,5-dihydroxybenzoic acid (DHB) matrix | Sciex | High resolution mass spectra | |
| Acetic acid | Sigma-Aldrich | A6283 | reagent |
| Ammonium chloride | Sigma-Aldrich | 254134 | reagent |
| aniline | Sigma-Aldrich | 132934 | reagent |
| Autopol III digital polarimeter | Rudolph Research Analytical | polarimeter | |
| AVANCE III HD (400 MHz) spectrometer | Bruker | NMR spectrometer | |
| Bruker Ascend 500 (500 MHz) | Bruker | NMR spectrometer | |
| Celite 535 | Sigma-Aldrich | 22138 | For Celite pad |
| Dichloromethane | Sigma-Aldrich | 270997 | solvent |
| Di-tert-butyl dicarbonate | Sigma-Aldrich | 361941 | reagent |
| Ethyl Acetate | Sigma-Aldrich | 270989 | solvent |
| Ethyl nitroacetate | Sigma-Aldrich | 192333 | reagent |
| Imidazole | Sigma-Aldrich | I2399 | reagent |
| INOVA 400WB (400 MHz) | Varian | NMR spectrometer | |
| JMS-700 | JEOL | High resolution mass spectra | |
| Methanol | Sigma-Aldrich | 322415 | solvent |
| N-Boc-O-tosylhydroxylamine | Sigma-Aldrich | 775037 | reagent |
| P-2000 | JASCO | polarimeter | |
| Palladium hydroxide on carbon | Sigma-Aldrich | 212911 | reagent |
| Phenyl-1H-tetrazole-5-thiol | TCI | P0640 | reagent |
| Silica gel | Sigma-Aldrich | 227196 | For flash clromatography |
| Silica gel on TLC plates | Merck | 60768 | TLC plate |
| Sodium acetate | Sigma-Aldrich | S8750 | reagent |
| Sodium azide | Sigma-Aldrich | S2002 | reagent |
| Sodium borohydride | Sigma-Aldrich | 452882 | reagent |
| Sodium carbonate | Sigma-Aldrich | S2127 | reagent |
| tert-Butyldimethylsilyl chloride | Sigma-Aldrich | 190500 | reagent |
| Tetrahydrofuran | Sigma-Aldrich | 401757 | solvent |
| Toluene | Sigma-Aldrich | 244511 | solvent |
| Zinc bromide | Sigma-Aldrich | 230022 | reagent |
| Zinc chloride | Sigma-Aldrich | 429430 | reagent |
Riferimenti
- Anastas, P. T., Warner, J. C. Principles of green chemistry. Green Chemistry: Theory and Practice. 29, (1998).
- Sheldon, R. A., Arends, I. W. C. E., Hanefeld, U. . Green Chemistry and Catalysis. , (2007).
- Trost, B. M. The atom economy-a search for synthetic efficiency. Science. 254 (5037), 1471-1477 (1991).
- Sheldon, R. A. The E factor: fifteen years on. Green Chemistry. 9 (12), 1273-1283 (2007).
- Li, C. J., Trost, B. M. Green chemistry for chemical synthesis. Proceedings of the National Academy of Sciences. 105 (36), 13197-13202 (2008).
- Sheldon, R. A. Fundamentals of green chemistry: efficiency in reaction design. Chemical Society Reviews. 41 (4), 1437-1451 (2012).
- Marion, P., et al. Sustainable chemistry: how to produce better and more from less. Green Chemistry. 19 (21), 4973-4989 (2017).
- Sheldon, R. A. The E factor 25 years on: the rise of green chemistry and sustainability. Green Chemistry. 19 (1), 18-43 (2017).
- Dembitsky, V. M., Terent'ev, A. O., Levitsky, D. O. Aziridine alkaloids: origin, chemistry and activity. Natural Products. , 977-1006 (2013).
- Ham, G. E. Activated aziridines. I. Reaction of anilines with O-ethyl-N,N-ethyleneurethane. mechanism and Hammett ρ-constant. Journal of Organic Chemistry. 29 (10), 3052-3055 (1964).
- Tanner, D. Chiral aziridine-their synthesis and use in stereoselective transformations. Angewandte Chemie International Edition. 33 (6), 599-619 (1994).
- Atkinson, R. S. 3-Acetoxyaminoquinazolinones (QNHOAc) as aziridinating agents: ring-opening of N-(Q)-substituted aziridines. Tetrahedron. 55 (6), 1519-1559 (1999).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Lu, P. Recent developments in regioselective ring opening of aziridines. Tetrahedron. 14 (66), 2549-2560 (2010).
- Ohno, H. Synthesis and applications of vinylaziridines and ethynylaziridines. Chemical Reviews. 114 (16), 7784-7814 (2014).
- Callebaut, G., Meiresonne, T., De Kimpe, N., Mangelinckx, S. Synthesis and reactivity of 2-(carboxymethyl) aziridine derivatives. Chemical Reviews. 114 (16), 7954-8015 (2014).
- Ghosal, N. C., et al. Organocatalysis by an aprotic imidazolium zwitterion: Regioselective ring-opening of aziridines and applicable to gram scale synthesis. Green Chemistry. 18 (2), 565-574 (2016).
- Rai, V. K., Rai, P. K., Bajaj, S., Kumar, A. An unprecedented synthesis of γ-lactams via mercaptoacetylation of aziridines in water. Green Chemistry. 13 (5), 1217-1223 (2011).
- Srivastava, V. P., Yadav, L. D. S. The first example of ring expansion of N-tosylaziridines to 2-aroyl-N-tosylazetidines with nitrogen ylides in an aqueous medium. Green Chemistry. 12 (8), 1460-1465 (2010).
- Stanković, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Ha, H. J., Jung, J. H., Lee, W. K. Application of regio-and stereoselective functional group transformations of chiral aziridine-2-carboxylates. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- D'hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-membered Heterocycles by Ring Expansion: Aza-, Oxa- and Thiaheterocyclic Small-Ring Systems. 1st ed. , (2016).
- Macha, L., Ha, H. -. J. Total synthesis and absolute stereochemical assignment of microgrewiapine A and its stereoisomers. Journal of Organic Chemistry. 84 (1), 94-103 (2019).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Głowacka, I. E., Trocha, A., Wróblewski, A. E., Piotrowska, D. G. N-(1-Phenylethyl) aziridine-2-carboxylate esters in the synthesis of biologically relevant compounds. Beilstein Journal of Organic Chemistry. 15 (1), 1722-1757 (2019).
- JoVE. Organic Chemistry II. Polarimeter. JoVE Science Education Database. , (2022).
- Mao, H., et al. Preparation of chiral contiguous epoxyaziridines and their regioselective ring-opening for drug syntheses. Chemistry-A European Journal. 24 (10), 2370-2374 (2018).
- Vesely, J., Ibrahem, I., Zhao, G. L., Rios, R., Córdova, A. Organocatalytic enantioselective aziridination of α,β-unsaturated aldehydes. Angewandte Chemie International Edition. 11 (46), 778-781 (2007).
- Arai, H., et al. Enantioselective aziridination reaction of α,β-unsaturated aldehydes using an organocatalyst and tert-butyl N-arenesulfonyloxycarbamates. Tetrahedron Letters. 50 (26), 3329-3332 (2009).
- Desmarchelier, A., et al. Organocatalyzed aziridination of α-branched enals: enantioselective synthesis of aziridines with a quaternary stereocenter. European Journal of Organic Chemistry. 20 (2011), 4046-4052 (2011).
- Jiang, H., Halskov, K. S., Johansen, T. K., Jørgensen, K. A. Deracemization of axially chiral α,β-unsaturated aldehydes through an amino-catalyzed symmetry-making-symmetry-breaking cascade. Chemistry-A European Journal. 17 (14), 3842-3846 (2011).
- Deiana, L., et al. Catalytic asymmetric aziridination of α,β-unsaturated aldehydes. Chemistry-A European Journal. 17 (28), 7904-7917 (2011).
- Molnár, I. G., Tanzer, E. M., Daniliuc, C., Gilmour, R. Enantioselective aziridination of cyclic enals facilitated by the fluorine-iminium Ion gauche effect. Chemistry-A European Journal. 20 (3), 794-800 (2014).
- Nemoto, T., et al. Enantioselective synthesis of (R)-Sumanirole using organocatalytic asymmetric aziridination of an α,β-unsaturated aldehyde. Tetrahedron: Asymmetry. 25 (15), 1133-1137 (2014).
- Sim, T. B., et al. A novel synthesis of 5-functionalized oxazolidin-2-ones from enantiomerically pure 2-substituted N-[(R)-(+)-α-methylbenzyl] aziridines. Journal of Organic Chemistry. 68 (1), 104-108 (2003).
- Silva, M. A., Goodman, J. M. Aziridinium ring opening: a simple ionic reaction pathway with sequential transition states. Tetrahedron Letters. 46 (12), 2067-2069 (2005).
- Yun, S. Y., et al. Nucleophile-dependent regioselective ring opening of 2-substituted N,N-dibenzylaziridinium ions: bromide versus hydride. Chemical Communications. (18), 2508-2510 (2009).
- Dolfen, J., et al. Bicyclic aziridinium ions in azaheterocyclic chemistry-preparation and synthetic application of 1-azoniabicyclo [n. 1.0] alkanes. Advanced Synthesis & Catalysis. 358 (22), 3485-3511 (2016).
- D'hooghe, M., et al. Systematic study of halide-induced ring opening of 2-substituted aziridinium salts and theoretical rationalization of the reaction pathways. European Journal of Organic Chemistry. 2010 (25), 4920-4931 (2010).
- Boydas, E. B., et al. Theoretical insight into the regioselective ring-expansions of bicyclic aziridinium ions. Organic & Biomolecular Chemistry. 16 (5), 796-806 (2018).
- Lee, B. K., et al. An efficient synthesis of chiral terminal 1, 2-diamines using an enantiomerically pure [1-(1′ R)-methylbenzyl] aziridine-2-yl] methanol. Tetrahedron. 62 (35), 8393-8397 (2006).
- Ha, H. J., et al. Addition of 1-Boc-2-tert-butyldimethylsilyloxypyrrole to N-methyleneamine equivalents: synthesis of 1-Boc-5-aminomehtyl-2,5-dihydropyrrole-2-ones and 1-Boc-2-oxo-1,7,9-triazaspiro[4,5]-dec-3-ene. Heterocycles. 50 (1), 203-214 (1999).
- Laughlin, R. G. The basicity of aliphatic sulfonamides. Journal of the American Chemical Society. 89 (17), 4268-4271 (1967).
- Moreira, J. A., Rosa da Costa, A. M., García-Río, L., Pessêgo, M. Equilibrium constants and protonation site for N-methylbenzenesulfonamides. Beilstein Journal of Organic Chemistry. 7 (1), 1732-1738 (2011).
- Song, K., et al. Highly active ruthenium metathesis catalysts enabling ring-opening metathesis polymerization of cyclopentadiene at low temperatures. Nature Communications. 10, 3860 (2019).
- Fukuta, Y., et al. De novo synthesis of Tamiflu via a catalytic asymmetric ring-opening of meso-aziridines with TMSN3. Journal of the American Chemical Society. 128 (19), 6312-6313 (2006).
- Jiang, H., et al. Intramolecular radical aziridination of allylic sulfamoyl azides by cobalt (II)-based metalloradical catalysis: effective construction of strained heterobicyclic structures. Angewandte Chemie International Edition. 55 (38), 11604-11608 (2016).
- Righi, G., Bovicelli, P., Barontini, M., Tirotta, I. Dimethyl carbonate in the regio-and stereocontrolled opening of three-membered heterocyclic rings. Green Chemistry. 14 (2), 495-502 (2012).
- Righi, P., et al. Solution- and solid-phase synthesis of 4-hydroxy-4,5-dihydroisoxazole derivatives from enantiomerically pure N-tosyl-2,3-aziridine alcohols. Organic Letters. 4 (4), 497-500 (2002).
- Yadav, N. N., Choi, J., Ha, H. -. J. One-pot multiple reactions: asymmetric synthesis of 2, 6-cis-disubstituted piperidine alkaloids from chiral aziridine. Organic & Biomolecular Chemistry. 14 (27), 6426-6434 (2016).
- Rhee, H. J., et al. Preparation and utilization of contiguous bisaziridines as chiral building blocks. Advanced Synthesis & Catalysis. 363 (13), 3250-3257 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon