A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصنيع واستخدام سقالات الجينات الجافة الكبيرة المسامية للنقل الفيروسي للخلايا التائية
In This Article
Summary
فيما يلي بروتوكول لإنشاء سقالات ألجينات جافة كبيرة المسام تتوسط في نقل الجينات الفيروسية الفعالة لاستخدامها في الهندسة الوراثية للخلايا التائية ، بما في ذلك الخلايا التائية للعلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية. تبين أن السقالات تقوم بتحويل الخلايا التائية الأولية المنشطة بنسبة >85٪.
Abstract
أصبحت الهندسة الوراثية للخلايا التائية للعلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية في طليعة علاج السرطان على مدى السنوات القليلة الماضية. يتم إنتاج الخلايا التائية ذات مستقبلات المستضدات الوهمية عن طريق نقل الجينات الفيروسية إلى الخلايا التائية. يتضمن المعيار الذهبي الحالي لنقل الجينات الفيروسية تدوير الصفائح المغلفة بالريترونيكتين ، وهو أمر مكلف ويستغرق وقتا طويلا. هناك حاجة كبيرة لطرق فعالة وفعالة من حيث التكلفة لتوليد الخلايا التائية ذات مستقبلات المستضدات الوهمية. الموصوفة هنا هي طريقة لتصنيع سقالات ألجينات غير مكلفة وجافة كبيرة المسام ، والمعروفة باسم سقالات Drydux ، والتي تعزز بكفاءة النقل الفيروسي للخلايا التائية المنشطة. تم تصميم السقالات لاستخدامها بدلا من الدوران القياسي الذهبي للصفائح المطلية بالريترونيكتين المزروعة بالفيروس وتبسيط عملية تحويل الخلايا. يتم ربط الجينات مع الكالسيوم-D-gluconate وتجميدها طوال الليل لإنشاء السقالات. يتم تجفيف السقالات المجمدة بالتجميد في مجفف بالتجميد لمدة 72 ساعة لإكمال تكوين السقالات الجافة التي يسهل اختراقها. تتوسط السقالات في نقل الجينات الفيروسية عندما يتم زرع الفيروس والخلايا التائية المنشطة معا فوق السقالة لإنتاج خلايا معدلة وراثيا. تنتج السقالات >85٪ من نقل الخلايا التائية الأولية ، وهو ما يمكن مقارنته بكفاءة نقل الدوران على الألواح المطلية بالريترونيكتين. توضح هذه النتائج أن سقالات الجينات الجافة التي يسهل اختراقها تعمل كبديل أرخص وأكثر ملاءمة لطريقة النقل التقليدية.
Introduction
برز العلاج المناعي كنموذج ثوري لعلاج السرطان نظرا لقدرته على استهداف الأورام على وجه التحديد ، والحد من السمية الخلوية خارج الهدف ، ومنع الانتكاس. على وجه الخصوص ، اكتسب العلاج بالخلايا الخيمرية لمستقبلات المستضد T (CAR-T) شعبية بسبب نجاحه في علاج الأورام اللمفاوية وسرطان الدم. وافقت إدارة الغذاء والدواء الأمريكية على أول علاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية في عام 2017 ، ومنذ ذلك الحين ، وافقت على أربعة علاجات أخرى للخلايا التائية ذات مستقبلات المستضدات الوهمية1،2،3،4،5. تحتوي CARs على مجال التعرف على المستضد يتكون عادة من جزء متغير سلسلة واحدة من جسم مضاد وحيد النسيلة خاص بمستضدمرتبط بالورم 3,4. عندما يتفاعل CAR مع المستضد المرتبط بالورم ، يتم تنشيط الخلايا التائية CAR-T ، مما يؤدي إلى استجابة مضادة للأورام تتضمن إطلاق السيتوكين ، وتحلل الخلايا ، وتعبير عامل النسخ ، وتكاثر الخلايا التائية. لإنتاج الخلايا التائية ذات مستقبلات المستضدات الوهمية ، يتم جمع الدم من المريض للحصول على الخلايا التائية. تضاف مستقبلات المستضدات الخيمرية وراثيا إلى الخلايا التائية للمريض باستخدام فيروس. تزرع الخلايا التائية ذات مستقبلات المستضدات الوهمية في المختبر وتغرس مرة أخرى في المريض2،3،4،6. يتم تحديد التوليد الناجح للخلايا التائية ذات مستقبلات المستضدات الوهمية من خلال كفاءة النقل ، والتي تصف عدد الخلايا التائية المعدلة وراثيا إلى خلايا تائية ذات مستقبلات المستضدات الوهمية.
حاليا ، المعيار الذهبي لتوليد الخلايا التائية ذات مستقبلات المستضدات الوهمية هو دوران الخلايا التائية المنشطة والفيروس على الألواح المطلية بالريترونيكتين 7,8. يبدأ النقل عندما تتفاعل الجسيمات الفيروسية مع سطح الخلايا التائية. يعزز Retronectin التمركز المشترك للفيروس والخلايا عن طريق زيادة كفاءة الربط بين الجسيمات الفيروسية والخلايا ، مما يعزز النقل 7,8. لا يعمل Retronectin بشكل جيد من تلقاء نفسه ويحتاج إلى أن يكون مصحوبا بالدوران ، مما يعزز نقل الجينات عن طريق تركيز الجسيمات الفيروسية وزيادة نفاذية سطح الخلية التائية ، مما يسمح بعدوى فيروسية أسهل8. على الرغم من نجاح الدوران على الألواح المطلية بالريترونيكتين ، إلا أنها عملية معقدة تتطلب دورات دوران متعددة وكواشف باهظة الثمن. لذلك ، فإن الطرق البديلة لنقل الجينات الفيروسية الأسرع والأرخص مرغوبة للغاية.
الجينات هي عديد السكاريد الأنيوني الطبيعي المستخدم على نطاق واسع في الصناعة الطبية الحيوية نظرا لتكلفتها المنخفضة ، وملف السلامة الجيد ، والقدرة على تكوين الهلاميات المائية عند الاختلاط مع الكاتيونات ثنائية التكافؤ9،10،11،12. الجينات عبارة عن بوليمر متوافق مع GMP ومعترف به عموما على أنه آمن (GRAS) من قبل إدارة الغذاء والدواءالأمريكية 13. يؤدي ربط الجينات مع الكاتيونات إلى إنشاء هلاميات مائية مستقرة تستخدم غالبا في التئام الجروح ، وتوصيل الأدوية والبروتينات الكيميائية الصغيرة ، ونقل الخلايا9،10،11،12،14،15،16. نظرا لخصائص التبلور الممتازة ، فإن الجينات هي المادة المفضلة لإنشاء سقالات مسامية عن طريق التجفيف بالتجميد10,17. هذه الخصائص للجينات تجعلها مرشحا جذابا لإنتاج سقالة يمكنها التوسط في نقل الجينات الفيروسية للخلايا المنشطة.
يوصف هنا بروتوكول لصنع سقالات الجينات الجافة الكبيرة التي يسهل اختراقها ، والمعروفة باسم سقالات Drydux ، والتي تنقل الخلايا التائية بشكل ثابت عن طريق نقل الجينات الفيروسية17,18. يوضح الشكل 1 عملية صنع هذه السقالات. هذه السقالات تلغي الحاجة إلى تدوير الألواح المطلية بالريترونيكتين. تشجع سقالات الجينات الكبيرة التي يسهل اختراقها تفاعل الجسيمات الفيروسية والخلايا التائية لتمكين نقل الجينات بكفاءة في خطوة واحدة دون التأثير على وظائف وصلاحية الخلايا التائية المهندسة17. عند اتباعها بشكل صحيح ، تتمتع سقالات الجينات الكبيرة التي يسهل اختراقها بكفاءة نقل لا تقل عن 80٪ ، مما يبسط ويقصر عملية النقل الفيروسي.
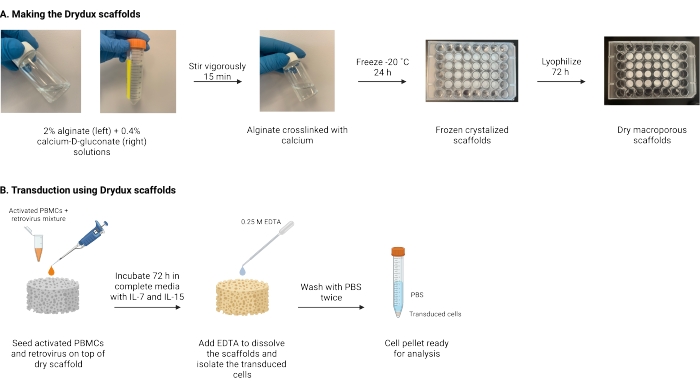
الشكل 1: التخطيطي والجدول الزمني للبروتوكول . (أ) الجدول الزمني لصنع سقالات الألجينات الجافة التي يسهل اختراقها. يرتبط الجينات مع الكالسيوم-D-غلوكونات ويتم تجميده بين عشية وضحاها. يتم تجفيف السقالات المجمدة بالتجميد لمدة 72 ساعة لإنشاء سقالات Drydux. ب: الجدول الزمني لنقل الخلايا المنشطة عبر الفيروس. يتم زرع الخلايا المنشطة والفيروسات (MOI 2) فوق السقالة ويتم تحضينها في وسائط كاملة مكملة ب IL-7 و IL-15. تمتص السقالات الخليط وتعزز نقل الجينات الفيروسية. يستخدم EDTA لإذابة السقالات وعزل الخلايا المحولة. بعد الغسيل مرتين باستخدام PBS ، يمكن استخدام حبيبات الخلية للتحليل. الاختصارات: PBS = محلول ملحي مخزن بالفوسفات ؛ PBMCs = خلايا الدم أحادية النواة المحيطية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
تم تنفيذ جميع الإجراءات التي تنطوي على خلايا الأولوية البشرية ونواقل الفيروسات القهقرية وفقا لإرشادات السلامة البيولوجية لجامعة ولاية كارولينا الشمالية ووافق عليها مكتب الصحة والسلامة البيئية. تم شراء خلايا الدم أحادية النواة المحيطية البشرية كمعاطف بافي من مصادر تجارية. يجب عزل الخلايا البشرية الأولية عن أجزاء المعطف البشري وتتطلب تصريحا من المستوى 2 للسلامة البيولوجية وإجراءات تشغيل قياسية مفصلة وموافقة من المؤسسة التي سيتم فيها العمل. ويمكن تصنيف النواقل الفيروسية، بما في ذلك المواد الطافية للناقلات الفيروسية الرجعية المستخدمة في النقل المعد على النحو الموصوف سابقا19، إما على أنها مستوى السلامة الأحيائية 1 أو مستوى السلامة الأحيائية 2 اعتمادا على البروتين المشفر وتتطلب موافقة لجنة السلامة الأحيائية المؤسسية ذات الصلة.
1. صنع سقالات الجينات الكبيرة التي يسهل اختراقها
- تحضير محلول مخزون بنسبة 0.4٪ (الوزن لكل حجم) غلوكونات الكالسيوم D عن طريق إضافة الماء منزوع الأيونات المعقم المصفى إلى غلوكونات الكالسيوم D في دورق زجاجي. يقلب على سرعة متوسطة حتى يذوب غلوكونات الكالسيوم (~ 1.5 ساعة) ، وفلتر معقم ، ويخزن في درجة حرارة الغرفة.
ملاحظة: ليس من الضروري التحقق من درجة الحموضة في المحلول. - تحضير محلول من 2 ٪ (الوزن لكل حجم) الجينات في قارورة غطاء المسمار أو دورق. أضف بعناية الجينات فائقة النقاء إلى الوعاء وأضف الماء منزوع الأيونات المعقم المصفى إلى الجينات. اختر أكبر شريط تحريك ممكن لن يعيق الخلط وأضفه إلى الوعاء.
ملاحظة: يمكن العثور على معلومات حول نوع الجينات فائقة النقاء المستخدمة في هذا البروتوكول في جدول المواد وعلى موقع Novamatrix20. لم يتم استكشاف الجينات المختلفة لهذه السقالات ، لأنها يمكن أن تؤدي إلى تغييرات غير مرغوب فيها في المسامية والتوافق الحيوي للسقالات9،10،11. - حرك المحلول على سرعة عالية حتى يذوب الجينات (~ 1 ساعة). إذا كانت هناك كتل كبيرة على جانبي السفينة ، فقم بإمالة الوعاء لإزاحتها. سوف تذوب كميات صغيرة من الجينات على الجانبين مع التحريك ولا تدعو للقلق.
ملاحظة: ليس من الضروري التحقق من درجة الحموضة في المحلول. - عندما يذوب الألجينات ، قلل من سرعة التحريك ، وأضف ببطء حجما متساويا من غلوكونات الكالسيوم D بنسبة 0.4٪ إلى محلول الجينات لمنع تكون كتل التشابك ، وحركه بقوة لمدة 15 دقيقة.
- قم بإمالة الدورق أو القارورة جانبا لإزالة أي كتل قد تكون تكونت.
ملاحظة: يوصى باستخدام الخالط. يجب أن يكون الحل النهائي واضحا بصريا. - ماصة الحجم المطلوب من الحل في كل بئر من لوحة 48 بئر أو لوحة 24 بئر. استخدم 300 ميكرولتر / بئر للوحة 48 بئرا و 1 مل / بئر للوحة 24 بئر. يلقي ببطء وتغيير النصائح بشكل متكرر ، لأن الحل سيكون لزجا وسوف يلتصق بالطرف.
- غطي الأطباق بأغطية وجمدها طوال الليل عند -20 درجة مئوية.
- قم بإعداد اللوحة لجهاز التجفيف بالتجميد عن طريق إزالة الغطاء وتأمين الجزء العلوي بمناديل وأربطة مطاطية. ضع الألواح في قوارير مجفف بالتجميد سعة 750 مل إلى 2000 مل ، وضعها على جهاز التجفيف بالتجميد لمدة 72 ساعة.
- بعد 72 ساعة ، أخرج اللوحة من جهاز التجفيد واستبدل الغطاء. أغلق الطبق وخزنه في درجة حرارة 4 درجات مئوية. للتخزين على المدى الطويل ، قم بإغلاق اللوحة بالمكنسة الكهربائية قبل التخزين عند 4 درجات مئوية. يحفظ جافا لحين الحاجة.
ملاحظة: اصنع محلولا إضافيا من الكالسيوم والجينات بسبب خطأ في الحجم (تلتصق بعض الجدران بجدران القارورة وأطراف الماصة). على سبيل المثال ، لصنع أربع سقالات في صفيحة ذات 24 بئرا ، يلزم 4 مل من المحلول المشترك (2 مل من الجينات + 2 مل من غلوكونات الكالسيوم D) ، ولكن يوصى بإعداد 2.5 مل من محلول ألجينات 2٪ و 2.5 مل من محلول غلوكونات الكالسيوم D بنسبة 0.4٪.
2. النقل
- تركيز المادة الطافية الفيروسية باستخدام مرشحات 100 كيلو دالتون
- رطب مرشح الطرد المركزي لمدة 2 دقيقة مع 1 مل من 1x محلول ملحي مخزن بالفوسفات (PBS). تجاهل برنامج تلفزيوني.
- ركز المعلق الفيروسي بإضافة 2 مل من التعليق الفيروسي (1 × 106 وحدة حرارية بريطانية / مل) وطرده بالطرد المركزي من خلال مرشح الطرد المركزي عند 1500 × جم لمدة 10 دقائق في دوار دلو متأرجح.
ملاحظة: هناك حاجة إلى مائتي ميكرولتر من الفيروس المركز لكل سقالة. - تدور لبضع دقائق إضافية إذا كان حجم تعليق الفيروس المركز أكبر من 200 ميكرولتر.
- كرر الخطوات 2.1.1-2.1.3 لكل سقالة.
ملاحظة: من المقبول أيضا تركيز مخزون كبير من الفيروس وأخذ 100-200 ميكرولتر من المخزون المركز.
- الخلايا المنشطة للبذور والفيروس معا.
- لكل سقالة ، قم بإعداد القسمة عن طريق تعليق 1 × 106 خلايا أحادية النواة في الدم المحيطي المنشط (PBMCs) في 50 ميكرولتر من وسائط زراعة الخلايا الكاملة (250 مل من وسائط Click + 250 مل من وسائط RPMI 1640 + 50 مل من مصل الأبقار الجنينية + 5 مل من بديل الجلوتامين + 5 مل من البنسلين / الستربتومايسين).
ملاحظة: راجع الملف التكميلي 1 للحصول على بروتوكول حول كيفية تنشيط PBMCs. - أضف المادة الطافية الفيروسية المركزة (~ 2 × 106 TU، MOI 2) إلى معلق الخلية. يجب ألا يتجاوز الحجم الإجمالي لتعليق فيروس الخلية 200 ميكرولتر لسقالة 48 بئرا أو 350 ميكرولتر لسقالة 24 بئرا.
- أضف خليط فيروس الخلية بالتنقيط إلى أعلى السقالة الجافة. بالنسبة لتجارب التحكم السلبية ، استخدم وسائط زراعة الخلايا الكاملة بدلا من الفيروس المركز. أضف معلق الخلية إلى الجزء العلوي من السقالة الجافة.
- كرر الخطوات 2.2.1-2.2.3 لكل سقالة.
- احتضان السقالات في حاضنة زراعة الخلايا عند 37 درجة مئوية لمدة 45-60 دقيقة. إزالة السقالات من الحاضنة. سوف تمتص السقالات المحلول بالكامل خلال هذا الوقت.
- للحث على الانتشار، تضاف وسائط زراعة خلوية كاملة مكملة ب IL-15 (5 نانوغرام/مل) وIL-7 (10 نانوغرام/مل) إلى كل بئر؛ يمكن أيضا استخدام IL-2. أضف 500 ميكرولتر إلى كل سقالة 48 بئرا أو 1 مل إلى كل سقالة 24 بئرا.
- احتضان السقالات عند 37 درجة مئوية لمدة 72 ساعة. مع تكاثر الخلايا ، ستتحول الوسائط إلى اللون البرتقالي.
- لكل سقالة ، قم بإعداد القسمة عن طريق تعليق 1 × 106 خلايا أحادية النواة في الدم المحيطي المنشط (PBMCs) في 50 ميكرولتر من وسائط زراعة الخلايا الكاملة (250 مل من وسائط Click + 250 مل من وسائط RPMI 1640 + 50 مل من مصل الأبقار الجنينية + 5 مل من بديل الجلوتامين + 5 مل من البنسلين / الستربتومايسين).
- عزل الخلايا من السقالات لتحليلها.
- قم بتخفيف 0.5 م EDTA إلى 0.25 M EDTA في 1x PBS.
- قم بإزالة الوسط الزائد من كل بئر وقم بتجميعه في أنابيب طرد مركزي منفصلة سعة 15 مل.
- لعزل الخلايا عن السقالة ، أضف 0.25 M EDTA إلى كل سقالة. أضف 300 ميكرولتر إلى سقالات 48 بئرا أو 1 مل إلى سقالات 24 بئرا. دع الطبق يجلس أو يحرك برفق لمدة 3-4 دقائق.
- بمجرد إذابة السقالة في الغالب ، قم بإدخال ماصة وإخراجها برفق داخل البئر. قد تكون بعض خطوات السحب للداخل والخارج ضرورية لإذابة السقالة بالكامل. إذا لم يذوب في 10 دقائق ، أضف 200 ميكرولتر أخرى من 0.25 M EDTA.
- بمجرد أن تذوب السقالة تماما ، انقل المحلول إلى أنبوب طرد مركزي سعة 15 مل.
- كرر الخطوتين 2.3.4 و 2.3.5 لكل سقالة.
- اغسل الخلايا مرتين بإضافة 12 مل PBS إلى كل أنبوب طرد مركزي والطرد المركزي عند 400 × جم لمدة 5 دقائق. سوف تتشكل بيليه الخلية في الجزء السفلي من كل أنبوب. نضح الطاف وكرر الغسيل. احرص على شفط المادة الطافية بالكامل مع كل غسلة لأنه من الضروري إزالة كل EDTA.
- بعد الغسيل الثاني باستخدام PBS ، أصبحت حبيبات الخلية جاهزة الآن للتحليل. اتبع البروتوكول المناسب المطلوب للتحليل.
النتائج
من السهل صنع سقالات الجينات الكبيرة التي يسهل اختراقها ويجب أن تخرج من جهاز التجفيف بالتجميد كأقراص مسامية ورقيقة وبيضاء. على الرغم من عدم دراسته في هذه التجربة ، يمكن صب محلول ألجينات الكالسيوم في قوالب مختلفة لإنشاء سقالات بأشكال مختلفة ، اعتمادا على احتياجات المستخدم 9,...
Discussion
يستمر العلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية في اكتساب الاهتمام لكل من التطبيقات البحثية والتجارية. على الرغم من النجاح الذي حققه العلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية في علاج سرطانات الدم، فإن التكلفة العالية للإجراء تحد من استخدامه. يقدم البروتوكول ا...
Disclosures
P.A. و Y.B. مخترعان في براءات الاختراع المتعلقة باستخدام المواد الحيوية لتوليد علاجات الخلايا التائية ذات مستقبلات المستضدات الوهمية. يتلقى Y.B. منحة بحثية برعاية الصناعة تتعلق بالتكنولوجيا العلاجية للخلايا التائية ذات مستقبلات المستضدات الوهمية (لا علاقة لها بهذا العمل). يعلن جميع المؤلفين الآخرين أنه ليس لديهم مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة من خلال أرقام منح المنح R37-CA260223 و R21CA246414. نشكر نواة قياس التدفق الخلوي NCSU على التدريب والتوجيه بشأن تحليل قياس التدفق الخلوي. تم إنشاء المخططات باستخدام Biorender.com
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | - | - | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | - | - | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | - | - | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | - | - | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O'Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 - Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved