Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung und Verwendung von trockenen makroporösen Alginatgerüsten für die virale Transduktion von T-Zellen
In diesem Artikel
Zusammenfassung
Hierin ist ein Protokoll zur Herstellung trockener makroporöser Alginatgerüste, die einen effizienten viralen Gentransfer für den Einsatz in der Gentechnik von T-Zellen, einschließlich T-Zellen für die CAR-T-Zelltherapie, vermitteln. Es wurde gezeigt, dass die Gerüste aktivierte primäre T-Zellen mit >85% Transduktion transduzieren.
Zusammenfassung
Die Gentechnik von T-Zellen für die CAR-T-Zelltherapie ist in den letzten Jahren in den Vordergrund der Krebsbehandlung gerückt. CAR-T-Zellen werden durch viralen Gentransfer in T-Zellen hergestellt. Der derzeitige Goldstandard des viralen Gentransfers beinhaltet die Spinokulation von retronektinbeschichteten Platten, was teuer und zeitaufwendig ist. Es besteht ein erheblicher Bedarf an effizienten und kostengünstigen Methoden zur Erzeugung von CAR-T-Zellen. Hier wird ein Verfahren zur Herstellung kostengünstiger, trockener makroporöser Alginatgerüste, bekannt als Drydux-Gerüste, beschrieben, die die virale Transduktion aktivierter T-Zellen effizient fördern. Die Gerüste sind so konzipiert, dass sie anstelle der Goldstandard-Spinokulation von retronektinbeschichteten Platten, die mit Viren besät sind, verwendet werden und den Prozess zur Übertragung von Zellen vereinfachen. Alginat wird mit Calcium-D-Gluconat vernetzt und über Nacht eingefroren, um die Gerüste zu bilden. Die gefrorenen Gerüste werden in einem Gefriertrockner für 72 h gefriergetrocknet, um die Bildung der trockenen makroporösen Gerüste zu vervollständigen. Die Gerüste vermitteln den viralen Gentransfer, wenn Virus- und aktivierte T-Zellen auf dem Gerüst zusammengesät werden, um genetisch veränderte Zellen zu produzieren. Die Gerüste erzeugen >85% primäre T-Zell-Transduktion, was mit der Transduktionseffizienz der Spinokulation auf retronektinbeschichteten Platten vergleichbar ist. Diese Ergebnisse zeigen, dass trockene makroporöse Alginatgerüste eine kostengünstigere und bequemere Alternative zur herkömmlichen Transduktionsmethode darstellen.
Einleitung
Die Immuntherapie hat sich aufgrund ihrer Fähigkeit, Tumore spezifisch anzugreifen, die Off-Target-Zytotoxizität zu begrenzen und einen Rückfall zu verhindern, zu einem revolutionären Krebsbehandlungsparadigma entwickelt. Insbesondere die chimäre Antigenrezeptor-T (CAR-T) -Zelltherapie hat aufgrund ihres Erfolgs bei der Behandlung von Lymphomen und Leukämien an Popularität gewonnen. Die FDA hat die erste CAR-T-Zelltherapie im Jahr 2017 zugelassen und seitdem vier weitere CAR-T-Zelltherapien 1,2,3,4,5 zugelassen. CARs haben eine Antigenerkennungsdomäne, die normalerweise aus einem einkettigen variablen Fragment eines monoklonalen Antikörpers besteht, der spezifisch für ein tumorassoziiertes Antigen 3,4 ist. Wenn eine CAR mit ihrem tumorassoziierten Antigen interagiert, werden die CAR-T-Zellen aktiviert, was zu einer Antitumorreaktion mit Zytokinfreisetzung, zytolytischer Degranulation, Transkriptionsfaktorexpression und T-Zellproliferation führt. Um CAR-T-Zellen zu produzieren, wird Blut vom Patienten gesammelt, um seine T-Zellen zu erhalten. CARs werden den T-Zellen des Patienten mit Hilfe eines Virus genetisch hinzugefügt. Die CAR-T-Zellen werden in vitro gezüchtet unddem Patienten 2,3,4,6 wieder infundiert. Die erfolgreiche Erzeugung von CAR-T-Zellen wird durch die Transduktionseffizienz bestimmt, die die Anzahl der T-Zellen beschreibt, die genetisch zu CAR-T-Zellen verändert werden.
Derzeit ist der Goldstandard für die CAR-T-Zellerzeugung die Spinokulation von aktivierten T-Zellen und Viren auf retronektinbeschichteten Platten 7,8. Die Transduktion beginnt, wenn Viruspartikel mit der Oberfläche der T-Zellen interagieren. Retronectin fördert die Kolokalisierung von Virus und Zellen, indem es die Bindungseffizienz zwischen den Viruspartikeln und den Zellen erhöht und die Transduktion verbessert 7,8. Retronectin allein wirkt nicht gut und muss von einer Spinokulation begleitet werden, die den Gentransfer verbessert, indem sie die Viruspartikel konzentriert und die Oberflächenpermeabilität der T-Zelle erhöht, was eine leichtere Virusinfektion ermöglicht8. Trotz des Erfolgs der Spinokulation auf retronektinbeschichteten Platten ist es ein komplexer Prozess, der mehrere Spinzyklen und teure Reagenzien erfordert. Daher sind alternative Methoden für den viralen Gentransfer, die schneller und billiger sind, sehr wünschenswert.
Alginat ist ein natürliches anionisches Polysaccharid, das in der biomedizinischen Industrie aufgrund seiner niedrigen Kosten, seines guten Sicherheitsprofils und seiner Fähigkeit, Hydrogele beim Mischen mit zweiwertigen Kationen 9,10,11,12 zu bilden, häufig verwendet wird. Alginat ist ein GMP-konformes Polymer und wird von der FDA13 allgemein als sicher (GRAS) anerkannt. Die Vernetzung von Alginat mit Kationen erzeugt stabile Hydrogele, die häufig in der Wundheilung, der Abgabe kleiner chemischer Medikamente und Proteine und des Zelltransports verwendetwerden 9,10,11,12,14,15,16. Aufgrund seiner hervorragenden Geliereigenschaften ist Alginat das bevorzugte Material zur Herstellung poröser Gerüste durch Gefriertrocknung10,17. Diese Eigenschaften von Alginat machen es zu einem attraktiven Kandidaten für die Herstellung eines Gerüsts, das den viralen Gentransfer aktivierter Zellen vermitteln kann.
Hier wird ein Protokoll zur Herstellung trockener makroporöser Alginatgerüste, bekannt als Drydux-Gerüste, beschrieben, die T-Zellen statisch durch viralen Gentransfer transduzieren17,18. Der Prozess zur Herstellung dieser Gerüste ist in Abbildung 1 dargestellt. Diese Gerüste machen die Spinokulation retronektinbeschichteter Platten überflüssig. Die makroporösen Alginatgerüste fördern die Interaktion von Viruspartikeln und T-Zellen, um einen effizienten Gentransfer in einem einzigen Schritt zu ermöglichen, ohne die Funktionalität und Lebensfähigkeit der technisch hergestellten T-Zellen zu beeinträchtigen17. Bei korrekter Befolgung haben diese makroporösen Alginatgerüste eine Transduktionseffizienz von mindestens 80%, was den viralen Transduktionsprozess vereinfacht und verkürzt.
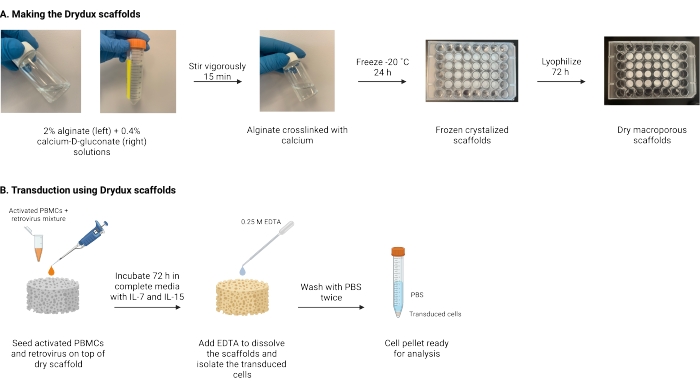
Abbildung 1: Schematische Darstellung und Zeitleiste des Protokolls . (A) Zeitplan für die Herstellung der trockenen makroporösen Alginatgerüste. Alginat wird mit Calcium-D-gluconat vernetzt und über Nacht eingefroren. Die gefrorenen Gerüste werden für 72 h lyophilisiert, um die Drydux-Gerüste herzustellen. (B) Zeitplan für die virale Transduktion aktivierter Zellen. Aktivierte Zellen und Viren (MOI 2) werden auf dem Gerüst ausgesät und in kompletten Medien inkubiert, ergänzt mit IL-7 und IL-15. Die Gerüste absorbieren die Mischung und fördern den viralen Gentransfer. EDTA wird verwendet, um die Gerüste aufzulösen und die transduzierten Zellen zu isolieren. Nach zweimaligem Waschen mit PBS kann das Zellpellet zur Analyse verwendet werden. Abkürzungen: PBS = phosphatgepufferte Kochsalzlösung; PBMCs = periphere mononukleäre Blutzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
Alle Verfahren mit menschlichen Primacy-Zellen und retroviralen Vektoren wurden in Übereinstimmung mit den Richtlinien für biologische Sicherheit der North Carolina State University durchgeführt und vom Environmental Health and Safety Office genehmigt. Menschliche mononukleäre Zellen des peripheren Blutes wurden als Buffy-Mäntel aus kommerziellen Quellen gekauft. Primäre menschliche Zellen müssen aus menschlichen Buffy-Fellfraktionen isoliert werden und erfordern eine Freigabe der Biosicherheitsstufe 2 sowie detaillierte Standardarbeitsanweisungen und die Genehmigung der Institution, in der die Arbeit stattfinden soll. Virale Vektoren, einschließlich der retroviralen Vektorüberstände, die für die zuvor beschriebene Transduktion verwendet werden19, können je nach kodiertem Protein entweder als Biosicherheitsstufe 1 oder Biosicherheitsstufe 2 eingestuft werden und bedürfen der Genehmigung durch den zuständigen institutionellen Ausschuss für biologische Sicherheit.
1. Herstellung der makroporösen Alginatgerüste
- Eine Stammlösung von 0,4% (Gewicht pro Volumen) Calcium-D-Gluconat wird durch Zugabe von steril gefiltertem entionisiertem Wasser zu Calcium-D-Gluconat in einem Becherglas hergestellt. Bei mittlerer Geschwindigkeit umrühren, bis sich das Calciumgluconat aufgelöst hat (~1,5 h), steril filtern und bei Raumtemperatur lagern.
HINWEIS: Es ist nicht notwendig, den pH-Wert der Lösung zu überprüfen. - Bereiten Sie eine Lösung von 2% (Gewicht pro Volumen) Alginat in einer Durchstechflasche oder einem Becherglas mit Schraubverschluss vor. Geben Sie das hochreine Alginat vorsichtig in das Gefäß und fügen Sie dem Alginat steril gefiltertes entionisiertes Wasser hinzu. Wählen Sie den größtmöglichen Rührstab, der das Mischen nicht behindert, und fügen Sie ihn dem Gefäß hinzu.
HINWEIS: Informationen über die Art des hochreinen Alginats, das für dieses Protokoll verwendet wird, finden Sie in der Materialtabelle und auf der Novamatrix-Website20. Verschiedene Alginate wurden für diese Gerüste nicht untersucht, da sie zu unerwünschten Veränderungen der Porosität und Biokompatibilität der Gerüste führen können 9,10,11. - Rühren Sie die Lösung auf hoher Geschwindigkeit, bis sich das Alginat auflöst (~ 1 h). Wenn sich an den Seiten des Gefäßes große Klumpen befinden, neigen Sie das Gefäß, um sie zu entfernen. Kleine Mengen Alginat an den Seiten lösen sich beim Rühren auf und sind kein Grund zur Besorgnis.
HINWEIS: Es ist nicht notwendig, den pH-Wert der Lösung zu überprüfen. - Wenn sich das Alginat auflöst, reduzieren Sie die Rührgeschwindigkeit, fügen Sie der Alginatlösung langsam ein gleiches Volumen von 0,4% Calcium-D-Gluconat hinzu, um die Bildung von Vernetzungsklumpen zu verhindern, und rühren Sie kräftig für 15 min.
- Neigen Sie das Becherglas oder die Durchstechflasche zur Seite, um eventuell gebildete Klumpen zu entfernen.
HINWEIS: Es wird empfohlen, einen Homogenisator zu verwenden. Die endgültige Lösung sollte optisch klar sein. - Pipettieren Sie das gewünschte Volumen der Lösung in jede Vertiefung einer 48-Well-Platte oder 24-Well-Platte. Verwenden Sie 300 μL/Welle für eine 48-Well-Platte und 1 ml/Welle für eine 24-Well-Platte. Gießen Sie langsam und wechseln Sie die Spitzen häufig, da die Lösung viskos ist und an der Spitze haften bleibt.
- Die Teller mit Deckeln abdecken und über Nacht bei -20 °C einfrieren.
- Bereiten Sie die Platte für den Gefriertrockner vor, indem Sie den Deckel entfernen und die Oberseite mit Tüchern und Gummibändern sichern. Legen Sie die Platten in 750 ml bis 2.000 ml Gefriertrocknungskolben und legen Sie sie für 72 h auf den Gefriertrockner.
- Nach 72 h die Platte aus dem Gefriertrockner nehmen und den Deckel wieder einsetzen. Die Platte verschließen und bei 4 °C lagern. Für eine Langzeitlagerung vakuumverschließen Sie die Platte vor der Lagerung bei 4 °C. Trocken lagern, bis sie benötigt werden.
HINWEIS: Stellen Sie aufgrund eines Volumenfehlers eine zusätzliche Calcium-Alginat-Lösung her (einige kleben an den Wänden der Durchstechflasche, Pipettenspitzen). Zum Beispiel, um vier Gerüste in einer 24-Well-Platte herzustellen, sind 4 ml kombinierte Lösung (2 ml Alginat + 2 ml Calcium-D-Gluconat) erforderlich, aber es wird empfohlen, 2,5 ml 2% ige Alginatlösung und 2,5 ml 0,4% ige Calcium-D-Gluconatlösung herzustellen.
2. Transduktion
- Konzentration des viralen Überstands mit 100 kDa-Filtern
- Hydratisieren Sie den Zentrifugalfilter für 2 min mit 1 ml 1x phosphatgepufferter Kochsalzlösung (PBS). Verwerfen Sie den PBS.
- Die virale Suspension wird konzentriert, indem Sie 2 ml Virussuspension (1 × 106 TU/ml) zugeben und durch den Zentrifugalfilter bei 1.500 × g für 10 min in einem schwingenden Schaufelrotor zentrifugieren.
HINWEIS: Pro Gerüst werden ein bis zweihundert Mikroliter konzentriertes Virus benötigt. - Für einige zusätzliche Minuten drehen, wenn das Volumen der konzentrierten Virussuspension größer als 200 μL ist.
- Wiederholen Sie die Schritte 2.1.1-2.1.3 für jedes Gerüst.
HINWEIS: Es ist auch akzeptabel, einen großen Virusvorrat zu konzentrieren und 100-200 μL Aliquots aus dem konzentrierten Bestand zu entnehmen.
- Samenaktivierte Zellen und Virus zusammen.
- Bereiten Sie für jedes Gerüst ein Aliquot vor, indem Sie 1 × 106 aktivierte mononukleäre Blutzellen (PBMCs) in 50 μL vollständiger Zellkulturmedien (250 ml Click-Medien + 250 ml RPMI 1640 Medien + 50 ml fetales Rinderserum + 5 ml Glutaminersatz + 5 ml Penicillin / Streptomycin) suspendieren.
Hinweis: Ein Protokoll zur Aktivierung von PBMCs finden Sie in der Zusatzdatei 1 . - Fügen Sie den konzentrierten viralen Überstand (~2 × 106 TU, MOI 2) zur Zellsuspension hinzu. Das Gesamtvolumen der Zellvirussuspension sollte 200 μL für ein 48-Well-Gerüst oder 350 μL für ein 24-Well-Gerüst nicht überschreiten.
- Fügen Sie die Zell-Virus-Mischung tropfenweise auf die Oberseite des trockenen Gerüsts hinzu. Verwenden Sie für Negativkontrollexperimente vollständige Zellkulturmedien anstelle des konzentrierten Virus. Fügen Sie die Zellsuspension oben auf das trockene Gerüst ein.
- Wiederholen Sie die Schritte 2.2.1-2.2.3 für jedes Gerüst.
- Inkubieren Sie die Gerüste in einem Zellkulturinkubator bei 37 °C für 45-60 min. Entfernen Sie die Gerüste aus dem Inkubator; Die Gerüste absorbieren die Lösung während dieser Zeit vollständig.
- Um die Proliferation zu induzieren, fügen Sie vollständige Zellkulturmedien, ergänzt mit IL-15 (5 ng / ml) und IL-7 (10 ng / ml) zu jeder Vertiefung; IL-2 kann auch verwendet werden. Fügen Sie 500 μL zu jedem 48-Well-Gerüst oder 1 ml zu jedem 24-Well-Gerüst hinzu.
- Die Gerüste bei 37 °C 72 h inkubieren. Wenn sich die Zellen vermehren, werden die Medien orange.
- Bereiten Sie für jedes Gerüst ein Aliquot vor, indem Sie 1 × 106 aktivierte mononukleäre Blutzellen (PBMCs) in 50 μL vollständiger Zellkulturmedien (250 ml Click-Medien + 250 ml RPMI 1640 Medien + 50 ml fetales Rinderserum + 5 ml Glutaminersatz + 5 ml Penicillin / Streptomycin) suspendieren.
- Isolieren Sie Zellen aus den Gerüsten für die Analyse.
- 0,5 M EDTA in 1x PBS auf 0,25 M EDTA verdünnen.
- Entfernen Sie überschüssiges Medium aus jeder Vertiefung und sammeln Sie es in separaten 15-ml-Zentrifugenröhrchen.
- Um Zellen aus dem Gerüst zu isolieren, fügen Sie 0,25 M EDTA zu jedem Gerüst hinzu. Fügen Sie 300 μL zu 48-Well-Gerüsten oder 1 ml zu 24-Well-Gerüsten hinzu. Lassen Sie den Teller 3-4 min ruhen oder rühren Sie ihn vorsichtig um.
- Sobald das Gerüst größtenteils aufgelöst ist, pipettieren Sie vorsichtig im Inneren des Brunnens. Ein paar ein- und ausgehende Pipettierschritte können notwendig sein, um das Gerüst vollständig aufzulösen. Wenn es sich nicht in 10 min auflöst, fügen Sie weitere 200 μL 0,25 M EDTA hinzu.
- Sobald sich das Gerüst vollständig aufgelöst hat, geben Sie die Lösung in ein 15-ml-Zentrifugenröhrchen.
- Wiederholen Sie die Schritte 2.3.4 und 2.3.5 für jedes Gerüst.
- Waschen Sie die Zellen zweimal, indem Sie 12 ml PBS in jedes Zentrifugenröhrchen geben und bei 400 × g für 5 min zentrifugieren. Am Boden jedes Röhrchens bildet sich ein Zellpellet. Saugen Sie den Überstand ab und wiederholen Sie die Wäsche. Achten Sie darauf, den Überstand bei jeder Wäsche vollständig abzusaugen, da es wichtig ist, das gesamte EDTA zu entfernen.
- Nach der zweiten Wäsche mit PBS ist das Zellpellet nun bereit für die Analyse. Befolgen Sie das entsprechende Protokoll, das für die Analyse erforderlich ist.
Ergebnisse
Diese makroporösen Alginatgerüste sind einfach herzustellen und sollten als poröse, flauschige und weiße Scheiben aus dem Gefriertrockner kommen. Obwohl in diesem Experiment nicht untersucht, kann Calcium-Alginat-Lösung in verschiedene Formen gegossen werden, um Gerüste unterschiedlicher Form zu erzeugen, abhängig von den Bedürfnissen des Benutzers 9,10. Die Gerüste sind elektrostatisch und können am Deckel der Well-Platte oder an einem behandschuhten F...
Diskussion
Die CAR-T-Zelltherapie gewinnt weiterhin an Interesse sowohl für die Forschung als auch für kommerzielle Anwendungen. Trotz des Erfolgs der CAR-T-Zelltherapie bei der Behandlung von Blutkrebs schränken die hohen Kosten des Verfahrens seine Verwendung ein. Das hier vorgestellte Protokoll stellt eine neue Methode für den viralen Gentransfer von T-Zellen vor, ohne dass eine Spinokulation von retronektinbeschichteten Platten erforderlich ist. Die Herstellung trockener makroporöser Alginatgerüste zur Vermittlung der Tra...
Offenlegungen
P.A. und Y.B. sind Erfinder von Patenten im Zusammenhang mit der Verwendung von Biomaterialien zur Erzeugung von CAR-T-Zelltherapeutika. Y.B. erhält ein von der Industrie gesponsertes Forschungsstipendium im Zusammenhang mit der therapeutischen CAR-T-Zelltechnologie (unabhängig von dieser Arbeit). Alle anderen Autoren erklären, dass sie keine Interessenkonflikte im Zusammenhang mit diesem Artikel haben.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health durch die Grant Award Nummern R37-CA260223, R21CA246414 unterstützt. Wir danken dem NCSU-Durchflusszytometrie-Kern für die Schulung und Anleitung zur Durchflusszytometrie-Analyse. Schaltpläne wurden mit Biorender.com erstellt
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | - | - | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | - | - | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | - | - | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | - | - | 1 x 106 TU/mL |
Referenzen
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O'Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 - Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten