A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור ושימוש בפיגומי אלגינט מקרו-נקבוביים יבשים להתמרה נגיפית של תאי T
In This Article
Summary
להלן פרוטוקול ליצירת פיגומי אלגינט מקרו-נקבוביים יבשים המתווכים העברת גנים נגיפית יעילה לשימוש בהנדסה גנטית של תאי T, כולל תאי T לטיפול בתאי CAR-T. הודגם כי הפיגומים מתמרים תאי T ראשוניים פעילים עם התמרה של >85%.
Abstract
הנדסה גנטית של תאי T לטיפול בתאי CAR-T הגיעה לחזית הטיפול בסרטן בשנים האחרונות. תאי CAR-T מיוצרים על ידי העברת גנים נגיפיים לתאי T. תקן הזהב הנוכחי של העברת גנים ויראליים כרוך בספינוקולציה של צלחות מצופות רטרונקטין, שהיא יקרה וגוזלת זמן. קיים צורך משמעותי בשיטות יעילות וחסכוניות ליצירת תאי CAR-T. מתוארת כאן שיטה לייצור פיגומי אלגינט מקרו-נקבוביים זולים ויבשים, המכונים פיגומי Drylux, המקדמים ביעילות התמרה נגיפית של תאי T פעילים. הפיגומים מתוכננים לשימוש במקום ספינוקולציה בתקן זהב של צלחות מצופות רטרונקטין שנזרעו בנגיף ולפשט את תהליך התמרת התאים. אלגינט מקושר באופן צולב עם סידן-D-גלוקונאט וקפוא למשך הלילה ליצירת הפיגומים. הפיגומים הקפואים מיובשים בהקפאה בליאופיליזר למשך 72 שעות כדי להשלים את היווצרות הפיגומים המקרו-נקבוביים היבשים. הפיגומים מתווכים העברת גנים נגיפית כאשר נגיפים ותאי T מופעלים נזרעים יחד על גבי הפיגום כדי לייצר תאים מהונדסים גנטית. הפיגומים מייצרים >85% התמרה של תאי T ראשוניים, הדומה ליעילות ההתמרה של ספינוקולציה על לוחות מצופים רטרונקטין. תוצאות אלה מראות כי פיגומי אלגינט מקרו-נקבוביים יבשים משמשים חלופה זולה ונוחה יותר לשיטת ההתמרות הקונבנציונלית.
Introduction
אימונותרפיה התגלתה כפרדיגמה מהפכנית לטיפול בסרטן בשל יכולתה להתמקד ספציפית בגידולים, להגביל ציטוטוקסיות מחוץ למטרה ולמנוע הישנות. במיוחד, טיפול בתאי קולטן אנטיגן כימרי T (CAR-T) צבר פופולריות בשל הצלחתו בטיפול בלימפומות ולוקמיה. ה-FDA אישר את הטיפול הראשון בתאי CAR-T בשנת 2017, ומאז אישר ארבעה טיפולים נוספים בתאי CAR-T 1,2,3,4,5. ל- CARs יש תחום זיהוי אנטיגן המורכב בדרך כלל מקטע משתנה שרשרת יחיד של נוגדן חד שבטי שהוא ספציפי לאנטיגןהקשור לגידול 3,4. כאשר CAR מקיים אינטראקציה עם האנטיגן הקשור לגידול שלו, תאי CAR-T מופעלים, מה שמוביל לתגובה אנטי-סרטנית הכוללת שחרור ציטוקינים, דה-גרנולציה ציטוליטית, ביטוי גורם שעתוק והתפשטות תאי T. כדי לייצר תאי CAR-T, הדם נאסף מהחולה כדי לקבל את תאי ה- T שלהם. CARs מתווספים גנטית לתאי T של המטופל באמצעות וירוס. תאי CAR-T גדלים במבחנה ומוחדרים בחזרה לחולה 2,3,4,6. ייצור מוצלח של תאי CAR-T נקבע על ידי יעילות ההתמרת, המתארת את מספר תאי ה-T המהונדסים גנטית לתאי CAR-T.
נכון לעכשיו, תקן הזהב לייצור תאי CAR-T הוא ספינוקולציה של תאי T מופעלים ונגיפים על לוחות מצופים רטרונקטין 7,8. ההתמרה מתחילה כאשר חלקיקים נגיפיים מתקשרים עם פני השטח של תאי T. רטרונקטין מקדם קולוקליזציה של נגיף ותאים על ידי הגברת יעילות הקשירה בין חלקיקי הנגיף לתאים, מה שמשפר את הטרנסדוקציה 7,8. רטרונקטין אינו פועל היטב בפני עצמו וצריך להיות מלווה בספינוקולציה, המשפרת את העברת הגנים על ידי ריכוז החלקיקים הנגיפיים והגדלת חדירות פני השטח של תא T, מה שמאפשר זיהום נגיפי קל יותר8. למרות ההצלחה של ספינוקולציה על לוחות מצופים רטרונקטין, זהו תהליך מורכב הדורש מחזורי ספין מרובים וריאגנטים יקרים. לכן, שיטות חלופיות להעברת גנים ויראליים מהירים וזולים יותר רצויות מאוד.
אלגינט הוא רב-סוכר אניוני טבעי הנמצא בשימוש נרחב בתעשייה הביו-רפואית בשל עלותו הנמוכה, פרופיל הבטיחות הטוב ויכולתו ליצור הידרוג'לים בעת ערבוב עם קטיונים דיוולנטיים 9,10,11,12. אלגינט הוא פולימר תואם GMP ובדרך כלל מוכר כבטוח (GRAS) על ידי ה-FDA13. קישור צולב של אלגינט עם קטיונים יוצר הידרוג'לים יציבים המשמשים לעתים קרובות לריפוי פצעים, העברת תרופות כימיות קטנות וחלבונים, והובלת תאים 9,10,11,12,14,15,16. בשל תכונות הג'ל המצוינות שלו, אלגינט הוא החומר המועדף ליצירת פיגומים נקבוביים על ידיייבוש בהקפאה של 10,17. מאפיינים אלה של אלגינט הופכים אותו למועמד אטרקטיבי לייצור פיגום שיכול לתווך העברת גנים נגיפית של תאים פעילים.
הפרוטוקול המתואר כאן הוא פרוטוקול לייצור פיגומי אלגינט מקרו-נקבוביים יבשים, המכונים פיגומי Drylux, המתמרים באופן סטטי תאי T על ידי העברת גנים נגיפיים17,18. תהליך ייצור הפיגומים האלה מוצג באיור 1. פיגומים אלה מבטלים את הצורך בספינוקולציה של לוחות מצופים רטרונקטין. פיגומי האלגינט המקרו-נקבוביים מעודדים אינטראקציה של חלקיקים נגיפיים ותאי T כדי לאפשר העברת גנים יעילה בשלב אחד מבלי להשפיע על הפונקציונליות והכדאיות של תאי T מהונדסים17. כאשר עוקבים אחריהם נכון, פיגומי אלגינט מקרו-נקבוביים אלה הם בעלי יעילות התמרה של לפחות 80%, מה שמפשט ומקצר את תהליך ההתמרה הנגיפית.
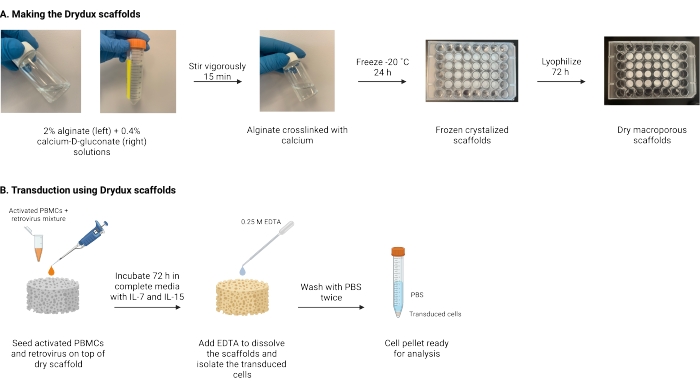
איור 1: סכימה וציר זמן של הפרוטוקול . (A) ציר הזמן להכנת פיגומי אלגינט מקרו-נקבוביים יבשים. אלגינט מקושר באופן צולב עם סידן-D-גלוקונאט וקפוא למשך הלילה. הפיגומים הקפואים עוברים ליופיליזציה למשך 72 שעות כדי ליצור את פיגומי Drydox. (B) ציר הזמן להתמרה נגיפית של תאים פעילים. תאים פעילים ונגיפים (MOI 2) נזרעים על גבי הפיגום ודוגרים במדיה מלאה בתוספת IL-7 ו- IL-15. הפיגומים סופגים את התערובת ומקדמים העברת גנים נגיפית. EDTA משמש להמסת הפיגומים ולבידוד התאים המתמרים. לאחר שטיפה פעמיים עם PBS, כדור התא יכול לשמש לניתוח. קיצורים: PBS = מלח עם מאגר פוספטים; PBMCs = תאי דם חד-גרעיניים היקפיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
כל ההליכים המערבים תאי עליונות אנושית וקטורים רטרו-ויראליים בוצעו בהתאם להנחיות הבטיחות הביולוגית של אוניברסיטת צפון קרוליינה ואושרו על ידי משרד הבריאות והבטיחות הסביבתית. תאי דם חד-גרעיניים של דם היקפי אנושי נרכשו כמעילי באפי ממקורות מסחריים. תאים אנושיים ראשוניים חייבים להיות מבודדים משברי מעיל באפי אנושיים ודורשים אישור Biosafety רמה 2 ונהלי הפעלה סטנדרטיים מפורטים ואישור מהמוסד שבו העבודה אמורה להתבצע. וקטורים נגיפיים, כולל הווקטורים הרטרו-ויראליים המשמשים להתמרה שהוכנה כפי שתואר קודםלכן 19, יכולים להיות מסווגים כ-Biosafety Level 1 או Biosafety Level 2 בהתאם לחלבון המקודד ודורשים אישור מהוועדה הביולוגית המוסדית הרלוונטית.
1. הכנת פיגומי אלגינט מקרו-נקבוביים
- הכינו תמיסת מלאי של 0.4% (משקל לנפח) סידן D גלוקונאט על ידי הוספת מים דה-יוניזציה מסוננים סטריליים לסידן D גלוקונאט בכוס. יש לערבב במהירות בינונית עד שהסידן גלוקונט נמס (~1.5 שעות), מסנן סטרילי ולאחסן בטמפרטורת החדר.
הערה: אין צורך לבדוק את ה- pH של התמיסה. - הכינו תמיסה של 2% (משקל לנפח) אלגינט בבקבוקון או עם מכסה בורג. בזהירות להוסיף את אלגינט ultrapure לכלי ולהוסיף מים מסוננים סטריליים deionized לאלגינט. בחר את סרגל הערבוב הגדול ביותר האפשרי שלא יעכב ערבוב והוסף אותו לכלי.
הערה: מידע על סוג האלגינט האולטרה-טהור המשמש לפרוטוקול זה ניתן למצוא בטבלת החומרים ובאתר Novamatrix20. אלגינטים שונים לא נחקרו עבור פיגומים אלה, מכיוון שהם יכולים להוביל לשינויים לא רצויים בנקבוביות ובתאימות הביולוגית של הפיגומים 9,10,11. - מערבבים את התמיסה במהירות גבוהה עד שהאלגינט מתמוסס (~1 שעות). אם יש גושים גדולים בצידי הספינה, הטה את כלי השיט כדי לעקור אותם. כמויות קטנות של אלגינט בצדדים יתמוססו תוך כדי ערבוב ואינן מהוות סיבה לדאגה.
הערה: אין צורך לבדוק את ה- pH של התמיסה. - כאשר האלגינט מתמוסס, הפחיתו את מהירות הערבוב, הוסיפו באיטיות נפח שווה של 0.4% סידן D גלוקונט לתמיסת האלגינט כדי למנוע היווצרות גושים צולבים, וערבבו במרץ במשך 15 דקות.
- הטה את הכוס או הבקבוקון הצידה כדי להסיר גושים שאולי נוצרו.
הערה: מומלץ להשתמש בהומוגנייזר. הפתרון הסופי צריך להיות ברור אופטית. - לשפוך את הנפח הרצוי של התמיסה לתוך כל באר של צלחת 48 באר או צלחת 24 באר. השתמש ב-300 μL/well עבור צלחת של 48 בארות וב-1 מ"ל/באר עבור צלחת של 24 בארות. יצקו לאט והחליפו טיפים לעתים קרובות, שכן הפתרון יהיה צמיג וייצמד לקצה.
- מכסים את הצלחות במכסים ומקפיאים למשך הלילה בטמפרטורה של -20 מעלות צלזיוס.
- הכינו את הצלחת לליופילייזר על ידי הסרת המכסה ואבטחת החלק העליון באמצעות מגבונים וגומיות. מניחים את הצלחות בבקבוקים של 750 מ"ל עד 2,000 מ"ל ליופיליזר, ומניחים על הליופיליזר למשך 72 שעות.
- לאחר 72 שעות, הסר את הצלחת מהליופילייזר והחלף את המכסה. אטמו את הצלחת ואחסנו בטמפרטורה של 4 מעלות צלזיוס. לאחסון לטווח ארוך, יש לאטום את הצלחת בוואקום לפני האחסון בטמפרטורה של 4 מעלות צלזיוס. יש לשמור על המוצר יבש עד הצורך.
הערה: הכינו תמיסת סידן-אלגינט נוספת עקב טעות בנפח (חלק מהנדבקים לדפנות הבקבוקון, קצות הפיפטה). לדוגמה, כדי ליצור ארבעה פיגומים בצלחת 24 בארות, 4 מ"ל של תמיסה משולבת (2 מ"ל אלגינט + 2 מ"ל סידן D גלוקונט) נדרש, אבל מומלץ להכין 2.5 מ"ל של 2% תמיסת אלגינט ו 2.5 מ"ל של 0.4% סידן D גלוקונאט פתרון.
2. התמרה
- ריכוז של סופרנטנט נגיפי באמצעות מסנני 100 kDa
- הרטיבו את המסנן הצנטריפוגלי למשך 2 דקות עם 1 מ"ל של 1x תמיסת מלח עם אגירת פוספט (PBS). בטל את ה- PBS.
- רכז את המתלה הנגיפי על ידי הוספת 2 מ"ל של תרחיף ויראלי (1 × 106 TU/mL) וצנטריפוגה אותו דרך המסנן הצנטריפוגלי ב 1,500 × גרם במשך 10 דקות ברוטור דלי מתנדנד.
הערה: יש צורך ב-100-200 מיקרוליטרים של נגיף מרוכז לכל פיגום. - סובבו במשך מספר דקות נוספות אם נפח תרחיף הנגיף המרוכז גדול מ-200 μL.
- חזור על שלבים 2.1.1-2.1.3 עבור כל פיגום.
הערה: מקובל גם לרכז מלאי גדול של וירוס ולקחת 100-200 μL aliquots מן המלאי המרוכז.
- זרעים מופעלים תאים ונגיפים יחד.
- עבור כל פיגום, הכינו אליקוט על ידי השהיית 1 × 106 תאי דם חד-גרעיניים היקפיים מופעלים (PBMCs) ב-50 מיקרון של מדיית תרבית תאים מלאה (250 מ"ל מדיה של קליק + 250 מ"ל RPMI 1640 מדיה + 50 מ"ל סרום בקר עוברי + 5 מ"ל תחליף גלוטמין + 5 מ"ל פניצילין/סטרפטומיצין).
הערה: ראה קובץ משלים 1 לקבלת פרוטוקול על אופן ההפעלה של PBMCs. - הוסף את הסופרנטנט הנגיפי המרוכז (~2 × 106 TU, MOI 2) לתליך התא. הנפח הכולל של תרחיף נגיף התא לא יעלה על 200 μL עבור פיגום 48 באר או 350 μL עבור פיגום 24 באר.
- מוסיפים את תערובת הווירוס התאי טיפה לחלק העליון של הפיגום היבש. עבור ניסויי בקרה שלילית, השתמש במדיה מלאה של תרבית תאים במקום הנגיף המרוכז. הוסיפו את מתלה התא לחלק העליון של הפיגום היבש.
- חזור על שלבים 2.2.1-2.2.3 עבור כל פיגום.
- דגירה של הפיגומים באינקובטור של תרבית תאים בטמפרטורה של 37 מעלות צלזיוס למשך 45-60 דקות. הסר את הפיגומים מהאינקובטור; הפיגומים יספגו את התמיסה במלואה במהלך תקופה זו.
- כדי לגרום להתפשטות, הוסיפו מדיה מלאה של תרבית תאים בתוספת IL-15 (5 ננוגרם/מ"ל) ו-IL-7 (10 ננוגרם/מ"ל) לכל באר; IL-2 יכול לשמש גם. יש להוסיף 500 מיקרו-ליטר לכל פיגום של 48 בארות או 1 מ"ל לכל פיגום של 24 בארות.
- לדגום את הפיגומים ב 37 מעלות צלזיוס במשך 72 שעות. ככל שהתאים מתרבים, המדיה תהפוך לכתומה.
- עבור כל פיגום, הכינו אליקוט על ידי השהיית 1 × 106 תאי דם חד-גרעיניים היקפיים מופעלים (PBMCs) ב-50 מיקרון של מדיית תרבית תאים מלאה (250 מ"ל מדיה של קליק + 250 מ"ל RPMI 1640 מדיה + 50 מ"ל סרום בקר עוברי + 5 מ"ל תחליף גלוטמין + 5 מ"ל פניצילין/סטרפטומיצין).
- לבודד תאים מהפיגומים לצורך ניתוח.
- יש לדלל 0.5 M EDTA ל-0.25 M EDTA ב-PBS אחד.
- הסר מדיום עודף מכל באר ואסוף לתוך צינורות צנטריפוגה נפרדים 15 מ"ל.
- כדי לבודד תאים מהפיגום, יש להוסיף 0.25 M EDTA לכל פיגום. יש להוסיף 300 מיקרו-ליטר לפיגומי 48 בארות או 1 מ"ל לפיגומי 24 בארות. תנו לצלחת לשבת או התסיסו בעדינות במשך 3-4 דקות.
- לאחר שהפיגום מומס ברובו, פיפטה פנימה והחוצה בעדינות בתוך הבאר. ייתכן שיהיה צורך בכמה שלבי צנרת פנימה והחוצה כדי להמיס את הפיגום במלואו. אם הוא לא מתמוסס תוך 10 דקות, הוסיפו עוד 200 מיקרון ליטר של 0.25 M EDTA.
- לאחר שהפיגום מתמוסס לחלוטין, העבירו את התמיסה לצינור צנטריפוגה של 15 מ"ל.
- חזור על שלבים 2.3.4 ו- 2.3.5 עבור כל פיגום.
- שטפו את התאים פעמיים על ידי הוספת PBS של 12 מ"ל לכל צינור צנטריפוגה וצנטריפוגה ב-400 × גרם למשך 5 דקות. כדור תא ייווצר בתחתית כל צינור. שאפו את הסופרנטנט וחזרו על הכביסה. הקפידו לשאוף באופן מלא את הסופר-נטנט בכל שטיפה, שכן חשוב להסיר את כל ה-EDTA.
- לאחר השטיפה השנייה עם PBS, כדור התא מוכן כעת לניתוח. בצע את הפרוטוקול המתאים הנדרש לניתוח.
תוצאות
פיגומי אלגינט מקרו-נקבוביים אלה קלים להכנה ואמורים לצאת מהליופילייזר כדיסקים נקבוביים, רכים ולבנים. למרות שלא נחקר בניסוי זה, ניתן ליצוק תמיסת סידן-אלגינט לתבניות שונות כדי ליצור פיגומים בצורות שונות, בהתאם לצרכי המשתמש 9,10. הפיגומים הם אלקטרוסטטיים ועלולי...
Discussion
טיפול בתאי CAR-T ממשיך לצבור עניין הן ביישומים מחקריים והן ביישומים מסחריים. למרות ההצלחה שיש לטיפול בתאי CAR-T בטיפול בסרטן הדם, העלות הגבוהה של ההליך מגבילה את השימוש בו. הפרוטוקול המוצג כאן מציג שיטה חדשה להעברת גנים נגיפיים של תאי T ללא צורך בספינוקולציה של צלחות מצופות רטרונקטין. ייצור פיג...
Disclosures
P.A. ו- Y.B. הם ממציאים על פטנטים הקשורים לשימוש בביו-חומרים לייצור טיפולים בתאי CAR-T. י.ב. מקבל מענק מחקר בחסות התעשייה הקשור לטכנולוגיה טיפולית בתאי CAR-T (שאינו קשור לעבודה זו). כל שאר המחברים מצהירים כי אין להם אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות באמצעות מספרי פרס מענק R37-CA260223, R21CA246414. אנו מודים לליבת הציטומטריה של זרימה NCSU על הדרכה והדרכה בניתוח ציטומטריה של זרימה. סכמות נוצרו עם Biorender.com
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | - | - | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | - | - | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | - | - | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | - | - | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O'Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 - Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved