É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fabricação e Uso de Andaimes Secos de Alginato Macroporoso para Transdução Viral de Células T
Neste Artigo
Resumo
Aqui está um protocolo para a criação de andaimes de alginato macroporoso secos que medeiam a transferência eficiente de genes virais para uso em engenharia genética de células T, incluindo células T para terapia com células CAR-T. Os andaimes demonstraram transduzir células T primárias ativadas com transdução de >85%.
Resumo
A engenharia genética de células T para terapia com células CAR-T chegou à vanguarda do tratamento do câncer nos últimos anos. As células CAR-T são produzidas pela transferência de genes virais para as células T. O atual padrão-ouro de transferência de genes virais envolve a espinoculação de placas revestidas de retronectina, o que é caro e demorado. Há uma necessidade significativa de métodos eficientes e econômicos para gerar células CAR-T. Descrito aqui é um método para a fabricação de andaimes de alginato macroporosos secos e baratos, conhecidos como andaimes Drydux, que promovem eficientemente a transdução viral de células T ativadas. Os andaimes são projetados para serem usados no lugar da espinoculação padrão-ouro de placas revestidas de retronectina semeadas com vírus e simplificam o processo de transdução de células. O alginato é reticulado com cálcio-D-gluconato e congelado durante a noite para criar os andaimes. Os andaimes congelados são liofilizados em um liofilizador por 72 h para completar a formação dos andaimes macroporosos secos. Os andaimes mediam a transferência de genes virais quando o vírus e as células T ativadas são semeados juntos no topo do andaime para produzir células geneticamente modificadas. Os andaimes produzem >85% de transdução primária de células T, o que é comparável à eficiência de transdução da espinoculação em placas revestidas de retronectina. Estes resultados demonstram que os andaimes de alginato macroporoso secos servem como uma alternativa mais barata e conveniente ao método de transdução convencional.
Introdução
A imunoterapia emergiu como um paradigma revolucionário de tratamento do câncer devido à sua capacidade de atingir especificamente tumores, limitar a citotoxicidade fora do alvo e prevenir a recaída. Particularmente, a terapia celular com receptor de antígeno quimérico T (CAR-T) ganhou popularidade devido ao seu sucesso no tratamento de linfomas e leucemias. A FDA aprovou a primeira terapia com células CAR-T em 2017 e, desde então, aprovou mais quatro terapias com células CAR-T 1,2,3,4,5. Os CARs têm um domínio de reconhecimento de antígeno geralmente consistindo de um fragmento variável de cadeia única de um anticorpo monoclonal que é específico para um antígeno associado ao tumor 3,4. Quando um CAR interage com seu antígeno associado ao tumor, as células CAR-T são ativadas, levando a uma resposta antitumoral envolvendo liberação de citocinas, degranulação citolítica, expressão do fator de transcrição e proliferação de células T. Para produzir células CAR-T, o sangue é coletado do paciente para obter suas células T. Os CARs são geneticamente adicionados às células T do paciente usando um vírus. As células CAR-T são cultivadas in vitro e infundidas de volta no paciente 2,3,4,6. A geração bem-sucedida de células CAR-T é determinada pela eficiência de transdução, que descreve o número de células T que são geneticamente modificadas em células CAR-T.
Atualmente, o padrão-ouro para a geração de células CAR-T é a espinoculação de células T ativadas e vírus em placas revestidas de retronectina 7,8. A transdução começa quando as partículas virais se envolvem com a superfície das células T. A retronectina promove a colocalização de vírus e células, aumentando a eficiência de ligação entre as partículas virais e as células, aumentando a transdução 7,8. A retronectina não funciona bem por si só e precisa ser acompanhada de espinoculação, o que aumenta a transferência gênica, concentrando as partículas virais e aumentando a permeabilidade superficial da célula T, permitindo uma infecção viral mais fácil8. Apesar do sucesso da espinoculação em placas revestidas de retronectina, é um processo complexo que requer múltiplos ciclos de rotação e reagentes caros. Portanto, métodos alternativos para a transferência de genes virais que são mais rápidos e mais baratos são altamente desejáveis.
O alginato é um polissacarídeo aniônico natural amplamente utilizado na indústria biomédica devido ao seu baixo custo, bom perfil de segurança e capacidade de formar hidrogéis após a mistura com cátions divalentes 9,10,11,12. O alginato é um polímero compatível com GMP e é geralmente reconhecido como seguro (GRAS) pela FDA13. A reticulação do alginato com cátions cria hidrogéis estáveis frequentemente utilizados na cicatrização de feridas, na entrega de pequenas drogas químicas e proteínas e no transporte celular 9,10,11,12,14,15,16. Devido às suas excelentes propriedades gelificantes, o alginato é o material preferido para criar andaimes porosos por liofilização10,17. Essas características do alginato o tornam um candidato atraente para a produção de um andaime que pode mediar a transferência de genes virais de células ativadas.
Descreve-se aqui um protocolo para a confecção de andaimes de alginato macroporoso secos, conhecidos como andaimes de Drydux, que transduziram estaticamente células T por transferência de genes virais17,18. O processo de fabricação desses andaimes é mostrado na Figura 1. Esses andaimes eliminam a necessidade de espinoculação de placas revestidas de retronectina. Os andaimes de alginato macroporoso estimulam a interação de partículas virais e células T para permitir a transferência eficiente de genes em uma única etapa, sem afetar a funcionalidade e a viabilidade das células T modificadas17. Quando seguidos corretamente, esses andaimes de alginato macroporoso têm uma eficiência de transdução de pelo menos 80%, simplificando e encurtando o processo de transdução viral.
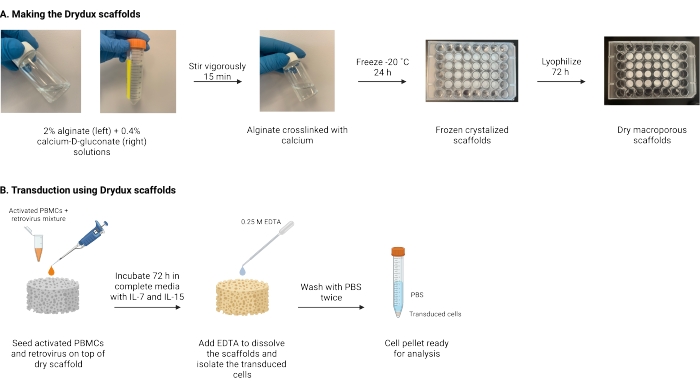
Figura 1: Esquema e linha do tempo do protocolo. (A) Linha do tempo para fazer os andaimes secos de alginato macroporoso. O alginato é reticulado com cálcio-D-gluconato e congelado durante a noite. Os andaimes congelados são liofilizados por 72 h para criar os andaimes Drydux. (B) Cronograma para transdução viral de células ativadas. As células ativadas e o vírus (MOI 2) são semeados no topo do andaime e incubados em meio completo suplementado com IL-7 e IL-15. Os andaimes absorvem a mistura e promovem a transferência de genes virais. O EDTA é usado para dissolver os andaimes e isolar as células transduzidas. Após a lavagem duas vezes com PBS, o pellet celular pode ser usado para análise. Abreviaturas: PBS = solução salina tamponada com fosfato; PBMCs = células mononucleares do sangue periférico. Por favor, clique aqui para ver uma versão maior desta figura.
Protocolo
Todos os procedimentos envolvendo células de primazia humana e vetores retrovirais foram realizados em conformidade com as diretrizes de Segurança Biológica da Universidade Estadual da Carolina do Norte e aprovados pelo Escritório de Saúde e Segurança Ambiental. As células mononucleares do sangue periférico humano foram compradas como casacos de buffy de fontes comerciais. As células humanas primárias devem ser isoladas de frações de pelagem humana e requerem autorização de nível 2 de biossegurança e procedimentos operacionais padrão detalhados e aprovação da instituição onde o trabalho deve ocorrer. Os vetores virais, incluindo os sobrenadantes vetoriais retrovirais utilizados para a transdução preparada conforme descrito anteriormente19, podem ser classificados como Nível de Biossegurança 1 ou Nível de Biossegurança 2, dependendo da proteína codificada e requerem aprovação do comitê de biossegurança institucional relevante.
1. Fazendo os andaimes de alginato macroporoso
- Preparar uma solução-mãe de gluconato D de cálcio a 0,4% (peso por volume) adicionando água desionizada filtrada estéril ao gluconato de cálcio D num copo. Mexa em velocidade média até que o gluconato de cálcio tenha se dissolvido (~1,5 h), filtro estéril e armazenar à temperatura ambiente.
NOTA: Não é necessário verificar o pH da solução. - Prepare uma solução de alginato a 2% (peso por volume) num frasco para injetáveis ou copo de tampa de rosca. Adicione cuidadosamente o alginato ultrapuro ao recipiente e adicione água deionizada filtrada estéril ao alginato. Escolha a maior barra de agitação possível que não impeça a mistura e adicione-a ao recipiente.
NOTA: Informações sobre o tipo de alginato ultrapuro utilizado para este protocolo podem ser encontradas na Tabela de Materiais e no site da Novamatrix20. Diferentes alginatos não foram explorados para esses andaimes, pois podem levar a mudanças indesejadas na porosidade e biocompatibilidade dos andaimes 9,10,11. - Mexa a solução a alta velocidade até que o alginato se dissolva (~1 h). Se houver grandes aglomerados nas laterais do vaso, incline o vaso para desalojá-los. Pequenas quantidades de alginato nos lados se dissolverão durante a agitação e não são motivo de preocupação.
NOTA: Não é necessário verificar o pH da solução. - Quando o alginato se dissolver, reduza a velocidade de agitação, adicione lentamente um volume igual de gluconato D de cálcio a 0,4% à solução de alginato para evitar a formação de aglomerados de reticulação e mexa vigorosamente por 15 min.
- Incline o copo ou o frasco para injetáveis para os lados para remover quaisquer aglomerados que possam ter se formado.
NOTA: Recomenda-se usar um homogeneizador. A solução final deve ser opticamente clara. - Pipetar o volume desejado da solução para cada poço de uma placa de 48 poços ou de 24 poços. Use 300 μL/poço para uma placa de 48 poços e 1 mL/poço para uma placa de 24 poços. Lance devagar e mude as pontas com frequência, pois a solução será viscosa e grudará na ponta.
- Cobrir as placas com tampas e congelar durante a noite a -20 °C.
- Prepare a placa para o liofilizador, removendo a tampa e prendendo o topo com lenços umedecidos e elásticos. Colocar as placas em frascos de liofilizador de 750 mL a 2.000 mL e colocar no liofilizador por 72 h.
- Após 72 h, retire a placa do liofilizador e substitua a tampa. Selar a placa e conservar a 4 °C. Para armazenamento a longo prazo, sele a vácuo a placa antes de armazenar a 4 °C. Mantenha seco até que seja necessário.
NOTA: Faça uma solução extra de cálcio-alginato devido a erro de volume (alguns aderem às paredes do frasco para injetáveis, pontas de pipeta). Por exemplo, para fazer quatro andaimes em uma placa de 24 poços, são necessários 4 mL de solução combinada (2 mL de alginato + 2 mL de gluconato de cálcio D), mas recomenda-se preparar 2,5 mL de solução de alginato a 2% e 2,5 mL de solução de gluconato D de cálcio a 0,4%.
2. Transdução
- Concentração de sobrenadante viral utilizando filtros de 100 kDa
- Hidrate o filtro centrífugo por 2 min com 1 mL de solução salina tamponada com fosfato (PBS) 1x. Descartar o PBS.
- Concentrar a suspensão viral adicionando 2 mL de suspensão viral (1 × 106 TU/mL) e centrifugando-a através do filtro centrífugo a 1.500 × g por 10 min em um rotor de caçamba oscilante.
NOTA: Um a duzentos microlitros de vírus concentrado é necessário por andaime. - Gire por alguns minutos adicionais se o volume concentrado de suspensão do vírus for maior que 200 μL.
- Repita as etapas 2.1.1-2.1.3 para cada andaime.
NOTA: É igualmente aceitável concentrar uma grande unidade populacional de vírus e retirar alíquotas de 100-200 μL da unidade populacional concentrada.
- Células ativadas por sementes e vírus juntos.
- Para cada andaime, preparar uma alíquota suspendendo 1 × 106 células mononucleares ativadas do sangue periférico (PBMCs) em 50 μL de meio de cultura celular completo (250 mL de meio de clique + 250 mL de RPMI 1640 meios + 50 mL de soro fetal bovino + 5 mL de substituto de glutamina + 5 mL de penicilina/estreptomicina).
Observação : consulte Arquivo suplementar 1 para obter um protocolo sobre como ativar PBMCs. - Adicione o sobrenadante viral concentrado (~2 × 106 TU, MOI 2) à suspensão celular. O volume total da suspensão do vírus celular não deve exceder 200 μL para um andaime de 48 poços ou 350 μL para um andaime de 24 poços.
- Adicione a mistura célula-vírus gota a gota na parte superior do andaime seco. Para experimentos de controle negativo, use meios de cultura celular completos no lugar do vírus concentrado. Adicione a suspensão da célula à parte superior do andaime seco.
- Repita as etapas 2.2.1-2.2.3 para cada andaime.
- Incubar os andaimes numa incubadora de cultura celular a 37 °C durante 45-60 min. Remova os andaimes da incubadora; os andaimes absorverão totalmente a solução durante este tempo.
- Para induzir a proliferação, adicionar meios de cultura celular completos suplementados com IL-15 (5 ng/mL) e IL-7 (10 ng/mL) a cada poço; IL-2 também pode ser usado. Adicione 500 μL a cada andaime de 48 poços ou 1 mL a cada andaime de 24 poços.
- Incubar os andaimes a 37 °C durante 72 h. À medida que as células proliferam, a mídia se tornará laranja.
- Para cada andaime, preparar uma alíquota suspendendo 1 × 106 células mononucleares ativadas do sangue periférico (PBMCs) em 50 μL de meio de cultura celular completo (250 mL de meio de clique + 250 mL de RPMI 1640 meios + 50 mL de soro fetal bovino + 5 mL de substituto de glutamina + 5 mL de penicilina/estreptomicina).
- Isole as células dos andaimes para análise.
- Diluir 0,5 M EDTA a 0,25 M EDTA em 1x PBS.
- Remova o excesso de meio de cada poço e colete em tubos de centrífuga separados de 15 mL.
- Para isolar as células do andaime, adicione 0,25 M EDTA a cada andaime. Adicione 300 μL a andaimes de 48 poços ou 1 mL a andaimes de 24 poços. Deixe a placa descansar ou agitar suavemente por 3-4 min.
- Uma vez que o andaime esteja praticamente dissolvido, pipete para dentro e para fora suavemente dentro do poço. Algumas etapas de pipetagem de entrada e saída podem ser necessárias para dissolver completamente o andaime. Se não se dissolver em 10 min, adicione mais 200 μL de 0,25 M EDTA.
- Uma vez que o andaime se dissolva completamente, transfira a solução para um tubo de centrífuga de 15 mL.
- Repita as etapas 2.3.4 e 2.3.5 para cada andaime.
- Lavar as células duas vezes adicionando 12 mL de PBS a cada tubo de centrífuga e centrifugando a 400 × g por 5 min. Um pellet de célula se formará na parte inferior de cada tubo. Aspirar o sobrenadante e repetir a lavagem. Tenha o cuidado de aspirar totalmente o sobrenadante a cada lavagem, pois é crucial remover todo o EDTA.
- Após a segunda lavagem com PBS, o pellet celular está agora pronto para análise. Siga o protocolo apropriado necessário para a análise.
Resultados
Esses andaimes de alginato macroporoso são fáceis de fazer e devem sair do liofilizador como discos porosos, macios e brancos. Embora não estudada neste experimento, a solução de alginato de cálcio pode ser fundida em diferentes moldes para criar andaimes de formas variadas, dependendo das necessidades do usuário 9,10. Os andaimes são eletrostáticos e podem aderir à tampa da placa do poço ou a um dedo enluvado. A Figura 2 ...
Discussão
A terapia celular CAR-T continua a ganhar interesse tanto para pesquisas quanto para aplicações comerciais. Apesar do sucesso que a terapia com células CAR-T teve no tratamento de cânceres no sangue, o alto custo do procedimento limita seu uso. O protocolo aqui apresentado introduz um novo método para a transferência de genes virais de células T sem a necessidade de espinoculação de placas revestidas de retronectina. A produção de andaimes de alginato macroporoso secos para mediar a transdução é relativamen...
Divulgações
P.A. e Y.B. são inventores de patentes relacionadas ao uso de biomateriais para geração de terapias com células CAR-T. Y.B. recebe uma bolsa de pesquisa patrocinada pela indústria relacionada à tecnologia terapêutica de células CAR-T (não relacionada a este trabalho). Todos os outros autores declaram que não têm interesses concorrentes.
Agradecimentos
Este trabalho foi apoiado pelos Institutos Nacionais de Saúde através dos Números de Concessão R37-CA260223, R21CA246414. Agradecemos ao núcleo de citometria de fluxo da NCSU pelo treinamento e orientação na análise da citometria de fluxo. Os esquemas foram criados com Biorender.com
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | - | - | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | - | - | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | - | - | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | - | - | 1 x 106 TU/mL |
Referências
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O'Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 - Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados