このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
T細胞のウイルス形質導入のための乾燥マクロポーラスアルギン酸スキャフォールドの作製と利用
要約
本明細書は、CAR-T細胞療法のためのT細胞を含むT細胞の遺伝子工学において使用するための効率的なウイルス遺伝子導入を媒介する乾燥マクロポーラスアルギン酸スキャフォールドを作成するためのプロトコルである。足場は、活性化された初代T細胞を>85%の形質導入で形質導入することが示された。
要約
CAR-T細胞治療のためのT細胞の遺伝子工学は、ここ数年で癌治療の最前線に来ています。CAR-T細胞は、T細胞へのウイルス遺伝子導入によって産生される。ウイルス遺伝子導入の現在のゴールドスタンダードは、レトロネクチンコーティングプレートのスピンオキュレーションを含み、これは高価で時間がかかります。CAR-T細胞を生成するための効率的で費用効果の高い方法に対する大きなニーズがあります。ここで説明するのは、活性化T細胞のウイルス形質導入を効率的に促進する、Dryduxスキャフォールドとして知られる安価で乾燥したマクロポーラスアルギン酸スキャフォールドを製造する方法です。足場は、ウイルスを播種したレトロネクチンコーティングプレートのゴールドスタンダードのスピンオキュレーションの代わりに使用するように設計されており、細胞を形質導入するプロセスを簡素化します。アルギン酸塩はカルシウム-D-グルコン酸塩と架橋され、一晩凍結して足場を作ります。凍結した足場を凍結乾燥機で72時間凍結乾燥して、乾燥したマクロポーラス足場の形成を完了します。足場は、ウイルスと活性化T細胞が足場の上に一緒に播種されて遺伝子組み換え細胞を生成するときに、ウイルス遺伝子導入を仲介します。足場は>85%の初代T細胞形質導入を生成し、これはレトロネクチンコーティングプレート上のスピンノキュレーションの形質導入効率に匹敵します。これらの結果は、乾燥マクロポーラスアルギン酸スキャフォールドが従来の形質導入法に代わる安価で便利な代替手段として機能することを示しています。
概要
免疫療法は、腫瘍を特異的に標的とし、オフターゲット細胞毒性を制限し、再発を防ぐ能力により、革新的な癌治療パラダイムとして浮上しています。特に、キメラ抗原受容体T(CAR-T)細胞療法は、リンパ腫や白血病の治療に成功したことで人気を博しています。FDAは2017年に最初のCAR-T細胞療法を承認し、それ以来、さらに4つのCAR-T細胞療法を承認しました1,2,3,4,5。CARは、通常、腫瘍関連抗原3,4に特異的であるモノクローナル抗体の一本鎖可変断片からなる抗原認識ドメインを有する。CARが腫瘍関連抗原と相互作用すると、CAR-T細胞が活性化され、サイトカイン放出、細胞溶解性脱顆粒、転写因子発現、およびT細胞増殖を含む抗腫瘍応答を引き起こします。CAR-T細胞を産生するために、患者から血液を採取してT細胞を得る。CARは、ウイルスを使用して患者のT細胞に遺伝的に追加されます。CAR-T細胞はインビトロで増殖し、患者に注入されます2、3、4、6。CAR-T細胞の生成の成功は、CAR-T細胞に遺伝子改変されたT細胞の数を記述する形質導入効率によって決定される。
現在、CAR-T細胞生成のゴールドスタンダードは、レトロネクチンコーティングプレート上での活性化T細胞およびウイルスのスピンオキュレーションである7,8。形質導入は、ウイルス粒子がT細胞の表面と係合するときに始まります。レトロネクチンは、ウイルス粒子と細胞との間の結合効率を高めることによってウイルスと細胞の共局在を促進し、形質導入を増強する7,8。レトロネクチンはそれ自体ではうまく機能せず、ウイルス粒子を濃縮し、T細胞の表面透過性を高めることによって遺伝子導入を促進する脊髄分泌を伴う必要があり、ウイルス感染を容易にします8。レトロネクチンコーティングプレートでのスピンオキュレーションの成功にもかかわらず、それは複数のスピンサイクルと高価な試薬を必要とする複雑なプロセスです。したがって、より迅速かつ安価なウイルス遺伝子導入のための代替方法が非常に望ましい。
アルギン酸塩は、その低コスト、優れた安全性プロファイル、および二価カチオンとの混合時にヒドロゲルを形成する能力のために、生物医学産業で広く使用されている天然アニオン性多糖類です9,10,11,12。アルギン酸塩はGMP準拠のポリマーであり、FDA13によって一般的に安全(GRAS)として認められています。アルギン酸塩を陽イオンと架橋すると、創傷治癒、少量の化学薬品やタンパク質の送達、および細胞輸送によく使用される安定したヒドロゲルが作成されます9、10、11、12、14、15、16。その優れたゲル化特性のために、アルギン酸塩は凍結乾燥によって多孔質足場を作成するための好ましい材料である10,17。アルギン酸塩のこれらの特性は、活性化細胞のウイルス遺伝子導入を媒介することができる足場を製造するための魅力的な候補となる。
ここで説明するのは、ウイルス遺伝子導入によってT細胞を静的に形質導入する、Drydux足場として知られる乾燥マクロポーラスアルギン酸足場を作製するためのプロトコルである17,18。これらの足場を作成するプロセスを図 1 に示します。これらの足場は、レトロネクチンコーティングプレートの脊髄分泌の必要性を排除します。マクロポーラスアルギン酸スキャフォールドは、ウイルス粒子とT細胞の相互作用を促進し、操作されたT細胞の機能および生存率に影響を与えることなく、単一ステップで効率的な遺伝子導入を可能にする17。正しく従えば、これらのマクロポーラスアルギン酸塩足場は、少なくとも80%の形質導入効率を有し、ウイルス形質導入プロセスを単純化および短縮する。
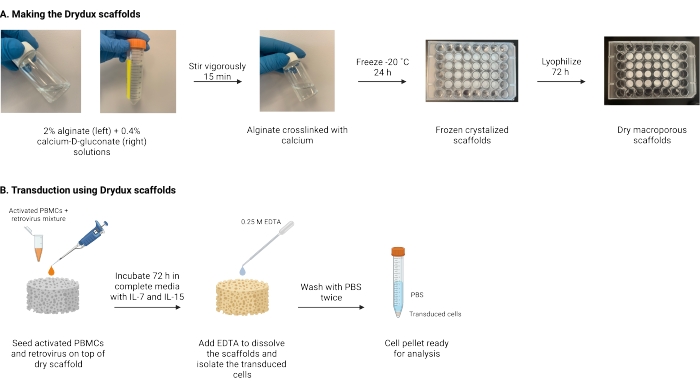
図1:プロトコルの概略図とタイムライン 。 (A)乾燥マクロポーラスアルギン酸塩足場を作製するためのタイムライン。アルギン酸塩はカルシウム-D-グルコン酸塩と架橋され、一晩凍結されます。凍結した足場を72時間凍結乾燥して、Drydux足場を作ります。(B)活性化細胞のウイルス形質導入のタイムライン。活性化細胞およびウイルス(MOI 2)を足場の上に播種し、IL-7およびIL-15を添加した完全培地中でインキュベートする。足場は混合物を吸収し、ウイルス遺伝子導入を促進します。EDTAは、足場を溶解し、形質導入された細胞を単離するために使用されます。PBSで2回洗浄した後、細胞ペレットを分析に使用できます。略語:PBS =リン酸緩衝生理食塩水;PBMC =末梢血単核細胞。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
ヒト優位性細胞とレトロウイルスベクターを含むすべての手順は、ノースカロライナ州立大学の生物学的安全性ガイドラインに準拠して実行され、環境衛生安全局によって承認されました。ヒト末梢血単核細胞は、商業的供給源からバフィーコートとして購入された。初代ヒト細胞は、ヒトバフィーコート画分から単離する必要があり、バイオセーフティレベル2のクリアランスと詳細な標準操作手順、および作業が行われる機関からの承認が必要です。前述のように調製された形質導入に使用されるレトロウイルスベクター上清を含むウイルスベクター19は、コードされたタンパク質に応じてバイオセーフティレベル1またはバイオセーフティレベル2のいずれかに分類することができ、関連する機関のバイオセーフティ委員会からの承認を必要とする。
1. マクロポーラスアルギン酸塩足場の作製
- ビーカー内のDグルコン酸カルシウムに滅菌ろ過された脱イオン水を加えて、0.4%(体積あたりの重量)のカルシウムDグルコン酸塩のストック溶液を調製します。グルコン酸カルシウムが溶解するまで中速で攪拌し(~1.5時間)、滅菌フィルターで、室温で保存します。
注:溶液のpHを確認する必要はありません。 - スクリューキャップバイアルまたはビーカーに2%(体積当たりの重量)アルギン酸塩の溶液を調製する。超高純度アルギン酸塩を容器に注意深く加え、滅菌ろ過された脱イオン水をアルギン酸塩に加えます。混合を妨げない可能な限り最大の攪拌子を選択し、それを容器に追加します。
注:このプロトコルに使用される超高純度アルギン酸塩の種類に関する情報は、材料表およびNovamatrixのウェブサイト20に記載されています。これらの足場については、足場の多孔性および生体適合性に望ましくない変化をもたらす可能性があるため、異なるアルギン酸塩は調査されなかった9,10,11。 - アルギン酸塩が溶解するまで(~1時間)高速で溶液を攪拌します。容器の側面に大きな塊がある場合は、容器を傾けてそれらを取り除きます。側面の少量のアルギン酸塩は攪拌中に溶解し、心配する必要はありません。
注:溶液のpHを確認する必要はありません。 - アルギン酸塩が溶解したら、攪拌速度を下げ、架橋塊の形成を防ぐためにアルギン酸塩溶液に等量の0.4%グルコン酸カルシウムDをゆっくりと加え、15分間激しく攪拌します。
- ビーカーまたはバイアルを横に傾けて、形成された可能性のある塊を取り除きます。
注意: ホモジナイザーを使用することをお勧めします。最終的な解決策は光学的に明確でなければなりません。 - 希望量の溶液を48ウェルプレートまたは24ウェルプレートの各ウェルにピペットで入れます。48ウェルプレートには300 μL/ウェル、24ウェルプレートには1 mL/ウェルを使用します。溶液は粘性があり、先端にくっつくため、ゆっくりとキャストし、チップを頻繁に交換します。
- プレートを蓋で覆い、-20°Cで一晩凍結する。
- 蓋を外し、ワイプと輪ゴムで上部を固定して、凍結乾燥機用のプレートを準備します。プレートを750 mL〜2,000 mLの凍結乾燥フラスコに入れ、凍結乾燥機に72時間置きます。
- 72時間後、凍結乾燥機からプレートを取り外し、蓋を元に戻します。プレートを密封し、4°Cで保存します。長期保存の場合は、プレートを真空シールしてから4°Cで保存してください。必要になるまで乾いた状態に保ちます。
注:容量誤差のために余分なカルシウム-アルギン酸塩溶液を作ります(バイアルの壁、ピペットチップに付着するものもあります)。例えば、24ウェルプレートに4つの足場を作るには、4mLの複合溶液(2mLアルギン酸塩+2mLカルシウムDグルコン酸塩)が必要であるが、2.5mLの2%アルギン酸塩溶液および2.5mLの0.4%カルシウムDグルコン酸塩溶液を調製することが推奨される。
2. 形質導入
- 100 kDaフィルターを用いたウイルス上清の濃度
- 遠心フィルターを1 mLの1xリン酸緩衝生理食塩水(PBS)で2分間水和します。PBS を破棄します。
- 2 mLのウイルス懸濁液(1 ×10 6 TU / mL)を加え、遠心フィルターを通して1,500 × g でスイングバケットローターで10分間遠心分離することにより、ウイルス懸濁液を濃縮します。
注:足場ごとに1〜200マイクロリットルの濃縮ウイルスが必要です。 - 濃縮ウイルス懸濁液量が200 μLを超える場合は、さらに数分間スピンします。
- スキャフォールディングごとに手順 2.1.1-2.1.3 を繰り返します。
注:大量のウイルスを濃縮し、濃縮ストックから100〜200μLのアリコートを採取することもできます。
- 活性化された細胞とウイルスを一緒に播種します。
- 各足場について、1×106 活性化末梢血単核球(PBMC)を50 μLの完全細胞培養培地(250 mLクリック培地 + 250 mL RPMI 1640培地 + 50 mLウシ胎児血清 + 5 mLグルタミン代替物+ 5 mLペニシリン/ストレプトマイシン)に懸濁してアリコートを調製します。
メモ: PBMC のアクティブ化方法に関するプロトコルについては、 補足ファイル 1 を参照してください。 - 濃縮されたウイルス上清(~2 × 106 TU、MOI 2)を細胞懸濁液に加えます。細胞ウイルス懸濁液の総容量は、48ウェル足場の場合は200μL、24ウェル足場の場合は350μLを超えてはなりません。
- 細胞とウイルスの混合物を乾いた足場の上部に滴下します。ネガティブコントロール実験では、濃縮ウイルスの代わりに完全な細胞培養培地を使用します。セル懸濁液を乾いた足場の上部に追加します。
- スキャフォールディングごとに手順 2.2.1 から 2.2.3 を繰り返します。
- スキャフォールドを細胞培養インキュベーター内で37°Cで45〜60分間インキュベートします。インキュベーターから足場を取り外します。足場はこの間に溶液を完全に吸収します。
- 増殖を誘導するには、IL-15(5 ng/mL)およびIL-7(10 ng/mL)を添加した完全な細胞培養培地を各ウェルに追加します。IL-2も使用することができる。各48ウェル足場に500 μL、または各24ウェル足場に1 mLを追加します。
- 足場を37°Cで72時間インキュベートします。細胞が増殖すると、培地はオレンジ色に変わります。
- 各足場について、1×106 活性化末梢血単核球(PBMC)を50 μLの完全細胞培養培地(250 mLクリック培地 + 250 mL RPMI 1640培地 + 50 mLウシ胎児血清 + 5 mLグルタミン代替物+ 5 mLペニシリン/ストレプトマイシン)に懸濁してアリコートを調製します。
- 分析のために足場から細胞を分離します。
- 1x PBSで0.5 M EDTAを0.25 M EDTAに希釈します。
- 各ウェルから余分な培地を取り除き、別々の15 mL遠沈管に集めます。
- スキャフォールドから細胞を単離するには、各スキャフォールドに0.25 M EDTAを追加します。300 μLを48ウェルスキャフォールドに追加するか、1 mLを24ウェルスキャフォールドに追加します。プレートを3〜4分間座らせるか、穏やかに攪拌します。
- 足場がほとんど溶解したら、ウェル内でピペットでゆっくりと出し入れします。足場を完全に溶解するには、いくつかのピペッティングのインとアウトのステップが必要になる場合があります。10分以内に溶解しない場合は、さらに200μLの0.25 M EDTAを追加します。
- 足場が完全に溶解したら、溶液を15 mLの遠沈管に移します。
- スキャフォールドごとに手順 2.3.4 と 2.3.5 を繰り返します。
- 各遠沈管に12 mL PBSを加え、400 × g で5分間遠心分離することにより、細胞を2回洗浄します。セルペレットが各チューブの底に形成されます。上清を吸引し、洗浄を繰り返す。すべてのEDTAを除去することが重要であるため、洗浄するたびに上清を完全に吸引するように注意してください。
- PBSによる2回目の洗浄後、細胞ペレットは分析の準備が整いました。分析に必要な適切なプロトコルに従います。
結果
これらのマクロポーラスアルギン酸塩足場は簡単に作成でき、凍結乾燥機から多孔質でふわふわした白いディスクとして出てくるはずです。この実験では検討されていないが、カルシウム−アルギン酸塩溶液を異なる型に鋳造して、ユーザのニーズに応じて様々な形状の足場を作り出すことができる9、10。足場は静電であり、ウェルプレートの蓋?...
ディスカッション
CAR-T細胞療法は、研究と商業的応用の両方で関心を集め続けています。CAR-T細胞療法が血液がんの治療に成功しているにもかかわらず、この手順の高コストはその使用を制限しています。ここで紹介するプロトコルは、レトロネクチンコーティングプレートの脊髄分泌を必要とせずにT細胞のウイルス遺伝子導入のための新しい方法を紹介します。形質導入を媒介する乾燥マクロポーラスアル?...
開示事項
P.A.およびY.B.は、CAR-T細胞治療薬の生成のための生体材料の使用に関連する特許の発明者である。Y.B.は、CAR-T細胞治療技術に関連する業界支援の研究助成金を受け取ります(この研究とは無関係)。他のすべての著者は、競合する利益がないことを宣言します。
謝辞
この研究は、助成金番号R37-CA260223、R21CA246414を通じて国立衛生研究所によってサポートされました。フローサイトメトリー分析に関するトレーニングとガイダンスを提供してくれたNCSUフローサイトメトリーコアに感謝します。回路図は Biorender.com で作成されました
資料
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | - | - | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | - | - | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | - | - | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | - | - | 1 x 106 TU/mL |
参考文献
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O'Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 - Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved