Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Fabrication et utilisation d’échafaudages d’alginate macroporeux secs pour la transduction virale des lymphocytes T
Dans cet article
Résumé
Voici un protocole pour créer des échafaudages d’alginate macroporeux secs qui interviennent dans le transfert efficace de gènes viraux pour une utilisation dans le génie génétique des cellules T, y compris les cellules T pour la thérapie cellulaire CAR-T. Il a été démontré que les échafaudages transduisaient les lymphocytes T primaires activés avec une transduction de >85%.
Résumé
Le génie génétique des lymphocytes T pour la thérapie cellulaire CAR-T est devenu au premier plan du traitement du cancer au cours des dernières années. Les cellules CAR-T sont produites par transfert de gènes viraux dans les cellules T. L’étalon-or actuel du transfert de gènes viraux implique la spinoculation de plaques recouvertes de rétronectine, ce qui est coûteux et prend beaucoup de temps. Il existe un besoin important de méthodes efficaces et rentables pour générer des cellules CAR-T. La méthode décrite ici est une méthode de fabrication d’échafaudages d’alginate macroporeux secs et peu coûteux, connus sous le nom d’échafaudages Drydux, qui favorisent efficacement la transduction virale des cellules T activées. Les échafaudages sont conçus pour être utilisés à la place de la spinoculation de référence des plaques enrobées de rétronectine ensemencées avec des virus et simplifient le processus de transmission des cellules. L’alginate est réticulé avec du gluconate de calcium D et congelé pendant la nuit pour créer les échafaudages. Les échafaudages congelés sont lyophilisés dans un lyophilisateur pendant 72 h pour compléter la formation des échafaudages macroporeux secs. Les échafaudages servent de médiateur au transfert de gènes viraux lorsque le virus et les lymphocytes T activés sont ensemencés ensemble sur le dessus de l’échafaudage pour produire des cellules génétiquement modifiées. Les échafaudages produisent >85% de transduction primaire des lymphocytes T, ce qui est comparable à l’efficacité de transduction de la spinoculation sur des plaques recouvertes de rétronectine. Ces résultats démontrent que les échafaudages d’alginate macroporeux secs constituent une alternative moins coûteuse et plus pratique à la méthode de transduction conventionnelle.
Introduction
L’immunothérapie est devenue un paradigme révolutionnaire de traitement du cancer en raison de sa capacité à cibler spécifiquement les tumeurs, à limiter la cytotoxicité hors cible et à prévenir les rechutes. En particulier, la thérapie cellulaire à récepteur antigénique chimérique T (CAR-T) a gagné en popularité en raison de son succès dans le traitement des lymphomes et des leucémies. La FDA a approuvé la première thérapie cellulaire CAR-T en 2017 et, depuis lors, a approuvé quatre autres thérapies cellulaires CAR-T 1,2,3,4,5. Les CARs ont un domaine de reconnaissance d’antigène généralement constitué d’un fragment variable à chaîne unique d’un anticorps monoclonal spécifique d’un antigène associé à une tumeur 3,4. Lorsqu’un CAR interagit avec son antigène associé à la tumeur, les cellules CAR-T s’activent, entraînant une réponse antitumorale impliquant la libération de cytokines, la dégranulation cytolytique, l’expression du facteur de transcription et la prolifération des lymphocytes T. Pour produire des cellules CAR-T, le sang est prélevé sur le patient pour obtenir ses cellules T. Les CARs sont génétiquement ajoutés aux lymphocytes T du patient à l’aide d’un virus. Les cellules CAR-T sont cultivées in vitro et réinjectées au patient 2,3,4,6. La génération réussie de cellules CAR-T est déterminée par l’efficacité de transduction, qui décrit le nombre de cellules T génétiquement modifiées en cellules CAR-T.
Actuellement, l’étalon-or pour la génération de cellules CAR-T est la spinoculation des lymphocytes T activés et du virus sur des plaques recouvertes de rétronectine 7,8. La transduction commence lorsque les particules virales s’engagent à la surface des lymphocytes T. La rétronectine favorise la colocalisation du virus et des cellules en augmentant l’efficacité de liaison entre les particules virales et les cellules, améliorant la transduction 7,8. La rétronectine ne fonctionne pas bien seule et doit être accompagnée d’une spinoculation, qui améliore le transfert de gènes en concentrant les particules virales et en augmentant la perméabilité de surface de la cellule T, ce qui facilite l’infection virale8. Malgré le succès de la spinoculation sur des plaques recouvertes de rétronectine, il s’agit d’un processus complexe qui nécessite plusieurs cycles d’essorage et des réactifs coûteux. Par conséquent, d’autres méthodes de transfert de gènes viraux plus rapides et moins coûteuses sont hautement souhaitables.
L’alginate est un polysaccharide anionique naturel largement utilisé dans l’industrie biomédicale en raison de son faible coût, de son bon profil d’innocuité et de sa capacité à former des hydrogels lors du mélange avec des cations divalents 9,10,11,12. L’alginate est un polymère conforme aux BPF et est généralement reconnu comme sûr (GRAS) par la FDA13. L’alginate de réticulation avec les cations crée des hydrogels stables souvent utilisés dans la cicatrisation des plaies, l’administration de petits médicaments chimiques et de protéines, et le transport cellulaire 9,10,11,12,14,15,16. En raison de ses excellentes propriétés gélifiantes, l’alginate est le matériau préféré pour créer des échafaudages poreux par lyophilisation10,17. Ces caractéristiques de l’alginate en font un candidat attrayant pour la production d’un échafaudage capable de servir de médiateur au transfert de gènes viraux de cellules activées.
On décrit ici un protocole de fabrication d’échafaudages d’alginate macroporeux secs, connus sous le nom d’échafaudages Drydux, qui transduisent statiquement les lymphocytes T par transfert de gènes viraux17,18. Le processus de fabrication de ces échafaudages est illustré à la figure 1. Ces échafaudages éliminent le besoin de spinoculation des plaques recouvertes de rétronectine. Les échafaudages d’alginate macroporeux favorisent l’interaction des particules virales et des lymphocytes T pour permettre un transfert efficace des gènes en une seule étape sans affecter la fonctionnalité et la viabilité des lymphocytes T modifiés17. Lorsqu’ils sont suivis correctement, ces échafaudages d’alginate macroporeux ont une efficacité de transduction d’au moins 80%, ce qui simplifie et raccourcit le processus de transduction virale.
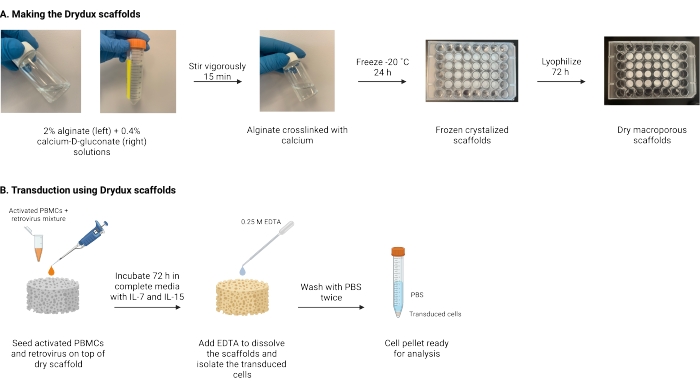
Figure 1 : Schéma et chronologie du protocole. (A) Calendrier de fabrication des échafaudages d’alginate macroporeux secs. L’alginate est réticulé avec le gluconate de calcium D et congelé pendant la nuit. Les échafaudages congelés sont lyophilisés pendant 72 h pour créer les échafaudages Drydux. (B) Chronologie de la transduction virale des cellules activées. Les cellules activées et le virus (MOI 2) sont ensemencés sur le dessus de l’échafaudage et incubés dans des milieux complets supplémentés en IL-7 et IL-15. Les échafaudages absorbent le mélange et favorisent le transfert de gènes viraux. L’EDTA est utilisé pour dissoudre les échafaudages et isoler les cellules transduites. Après avoir été lavé deux fois avec du PBS, le granulé de cellule peut être utilisé pour l’analyse. Abréviations : PBS = solution saline tamponnée au phosphate; PBMC = cellules mononucléées du sang périphérique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Toutes les procédures impliquant des cellules primitives humaines et des vecteurs rétroviraux ont été effectuées conformément aux directives de sécurité biologique de l’Université d’État de Caroline du Nord et approuvées par le Bureau de la santé et de la sécurité environnementales. Des cellules mononucléées du sang périphérique humain ont été achetées sous forme de couches leucocytaires auprès de sources commerciales. Les cellules humaines primaires doivent être isolées des fractions d’enveloppe leucocytaire humaine et nécessitent une autorisation de niveau de biosécurité 2 ainsi que des procédures opérationnelles normalisées détaillées et l’approbation de l’établissement où les travaux doivent avoir lieu. Les vecteurs viraux, y compris les surnageants de vecteurs rétroviraux utilisés pour la transduction préparée comme décrit précédemment19, peuvent être classés au niveau de biosécurité 1 ou au niveau de biosécurité 2 selon la protéine codée et nécessitent l’approbation du comité de biosécurité de l’établissement concerné.
1. Fabrication des échafaudages d’alginate macroporeux
- Préparer une solution mère de gluconate de calcium D à 0,4 % (poids par volume) en ajoutant de l’eau désionisée filtrée stérile au gluconate de calcium D dans un bécher. Mélanger à vitesse moyenne jusqu’à ce que le gluconate de calcium soit dissous (~1,5 h), filtrer stérile et conserver à température ambiante.
NOTE: Il n’est pas nécessaire de vérifier le pH de la solution. - Préparer une solution d’alginate à 2% (poids par volume) dans un flacon à bouchon à vis ou un bécher. Ajouter soigneusement l’alginate ultrapur dans le récipient et ajouter de l’eau désionisée filtrée stérile à l’alginate. Choisissez la plus grande barre d’agitation possible qui n’empêchera pas le mélange et ajoutez-la au récipient.
NOTE: Des informations sur le type d’alginate ultrapur utilisé pour ce protocole peuvent être trouvées dans le tableau des matériaux et sur le site Web de Novamatrix20. Différents alginates n’ont pas été explorés pour ces échafaudages, car ils peuvent entraîner des changements indésirables dans la porosité et la biocompatibilité des échafaudages 9,10,11. - Remuer la solution à grande vitesse jusqu’à ce que l’alginate se dissolve (~1 h). S’il y a de gros touffes sur les côtés du navire, inclinez le récipient pour les déloger. De petites quantités d’alginate sur les côtés se dissolvent pendant l’agitation et ne sont pas préoccupantes.
NOTE: Il n’est pas nécessaire de vérifier le pH de la solution. - Lorsque l’alginate se dissout, réduire la vitesse d’agitation, ajouter lentement un volume égal de gluconate de calcium D à 0,4% à la solution d’alginate pour empêcher la formation de touffes de réticulation et remuer vigoureusement pendant 15 minutes.
- Inclinez le bécher ou le flacon latéralement pour enlever les touffes qui ont pu se former.
REMARQUE: Il est recommandé d’utiliser un homogénéisateur. La solution finale doit être optiquement claire. - Pipeter le volume souhaité de la solution dans chaque puits d’une plaque de 48 puits ou d’une plaque de 24 puits. Utilisez 300 μL/puits pour une plaque de 48 puits et 1 mL/puits pour une plaque de 24 puits. Lancez lentement et changez fréquemment les pointes, car la solution sera visqueuse et collera à la pointe.
- Couvrir les plaques avec des couvercles et congeler toute la nuit à -20 °C.
- Préparez la plaque pour le lyophilisateur en retirant le couvercle et en fixant le dessus avec des lingettes et des élastiques. Placer les plaques dans des flacons lyophilisants de 750 ml à 2 000 ml et les placer sur le lyophiliseur pendant 72 h.
- Après 72 h, retirez la plaque du lyophilisateur et replacez le couvercle. Sceller la plaque et la conserver à 4 °C. Pour un stockage à long terme, sceller sous vide la plaque avant de la conserver à 4 °C. Garder au sec jusqu’à ce que vous en ayez besoin.
REMARQUE: Faire une solution supplémentaire d’alginate de calcium en raison d’une erreur de volume (certains collent aux parois du flacon, pointes de pipette). Par exemple, pour fabriquer quatre échafaudages dans une plaque de 24 puits, 4 mL de solution combinée (2 mL d’alginate + 2 mL de gluconate de calcium D) sont nécessaires, mais il est recommandé de préparer 2,5 mL de solution d’alginate à 2 % et 2,5 mL de solution de gluconate de calcium D à 0,4 %.
2. Transduction
- Concentration du surnageant viral à l’aide de filtres de 100 kDa
- Hydrater le filtre centrifuge pendant 2 min avec 1 mL de 1x solution saline tamponnée au phosphate (PBS). Jetez le PBS.
- Concentrer la suspension virale en ajoutant 2 mL de suspension virale (1 × 106 TU/mL) et la centrifuger à travers le filtre centrifuge à 1 500 × g pendant 10 min dans un rotor de godet oscillant.
REMARQUE: Un à deux cents microlitres de virus concentré sont nécessaires par échafaudage. - Faites tourner pendant quelques minutes supplémentaires si le volume de suspension virale concentrée est supérieur à 200 μL.
- Répétez les étapes 2.1.1 à 2.1.3 pour chaque échafaudage.
NOTA : Il est également acceptable de concentrer un stock important de virus et de prélever de 100 à 200 μL d’aliquotes dans le stock concentré.
- Ensemencer les cellules activées et le virus ensemble.
- Pour chaque échafaudage, préparer une partie aliquote en suspendant 1 × 106 cellules mononucléées activées du sang périphérique (PBMC) dans 50 μL de milieux de culture cellulaire complets (250 mL de média Click + 250 mL de média RPMI 1640 + 50 mL de sérum fœtal bovin + 5 mL de substitut de glutamine + 5 mL de pénicilline/streptomycine).
REMARQUE : consultez le fichier supplémentaire 1 pour obtenir un protocole expliquant comment activer les PBMC. - Ajouter le surnageant viral concentré (~2 × 106 TU, MOI 2) à la suspension cellulaire. Le volume total de la suspension cellule-virus ne doit pas dépasser 200 μL pour un échafaudage de 48 puits ou 350 μL pour un échafaudage de 24 puits.
- Ajouter le mélange cellule-virus goutte à goutte au sommet de l’échafaudage sec. Pour les expériences de contrôle négatif, utiliser des milieux de culture cellulaire complets à la place du virus concentré. Ajouter la suspension cellulaire au sommet de l’échafaudage sec.
- Répétez les étapes 2.2.1 à 2.2.3 pour chaque échafaudage.
- Incuber les échafaudages dans un incubateur de culture cellulaire à 37 °C pendant 45-60 min. Retirez les échafaudages de l’incubateur; Les échafaudages absorberont complètement la solution pendant ce temps.
- Pour induire la prolifération, ajouter des milieux de culture cellulaire complets supplémentés en IL-15 (5 ng/mL) et IL-7 (10 ng/mL) à chaque puits; IL-2 peut également être utilisé. Ajouter 500 μL à chaque échafaudage de 48 puits ou 1 mL à chaque échafaudage de 24 puits.
- Incuber les échafaudages à 37 °C pendant 72 h. Au fur et à mesure que les cellules prolifèrent, le média devient orange.
- Pour chaque échafaudage, préparer une partie aliquote en suspendant 1 × 106 cellules mononucléées activées du sang périphérique (PBMC) dans 50 μL de milieux de culture cellulaire complets (250 mL de média Click + 250 mL de média RPMI 1640 + 50 mL de sérum fœtal bovin + 5 mL de substitut de glutamine + 5 mL de pénicilline/streptomycine).
- Isoler les cellules des échafaudages pour analyse.
- Diluer 0,5 M EDTA à 0,25 M EDTA dans 1x PBS.
- Retirer l’excès de milieu de chaque puits et recueillir dans des tubes à centrifuger séparés de 15 mL.
- Pour isoler les cellules de l’échafaudage, ajoutez 0,25 M d’EDTA à chaque échafaudage. Ajouter 300 μL à des échafaudages à 48 puits ou 1 mL à des échafaudages à 24 puits. Laisser reposer l’assiette ou agiter doucement pendant 3-4 min.
- Une fois que l’échafaudage est en grande partie dissous, pipeter doucement à l’intérieur du puits. Quelques étapes de pipetage vers l’intérieur et vers l’extérieur peuvent être nécessaires pour dissoudre complètement l’échafaudage. S’il ne se dissout pas en 10 min, ajouter 200 μL supplémentaires de 0,25 M d’EDTA.
- Une fois l’échafaudage complètement dissous, transférer la solution dans un tube à centrifuger de 15 mL.
- Répétez les étapes 2.3.4 et 2.3.5 pour chaque échafaudage.
- Lavez les cellules deux fois en ajoutant 12 mL de PBS à chaque tube de centrifugation et en centrifugeant à 400 × g pendant 5 min. Une pastille de cellule se formera au fond de chaque tube. Aspirer le surnageant et répéter le lavage. Veillez à aspirer complètement le surnageant à chaque lavage car il est crucial d’éliminer tout l’EDTA.
- Après le deuxième lavage avec PBS, la pastille de cellule est maintenant prête pour l’analyse. Suivez le protocole approprié requis pour l’analyse.
Résultats
Ces échafaudages d’alginate macroporeux sont faciles à fabriquer et devraient sortir du lyophilisateur sous forme de disques poreux, duveteux et blancs. Bien que non étudiée dans cette expérience, la solution d’alginate de calcium peut être coulée dans différents moules pour créer des échafaudages de formes variables, en fonction des besoins de l’utilisateur 9,10. Les échafaudages sont électrostatiques et peuvent coller au couvercle de la plaque...
Discussion
La thérapie cellulaire CAR-T continue de susciter de l’intérêt pour la recherche et les applications commerciales. Malgré le succès de la thérapie cellulaire CAR-T dans le traitement des cancers du sang, le coût élevé de la procédure limite son utilisation. Le protocole présenté ici introduit une nouvelle méthode pour le transfert de gènes viraux de lymphocytes T sans avoir besoin de spinoculation de plaques recouvertes de rétronectine. La production d’échafaudages d’alginate macroporeux secs pour f...
Déclarations de divulgation
P.A. et Y.B. sont des inventeurs de brevets liés à l’utilisation de biomatériaux pour la génération de thérapies cellulaires CAR-T. Y.B. reçoit une subvention de recherche parrainée par l’industrie liée à la technologie thérapeutique des cellules CAR-T (non liée à ce travail). Tous les autres auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Ce travail a été soutenu par les National Institutes of Health par le biais des numéros d’attribution de subvention R37-CA260223, R21CA246414. Nous remercions le noyau de cytométrie en flux du NCSU pour sa formation et ses conseils sur l’analyse de cytométrie en flux. Les schémas ont été créés avec Biorender.com
matériels
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | - | - | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | - | - | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | - | - | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | - | - | 1 x 106 TU/mL |
Références
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O'Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 - Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon