A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير المقطعي بالإصدار البوزيتروني لتهريب الخلايا: طريقة لوضع العلامات الإشعاعية للخلايا
In This Article
Summary
يظهر هنا بروتوكول لخلايا التسمية الإشعاعية ذات النظائر المشعة للتصوير المقطعي بالإصدار البوزيتروني (PET) ، 89 Zr (t1/2 78.4 h) ، باستخدام سينثون وضع العلامات الإشعاعية الجاهزة للاستخدام ، [89 Zr] Zr-p-isothiocyanatobenzyl-desferrioxamine ([89Zr] Zr-DBN). تسمح خلايا الملصقات الإشعاعية التي تحتوي على [89Zr] Zr-DBN بالتتبع والتصوير غير الباضعين للخلايا ذات العلامات الإشعاعية التي يتم إعطاؤها في الجسم باستخدام التصوير المقطعي بالإصدار البوزيتروني لمدة تصل إلى 7 أيام بعد تناولها.
Abstract
تظهر علاجات الخلايا الجذعية ومستقبلات المستضدات الخيمرية (CAR) كعلاجات واعدة لتجديد الأعضاء وكعلاج مناعي لمختلف أنواع السرطان. على الرغم من التقدم الكبير الذي تم إحرازه في هذه المجالات ، لا يزال هناك المزيد الذي يجب تعلمه لفهم الحرائك الدوائية والديناميكا الدوائية للخلايا العلاجية المدارة في النظام الحي بشكل أفضل. بالنسبة للتتبع غير الجراحي للخلايا باستخدام التصوير المقطعي بالإصدار البوزيتروني (PET) ، تم تطوير طريقة جديدة [89 Zr] Zr-p-isothiocyanatobenzyl-desferrioxamine ([89 Zr] Zr-DBN) بوساطة الوسم الإشعاعي للخلايا باستخدام 89Zr (t1/2 78.4 h). يصف البروتوكول الحالي [89Zr] Zr-DBN بوساطة ، جاهز للاستخدام ، موالفة إشعاعية لوضع العلامات الإشعاعية المباشرة لمجموعة متنوعة من الخلايا ، بما في ذلك الخلايا الجذعية الوسيطة ، والخلايا الجذعية الموجهة بالقلب الموجهة بالنسب ، وخلايا الكبد المتجددة للكبد ، وخلايا الدم البيضاء ، وخلايا سرطان الجلد ، والخلايا المتغصنة. تتيح المنهجية المطورة التصوير غير الجراحي بالتصوير المقطعي بالإصدار البوزيتروني لتهريب الخلايا لمدة تصل إلى 7 أيام بعد الإعطاء دون التأثير على طبيعة أو وظيفة الخلايا ذات العلامات الإشعاعية. بالإضافة إلى ذلك ، يصف هذا البروتوكول طريقة تدريجية للتخليق الإشعاعي ل [89 Zr] Zr-DBN ، وصياغة متوافقة حيويا ل [89 Zr] Zr-DBN ، وإعداد الخلايا لوضع العلامات الإشعاعية ، وأخيرا وضع العلامات الإشعاعية للخلايا باستخدام [89Zr] Zr-DBN ، بما في ذلك جميع التفاصيل المعقدة اللازمة لنجاح وضع العلامات الإشعاعية للخلايا.
Introduction
تكتسب علاجات الخلايا التائية للخلايا الجذعية ومستقبلات المستضد الخيمري (CAR) شعبية وتخضع للتحقيق النشط لعلاج أمراض مختلفة ، مثل فشل عضلة القلب1،2 ، تنكس الشبكية 2 ، الضمور البقعي 2 ، مرض السكري 2 ، احتشاء عضلة القلب3،4،5 ، والسرطانات6،7،8،9 ،10. من بين النهجين المعقولين للعلاج بالخلايا الجذعية ، يمكن إما أن تكون الخلايا الجذعية مغمورة مباشرة في موقع المرض لإحداث استجابة علاجية ، أو إحداث تغييرات في البيئة المكروية لموقع المرض دون الالتزام بموقع المرض لبدء استجابة علاجية غير مباشرة. يمكن أن تسبب الاستجابة العلاجية غير المباشرة تغييرات في البيئة المكروية لموقع المرض عن طريق إطلاق العوامل التي من شأنها إصلاح المرض أو علاجه5. يمكن تقييم هذه الأساليب للعلاجات بالخلايا الجذعية عن طريق التصوير غير الباضع للخلايا الجذعية ذات العلامات الإشعاعية. يمكن أن يربط التصوير غير الباضع امتصاص الخلايا الموسومة إشعاعيا في موقع المرض باستجابة علاجية لفك رموز الاستجابة العلاجية المباشرة مقابل غير المباشرة.
بالإضافة إلى ذلك ، يتم تطوير العلاجات القائمة على الخلايا المناعية لعلاج أنواع مختلفة من السرطان باستخدام CAR T-cell6،7،8،9،10والعلاج المناعي للخلايا المتغصنة11،12. ميكانيكيا ، في العلاج المناعي للخلايا التائية CART 6،7،8،9،10 ، تم تصميم الخلايا التائية للتعبير عن حاتمة ترتبط بمستضد معين على الأورام التي تحتاج إلى علاج. ترتبط هذه الخلايا التائية ذات مستقبلات المستضدات الخيمرية المهندسة ، عند تناولها ، بالمستضد المحدد الموجود على الخلايا السرطانية من خلال تفاعل مستضد الحوامة. بعد الارتباط ، تخضع الخلايا التائية ذات مستقبلات المستضدات الخيمرية المرتبطة للتنشيط ثم تتكاثر وتطلق السيتوكينات ، مما يشير إلى الجهاز المناعي للمضيف لمهاجمة الورم معبرا عن المستضد المحدد. في المقابل ، في حالة علاجات الخلايا المتغصنة11,12 ، تم تصميم الخلايا المتغصنة لتقديم مستضد سرطان معين على سطحها. هذه الخلايا المتغصنة المهندسة ، عند إعطائها ، موطن الغدد الليمفاوية وترتبط بالخلايا التائية في الغدد الليمفاوية. تخضع الخلايا التائية ، عند ارتباطها بمستضدات السرطان المحددة على الخلايا المتغصنة المدارة ، للتنشيط / الانتشار وتبدأ استجابة مناعية للمضيف ضد الورم الذي يعبر عن هذا المستضد المحدد. ومن ثم ، فإن تقييم الاتجار بالخلايا التائية ذات مستقبلات المستضدات الخيمرية المدارة إلى موقع الورم9,10 وتوجيه الخلايا المتغصنة إلى الغدد الليمفاوية11,12 ممكن عن طريق تصوير الخلايا التائية ذات العلامات الإشعاعية والخلايا المتغصنة لتحديد فعالية العلاج المناعي. علاوة على ذلك ، يمكن أن يساعد الاتجار بالخلايا غير الغازية في فهم الإمكانات العلاجية بشكل أفضل ، وتوضيح الاستجابة العلاجية المباشرة مقابل غير المباشرة ، والتنبؤ بالاستجابة العلاجية لكل من الخلايا الجذعية والعلاجات القائمة على الخلايا المناعية ومراقبتها.
تم استكشاف طرق تصوير مختلفة لتهريب الخلايا3،4،9،10،12 ، بما في ذلك التصوير البصري والتصوير بالرنين المغناطيسي (MRI) والتصوير المقطعي المحوسب بإصدار فوتون واحد (SPECT) والتصوير المقطعي بالإصدار البوزيتروني (PET). كل من هذه التقنيات لها مزاياها وعيوبها. من بين هذه ، يعد التصوير المقطعي بالإصدار البوزيتروني أكثر الطرق الواعدة نظرا لطبيعته الكمية وحساسيته العالية ، والتي تعتبر ضرورية للقياس الكمي الموثوق للخلايا في الاتجار بالخلايا القائمة على التصوير3،4،9،10.
النظير المشع الباعث للبوزيترون 89Zr ، مع عمر نصف يبلغ 78.4 ساعة ، مناسب لوضع العلامات على الخلايا. يسمح بتصوير PET لتهريب الخلايا لأكثر من أسبوع واحد ويتم إنتاجه بسهولة بواسطة السيكلوترونات الطبية منخفضة الطاقة المتوفرة على نطاق واسع13،14،15،16،17. بالإضافة إلى ذلك ، يتوفر مخلب p-isothiocyanatobenzyl-desferrioxamine (DFO-Bn-NCS) الذي يعمل بشكل مناسب تجاريا لتخليق مركب وضع العلامات على الخلايا 89Zr ، الجاهز للاستخدام ، [89 Zr] Zr-p-isothiocyanatobenzyl-desferrioxamine ، المعروف أيضا باسم [89Zr] Zr-DBN18،19،20،21،22،23،24، 25. يعتمد مبدأ وضع العلامات الخلوية بوساطة [89 Zr] Zr-DBN على تفاعل بين الأمينات الأولية لبروتينات غشاء الخلية وجزء الأيزوثيوسيانات (NCS) ل [89Zr] Zr-DBN لإنتاج رابطة ثيوريا تساهمية مستقرة.
[89زر] تم نشر وسم الخلايا المستندة إلى Zr-DBN والتصوير لتتبع مجموعة متنوعة من الخلايا المختلفة ، بما في ذلك الخلايا الجذعية 18،23،25 ، والخلايا المتغصنة18 ، والخلايا الجذعية القلبية19 ، والخلايا اللحمية النفضية 20 ، والبلاعم المشتقة من نخاع العظم 20 ، وخلايا الدم المحيطية أحادية النواة 20 ، والخلايا التائية Jurkat / CAR 21 ، وخلايا الكبد 22،24 ، وخلايا الدم البيضاء 25. يوفر البروتوكول التالي طرقا خطوة بخطوة للتحضير ووضع العلامات الإشعاعية للخلية باستخدام [89Zr] Zr-DBN ويصف التغييرات التي قد تكون مطلوبة في بروتوكول وضع العلامات الراديوية لنوع معين من الخلايا. لمزيد من الوضوح ، تنقسم طريقة وضع العلامات الإشعاعية الخلوية المعروضة هنا إلى أربعة أقسام. يتناول القسم الأول إعداد [89 Zr] Zr-DBN عن طريق مخلب 89Zr باستخدام DFO-Bn-NCS. يصف القسم الثاني إعداد تركيبة متوافقة حيويا من [89Zr] Zr-DBN يمكن استخدامها بسهولة لوضع العلامات الإشعاعية للخلية. ويغطي القسم الثالث الخطوات اللازمة للتهيئة المسبقة للخلايا من أجل وضع العلامات الإشعاعية. يتضمن التكييف المسبق للخلايا غسل الخلايا بمحلول ملحي خال من البروتين (PBS) ومحلول ملح هانكس المتوازن المخزن HEPES (H-HBSS) لإزالة البروتينات الخارجية ، والتي قد تتداخل أو تتنافس مع تفاعل [89Zr] Zr-DBN مع الأمينات الأولية الموجودة على بروتينات سطح الخلية أثناء وضع العلامات الإشعاعية. يقدم القسم الأخير الخطوات التي ينطوي عليها وضع العلامات الإشعاعية الفعلية للخلايا وتحليل مراقبة الجودة.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم الحصول على الخلايا المتغصنة وخلايا سرطان الجلد تجاريا18. تم عزل خلايا الكبد من كبد الخنازير بعد استئصال الكبد الجزئي بالمنظار22,24. تم عزل الخلايا الجذعية من شفط نخاع العظم18،19،26. تم الحصول على الخلايا الجذعية المشتقة من الأنسجة الدهنية من مختبر العلاج الخلوي البشري، Mayo Clinic Rochester23. تم عزل خلايا الدم البيضاء البشرية من الدم الذي تم جمعه من قسم طب نقل الدم، Mayo Clinic (مايو كلينك) في روتشستر25. تم الحصول على خلايا مختلفة تستخدم لوضع العلامات الإشعاعية واستخدامها وفقا للإرشادات التي أوصت بها اللجنة المؤسسية لرعاية الحيوان واستخدامه، واللجنة الفرعية للإشراف على أبحاث الخلايا الجذعية في Mayo Clinic، ولجنة أبحاث قسم طب نقل الدم، واللجنة المؤسسية للسلامة البيولوجية، ولجنة السلامة الإشعاعية.
1. إعداد [89 Zr] Zr-p-isothiocyanatobenzyl-desferrioxamine ([89Zr] Zr-DBN)
توقيت: ~ 160-220 دقيقة
ملاحظة: لتحضير [89 Zr]Zr-DBN ، اعزل 89 Zr في شكل [89 Zr] Zr-فوسفات الهيدروجين ([89 Zr] Zr (HPO 4) 2) أو [89 Zr] Zr-chloride ([89Zr] ZrCl4) ، كما هو مذكور في الخطوة 1.1.
- اعزل 89 Zr من الأصل 89Y باستخدام طريقة تنقية راسخة قائمة على راتنج الهيدروكسيمات13,17. باختصار ، قم أولا بإعداد عمود يحتوي على ~ 100 مجم من راتنج الهيدروكسيمات ، ثم قم بتنشيط راتنج الهيدروكسيمات عن طريق غسل العمود ب 8.0 مل من الأسيتونيتريل اللامائي النقي ، متبوعا بتدفق 5.0-6.0 مل من الهواء. بعد ذلك ، اغسل العمود ب 15 مل من الماء منزوع الأيونات ، متبوعا بتدفق آخر مع 5.0-6.0 مل من الهواء ، ثم مرر 2.0 مل من 0.50 نيوتن حمض الهيدروكلوريك (درجة أساس المعادن النزرة) متبوعا بتدفق إضافي مع 5.0-6.0 مل من الهواء. بعد ذلك ، قم بتحميل المحلول الذي يحتوي على كل من 89 Zr و 89 Y إلى راتنج الهيدروكسيمات ببطء ، واغسل 89Y غير المنضم من راتنج الهيدروكسيمات ب 20 مل من 2.0 N HCl ، متبوعا ب 10 mL من الماء منزوع الأيونات وتدفق مع 5.0-6.0 mL من الهواء.
ملاحظة: بعد التدفق بالهواء ، يمكن إجراء شطف 89Zr كما هو موضح أدناه.- لاستخلاص 89 Zr على شكل [89 Zr] Zr (HPO 4) 2 ، أضف أولا 0.50 مل من 1.2 M K 2 HPO 4 / KH 2 PO 4 buffer (pH 3.5) إلى العمود من الخطوة 1.1 واتركه يجلس على العمود لمدة 30 دقيقة للترويج لإطلاق 89 Zr ك [89Zr] Zr (HPO 4) 2 من الراتنج. بعد ذلك ، قم بسحب 89Zr من العمود ب 1.50 مل إضافية من 1.2 M K 2 HPO 4 / KH2PO4 buffer (درجة الحموضة 3.5). بعد شطف [89 Zr]Zr(HPO 4)2، اتبع الخطوات 1.2 و1.2.1 و1.2.2 لإعداد [89 Zr]Zr-DBN باستخدام [89Zr]Zr(HPO4)2، كما هو موضح في الشكل 1.
- للحصول على 89 Zr ك [89 Zr] ZrCl4 ، أول elute 89 Zr ك [89Zr] Zr-oxalate.
- لاستخلاص 89 Zr على شكل [89 Zr] Zr-oxalate ، أضف 0.50 مل من 1.0 M حمض الأكساليك إلى العمود من الخطوة 1.1 واتركه يجلس على العمود لمدة دقيقة واحدة لتعزيز إطلاق 89 Zr ك [89Zr] - أكسالات من الراتنج. بعد ذلك ، قم بسحب 89Zr من العمود ب 2.50 mL إضافية من 1.0 M حمض الأكساليك (إجمالي 3.0 mL)17.
- لتحويل [89 Zr]Zr-oxalate إلى [89Zr]ZrCl4 باستخدام عمود تبادل الأنيون، كما وصفه Larenkov et al.14، قم أولا بتنشيط العمود عن طريق الغسيل باستخدام 6.0 مل من الأسيتونيتريل، متبوعا بتدفق مع 5.0-6.0 مل من الهواء. ثم اغسل العمود ب 10.0 مل من المحلول الملحي ، متبوعا بتدفق آخر من 5.0-6.0 مل من الهواء. أخيرا ، مرر 10.0 مل من الماء منزوع الأيونات ، متبوعا بتدفق 5.0-6.0 مل من الهواء.
- قم بتحميل محلول 3.0 مل الذي يحتوي على [89Zr] Zr-oxalate على عمود تبادل الأنيون المنشط ببطء ، متبوعا بتدفق 5.0-6.0 مل من الهواء. بعد ذلك ، اغسل العمود المحمل ب 89Zr ب 50.0 مل من الماء منزوع الأيونات لإزالة أيون الأكسالات غير المرتبط ، متبوعا بتدفق 5.0-6.0 مل من الهواء.
- لاستخلاص 89 Zr على شكل [89 Zr] ZrCl 4 ، أضف 0.10 مل من 1.0 N HCl إلى العمود ، واتركه يجلس على العمود لمدة 1.0 دقيقة لتعزيز إطلاق 89 Zr ك [89 Zr] ZrCl4 من الراتنج ، وقم بإزالة 89Zr من العمود ب 0.40 مل إضافي من 1.0 N HCl (إجمالي 0.5 مل). جفف [89Zr] ZrCl4 في قنينة على شكل حرف V عن طريق وضعها في كتلة تسخين عند 65 درجة مئوية تحت تدفق مستمر لغاز النيتروجين لمدة 10-30 دقيقة. بعد التجفيف ، أعد تكوين المجفف [89 Zr] ZrCl 4 في الماء واتبع الخطوتين 1.3 و 1.3.1 لإعداد [89 Zr] Zr-DBN باستخدام [89Zr] ZrCl4 ، كما هو موضح في الشكل 1.
- خذ ~ 120 ميكرولتر من [89Zr] Zr (HPO 4) 2 ، تمت صياغته في 1.2 M K 2 HPO 4 / KH 2 PO4 (pH 3.5) (10-25 MBq) من الخطوة 1.1.1 ، وقم بتحييد المحلول لتحقيق الرقم الهيدروجيني 7.5-8.0 مع ~ 100 ميكرولتر من 1.0 M HEPES-KOH (درجة الحموضة 7.5) و ~ 65 ميكرولتر من 1.0 M K 2CO3.
- للحصول على الكمية المناسبة من DFO-Bn-NCS للخطوات 1.2.2 أو 1.3.1 لتركيبات 89 Zr المختلفة ذات النشاط النوعي الظاهر المتنوع 89 Zr ، قم بإجراء مجموعة من تفاعلات الاستخلاب باستخدام حجم ثابت من تركيبة محايدة من [89 Zr] Zr (HPO 4) 2 أو [89Zr] ZrCl4 مع مجموعة من DFO-Bn-NCS (7.5-15 ميكروغرام). في حالة [89Zr] Zr (HPO4) 2 ، احتضان تفاعل الاستخلاب عند 37 درجة مئوية في شاكر عند ~ 550 دورة في الدقيقة لمدة 60 دقيقة. بينما ، في حالة [89Zr] ZrCl4 ، احتضان تفاعل الاستخلاب عند 25 درجة مئوية في شاكر عند ~ 550 دورة في الدقيقة لمدة 30 دقيقة. تجاهل تفاعل الاستخلاب الذي يظهر ترسب أثناء أو في نهاية الحضانة. في نهاية الحضانة ، قم بإجراء كروماتوغرافيا الطبقة الرقيقة المشعة (rad-TLC) مع 100 mM diethylenetriamine pentaacetate (DTPA) ، الرقم الهيدروجيني 7.0 ، كمرحلة متنقلة لتقدير كفاءة الاستخلاب ل DFO-Bn-NCS لكل تفاعل استخلاب ، كما هو موضح أدناه في الخطوة 1.5.
ملاحظة: استنادا إلى كفاءة الاستخلاب، استخدم الحد الأدنى من DFO-Bn-NCS في الخطوات 1.2.2 أو 1.3.1 اللازمة لتحقيق كفاءة استخلاب بنسبة ≥97٪ دون التسبب في ترسيب DFO-Bn-NCS في الصيغة المحايدة ل [89 Zr]Zr(HPO 4)2 أو [89Zr]ZrCl 4. هنا ، تم تصنيع [89Zr] Zr-DBN بنقاوة كيميائية إشعاعية ≥97٪. - قم بإعداد 5.0 mM DFO-Bn-NCS طازجة في DMSO اللامائي (3.76 مجم / مل) وأضف 4.0 ميكرولتر من 5.0 مللي متر DFO-Bn-NCS (20 نانومول أو 15 ميكروغرام) إلى ~ 285 ميكرولتر من [89Zr] Zr (HPO4) 2 (10-25 ميجابايت) من الخطوة 1.2 واخلط المحلول عن طريق الماصة. حافظ على تركيز DMSO النهائي في خليط الاستخلاب أقل من 2٪ من الحجم الكلي.
- للحصول على الكمية المناسبة من DFO-Bn-NCS للخطوات 1.2.2 أو 1.3.1 لتركيبات 89 Zr المختلفة ذات النشاط النوعي الظاهر المتنوع 89 Zr ، قم بإجراء مجموعة من تفاعلات الاستخلاب باستخدام حجم ثابت من تركيبة محايدة من [89 Zr] Zr (HPO 4) 2 أو [89Zr] ZrCl4 مع مجموعة من DFO-Bn-NCS (7.5-15 ميكروغرام). في حالة [89Zr] Zr (HPO4) 2 ، احتضان تفاعل الاستخلاب عند 37 درجة مئوية في شاكر عند ~ 550 دورة في الدقيقة لمدة 60 دقيقة. بينما ، في حالة [89Zr] ZrCl4 ، احتضان تفاعل الاستخلاب عند 25 درجة مئوية في شاكر عند ~ 550 دورة في الدقيقة لمدة 30 دقيقة. تجاهل تفاعل الاستخلاب الذي يظهر ترسب أثناء أو في نهاية الحضانة. في نهاية الحضانة ، قم بإجراء كروماتوغرافيا الطبقة الرقيقة المشعة (rad-TLC) مع 100 mM diethylenetriamine pentaacetate (DTPA) ، الرقم الهيدروجيني 7.0 ، كمرحلة متنقلة لتقدير كفاءة الاستخلاب ل DFO-Bn-NCS لكل تفاعل استخلاب ، كما هو موضح أدناه في الخطوة 1.5.
- خذ ~ 180 ميكرولتر من [89 Zr] ZrCl 4 المركب في 0.1 N HCl (40-80 MBq) من الخطوة 1.1.2.4 وقم بتحييد المحلول الناتج لتحقيق الرقم الهيدروجيني 7.5-8.0 مع ~ 25 ميكرولتر من 1.0 M Na2CO3.
- تحضير 2.5 mM DFO-Bn-NCS الطازج في ثنائي ميثيل سلفوكسيد اللامائي (DMSO) (1.88 مجم / مل) وإضافة 4.0 ميكرولتر من 2.5 mM DFO-Bn-NCS (10 نانومول أو 7.5 ميكروغرام) إلى ~ 205 ميكرولتر من [89 Zr] ZrCl4 (40-80 ميجابايت) من الخطوة 1.3. امزج المحلول عن طريق الماصة. حافظ على تركيز DMSO النهائي في خليط الاستخلاب أقل من 2٪ من الحجم الكلي.
- استمر في استخلاب 89 Zr عند 37 درجة مئوية في شاكر عند ~ 550 دورة في الدقيقة لمدة 60 دقيقة في حالة [89 Zr] Zr (HPO 4) 2 ، أو عند 25 درجة مئوية في شاكر عند ~ 550 دورة في الدقيقة لمدة 30 دقيقة في حالة [89Zr] ZrCl4.
- تحديد كفاءة الاستخلاب 89Zr بواسطة rad-TLC مع 100 mM DTPA (الرقم الهيدروجيني 7.0) كمذيب متنقل rad-TLC. توقع أن يظهر [89 Zr] Zr-DBN R f من ~ 0.021-0.035 ، [89 Zr] ZrCl 4 لإظهار R f من ~ 1.0 ، و [89Zr] Zr (HPO4) 2 لإظهار R f ~ 1.0. احسب كفاءة الاستخلاب (٪) باستخدام المعادلة (1):
النسبة المئوية ل 89 Zr مخلب إلى DFO-NCS لتشكيل [89 Zr]Zr-DBN = [ (النشاط الإشعاعي عند R f من [89 Zr] Zr - DBN) / (مجموع الأنشطة الراديوية عند R f من [89 Zr] Zr - DBN وعند R f من [89 Zr] Zr (HPO 4) 2 أو [89Zr] ZrCl4)] × 100 (1)
ملاحظة: كفاءة الاستخلاب 89Zr المقبولة للمضي قدما في وضع العلامات الإشعاعية للخلايا ، على النحو الذي يحدده rad-TLC ، هي ≥97٪. تم تعيين النقاء الكيميائي الإشعاعي المقترح ≥97٪ ل [89Zr] Zr-DBN وفقا لمتطلبات النقاء الكيميائي الإشعاعي القياسية للمستحضرات الصيدلانية الإشعاعية الأخرى المستخدمة في هذا المجال. انظر راد TLC التمثيلي في الشكل التكميلي S1 والشكل التكميلي S2.

الشكل 1: رسم تخطيطي لإعداد [89Zr]Zr-DBN. لإعداد [89 Zr]Zr-DBN ، قم بتحييد الصياغة المسبقة [89 Zr] Zr (HPO 4) 2 أو [89Zr] ZrCl4 إلى درجة حموضة 7.5-8.0. احتضان الحل المحايد باستخدام DFO-Bn-NCS. تحقق من كفاءة الاستخلاب من 89Zr إلى DFO-Bn-NCS بواسطة rad-TLC. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تركيبة متوافقة حيويا من [89Zr] Zr-DBN لوضع العلامات الإشعاعية للخلايا (الشكل 2)
التوقيت: ~ 35 دقيقة
ملاحظة: بالنظر إلى الوقت المستغرق لإعداد الخلايا في الخطوة 3 ، ابدأ الخطوة 3 قبل 20 دقيقة تقريبا من بداية الخطوة 2 لحضانة ~ 30 دقيقة. يسمح هذا بوضع العلامات الإشعاعية الخلوية في الخطوة 4 في غضون ~ 5-10 دقائق بعد الانتهاء من الخطوات 2-3.2.2.
- بالنسبة لتركيبة [89 Zr]Zr-DBN المصنوعة من [89 Zr]ZrCl 4 ، أضف 50.0 ميكرولتر من خليط متوافق مع الخلايا يتكون من ~ 27.0 ميكرولتر من 1.2 M K 2 HPO 4 / KH2PO 4 (درجة الحموضة 3.5) + ~ 23.0 ميكرولتر من 1.0 متر مخزن مؤقت HEPES-KOH (درجة الحموضة 7.5) إلى 50.0 ميكرولتر من [89 Zr] Zr-DBN. احتضان الخليط المتوافق مع [89Zr] Zr-DBN لمدة ~ 30 دقيقة في درجة حرارة الغرفة (25 درجة مئوية).
ملاحظة: تركيبة [89 Zr] Zr-DBN المصنوعة من [89Zr] Zr (HPO4) 2 متوافقة حيويا مع العلامات الإشعاعية للخلايا ولا تتطلب الخطوة 2.
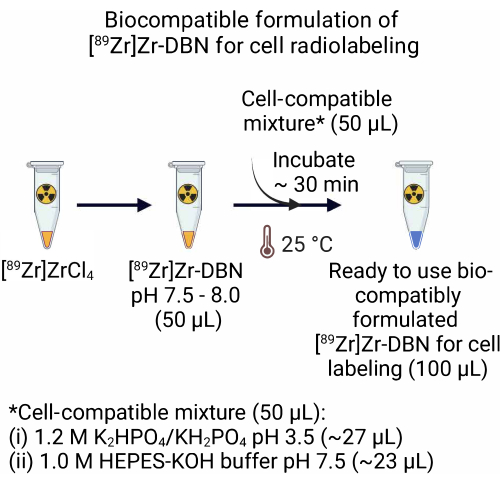
الشكل 2: تحضير التركيبة المتوافقة حيويا ل [89Zr]Zr-DBN لوضع العلامات الإشعاعية للخلية. لتحضير تركيبة متوافقة حيويا جاهزة للاستخدام من مركب الملصقات الإشعاعية ، أضف حجما متساويا من الخليط المتوافق مع الخلايا ، والذي يتألف من 1.2 M K 2 HPO 4 / KH2PO4 (الرقم الهيدروجيني 3.5) + 1.0 M HEPES-KOH إلى حجم متساو من [89Zr] Zr-DBN. احتضان في 25 درجة مئوية لمدة ~ 30 دقيقة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
3. تحضير الخلايا لوضع العلامات الإشعاعية
التوقيت: ~ 40-50 دقيقة
- التربسينيز ~ 12 × 106 خلايا ملتصقة (الخلايا الجذعية ، خلايا سرطان الجلد ، الخلايا الجذعية المكونة للقلب ، الخلايا المتغصنة ، أو خلايا الكبد) وأجهزة الطرد المركزي الخلايا في أنبوب طرد مركزي مخروطي 15.0 مل عند ~ 96 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية ، وأعد تعليق حبيبات الخلية في ~ 500 ميكرولتر من PBS ، وانقل تعليق الخلية إلى أنبوب طرد مركزي دقيق سعة 1.5 مل. أجهزة الطرد المركزي الخلايا في جهاز طرد مركزي دقيق في ~ 96 × جم لمدة 10 دقائق عند 4 °C.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في ~ 500 ميكرولتر من H-HBSS. أجهزة الطرد المركزي الخلايا في جهاز طرد مركزي دقيق سعة 1.5 مل عند ~ 96 × جم لمدة 10 دقائق عند 4 درجات مئوية. كرر الخطوة 3.1.2 مرة أخرى وانتقل إلى الخطوة 4.1.1.
ملاحظة: H-HBSS هو محلول ملح هانكس المتوازن مع 0.01 M HEPES (درجة الحموضة 8.0).
- في حالة الخلايا غير الملتصقة ، مثل خلايا الدم البيضاء البشرية (خلايا الدم البيضاء البشرية المعزولة حديثا من الدم) ، تخطي التربسين والطرد المركزي تعليق الخلية الذي يحتوي على ~ 12 × 106 خلايا في جهاز طرد مركزي دقيق سعة 1.5 مل عند ~ 96 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية ، وأعد تعليق حبيبات الخلية في ~ 500 ميكرولتر من PBS ، وقم بالطرد المركزي للخلايا في جهاز طرد مركزي دقيق سعة 1.5 مل عند ~ 96 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في ~ 500 ميكرولتر من H-HBSS. أجهزة الطرد المركزي الخلايا في جهاز طرد مركزي دقيق سعة 1.5 مل عند ~ 96 × جم لمدة 10 دقائق عند 4 درجات مئوية. كرر الخطوة 3.2.2 مرة أخرى وانتقل إلى الخطوة 4.1.1.
4. وضع العلامات الإشعاعية للخلايا
التوقيت: ~ 125-155 دقيقة
- بدء وضع العلامات الإشعاعية الخلوية (الشكل 3)
- استخدم تعليق الخلية من الخطوة 3.1.2 أو الخطوة 3.2.2 لإعداد تعليق خلية ~ 500 ميكرولتر مع ما يقرب من ~ 6 × 106 خلايا في ~ 500 ميكرولتر من H-HBSS عند درجة الحموضة 7.5-8.0 في أنبوب طرد مركزي دقيق 1.5 مل.
- لهذا ، أضف ~ 100 ميكرولتر من المركب الحيوي [89Zr] Zr-DBN من الخطوة 2.
- حضانة الخلايا لوضع العلامات الإشعاعية (الشكل 4)
- امزج المركب حيويا [89 Zr] Zr-DBN وتعليق الخلية عن طريق السحب برفق لأعلى ولأسفل باستخدام ماصة صغيرة مضبوطة على ~ 500 ميكرولتر. قم بقياس كمية النشاط الإشعاعي في أنبوب الحضانة باستخدام معاير جرعة النشاط الإشعاعي عند إعداد 489 لنظير 89Zr16.
- احتضان الخلايا وخليط [89Zr] Zr-DBN في شاكر عند ~ 550 دورة في الدقيقة عند 25-37 درجة مئوية لمدة 30-45 دقيقة لوضع العلامات على الخلايا.
ملاحظة: ستختلف درجة حرارة الحضانة اعتمادا على أنواع الخلايا المستخدمة في وضع العلامات الإشعاعية ، كما هو موضح في الجدول 1. - بعد الحضانة في الخطوة 4.2.2 ، قم بإجراء rad-TLC على تفاعل وضع العلامات الإشعاعية للخلية باستخدام مذيب rad-TLC المحضر حديثا (20 mM سترات الصوديوم [pH 4.9-5.1]: الميثانول [1: 1 ، V: V]). بعد تشغيل rad-TLC ، ابحث عن [89 Zr] Zr-DBN و [89 Zr] ZrCl4 حول R f = ~ 0.73-0.81 و R f = ~ 0.01-0.02 للخلايا ذات العلامات الإشعاعية. احسب النسبة المئوية للنشاط الإشعاعي عند Rf = ~ 0.01-0.02 باستخدام المعادلة (2).
النسبة المئوية للنشاط الإشعاعي عند R f = ~ 0.01-0.02 = [(النشاط الإشعاعي عند R f = ~ 0.01 - 0.02) / (مجموع الأنشطة الإشعاعية عند R f = ~ 0.01 - 0.02 و R f = ~ 0.73 - 0.81)] × 100 (2)
ملاحظة: لفهم القمم المرئية عند R f = ~ 0.01-0.02 و R f = ~ 0.73-0.81 ، انظر rad-TLC لتفاعل العلامات الإشعاعية لخلايا الدم البيضاء في الشكل التكميلي S3. - في أنبوب طرد مركزي صغير منفصل سعة 1.5 مل ، امزج ~ 100 ميكرولتر من المركب الحيوي [89Zr] Zr-DBN مع ~ 500 ميكرولتر من H-HBSS عند درجة الحموضة 7.5-8.0 لاستخدامها كعنصر تحكم بدون خلية لتصحيح الخلفية في الخطوة 4.2.5. بعد الحضانة في درجة حرارة ووقت مماثلين كما هو مستخدم في الخطوة 4.2.2 ، قم بإجراء rad-TLC. بعد تشغيل rad-TLC ، ابحث عن [89 Zr] Zr-DBN و [89 Zr] ZrCl4 حول Rf = ~ 0.73-0.81. احسب النسبة المئوية للنشاط الإشعاعي عند Rf = ~ 0.01-0.02 باستخدام المعادلة (3).
النشاط الإشعاعي عند R f = ~ 0.01-0.02 = [(النشاط الإشعاعي عند R f = ~ 0.01 - 0.02) / (مجموع الأنشطة الإشعاعية عند R f = ~ 0.01 - 0.02 و R f = ~ 0.73 - 0.81)] × 100 (3)
ملاحظة: لفهم القمم المرئية عند Rf = ~ 0.01-0.02 و ~ 0.73-0.81 ، انظر rad-TLC لتفاعل التحكم بدون خلية في الشكل التكميلي S4. - احسب العلامات الإشعاعية الفعالة للخلية (٪) عن طريق طرح نسبة النشاط الإشعاعي عند R f = ~ 0.01-0.02 (من rad-TLC من الخطوة 4.2.4) من النسبة المئوية للنشاط الإشعاعي عند R f = ~ 0.01-0.02 (من rad-TLC من الخطوة 4.2.3).
- تبريد العلامات الإشعاعية وغسل الخلايا (الشكل 5)
- بعد التأكد من الانتهاء من وضع العلامات الإشعاعية بواسطة rad-TLC في الخطوة 4.2.5 ، قم بإجراء إخماد تفاعل الوسم الإشعاعي بإضافة ~ 600 ميكرولتر من الوسط الكامل المبرد المناسب للخلية ، أو بإضافة H-HBSS ، كما هو موضح في الجدول 1.
- أجهزة الطرد المركزي الخلايا في جهاز طرد مركزي دقيق في ~ 96 × جم لمدة 10 دقائق عند 4 °C. تخلص من المادة الطافية.
- أعد تعليق الخلايا المحببة برفق في ~ 500 ميكرولتر من الوسط المبرد (وسط النسر المعدل من Dulbecco (DMEM) + 10٪ مصل بقري جنيني + 5٪ بنسلين / ستربتومايسين أو معهد روزويل بارك التذكاري -1640 (RPMI-1640) + 10٪ مصل بقري جنيني + 5٪ بنسلين / ستربتومايسين أو H-HBSS لنوع معين من الخلايا ، كما هو موضح في الجدول 1. قم بإعادة تعليق حبيبات الخلية عن طريق السحب برفق لأعلى ولأسفل باستخدام ماصة صغيرة مضبوطة على ~ 500 ميكرولتر.
- أجهزة الطرد المركزي الخلايا في جهاز طرد مركزي دقيق في ~ 96 × جم لمدة 10 دقائق عند 4 °C.
- كرر الخطوات 4.3.2-4.3.4 مرتين لإزالة النشاط الإشعاعي غير المقيد.
- انقل الحبيبات إلى أنبوب طرد مركزي دقيق جديد سعة 1.5 مل مع DMEM + 10٪ مصل بقري جنيني + 5٪ بنسلين / ستربتومايسين في حالة الخلايا الجذعية أو H-HBSS وقم بقياس النشاط الإشعاعي في حبيبات الخلية باستخدام معاير الجرعة في إعداد 489 ل 89Zr-isotope16.
- احسب كفاءة وضع العلامات الإشعاعية النهائية بعد كل عمليات الغسيل باستخدام المعادلة (4).
كفاءة وضع العلامات الإشعاعية = [(النشاط الإشعاعي المصحح للاضمحلال في حبيبات الخلية في الخطوة 4.3.6) / (النشاط الإشعاعي المصحح للاضمحلال في حبيبات الخلية و H-HBSS في الخطوة 4.2.1)] × 100 (4) - لضمان جودة الخلايا ذات العلامات الإشعاعية ، افحص أولا بصريا التعليق النهائي للخلايا ذات العلامات الإشعاعية بحثا عن وجود أي كتل. إذا لم تكن هناك كتل ، فتابع هذا التعليق النهائي إلى الخطوة التالية. إذا كانت هناك كتل ، ولكن يمكن إعادة تعليقها عن طريق السحب أو عن طريق الهز اللطيف ، فافعل ذلك وانتقل إلى الخطوة التالية ، حيث يجتاز هذا الفحص البصري. ومع ذلك ، إذا لم يتم إعادة تعليق الكتل إما عن طريق السحب أو الهز اللطيف ، فتخلص من التعليق وابدأ من جديد.
- إذا تم اجتياز الفحص البصري ، فقم بإجراء اختبار صلاحية استبعاد التريبان الأزرق باستخدام محلول تريبان الأزرق بنسبة 0.4٪ المحضر في برنامج تلفزيوني في غضون 1 ساعة من وضع العلامات الإشعاعية وخطوات الغسيل (4.3.3-4.3.7) لتقييم صلاحية الخلية للخلايا ذات العلامات الإشعاعية.
- لإجراء الاختبار ، أضف 10.0 ميكرولتر من محلول تريبان الأزرق 0.4٪ إلى معلق خلية 10.0 ميكرولتر لكل من الخلايا ذات العلامات الإشعاعية وغير الموسومة واخلطها عن طريق سحب معلق الخلايا الزرقاء تريبان لأعلى ولأسفل مع ضبط الماصة الدقيقة على 10.0 ميكرولتر.
- قم بتحميل مقياس الدم باستخدام ~ 10.0 ميكرولتر من خليط تعليق الخلية الزرقاء trypan ، واحسب على الفور عدد الخلايا الملطخة باللون الأزرق والعدد الإجمالي للخلايا في مقياس الدم تحت المجهر عند التكبير المنخفض أو باستخدام عداد خلية آلي. احسب النسبة المئوية للخلايا القابلة للحياة باستخدام المعادلة (5).
النسبة المئوية للخلايا القابلة للحياة = 100 - [(عدد الخلايا الزرقاء الملطخة) / (عدد الخلايا الإجمالية)] × 100 (5)
- استخدم الخلايا ذات العلامات الإشعاعية إذا لم يكن هناك تغيير في النسبة المئوية للخلايا القابلة للحياة في معلق الخلية الموسوم إشعاعيا مقارنة بالنظير غير المصنف. تخلص من الخلايا ذات العلامات الإشعاعية إذا كانت النسبة المئوية للخلايا القابلة للحياة أقل من نظيرتها غير المصنفة.
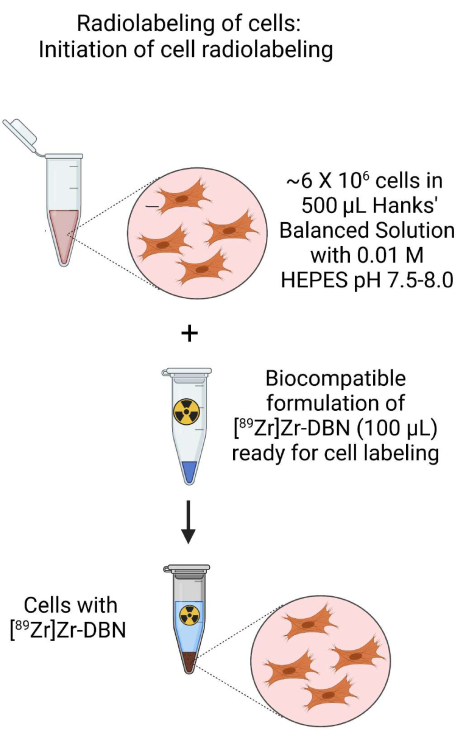
الشكل 3: رسم تخطيطي لبدء وضع العلامات الإشعاعية الخلوية. بدء وضع العلامات الإشعاعية للخلايا عن طريق إضافة [89Zr] Zr-DBN المتوافق حيويا إلى تعليق الخلية المحضر في محلول ملح هانكس المتوازن HEPES. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
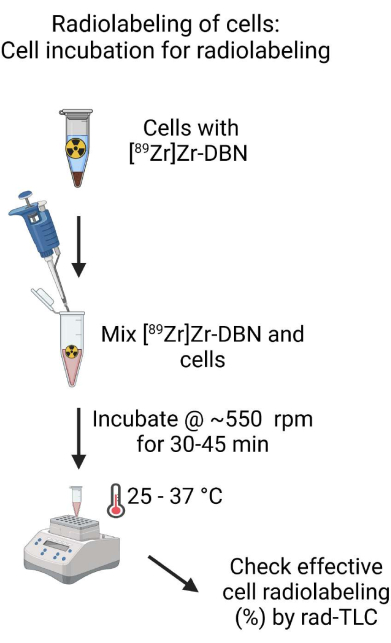
الشكل 4: رسم تخطيطي لحضانة الخلايا لوضع العلامات الإشعاعية. امزج جيدا [89Zr] Zr-DBN المتوافق حيويا مع تعليق الخلية واحتضان تعليق الخلية في كتلة تسخين يتم التحكم في درجة حرارتها على شاكر لمدة 30-60 دقيقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
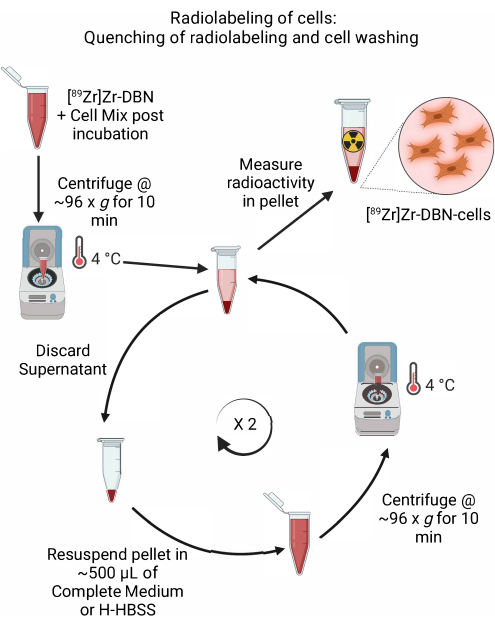
الشكل 5: رسم تخطيطي لتبريد الملصقات الإشعاعية وغسل الخلايا. إخماد العلامات الإشعاعية للخلايا عن طريق إضافة وسط الخلية المبردة أو H-HBSS ، تليها الطرد المركزي عند 4 درجات مئوية. لغسل الخلايا ، تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في ~ 500 ميكرولتر من وسط الخلية المبردة أو H-HBSS. كرر دورة التخلص من المادة الطافية وإعادة تعليق حبيبات الخلية في وسط جديد لإزالة أي سينثون غير مرتبط بالملصقات الإشعاعية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم تجميع النتائج التمثيلية المقدمة في هذه المخطوطة من الدراسات السابقة [89Zr] Zr-DBN للتوليف ووضع العلامات الإشعاعية للخلايا18،19،22،23،24،25. باختصار ، يمكن تعقيد 89Zr بنجاح باست...
Access restricted. Please log in or start a trial to view this content.
Discussion
فيما يلي خطوات حاسمة في البروتوكول تحتاج إلى تحسين من أجل وضع العلامات الإشعاعية الخلوية الفعالة. في الخطوتين 1.2 و 1.3 من البروتوكول ، اعتمادا على حجم [89 Zr] Zr (HPO 4) 2 أو [89Zr] ZrCl4 المستخدم ، يجب استخدام حجم مناسب (ميكرولتر) من القاعدة ؛ يجب استخدام محلول 1.0M K 2 CO 3 ل...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس للمؤلفين مصلحة مالية متنافسة ولكنهم مخترعون هذه التكنولوجيا (براءة الاختراع # US20210330823A1).
Acknowledgements
تم دعم هذا العمل من قبل NIH 5R21HL127389-02 ، NIH 4T32HL007111-39 ، NIH R01HL134664 ، ومنح DOE DE-SC0008947 ، الوكالة الدولية للطاقة الذرية ، فيينا ، قسم Mayo Clinic للطب النووي ، قسم الأشعة ، ومركز Mayo Clinic للطب التجديدي ، روتشستر ، مينيسوتا. تم إنشاء جميع الأرقام باستخدام BioRender.com.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A996-4 | |
| Alpha Minimum Essential Medium | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 12571063 | |
| Anion exchange column | Macherey-Nagel, Inc., Düren, Germany | 731876 | Chromafix 30-PS-HCO3 SPE 45 mg cartridge |
| Conical centrifuge tubes (15 mL) | Corning Inc., Glendale, AZ, USA | 352096 | Falcon 15 mL high-clarity polypropylene (PP) conical centrifuge tubes |
| Dendritic cells | The American Type Culture Collection, Manassas, VA, USA | CRL-11904 | |
| DFO-Bn-NCS | Macrocyclics, Inc., Plano, TX, USA | B-705 | p-SCN-Bn-Deferoxamine |
| DMSO | Sigma-Aldrich, Inc., St. Louis, MO | 276855 | |
| Dose calibrator | Mirion Technologies (Capintec), Inc., Florham Park, NJ, USA | 5130-3234 | CRC -55tR Dose Calibrator |
| Dulbecco’s modified Eagle’s medium | The American Type Culture Collection, Manassas, VA, USA | 30-2002 | |
| Fetal Bovine Serum (FBS) | The American Type Culture Collection, Manassas, VA, USA | 30-2020 | |
| Hanks Balanced Salt solution (HBSS) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 14025092 | For preparation of H-HBSS |
| Hydrochloric Acid (trace metal basis grade) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A508P212 | |
| Melanoma cells | The American Type Culture Collection, Manassas, VA, USA | CRL-6475 | |
| Methanol | Sigma-Aldrich, Inc., St. Louis, MO | 34860 | |
| Microcentrifuge tube | Eppendorf, Hamburg, Germany | 30108442 | Protein LoBind microcentrifuge tube |
| Murine GM-CSF | R&D Systems, Inc., Minneapolis, MN USA | 415-ML-010 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 15140-122 | |
| Phosphate Buffered Saline without Ca2+ and Mg2+ | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 10010023 | For washing cells |
| Saline | Covidien LLC, Mansfield, MA, USA | 1020 | 0.9% Sterile Saline Solution |
| Shaker | Eppendorf, Hamburg, Germany | T1317 | Thermomixer |
| Silica gel-rad-TLC paper sheet | Agilent Technologies Inc., Santa Clara, CA, USA | SGI0001 | iTLC-SG |
References
- Bhawnani, N., et al. Effectiveness of stem cell therapies in improving clinical outcomes in patients with heart failure. Cureus. 13 (8), e17236(2021).
- Zakrzewski, W., Dobrzynski, M., Szymonowicz, M., Rybak, Z. Stem cells: past, present, and future. Stem Cell Research & Therapy. 10 (1), 68(2019).
- Bukhari, A. B., Dutta, S., De, A. Image guidance in stem cell therapeutics: unfolding the blindfold. Current Drug Targets. 16 (6), 658-671 (2015).
- Momeni, A., Neelamegham, S., Parashurama, N. Current challenges for the targeted delivery and molecular imaging of stem cells in animal models. Bioengineered. 8 (4), 316-324 (2017).
- Gnecchi, M., Zhang, Z., Ni, A., Dzau, V. J. Paracrine mechanisms in adult stem cell signaling and therapy. Circulation Research. 103 (11), 1204-1219 (2008).
- D'Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282(2018).
- Zhang, Q., et al. CAR-T cell therapy in cancer: tribulations and road ahead. Journal of Immunology Research. 2020, 1924379(2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69(2021).
- Shao, F., et al. Radionuclide-based molecular imaging allows CAR-T cellular visualization and therapeutic monitoring. Theranostics. 11 (14), 6800-6817 (2021).
- Sakemura, R., Can, I., Siegler, E. L., Kenderian, S. S. In vivo CART cell imaging: Paving the way for success in CART cell therapy. Molecular Therapy Oncolytics. 20, 625-633 (2021).
- Wang, Y., et al. Dendritic cell biology and its role in tumor immunotherapy. Journal of Hematology & Oncology. 13 (1), 107(2020).
- Bulte, J. W. M., Shakeri-Zadeh, A. In vivo MRI tracking of tumor vaccination and antigen presentation by dendritic cells. Molecular Imaging and Biology. 24 (2), 198-207 (2022).
- Holland, J. P., Sheh, Y., Lewis, J. S. Standardized methods for the production of high specific-activity zirconium-89. Nuclear Medicine and Biology. 36 (7), 729-739 (2009).
- Larenkov, A., et al. Preparation of zirconium-89 solutions for radiopharmaceutical purposes: interrelation between formulation, radiochemical purity, stability and biodistribution. Molecules. 24 (8), 1534(2019).
- Pandey, M. K., et al. A new solid target design for the production of 89Zr and radiosynthesis of high molar activity [89Zr]Zr-DBN. American Journal of Nuclear Medicine and Molecular Imaging. 12 (1), 15-24 (2022).
- Pandey, M. K., et al. Improved production and processing of 89Zr using a solution target. Nuclear Medicine and Biology. 43 (1), 97-100 (2016).
- Pandey, M. K., Engelbrecht, H. P., Byrne, J. P., Packard, A. B., DeGrado, T. R. Production of 89Zr via the 89Y(p,n)89Zr reaction in aqueous solution: effect of solution composition on in-target chemistry. Nuclear Medicine and Biology. 41 (4), 309-316 (2014).
- Bansal, A., et al. Novel 89Zr cell labeling approach for PET-based cell trafficking studies. EJNMMI Research. 5, 19(2015).
- Bansal, A., et al. 89Zr]Zr-DBN labeled cardiopoietic stem cells proficient for heart failure. Nuclear Medicine and Biology. 90-91, 23-30 (2020).
- Friberger, I., et al. Optimisation of the synthesis and cell labelling conditions for [89Zr]Zr-oxine and [89Zr]Zr-DFO-NCS: a direct in vitro comparison in cell types with distinct therapeutic applications. Molecular Imaging and Biology. 23 (6), 952-962 (2021).
- Lee, S. H., et al. Feasibility of real-time in vivo 89Zr-DFO-labeled CAR T-cell trafficking using PET imaging. PLoS One. 15 (1), e0223814(2020).
- Nicolas, C. T., et al. Hepatocyte spheroids as an alternative to single cells for transplantation after ex vivo gene therapy in mice and pig models. Surgery. 164 (3), 473-481 (2018).
- Yang, B., et al. Tracking and therapeutic value of human adipose tissue-derived mesenchymal stem cell transplantation in reducing venous neointimal hyperplasia associated with arteriovenous fistula. Radiology. 279 (2), 513-522 (2016).
- Nicolas, C. T., et al. Ex vivo cell therapy by ectopic hepatocyte transplantation treats the porcine tyrosinemia model of acute liver failure. Molecular Therapy. Methods & Clinical Development. 18, 738-750 (2020).
- Bansal, A., Sharma, S., Klasen, B., Rosch, F., Pandey, M. K. Evaluation of different 89Zr-labeled synthons for direct labeling and tracking of white blood cells and stem cells in healthy athymic mice. Scientific Reports. 12 (1), 15646(2022).
- Behfar, A., et al. Guided cardiopoiesis enhances therapeutic benefit of bone marrow human mesenchymal stem cells in chronic myocardial infarction. Journal of the American College of Cardiology. 56 (9), 721-734 (2010).
- Charoenphun, P., et al. 89Zr]oxinate4 for long-term in vivo cell tracking by positron emission tomography. European Journal of Nuclear Medicine and Molecular Imaging. 42 (2), 278-287 (2015).
- Sato, N., et al. In vivo tracking of adoptively transferred natural killer cells in rhesus macaques using 89zirconium-oxine cell labeling and PET imaging. Clinical Cancer Research. 26 (11), 2573-2581 (2020).
- Volpe, A., Pillarsetty, N. V. K., Lewis, J. S., Ponomarev, V. Applications of nuclear-based imaging in gene and cell therapy: probe considerations. Molecular Therapy Oncolytics. 20, 447-458 (2021).
- Fogli, L. K., et al. Challenges and next steps in the advancement of immunotherapy: summary of the 2018 and 2020 National Cancer Institute workshops on cell-based immunotherapy for solid tumors. Journal for Immunotherapy of Cancer. 9 (7), e003048(2021).
- Li, X., Hacker, M. Molecular imaging in stem cell-based therapies of cardiac diseases. Advanced Drug Delivery Reviews. 120, 71-88 (2017).
- Puges, M., et al. Retrospective study comparing WBC scan and 18F-FDG PET/CT in patients with suspected prosthetic vascular graft infection. European Journal of Vascular and Endovascular Surgery. 57 (6), 876-884 (2019).
- Butterfield, L. H. Dendritic cells in cancer immunotherapy clinical trials: are we making progress. Frontiers in Immunology. 4, 454(2013).
- de Vries, I. J. M., et al. Magnetic resonance tracking of dendritic cells in melanoma patients for monitoring of cellular therapy. Nature Biotechnology. 23 (11), 1407-1413 (2005).
- Gosmann, D., et al. Promise and challenges of clinical non-invasive T-cell tracking in the era of cancer immunotherapy. EJNMMI Research. 12 (1), 5(2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved