Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Positronen-Emissions-Tomographie-Bildgebung des Zelltransports: Eine Methode der radioaktiven Markierung von Zellen
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll zur radioaktiven Markierung von Zellen mit einem Positronen-Emissions-Tomographie (PET)-Radioisotop, 89 Zr (t1/2 78,4 h), unter Verwendung eines gebrauchsfertigen radioaktiv markierenden Synthons, [89 Zr]Zr-p-isothiocyanatobenzyl-desferrioxamin ([89Zr]Zr-DBN), vorgestellt. Die radioaktive Markierung von Zellen mit [89Zr]Zr-DBN ermöglicht die nicht-invasive Verfolgung und Bildgebung von radioaktiv markierten Zellen im Körper mit PET für bis zu 7 Tage nach der Verabreichung.
Zusammenfassung
Stammzell- und chimäre Antigenrezeptor (CAR)-T-Zell-Therapien entwickeln sich zu vielversprechenden Therapeutika für die Organregeneration und als Immuntherapie für verschiedene Krebsarten. Trotz erheblicher Fortschritte in diesen Bereichen gibt es noch mehr zu lernen, um die Pharmakokinetik und Pharmakodynamik der verabreichten therapeutischen Zellen im lebenden System besser zu verstehen. Für die nicht-invasive, in vivo Verfolgung von Zellen mit Positronen-Emissions-Tomographie (PET) wurde eine neuartige [89 Zr]Zr-p-isothiocyanatobenzyl-desferrioxamin ([89 Zr]Zr-DBN)-vermittelte Zellradiomarkierungsmethode unter Verwendung von 89Zr (t1/2 78,4 h) entwickelt. Das vorliegende Protokoll beschreibt ein [89Zr]Zr-DBN-vermitteltes, gebrauchsfertiges, radioaktiv markierendes Synthon für die direkte radioaktive Markierung einer Vielzahl von Zellen, einschließlich mesenchymaler Stammzellen, liniengesteuerter kardiopoetischer Stammzellen, leberregenerierender Hepatozyten, weißer Blutkörperchen, Melanomzellen und dendritischen Zellen. Die entwickelte Methodik ermöglicht eine nicht-invasive PET-Bildgebung des Zelltransports für bis zu 7 Tage nach der Verabreichung, ohne die Beschaffenheit oder Funktion der radioaktiv markierten Zellen zu beeinträchtigen. Darüber hinaus beschreibt dieses Protokoll eine schrittweise Methode für die Radiosynthese von [89 Zr]Zr-DBN, die biokompatible Formulierung von [89 Zr]Zr-DBN, die Vorbereitung von Zellen für die radioaktive Markierung und schließlich die radioaktive Markierung von Zellen mit [89Zr]Zr-DBN, einschließlich aller komplizierten Details, die für die erfolgreiche radioaktive Markierung von Zellen erforderlich sind.
Einleitung
Stammzell- und chimäre Antigenrezeptor (CAR)-T-Zell-Therapien gewinnen an Popularität und werden aktiv für die Behandlung verschiedener Krankheiten wie Myokardversagen1,2, Netzhautdegeneration 2, Makuladegeneration 2, Diabetes 2, Myokardinfarkt 3,4,5 und Krebs 6,7,8,9 untersucht.10. Unter den beiden plausiblen Ansätzen von Stammzelltherapien können Stammzellen entweder direkt auf die Krankheitsstelle transplantiert werden, um eine therapeutische Reaktion hervorzurufen, oder Veränderungen in der Mikroumgebung der Krankheitsstelle verursachen, ohne an der Krankheitsstelle zu haften, um eine indirekte therapeutische Reaktion auszulösen. Ein indirektes therapeutisches Ansprechen könnte Veränderungen in der Mikroumgebung des Krankheitsortes verursachen, indem Faktoren freigesetzt werden, die die Krankheit reparieren oder behandeln würden5. Diese Ansätze von Stammzelltherapien konnten durch nicht-invasive Bildgebung von radioaktiv markierten Stammzellen evaluiert werden. Die nicht-invasive Bildgebung könnte die Aufnahme der radioaktiv markierten Zellen an der Krankheitsstelle mit einem therapeutischen Ansprechen korrelieren, um das direkte und indirekte therapeutische Ansprechen zu entschlüsseln.
Darüber hinaus werden immunzellbasierte Therapien entwickelt, um verschiedene Krebsarten mit CAR-T-Zellen 6,7,8,9,10 und dendritischen Zellimmuntherapien 11,12 zu behandeln. Mechanistisch werden T-Zellen in der CAR-T-Zell-Immuntherapie 6,7,8,9,10 so verändert, dass sie ein Epitop exprimieren, das an ein spezifisches Antigen auf Tumoren bindet, das behandelt werden muss. Diese gentechnisch veränderten CAR-T-Zellen binden nach der Verabreichung durch eine Epitop-Antigen-Interaktion an das spezifische Antigen, das auf den Tumorzellen vorhanden ist. Nach der Bindung werden die gebundenen CAR-T-Zellen aktiviert, vermehren sich dann und setzen Zytokine frei, die dem Immunsystem des Wirts signalisieren, den Tumor anzugreifen, der das spezifische Antigen exprimiert. Im Gegensatz dazu werden dendritische Zellen im Falle von dendritischen Zelltherapien11,12 so verändert, dass sie ein spezifisches Krebsantigen auf ihrer Oberfläche präsentieren. Diese manipulierten dendritischen Zellen besiedeln bei der Verabreichung die Lymphknoten und binden an die T-Zellen in den Lymphknoten. Die T-Zellen durchlaufen nach der Bindung an die spezifischen Krebsantigene auf den verabreichten dendritischen Zellen eine Aktivierung/Proliferation und initiieren eine Immunantwort des Wirts gegen den Tumor, der dieses spezifische Antigen exprimiert. Daher ist die Beurteilung des Transports von verabreichten CAR-T-Zellen zu einer Tumorstelle9,10 und des Homings von dendritischen Zellen zu den Lymphknoten11,12 durch die Bildgebung von radioaktiv markierten CAR-T-Zellen und dendritischen Zellen möglich, um die Wirksamkeit der Immuntherapie zu bestimmen. Darüber hinaus kann der nicht-invasive Zelltransport dazu beitragen, das therapeutische Potenzial besser zu verstehen, das direkte und indirekte therapeutische Ansprechen zu klären und das therapeutische Ansprechen sowohl von Stammzell- als auch von Immunzell-basierten Therapien vorherzusagen und zu überwachen.
Es wurden verschiedene bildgebende Modalitäten für den Zelltransport untersucht 3,4,9,10,12, darunter optische Bildgebung, Magnetresonanztomographie (MRT), Einzelphotonenemissions-Computertomographie (SPECT) und Positronen-Emissions-Tomographie (PET). Jede dieser Techniken hat ihre eigenen Vor- und Nachteile. Unter diesen ist PET aufgrund ihrer quantitativen Natur und hohen Sensitivität, die für die zuverlässige Quantifizierung von Zellen im bildgebenden Zelltransport unerlässlich sind, die vielversprechendste Modalität 3,4,9,10.
Das Positronen-emittierende Radioisotop 89Zr mit einer Halbwertszeit von 78,4 h eignet sich für die Zellmarkierung. Es ermöglicht die PET-Bildgebung des Zelltransports über 1 Woche lang und wird von weit verbreiteten, energiearmen medizinischen Zyklotronen 13,14,15,16,17 leicht hergestellt. Darüber hinaus ist ein entsprechend funktionalisierter, p-Isothiocyanatobenzyl-Desferrioxamin (DFO-Bn-NCS)-Chelator für die Synthese eines 89 Zr-markierten, gebrauchsfertigen, zellmarkierenden Synthons, [89 Zr]Zr-p-isothiocyanatobenzyl-desferrioxamin, auch bekannt als [89Zr]Zr-DBN 18,19,20,21,22,23,24, kommerziell erhältlich,25. Das Prinzip der [89 Zr]Zr-DBN-vermittelten Zellmarkierung basiert auf einer Reaktion zwischen primären Aminen von Zellmembranproteinen und dem Isothiocyanat (NCS)-Teil von [89Zr]Zr-DBN, um eine stabile kovalente Thioharnstoffbindung zu erzeugen.
[89Zr] Zr-DBN-basierte Zellmarkierung und Bildgebung wurden veröffentlicht, um eine Vielzahl verschiedener Zellen zu verfolgen, darunter Stammzellen 18,23,25, dendritische Zellen18, kardiopoetische Stammzellen19, deziduale Stromazellen 20, aus dem Knochenmark stammende Makrophagen 20, mononukleäre Zellen des peripheren Blutes 20, Jurkat/CAR-T-Zellen 21, Hepatozyten 22,24 und weiße Blutkörperchen 25. Das folgende Protokoll enthält Schritt-für-Schritt-Methoden zur Präparation und Radiomarkierung von Zellen mit [89Zr]Zr-DBN und beschreibt Änderungen, die im Radiomarkierungsprotokoll für einen bestimmten Zelltyp erforderlich sein können. Zur besseren Übersichtlichkeit ist die hier vorgestellte Methode der radioaktiven Zellmarkierung in vier Abschnitte unterteilt. Der erste Abschnitt befasst sich mit der Herstellung von [89 Zr]Zr-DBN durch Chelatbildung von 89Zr mit DFO-Bn-NCS. Der zweite Abschnitt beschreibt die Herstellung einer biokompatiblen Formulierung von [89Zr]Zr-DBN, die leicht für die radioaktive Markierung von Zellen verwendet werden kann. Der dritte Abschnitt behandelt die Schritte, die für die Vorkonditionierung von Zellen für die radioaktive Markierung erforderlich sind. Die Vorkonditionierung der Zellen beinhaltet das Waschen der Zellen mit proteinfreier phosphatgepufferter Kochsalzlösung (PBS) und HEPES-gepufferter Hanks-Salzlösung (H-HBSS), um externe Proteine zu entfernen, die die Reaktion von [89Zr]Zr-DBN mit primären Aminen, die während der radioaktiven Markierung auf den Proteinen der Zelloberfläche vorhanden sind, stören oder mit ihr konkurrieren könnten. Der letzte Abschnitt beschreibt die Schritte der eigentlichen radioaktiven Markierung der Zellen und der Analyse der Qualitätskontrolle.
Protokoll
Dendritische Zellen und Melanomzellen wurden kommerziell gewonnen18. Hepatozyten wurden nach laparoskopischer partieller Hepatektomie aus der Leber von Schweinen isoliert22,24. Die Stammzellen wurden aus Knochenmarkaspiraten isoliert18,19,26. Die aus dem Fettgewebe gewonnenen Stammzellen wurden aus dem Human Cellular Therapy Laboratory, Mayo Clinic Rochester23, gewonnen. Menschliche weiße Blutkörperchen wurden aus dem entnommenen Blut isoliert, das von der Abteilung für Transfusionsmedizin der Mayo Clinic Rochester25 erhalten wurde. Verschiedene Zellen, die für die radioaktive Markierung verwendet wurden, wurden in Übereinstimmung mit den Richtlinien gewonnen und verwendet, die vom Institutional Animal Care and Use Committee, dem Mayo Clinic Stem Cell Research Oversight Subcommittee, dem Division of Transfusion Medicine Research Committee, dem Institutional Biosafety Committee und dem Radiation Safety Committee empfohlen wurden.
1. Herstellung von [ 89 Zr ]Zr-p-isothiocyanatobenzyl-desferrioxamin ([ 89Zr ]Zr-DBN)
Zeit: ~160-220 min
ANMERKUNG: Zur Herstellung von [89 Zr]Zr-DBN 89 Zr in Form von [89 Zr]Zr-Hydrogenphosphat ([89 Zr]Zr(HPO4)2) oder [89 Zr]Zr-Chlorid ([89Zr]ZrCl4) isolieren, wie in Schritt 1.1 beschrieben.
- Isolierung von 89 Zr aus dem Mutterstoff 89Y unter Verwendung eines etablierten Reinigungsverfahrens auf Hydroxamatharzbasis13,17. Kurz gesagt, bereiten Sie zuerst eine Säule mit ~100 mg Hydroxamatharz vor, aktivieren Sie dann das Hydroxamatharz, indem Sie die Säule mit 8,0 ml reinem wasserfreiem Acetonitril waschen, gefolgt von einer Spülung mit 5,0-6,0 ml Luft. Dann wird die Säule mit 15 ml deionisiertem Wasser gewaschen, gefolgt von einer weiteren Spülung mit 5,0 bis 6,0 ml Luft und dann 2,0 ml 0,50 N HCl (Spurenmetallbasis), gefolgt von einer zusätzlichen Spülung mit 5,0 bis 6,0 ml Luft. Als nächstes wird die Lösung, die sowohl 89 Zr als auch 89 Y enthält, langsam in das Hydroxamatharz geladen und die ungebundenen 89Y aus dem Hydroxamatharz mit 20 ml 2,0 N HCl gewaschen, gefolgt von 10 ml deionisiertem Wasser und einer Spülung mit 5,0 bis 6,0 ml Luft.
HINWEIS: Nach dem Spülen mit Luft kann die Elution von 89Zr wie unten gezeigt durchgeführt werden.- Um 89 Zr in Form von [89 Zr]Zr(HPO4)2 zu eluieren, werden zunächst 0,50 ml 1,2 MK2HPO4/KH2PO4-Puffer (pH3,5) in die Säule aus Schritt 1.1 gegeben und 30 Minuten auf der Säule sitzen gelassen, um die Freisetzung von 89 Zr als [89Zr]Zr(HPO 4)2 aus dem Harz zu fördern. Anschließend werden die 89Zr aus der Säule mit zusätzlichen 1,50 ml 1,2 M K2 HPO4/KH2PO4-Puffer (pH 3,5) eluiert. Nach der Elution von [89 Zr]Zr(HPO 4)2 sind die Schritte 1.2, 1.2.1 und 1.2.2 zur Herstellung von [89 Zr]Zr-DBN unter Verwendung von [89Zr]Zr(HPO 4)2 zu befolgen, wie in Abbildung 1 dargestellt.
- Um 89 Zr als [89 Zr]ZrCl4 zu erhalten, werden zunächst 89 Zr als [89Zr]Zr-Oxalat eluiert.
- Zum Eluieren von 89 Zr in Form von [89 Zr]Zr-Oxalat werden 0,50 ml 1,0 M Oxalsäure in die Säule aus Schritt 1.1 gegeben und 1 Minute auf der Säule ruhen gelassen, um die Freisetzung von 89 Zr als [89Zr]-Oxalat aus dem Harz zu fördern. Anschließend werden die 89Zr aus der Säule mit zusätzlichen 2,50 ml 1,0 M Oxalsäure (insgesamt 3,0 ml)17 eluiert.
- Um [89Zr]Zr-Oxalat unter Verwendung einer Anionenaustauschsäule in [89Zr]ZrCl4 umzuwandeln, wie von Larenkov et al.14 beschrieben, wird die Säule zunächst durch Waschen mit 6,0 ml Acetonitril aktiviert, gefolgt von einer Spülung mit 5,0 bis 6,0 ml Luft. Waschen Sie dann die Säule mit 10,0 ml Kochsalzlösung, gefolgt von einer weiteren Spülung mit 5,0-6,0 ml Luft. Zum Schluss 10,0 ml deionisiertes Wasser ablassen, gefolgt von einer Spülung mit 5,0-6,0 ml Luft.
- Die 3,0-ml-Lösung, die [89Zr]Zr-Oxalat enthält, wird langsam auf die aktivierte Anionenaustauschsäule geladen, gefolgt von einer Spülung von 5,0-6,0 ml Luft. Waschen Sie dann die mit 89Zr beladene Säule mit 50,0 ml deionisiertem Wasser, um das ungebundene Oxalat-Ion zu entfernen, gefolgt von einer Spülung mit 5,0-6,0 ml Luft.
- Um 89 Zr in Form von [89 Zr]ZrCl4 zu eluieren, werden 0,10 ml 1,0 N HCl in die Säule gegeben, 1,0 Minuten auf der Säule sitzen gelassen, um die Freisetzung von 89 Zr als [89 Zr]ZrCl4 aus dem Harz zu fördern, und die 89Zr aus der Säule mit zusätzlichen 0,40 ml 1,0 N HCl (insgesamt 0,5 ml) eluiert. Trocknen Sie das eluierte [89Zr]ZrCl4 in einem V-förmigen Fläschchen, indem Sie es in einen Heizblock bei 65 °C unter einem stetigen Stickstoffgasstrom für 10-30 Minuten geben. Nach dem Trocknen wird das getrocknete [89 Zr]ZrCl4 in Wasser rekonstituiert und die Schritte 1.3 und 1.3.1 zur Herstellung von [89 Zr]Zr-DBN unter Verwendung von [89Zr]ZrCl4 befolgt, wie in Abbildung 1 dargestellt.
- Es werden ~120 μl [89Zr]Zr(HPO 4)2, formuliert in 1,2 MK2HPO 4/KH2PO 4 (pH 3,5) (10 bis 25 MBq) aus Schritt 1.1.1 entnommen und die Lösung neutralisiert, um einen pH-Wert von 7,5 bis 8,0 mit ~100 μl 1,0 M HEPES-KOH (PH 7,5) und ~65 μl 1,0 MK2CO3zu erreichen.
- Um die geeignete Menge an DFO-Bn-NCS für die Schritte 1.2.2 oder 1.3.1 für verschiedene 89 Zr-Formulierungen mit einer unterschiedlichen scheinbaren spezifischen Aktivität von 89 Zr zu erhalten, wird eine Reihe von Chelatreaktionen unter Verwendung eines festen Volumens einer neutralisierten Formulierung von [89 Zr]Zr(HPO4)2 oder [89Zr]ZrCl4 mit einem Bereich von DFO-Bn-NCS (7,5-15 μg) durchgeführt. Im Fall von [89Zr]Zr(HPO4)2 wird die Chelatreaktion bei 37 °C in einem Shaker bei ~550 U/min für 60 min inkubiert. Im Fall von [89Zr]ZrCl4 wird die Chelatreaktion bei 25 °C in einem Shaker bei ~550 U/min für 30 min inkubiert. Verwerfen Sie die Chelatreaktion, die während oder am Ende der Inkubation einen Niederschlag zeigt. Am Ende der Inkubation wird eine radioaktive Dünnschichtchromatographie (rad-DC) mit 100 mM Diethylentriaminpentaacetat (DTPA), pH 7,0, als mobile Phase durchgeführt, um die Chelatierungseffizienz von DFO-Bn-NCS für jede Chelatreaktion abzuschätzen, wie unten in Schritt 1.5 beschrieben.
ANMERKUNG: Basierend auf der Chelatierungseffizienz ist die Mindestmenge an DFO-Bn-NCS in den Schritten 1.2.2 oder 1.3.1 zu verwenden, die erforderlich ist, um eine Chelatierungseffizienz von ≥97 % zu erreichen, ohne eine Ausfällung von DFO-Bn-NCS in der neutralisierten Formulierung von [89 Zr]Zr(HPO 4)2 oder [89Zr]ZrCl4 zu verursachen. Hierin wurde [89Zr]Zr-DBN in ≥97%iger radiochemischer Reinheit synthetisiert. - Bereiten Sie frische 5,0 mM DFO-Bn-NCS in wasserfreiem DMSO (3,76 mg/ml) vor und fügen Sie 4,0 μl 5,0 mM DFO-Bn-NCS (20 nmol oder 15 μg) zu ~285 μl neutralisiertem [89Zr]Zr(HPO4)2 (10-25 MBq) aus Schritt 1.2 hinzu und mischen Sie die Lösung durch Pipettieren. Halten Sie die endgültige DMSO-Konzentration in der Chelatmischung unter 2 % des Gesamtvolumens.
- Um die geeignete Menge an DFO-Bn-NCS für die Schritte 1.2.2 oder 1.3.1 für verschiedene 89 Zr-Formulierungen mit einer unterschiedlichen scheinbaren spezifischen Aktivität von 89 Zr zu erhalten, wird eine Reihe von Chelatreaktionen unter Verwendung eines festen Volumens einer neutralisierten Formulierung von [89 Zr]Zr(HPO4)2 oder [89Zr]ZrCl4 mit einem Bereich von DFO-Bn-NCS (7,5-15 μg) durchgeführt. Im Fall von [89Zr]Zr(HPO4)2 wird die Chelatreaktion bei 37 °C in einem Shaker bei ~550 U/min für 60 min inkubiert. Im Fall von [89Zr]ZrCl4 wird die Chelatreaktion bei 25 °C in einem Shaker bei ~550 U/min für 30 min inkubiert. Verwerfen Sie die Chelatreaktion, die während oder am Ende der Inkubation einen Niederschlag zeigt. Am Ende der Inkubation wird eine radioaktive Dünnschichtchromatographie (rad-DC) mit 100 mM Diethylentriaminpentaacetat (DTPA), pH 7,0, als mobile Phase durchgeführt, um die Chelatierungseffizienz von DFO-Bn-NCS für jede Chelatreaktion abzuschätzen, wie unten in Schritt 1.5 beschrieben.
- Man nehme ~180 μl [89 Zr]ZrCl4, formuliert in 0,1 N HCl (40–80MBq) aus Schritt 1.1.2.4 und neutralisiere die resultierende Lösung, um einen pH-Wert von 7,5–8,0 mit ~25 μl 1,0 MNa2CO3zu erreichen.
- Bereiten Sie frische 2,5 mM DFO-Bn-NCS in wasserfreiem Dimethylsulfoxid (DMSO) (1,88 mg/ml) vor und geben Sie 4,0 μl 2,5 mM DFO-Bn-NCS (10 nmol oder 7,5 μg) zu ~205 μl neutralisiertem [89 Zr]ZrCl4(40-80 MBq) aus Schritt 1.3. Mischen Sie die Lösung durch Pipettieren. Halten Sie die endgültige DMSO-Konzentration in der Chelatmischung unter 2 % des Gesamtvolumens.
- Fahren Sie mit der Chelatbildung von 89 Zr bei 37 °C in einem Shaker bei ~550 U/min für 60 min im Fall von [89 Zr]Zr(HPO 4)2 oder bei 25 °C in einem Shaker bei ~550 U/min für 30 min im Fall von [89Zr]ZrCl4 fort.
- Bestimmung der Chelatbildungseffizienz von 89Zr mittels rad-TLC mit 100 mM DTPA (pH 7,0) als mobiles Lösungsmittel rad-TLC. Erwarten Sie, dass [89 Zr]Zr-DBN ein R f von ~0,021-0,035 zeigt, [89 Zr]ZrCl 4 ein R f von ~1,0 und [89Zr]Zr(HPO4)2 ein R f von ~1,0. Berechnen Sie die Chelat-Effizienz (%) anhand von Gleichung (1):
Prozentsatz von 89 Zr, die zu DFO-NCS chelatisiert werden, um [89 Zr]Zr-DBN = [ (Radioaktivität bei Rf von [89 Zr]Zr - DBN) / (Summe der Radioaktivitäten bei R f von [89 Zr]Zr - DBN und bei R f von [89 Zr]Zr(HPO 4)2 oder [89Zr]ZrCl4) ] × 100 (1)
ANMERKUNG: Die akzeptable Chelatierungseffizienz von 89Zr, um mit der radioaktiven Markierung der Zellen fortzufahren, wie durch rad-TLC bestimmt, beträgt ≥97%. Die vorgeschlagene radiochemische Reinheit von ≥97 % von [89Zr]Zr-DBN wurde gemäß der radiochemischen Standardreinheitsanforderung für andere im Feld verwendete Radiopharmazeutika festgelegt. Siehe die repräsentative rad-TLC in der ergänzenden Abbildung S1 und der ergänzenden Abbildung S2.

Abbildung 1: Schematische Darstellung der [89Zr]Zr-DBN-Präparation. Zur Herstellung von [89 Zr]Zr-DBN wird vorformuliertes [89 Zr]Zr(HPO4)2 oder [89Zr]ZrCl4auf einen pH-Wert von 7,5 bis 8,0 neutralisiert. Inkubieren Sie die neutralisierte Lösung mit DFO-Bn-NCS. Überprüfen Sie die Chelatierungseffizienz von 89Zr zu DFO-Bn-NCS durch rad-TLC. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Biokompatible Formulierung von [ 89Zr ]Zr-DBN für die radioaktive Markierung von Zellen (Abbildung 2)
Zeit: ~35 min
HINWEIS: Angesichts der Zeit, die für die Vorbereitung der Zellen in Schritt 3 benötigt wird, beginnen Sie Schritt 3 etwa 20 Minuten vor Beginn von Schritt 2 für eine ~30-minütige Inkubation. Dadurch kann die radioaktive Markierung der Zellen in Schritt 4 innerhalb von ~5-10 Minuten nach Abschluss der Schritte 2-3.2.2 beginnen.
- Für die [89 Zr]Zr-DBN-Formulierung aus dem [89 Zr]ZrCl4 werden 50,0 μl eines zellkompatiblen Gemisches zugegeben, das ~27,0 μl 1,2 MK2HPO 4/KH2PO4 (pH 3,5) + ~23,0 μl 1,0 M HEPES-KOH-Puffer (pH 7,5) zu 50,0 μl [89 Zr]Zr-DBN enthält. Inkubieren Sie das [89Zr]Zr-DBN-Zell-kompatible Gemisch für ~30 Minuten bei Raumtemperatur (25 °C).
HINWEIS: Die [89 Zr]Zr-DBN-Formulierung aus [89Zr]Zr(HPO4)2 ist biokompatibel für die radioaktive Markierung von Zellen und erfordert keinen Schritt 2.
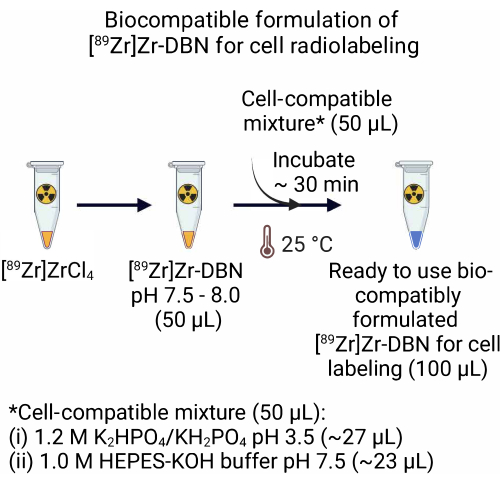
Abbildung 2: Herstellung der biokompatiblen Formulierung des [89Zr]Zr-DBN für die radioaktive Markierung von Zellen. Zur Herstellung einer gebrauchsfertigen biokompatiblen Formulierung des radioaktiv markierenden Synthons wird ein gleiches Volumen einer zellkompatiblen Mischung, bestehend aus 1,2 MK2HPO 4/KH2PO4 (pH 3,5) + 1,0 M HEPES-KOH, zu einem gleichen Volumen von [89Zr]Zr-DBN zugegeben. Bei 25 °C ~30 min inkubieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Vorbereitung der Zellen für die radioaktive Markierung
Zeit: ~40-50 min
- Trypsinisieren Sie ~12 × 106 adhärente Zellen (Stammzellen, Melanomkrebszellen, kardiopoetische Stammzellen, dendritische Zellen oder Hepatozyten) und zentrifugieren Sie die Zellen in einem konischen 15,0-ml-Zentrifugenröhrchen bei ~96 × g für 10 Minuten bei 4 °C.
- Verwerfen Sie den Überstand, resuspendieren Sie das Zellpellet in ~500 μl PBS und überführen Sie die Zellsuspension in ein 1,5-ml-Mikrozentrifugenröhrchen. Zentrifugieren Sie die Zellen in einer Mikrozentrifuge bei ~96 × g für 10 min bei 4 °C.
- Verwerfen Sie den Überstand und resuspendieren Sie das Zellpellet in ~500 μl H-HBSS. Zentrifugieren Sie die Zellen in einer 1,5-ml-Mikrozentrifuge bei ~96 × g für 10 Minuten bei 4 °C. Wiederholen Sie Schritt 3.1.2 noch einmal und fahren Sie mit Schritt 4.1.1 fort.
HINWEIS: H-HBSS ist eine ausgewogene Hanks-Salzlösung mit 0,01 M HEPES (pH 8,0).
- Bei nicht adhärenten Zellen, wie z. B. menschlichen weißen Blutkörperchen (frisch isolierte menschliche weiße Blutkörperchen aus dem Blut), überspringen Sie die Trypsinisierung und zentrifugieren Sie die Zellsuspension mit ~12 × 10 6 Zellen in einer 1,5 ml Mikrozentrifuge bei ~96 × g für10 min bei 4 °C.
- Verwerfen Sie den Überstand, resuspendieren Sie das Zellpellet in ~500 μl PBS und zentrifugieren Sie die Zellen in einer 1,5-ml-Mikrozentrifuge bei ~96 × g für 10 Minuten bei 4 °C.
- Verwerfen Sie den Überstand und resuspendieren Sie das Zellpellet in ~500 μl H-HBSS. Zentrifugieren Sie die Zellen in einer 1,5-ml-Mikrozentrifuge bei ~96 × g für 10 Minuten bei 4 °C. Wiederholen Sie Schritt 3.2.2 noch einmal und fahren Sie mit Schritt 4.1.1 fort.
4. Radioaktive Markierung von Zellen
Zeit: ~125-155 min
- Initiierung der radioaktiven Markierung von Zellen (Abbildung 3)
- Verwenden Sie die Zellsuspension aus Schritt 3.1.2 oder Schritt 3.2.2, um eine ~500 μl Zellsuspension mit ca. ~6 × 106 Zellen in ~500 μl H-HBSS bei pH 7,5-8,0 in einem 1,5 ml Mikrozentrifugenröhrchen herzustellen.
- Dazu fügen Sie ~100 μl des biokompatibel formulierten [89Zr]Zr-DBN aus Schritt 2 hinzu.
- Zellinkubation für die radioaktive Markierung (Abbildung 4)
- Mischen Sie das biokompatibel formulierte [89 Zr]Zr-DBN und die Zellsuspension, indem Sie vorsichtig mit einer Mikropipette auf ~500 μl auf und ab pipettieren. Messen Sie die Radioaktivitätsmenge im Inkubationsröhrchen mit einem Radioaktivitätskalibrator bei der Einstellung 489 für 89Zr-Isotop16.
- Inkubieren Sie die Zellen und das [89Zr]Zr-DBN-Gemisch in einem Schüttler bei ~550 U/min bei 25-37 °C für 30-45 Minuten für die Zellmarkierung.
HINWEIS: Die Temperatur der Inkubation hängt von den Zelltypen ab, die für die radioaktive Markierung verwendet werden, wie in Tabelle 1 dargestellt. - Nach der Inkubation in Schritt 4.2.2 wird die radioaktive Markierungsreaktion der Zelle mit einem frisch hergestellten rad-TLC-Lösungsmittel (20 mM Natriumcitrat [pH 4,9-5,1]:Methanol [1:1, V:V]) durchgeführt. Nach dem rad-TLC-Lauf ist nach [89 Zr]Zr-DBN und [89 Zr]ZrCl4 um R f = ~0,73-0,81 und R f = ~0,01-0,02 für die radioaktiv markierten Zellen zu suchen. Berechnen Sie den prozentualen Anteil der Radioaktivität bei Rf = ~0,01-0,02 unter Verwendung von Gleichung (2).
Prozentsatz der Radioaktivität bei R f = ~0,01-0,02 = [ (Radioaktivität bei R f= ~0,01 - 0,02) / (Summe der Radioaktivitäten bei R f = ~0,01 - 0,02 und R f = ~0,73 - 0,81) ] × 100 (2)
ANMERKUNG: Um die Peaks zu verstehen, die bei R f = ~0,01-0,02 und R f = ~0,73-0,81 visualisiert werden, siehe die rad-TLC für die radioaktive Markierungsreaktion der weißen Blutkörperchen in Ergänzender Abbildung S3. - Mischen Sie in einem separaten 1,5-ml-Mikrozentrifugenröhrchen ~100 μl des biokompatibel formulierten [89Zr]Zr-DBN mit ~500 μl H-HBSS bei einem pH-Wert von 7,5-8,0 zur Verwendung als No-Cell-Kontrolle für die Hintergrundkorrektur in Schritt 4.2.5. Nach der Inkubation bei einer ähnlichen Temperatur und Zeit wie in Schritt 4.2.2 ist die rad-TLC durchzuführen. Suchen Sie nach dem rad-TLC-Lauf nach [89 Zr]Zr-DBN und [89 Zr]ZrCl4 um Rf = ~0,73-0,81. Berechnen Sie den prozentualen Anteil der Radioaktivität bei Rf = ~0,01-0,02 unter Verwendung von Gleichung (3).
Radioaktivität bei R f = ~0,01-0,02 = [ (Radioaktivität bei R f= ~0,01 - 0,02) / (Summe der Radioaktivitäten bei R f= ~0,01 - 0,02 und R f= ~0,73 - 0,81) ] × 100 (3)
ANMERKUNG: Um die bei Rf = ~0,01-0,02 und ~0,73-0,81 visualisierten Peaks zu verstehen, siehe die rad-TLC der No-Cell-Kontrollreaktion in der ergänzenden Abbildung S4. - Berechnen Sie die effektive Radiomarkierung der Zellen (%), indem Sie den Radioaktivitätsprozentsatz bei R f = ~0,01-0,02 (von rad-TLC aus Schritt 4.2.4) vom Radioaktivitätsprozentsatz bei R f = ~0,01-0,02 (von rad-TLC aus Schritt 4.2.3) subtrahieren.
- Quenching von radioaktiver Markierung und Zellwäsche (Abbildung 5)
- Nachdem Sie den Abschluss der radioaktiven Markierung durch rad-TLC in Schritt 4.2.5 bestätigt haben, ist die radioaktive Markierungsreaktion durch Zugabe von ~600 μl gekühltem, zellgeeignetem vollständigem Medium oder durch Zugabe von H-HBSS zu löschen, wie in Tabelle 1 gezeigt.
- Zentrifugieren Sie die Zellen in einer Mikrozentrifuge bei ~96 × g für 10 min bei 4 °C. Verwerfen Sie den Überstand.
- Resuspendieren Sie die pelletierten Zellen vorsichtig in ~500 μl gekühltem Medium (Dulbecco's modifiziertes Eagle Medium (DMEM) + 10 % fötales Kälberserum + 5 % Penicillin/Streptomycin oder Roswell Park Memorial Institute-1640 (RPMI-1640) + 10 % fötales Kälberserum + 5 % Penicillin/Streptomycin oder H-HBSS für einen bestimmten Zelltyp, wie in Tabelle 1 dargestellt. Führen Sie die Resuspension des Zellpellets durch, indem Sie vorsichtig mit einer Mikropipette auf ~500 μl auf und ab pipettieren.
- Zentrifugieren Sie die Zellen in einer Mikrozentrifuge bei ~96 × g für 10 min bei 4 °C.
- Wiederholen Sie die Schritte 4.3.2 bis 4.3.4 zweimal, um die ungebundene Radioaktivität abzuwaschen.
- Das Pellet wird in ein frisches 1,5-ml-Mikrozentrifugenröhrchen mit DMEM + 10 % fötalem Rinderserum + 5 % Penicillin/Streptomycin im Falle von Stammzellen oder H-HBSS überführt und die Radioaktivität im Zellpellet mit einem Dosiskalibrator bei der Einstellung 489 für 89Zr-Isotop16 gemessen.
- Berechnen Sie die endgültige radioaktive Markierungseffizienz nach allen Wäschen anhand von Gleichung (4).
Radioaktivierungseffizienz = [(Zerfallskorrigierte Radioaktivität in Zellpellets in Schritt 4.3.6) / (Zerfallskorrigierte Radioaktivität in Zellpellets und H-HBSS in Schritt 4.2.1) ] × 100 (4) - Um die Qualität der radioaktiv markierten Zellen sicherzustellen, wird zunächst die endgültige Suspension der radioaktiv markierten Zellen visuell auf das Vorhandensein von Klumpen untersucht. Wenn keine Klumpen vorhanden sind, fahren Sie mit dieser letzten Aufhängung mit dem nächsten Schritt fort. Wenn Klumpen vorhanden sind, diese aber durch Pipettieren oder leichtes Schütteln wieder suspendiert werden können, tun Sie dies und fahren Sie mit dem nächsten Schritt fort, da dieser die Sichtprüfung besteht. Wenn die Klumpen jedoch weder durch Pipettieren noch durch leichtes Schütteln resuspendiert werden, verwerfen Sie die Suspension und beginnen Sie von vorne.
- Wenn die Sichtprüfung bestanden wurde, ist innerhalb von 1 Stunde nach der radioaktiven Markierung und den Waschschritten (4.3.3-4.3.7) zur Beurteilung der Zelllebensfähigkeit der radioaktiv markierten Zellen ein Trypanblau-Ausschluss-Viabilitätstest mit 0,4%iger Trypanblau-Lösung durchzuführen, die in PBS hergestellt wurde.
- Um den Test durchzuführen, werden 10,0 μl 0,4%ige Trypanblaulösung in die 10,0 μl-Zellsuspension von radioaktiv markierten und nicht markierten Zellen gegeben und gemischt, indem die Trypan-Blaukörperchen-Suspension mit einer auf 10,0 μl eingestellten Mikropipette auf und ab pipettiert wird.
- Befüllen Sie ein Hämazytometer mit ~10,0 μl der Trypan-Blaukörperchen-Suspensionsmischung, zählen Sie sofort die Anzahl der blau gefärbten Zellen und die Gesamtzahl der Zellen im Hämazytometer unter einem Mikroskop bei geringer Vergrößerung oder mit einem automatischen Zellzähler. Berechnen Sie den Prozentsatz lebensfähiger Zellen mit Hilfe von Gleichung (5).
Prozentsatz lebensfähiger Zellen = 100 - [(Anzahl der blau gefärbten Zellen) / (Anzahl der Zellen insgesamt)] × 100 (5)
- Verwenden Sie die radioaktiv markierten Zellen, wenn sich der Prozentsatz der lebensfähigen Zellen in der radioaktiv markierten Zellsuspension im Vergleich zum unmarkierten Gegenstück nicht ändert. Verwerfen Sie die radioaktiv markierten Zellen, wenn der Prozentsatz der lebensfähigen Zellen geringer ist als das unmarkierte Gegenstück.
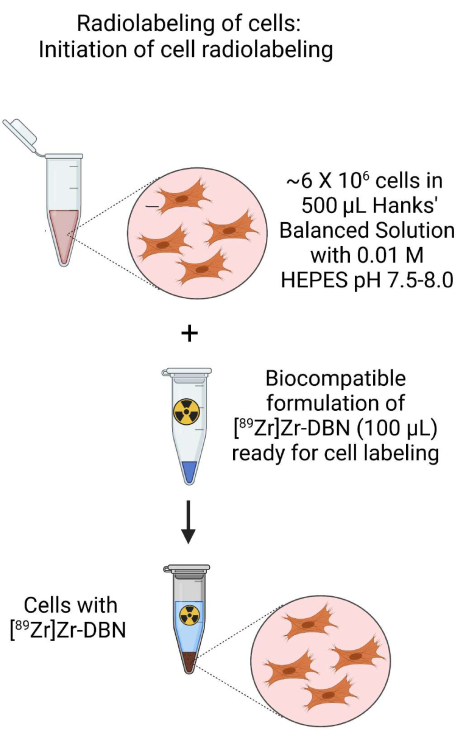
Abbildung 3: Schematische Darstellung der Initiierung der radioaktiven Markierung von Zellen. Initiierung der radioaktiven Markierung von Zellen durch Zugabe des biokompatibel formulierten [89Zr]Zr-DBN zu der Zellsuspension, die in HEPES-gepufferter Hanks-balancierter Salzlösung hergestellt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
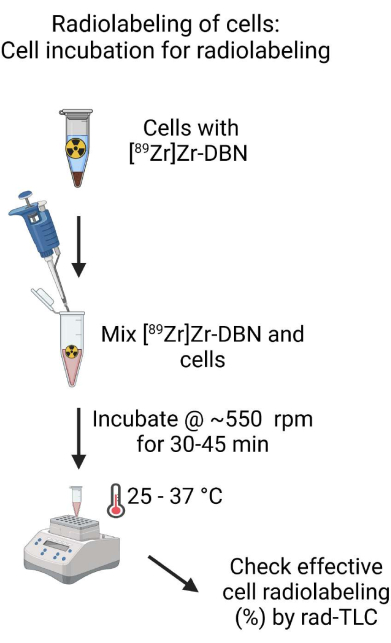
Abbildung 4: Schematische Darstellung der Zellinkubation für die radioaktive Markierung. Mischen Sie das biokompatibel formulierte [89Zr]Zr-DBN gründlich mit der Zellsuspension und inkubieren Sie die Zellsuspension in einem temperaturgeregelten Heizblock auf einem Schüttler für 30-60 min. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
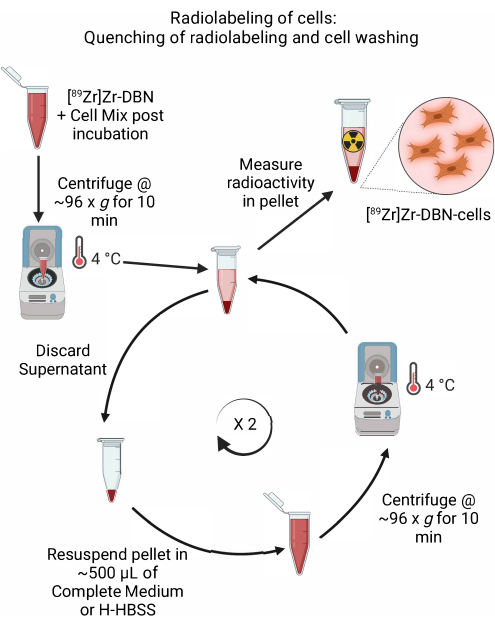
Abbildung 5: Schematische Darstellung des Abschreckens von radioaktiver Markierung und Zellwäsche. Die radioaktive Markierung der Zellen wird durch Zugabe von gekühltem Zellmedium oder H-HBSS gelöscht, gefolgt von einer Zentrifugation bei 4 °C. Zum Waschen der Zellen wird der Überstand verworfen und das Zellpellet in ~500 μl gekühltem Zellmedium oder H-HBSS resuspendiert. Wiederholen Sie den Zyklus des Verwerfens des Überstandes und der Resuspendierung des Zellpellets in frischem Medium, um das ungebundene radioaktiv markierte Synthon zu entfernen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Die repräsentativen Ergebnisse, die in diesem Manuskript vorgestellt werden, wurden aus den vorangegangenen [89Zr]Zr-DBN-Synthese- und Zellradiomarkierungsstudienzusammengestellt 18,19,22,23,24,25. Kurz gesagt, 89Zr können erfolgreich mit DFO-Bn-NCS in ~30-60 min bei 25-37 °C unter Verwendung von 7,5-...
Diskussion
Im Folgenden sind wichtige Schritte im Protokoll aufgeführt, die für eine effektive Radiomarkierung von Zellen optimiert werden müssen. In den Protokollschritten 1.2 und 1.3 muss je nach verwendetem Volumen von [89 Zr]Zr(HPO4)2 oder [89Zr]ZrCl4 ein geeignetes Volumen (Mikroliter) Base verwendet werden; 1,0 MK2CO3-Lösung muss für die Neutralisation von [89 Zr]Zr(HPO4)2 und 1,0 M Na2CO3-Lösung für die Neutralisation von [
Offenlegungen
Die Autoren haben keine finanziellen konkurrierenden Interessen, sondern sind die Erfinder dieser Technologie (Patent # US20210330823A1).
Danksagungen
Diese Arbeit wurde unterstützt durch NIH 5R21HL127389-02, NIH 4T32HL007111-39, NIH R01HL134664 und DOE DE-SC0008947 Grants, Internationale Atomenergie-Organisation, Wien, Mayo Clinic Division of Nuclear Medicine, Abteilung für Radiologie, und Mayo Clinic Center for Regenerative Medicine, Rochester, MN. Alle Figuren wurden mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A996-4 | |
| Alpha Minimum Essential Medium | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 12571063 | |
| Anion exchange column | Macherey-Nagel, Inc., Düren, Germany | 731876 | Chromafix 30-PS-HCO3 SPE 45 mg cartridge |
| Conical centrifuge tubes (15 mL) | Corning Inc., Glendale, AZ, USA | 352096 | Falcon 15 mL high-clarity polypropylene (PP) conical centrifuge tubes |
| Dendritic cells | The American Type Culture Collection, Manassas, VA, USA | CRL-11904 | |
| DFO-Bn-NCS | Macrocyclics, Inc., Plano, TX, USA | B-705 | p-SCN-Bn-Deferoxamine |
| DMSO | Sigma-Aldrich, Inc., St. Louis, MO | 276855 | |
| Dose calibrator | Mirion Technologies (Capintec), Inc., Florham Park, NJ, USA | 5130-3234 | CRC -55tR Dose Calibrator |
| Dulbecco’s modified Eagle’s medium | The American Type Culture Collection, Manassas, VA, USA | 30-2002 | |
| Fetal Bovine Serum (FBS) | The American Type Culture Collection, Manassas, VA, USA | 30-2020 | |
| Hanks Balanced Salt solution (HBSS) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 14025092 | For preparation of H-HBSS |
| Hydrochloric Acid (trace metal basis grade) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A508P212 | |
| Melanoma cells | The American Type Culture Collection, Manassas, VA, USA | CRL-6475 | |
| Methanol | Sigma-Aldrich, Inc., St. Louis, MO | 34860 | |
| Microcentrifuge tube | Eppendorf, Hamburg, Germany | 30108442 | Protein LoBind microcentrifuge tube |
| Murine GM-CSF | R&D Systems, Inc., Minneapolis, MN USA | 415-ML-010 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 15140-122 | |
| Phosphate Buffered Saline without Ca2+ and Mg2+ | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 10010023 | For washing cells |
| Saline | Covidien LLC, Mansfield, MA, USA | 1020 | 0.9% Sterile Saline Solution |
| Shaker | Eppendorf, Hamburg, Germany | T1317 | Thermomixer |
| Silica gel-rad-TLC paper sheet | Agilent Technologies Inc., Santa Clara, CA, USA | SGI0001 | iTLC-SG |
Referenzen
- Bhawnani, N., et al. Effectiveness of stem cell therapies in improving clinical outcomes in patients with heart failure. Cureus. 13 (8), e17236 (2021).
- Zakrzewski, W., Dobrzynski, M., Szymonowicz, M., Rybak, Z. Stem cells: past, present, and future. Stem Cell Research & Therapy. 10 (1), 68 (2019).
- Bukhari, A. B., Dutta, S., De, A. Image guidance in stem cell therapeutics: unfolding the blindfold. Current Drug Targets. 16 (6), 658-671 (2015).
- Momeni, A., Neelamegham, S., Parashurama, N. Current challenges for the targeted delivery and molecular imaging of stem cells in animal models. Bioengineered. 8 (4), 316-324 (2017).
- Gnecchi, M., Zhang, Z., Ni, A., Dzau, V. J. Paracrine mechanisms in adult stem cell signaling and therapy. Circulation Research. 103 (11), 1204-1219 (2008).
- D'Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282 (2018).
- Zhang, Q., et al. CAR-T cell therapy in cancer: tribulations and road ahead. Journal of Immunology Research. 2020, 1924379 (2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Shao, F., et al. Radionuclide-based molecular imaging allows CAR-T cellular visualization and therapeutic monitoring. Theranostics. 11 (14), 6800-6817 (2021).
- Sakemura, R., Can, I., Siegler, E. L., Kenderian, S. S. In vivo CART cell imaging: Paving the way for success in CART cell therapy. Molecular Therapy Oncolytics. 20, 625-633 (2021).
- Wang, Y., et al. Dendritic cell biology and its role in tumor immunotherapy. Journal of Hematology & Oncology. 13 (1), 107 (2020).
- Bulte, J. W. M., Shakeri-Zadeh, A. In vivo MRI tracking of tumor vaccination and antigen presentation by dendritic cells. Molecular Imaging and Biology. 24 (2), 198-207 (2022).
- Holland, J. P., Sheh, Y., Lewis, J. S. Standardized methods for the production of high specific-activity zirconium-89. Nuclear Medicine and Biology. 36 (7), 729-739 (2009).
- Larenkov, A., et al. Preparation of zirconium-89 solutions for radiopharmaceutical purposes: interrelation between formulation, radiochemical purity, stability and biodistribution. Molecules. 24 (8), 1534 (2019).
- Pandey, M. K., et al. A new solid target design for the production of 89Zr and radiosynthesis of high molar activity [89Zr]Zr-DBN. American Journal of Nuclear Medicine and Molecular Imaging. 12 (1), 15-24 (2022).
- Pandey, M. K., et al. Improved production and processing of 89Zr using a solution target. Nuclear Medicine and Biology. 43 (1), 97-100 (2016).
- Pandey, M. K., Engelbrecht, H. P., Byrne, J. P., Packard, A. B., DeGrado, T. R. Production of 89Zr via the 89Y(p,n)89Zr reaction in aqueous solution: effect of solution composition on in-target chemistry. Nuclear Medicine and Biology. 41 (4), 309-316 (2014).
- Bansal, A., et al. Novel 89Zr cell labeling approach for PET-based cell trafficking studies. EJNMMI Research. 5, 19 (2015).
- Bansal, A., et al. 89Zr]Zr-DBN labeled cardiopoietic stem cells proficient for heart failure. Nuclear Medicine and Biology. 90-91, 23-30 (2020).
- Friberger, I., et al. Optimisation of the synthesis and cell labelling conditions for [89Zr]Zr-oxine and [89Zr]Zr-DFO-NCS: a direct in vitro comparison in cell types with distinct therapeutic applications. Molecular Imaging and Biology. 23 (6), 952-962 (2021).
- Lee, S. H., et al. Feasibility of real-time in vivo 89Zr-DFO-labeled CAR T-cell trafficking using PET imaging. PLoS One. 15 (1), e0223814 (2020).
- Nicolas, C. T., et al. Hepatocyte spheroids as an alternative to single cells for transplantation after ex vivo gene therapy in mice and pig models. Surgery. 164 (3), 473-481 (2018).
- Yang, B., et al. Tracking and therapeutic value of human adipose tissue-derived mesenchymal stem cell transplantation in reducing venous neointimal hyperplasia associated with arteriovenous fistula. Radiology. 279 (2), 513-522 (2016).
- Nicolas, C. T., et al. Ex vivo cell therapy by ectopic hepatocyte transplantation treats the porcine tyrosinemia model of acute liver failure. Molecular Therapy. Methods & Clinical Development. 18, 738-750 (2020).
- Bansal, A., Sharma, S., Klasen, B., Rosch, F., Pandey, M. K. Evaluation of different 89Zr-labeled synthons for direct labeling and tracking of white blood cells and stem cells in healthy athymic mice. Scientific Reports. 12 (1), 15646 (2022).
- Behfar, A., et al. Guided cardiopoiesis enhances therapeutic benefit of bone marrow human mesenchymal stem cells in chronic myocardial infarction. Journal of the American College of Cardiology. 56 (9), 721-734 (2010).
- Charoenphun, P., et al. 89Zr]oxinate4 for long-term in vivo cell tracking by positron emission tomography. European Journal of Nuclear Medicine and Molecular Imaging. 42 (2), 278-287 (2015).
- Sato, N., et al. In vivo tracking of adoptively transferred natural killer cells in rhesus macaques using 89zirconium-oxine cell labeling and PET imaging. Clinical Cancer Research. 26 (11), 2573-2581 (2020).
- Volpe, A., Pillarsetty, N. V. K., Lewis, J. S., Ponomarev, V. Applications of nuclear-based imaging in gene and cell therapy: probe considerations. Molecular Therapy Oncolytics. 20, 447-458 (2021).
- Fogli, L. K., et al. Challenges and next steps in the advancement of immunotherapy: summary of the 2018 and 2020 National Cancer Institute workshops on cell-based immunotherapy for solid tumors. Journal for Immunotherapy of Cancer. 9 (7), e003048 (2021).
- Li, X., Hacker, M. Molecular imaging in stem cell-based therapies of cardiac diseases. Advanced Drug Delivery Reviews. 120, 71-88 (2017).
- Puges, M., et al. Retrospective study comparing WBC scan and 18F-FDG PET/CT in patients with suspected prosthetic vascular graft infection. European Journal of Vascular and Endovascular Surgery. 57 (6), 876-884 (2019).
- Butterfield, L. H. Dendritic cells in cancer immunotherapy clinical trials: are we making progress. Frontiers in Immunology. 4, 454 (2013).
- de Vries, I. J. M., et al. Magnetic resonance tracking of dendritic cells in melanoma patients for monitoring of cellular therapy. Nature Biotechnology. 23 (11), 1407-1413 (2005).
- Gosmann, D., et al. Promise and challenges of clinical non-invasive T-cell tracking in the era of cancer immunotherapy. EJNMMI Research. 12 (1), 5 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten