É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem por Tomografia por Emissão de Pósitrons do Tráfico Celular: Um Método de Radiomarcação Celular
Neste Artigo
Resumo
Apresentamos aqui um protocolo para radiomarcar células com um radioisótopo de tomografia por emissão de pósitrons (PET), 89 Zr (t1/2 78,4 h), usando um sintetizador de radiomarcação pronto para uso, [89 Zr]Zr-p-isothiocyanatobenzyl-desferrioxamine ([89Zr]Zr-DBN). A radiomarcação de células com [89Zr]Zr-DBN permite rastreamento não invasivo e imagens de células radiomarcadas administradas no corpo com PET por até 7 dias após a administração.
Resumo
Terapias com células-tronco e receptores de antígenos quiméricos (CAR) estão emergindo como terapêuticas promissoras para regeneração de órgãos e como imunoterapia para vários tipos de câncer. Apesar de avanços significativos nessas áreas, ainda há muito a ser aprendido para melhor compreender a farmacocinética e farmacodinâmica das células terapêuticas administradas no sistema vivo. Para rastreamento in vivo não invasivo de células com tomografia por emissão de pósitrons (PET), um novo método de radiomarcação celular mediado por [89 Zr]Zr-p-isothiocyanatobenzyl-desferrioxamine ([89 Zr]Zr-DBN) foi desenvolvido utilizando 89Zr (t1/2 78,4 h). O presente protocolo descreve um sintetizador radiomarcador mediado por [89Zr]Zr-DBN, pronto para uso, para marcação direta de uma variedade de células, incluindo células-tronco mesenquimais, células-tronco cardiopoéticas guiadas por linhagem, hepatócitos em regeneração hepática, glóbulos brancos, células de melanoma e células dendríticas. A metodologia desenvolvida permite imagens PET não invasivas do tráfego celular por até 7 dias após a administração sem afetar a natureza ou a função das células radiomarcadas. Além disso, este protocolo descreve um método passo a passo para a radiossíntese de [89 Zr]Zr-DBN, formulação biocompatível de [89 Zr]Zr-DBN, preparação de células para radiomarcação e, finalmente, a radiomarcação de células com [89Zr]Zr-DBN, incluindo todos os detalhes intrincados necessários para o sucesso da radiomarcação de células.
Introdução
As terapias com células-tronco e receptores de antígenos quiméricos (CAR) estão ganhando popularidade e estão sob investigação ativa para o tratamento de várias doenças, como insuficiência miocárdica1,2, degeneração retiniana 2, degeneração macular 2, diabetes 2, infarto do miocárdio 3,4,5 e cânceres 6,7,8,9,10. Entre as duas abordagens plausíveis das terapias com células-tronco, as células-tronco podem ser diretamente enxertadas no local da doença para causar uma resposta terapêutica ou causar alterações no microambiente do sítio da doença sem aderir ao local da doença para iniciar uma resposta terapêutica indireta. Uma resposta terapêutica indireta poderia causar alterações no microambiente do sítio da doença, liberando fatores que reparariam ou tratariam a doença5. Essas abordagens de terapias com células-tronco poderiam ser avaliadas por imagens não invasivas de células-tronco radiomarcadas. Imagens não invasivas poderiam correlacionar a captação das células radiomarcadas no local da doença com uma resposta terapêutica para decifrar a resposta terapêutica direta versus indireta.
Além disso, terapias baseadas em células imunes estão sendo desenvolvidas para tratar vários cânceres usando imunoterapia com células T CAR 6,7,8,9,10 e células dendríticas 11,12. Mecanisticamente, na imunoterapia com células T CAR 6,7,8,9,10, as células T são projetadas para expressar um epítopo que se liga a um antígeno específico em tumores que precisam ser tratados. Estas células T CAR modificadas, após a administração, ligam-se ao antígeno específico presente nas células tumorais através de uma interação epítopo-antígeno. Após a ligação, as células T CAR ligadas sofrem ativação e, em seguida, proliferam e liberam citocinas, que sinalizam o sistema imunológico do hospedeiro para atacar o tumor que expressa o antígeno específico. Em contraste, no caso das terapias com células dendríticas11,12, as células dendríticas são projetadas para apresentar um antígeno específico do câncer em sua superfície. Essas células dendríticas projetadas, quando administradas, abrigam os gânglios linfáticos e se ligam às células T nos gânglios linfáticos. As células T, ao se ligarem aos antígenos específicos do câncer nas células dendríticas administradas, sofrem ativação/proliferação e iniciam uma resposta imune do hospedeiro contra o tumor que expressa esse antígeno específico. Assim, a avaliação do tráfego de células T CAR administradas para um sítio tumoral9,10 e o homing de células dendríticas para os linfonodos11,12 é possível por meio de imagens de células T CAR radiomarcadas e células dendríticas para determinar a eficácia da imunoterapia. Além disso, o tráfico de células não invasivas pode ajudar a compreender melhor o potencial terapêutico, esclarecer a resposta terapêutica direta versus indireta e prever e monitorar a resposta terapêutica de terapias baseadas em células-tronco e células imunes.
Diferentes modalidades de imagem para o tráfego celular têm sido exploradas3,4,9,10,12, incluindo imagens ópticas, ressonância magnética (RM), tomografia computadorizada por emissão de fóton único (SPECT) e tomografia por emissão de pósitrons (PET). Cada uma dessas técnicas tem suas próprias vantagens e desvantagens. Dentre estas, a PET é a modalidade mais promissora devido à sua natureza quantitativa e alta sensibilidade, essenciais para a quantificação confiável de células no tráfico celular baseado em imagens 3,4,9,10.
O radioisótopo emissor de pósitrons 89Zr, com meia-vida de 78,4 h, é adequado para marcação celular. Permite imagens de PET do tráfego celular por mais de 1 semana e é prontamente produzido por cíclotrons médicos de baixa energia amplamente disponíveis 13,14,15,16,17. Além disso, um quelante p-isothiocyanatobenzyl-desferrioxamine (DFO-Bn-NCS) adequadamente funcionalizado está comercialmente disponível para a síntese de um sintetizador de marcação celular marcado com 89 Zr, pronto para uso, [89 Zr]Zr-p-isothiocyanatobenzyl-desferrioxamine, também conhecido como [89Zr]Zr-DBN 18,19,20,21,22,23,24,25. O princípio da marcação celular mediada por [89 Zr]Zr-DBN é baseado em uma reação entre aminas primárias de proteínas da membrana celular e a porção de isotiocianato (NCS) de [89Zr]Zr-DBN para produzir uma ligação covalente estável de tiouréia.
[89Zr] A marcação e a imagem de células baseadas em Zr-DBN foram publicadas para rastrear uma variedade de células diferentes, incluindo células-tronco 18,23,25, células dendríticas18, células-tronco cardiopoéticas19, células estromais deciduais 20, macrófagos derivados da medula óssea 20, células mononucleares do sangue periférico 20, células T Jurkat/CAR 21, hepatócitos 22,24 e leucócitos 25. O protocolo a seguir fornece métodos passo a passo de preparação e marcação radiocelular com [89Zr]Zr-DBN e descreve mudanças que podem ser necessárias no protocolo de radiomarcação para um tipo específico de célula. Para maior clareza, o método de radiomarcação celular aqui apresentado é dividido em quatro seções. A primeira seção trata da preparação de [89 Zr]Zr-DBN por quelação de 89Zr com DFO-Bn-NCS. A segunda seção descreve a preparação de uma formulação biocompatível de [89Zr]Zr-DBN que pode ser prontamente usada para marcação radiocelular celular. A terceira seção aborda as etapas necessárias para o pré-condicionamento das células para radiomarcação. O pré-condicionamento das células envolve a lavagem das células com solução salina tamponada com fosfato livre de proteínas (PBS) e solução salina balanceada de Hanks tamponada com HEPES (H-HBSS) para remover proteínas externas, que podem interferir ou competir com a reação de [89Zr]Zr-DBN com aminas primárias presentes nas proteínas de superfície celular durante a radiomarcação. A seção final fornece as etapas envolvidas na marcação radioativa real das células e na análise do controle de qualidade.
Protocolo
Células dendríticas e células de melanoma foram obtidas comercialmente18. Hepatócitos foram isolados do fígado de suínos após hepatectomia parcial laparoscópica22,24. Células-tronco foram isoladas de aspirados de medula óssea18,19,26. As células-tronco derivadas do tecido adiposo foram obtidas do Laboratório de Terapia Celular Humana, Mayo Clinic Rochester23. Os leucócitos humanos foram isolados do sangue coletado recebido da Divisão de Medicina Transfusional da Mayo Clinic Rochester25. Várias células usadas para marcação radiológica foram obtidas e usadas de acordo com as diretrizes recomendadas pelo Comitê Institucional de Cuidados e Uso de Animais, Subcomitê de Supervisão de Pesquisa com Células-Tronco da Mayo Clinic, Comitê de Pesquisa da Divisão de Medicina Transfusional, Comitê Institucional de Biossegurança e pelo Comitê de Segurança em Radiação.
1. Preparação de [ 89 Zr ]Zr-p-isothiocyanatobenzyl-desferrioxamine ([ 89Zr ]Zr-DBN)
Tempo: ~160-220 min
NOTA: Para a preparação de [89 Zr]Zr-DBN, isolar 89 Zr sob a forma de [89 Zr]Zr-hidrogenofosfato ([89 Zr]Zr(HPO 4)2) ou [89 Zr]Zr-cloreto ([89Zr]ZrCl4), conforme mencionado no passo 1.1.
- Isole 89 Zr do pai 89Y usando um método de purificação estabelecido à base de resina hidroxamato13,17. Em resumo, primeiro prepare uma coluna com ~100 mg de resina hidroxamato e, em seguida, ative a resina hidroxamato lavando a coluna com 8,0 mL de acetonitrila anidra pura, seguida de uma lavagem com 5,0-6,0 mL de ar. Em seguida, lavar a coluna com 15 mL de água deionizada, seguida de outra lavagem com 5,0-6,0 mL de ar e, em seguida, passar 2,0 mL de HCl 0,50 N (grau de base de metal traço) seguido de uma lavagem adicional com 5,0-6,0 mL de ar. Em seguida, carregar lentamente a solução contendo 89 Zr e 89 Y na resina de hidroxamato e lavar lentamente a solução 89Y não ligada da resina de hidroxamato com 20 mL de HCl 2,0 N, seguido de 10 mL de água deionizada e uma descarga com 5,0-6,0 mL de ar.
NOTA: Após a lavagem com ar, a eluição de 89Zr pode ser realizada como mostrado abaixo.- Para eluír 89 Zr na forma de [89 Zr]Zr(HPO 4)2, primeiro adicione 0,50 mL de tampão 1,2 M K 2 HPO 4/KH 2 PO 4 (pH 3,5) à coluna a partir do passo 1.1 e deixe-a descansar na coluna por 30 min para promover a liberação de 89 Zr como um [89Zr]Zr(HPO 4)2 da resina. Em seguida, eluir o 89Zr da coluna com mais 1,50 mL de tampão 1,2 M K 2 HPO 4/KH2PO4 (pH 3,5). Após a eluição de [89 Zr]Zr(HPO 4)2, siga as etapas 1.2, 1.2.1 e 1.2.2 para a preparação de [89 Zr]Zr-DBN usando [89Zr]Zr(HPO 4)2, conforme mostrado na Figura 1.
- Para obter 89 Zr como [89 Zr]ZrCl4, primeiro elute 89 Zr como [89Zr]Zr-oxalato.
- Para eluír 89 Zr sob a forma de [89 Zr]Zr-oxalato, adicionar 0,50 ml de ácido oxálico 1,0 M à coluna a partir do passo 1.1 e deixá-la assentar na coluna durante 1 min para promover a libertação de 89 Zr como [89Zr]-oxalato da resina. Em seguida, eluir os 89Zr da coluna com mais 2,50 mL de ácido oxálico 1,0 M (total de 3,0 mL)17.
- Para converter [89 Zr]Zr-oxalato em [89Zr]ZrCl4 usando uma coluna de troca aniônica, como descrito por Larenkov et al.14, primeiro ative a coluna lavando com 6,0 mL de acetonitrila, seguido de uma lavagem com 5,0-6,0 mL de ar. Em seguida, lavar a coluna com 10,0 mL de soro fisiológico, seguido de outra lavagem de 5,0-6,0 mL de ar. Finalmente, passe 10,0 mL de água deionizada, seguido de uma descarga com 5,0-6,0 mL de ar.
- Carregar lentamente a solução de 3,0 ml contendo [89Zr]Zr-oxalato na coluna de permuta aniónica activada, seguida de um descarga de 5,0-6,0 ml de ar. Em seguida, lavar a coluna carregada com 89Zr com 50,0 mL de água deionizada para remover o íon oxalato não ligado, seguido de uma lavagem com 5,0-6,0 mL de ar.
- Para eluir 89 Zr na forma de [89 Zr]ZrCl 4, adicionar 0,10 mL de HCl 1,0 N à coluna, deixá-la descansar na coluna por 1,0 min para promover a liberação de 89 Zr como [89 Zr]ZrCl 4 da resina e eluir os 89Zr da coluna com 0,40 mL adicionais de HCl 1,0 N (total de 0,5 mL). Secar o [89Zr]ZrCl4 eluído num frasco para injetáveis em forma de V, colocando-o num bloco de aquecimento a 65 °C sob um fluxo constante de gás azoto durante 10-30 minutos. Após a secagem, reconstituir o [89 Zr]ZrCl 4 seco em água e seguir os passos 1.3 e 1.3.1 para a preparação de [89 Zr]Zr-DBN utilizando [89Zr]ZrCl4, como mostrado na Figura 1.
- Pegue ~120 μL de [89Zr]Zr(HPO 4)2, formulado em 1,2 M K 2 HPO 4/KH 2 PO4 (pH 3,5) (10-25 MBq) da etapa 1.1.1, e neutralize a solução para atingir pH 7,5-8,0 com ~100 μL de 1,0 M HEPES-KOH (pH 7,5) e ~65 μL de 1,0 M K 2CO3.
- Para obter a quantidade adequada de DFO-Bn-NCS para as etapas 1.2.2 ou 1.3.1 para diferentes formulações de 89 Zr com uma atividade específica aparente variada de 89 Zr, execute um conjunto de reações de quelação usando um volume fixo de uma formulação neutralizada de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl4 com uma faixa de DFO-Bn-NCS (7,5-15 μg). No caso de [89Zr]Zr(HPO4)2, incubar a reação de quelação a 37 °C em um agitador a ~550 rpm por 60 min. Considerando que, no caso de [89Zr]ZrCl4, incubar a reação de quelação a 25 °C em um agitador a ~550 rpm por 30 min. Descarte a reação quelante que se mostra precipitada durante ou no final da incubação. Ao final da incubação, realizar cromatografia em camada delgada radioativa (rad-TLC) com 100 mM de pentaacetato de dietilenotriamina (DTPA), pH 7,0, como fase móvel para estimar a eficiência de quelação do DFO-Bn-NCS para cada reação quelante, conforme discutido a seguir na etapa 1.5.
NOTA: Com base na eficiência de quelação, use a quantidade mínima de DFO-Bn-NCS nas etapas 1.2.2 ou 1.3.1 necessária para alcançar uma eficiência de quelação de ≥97% sem causar precipitação de DFO-Bn-NCS na formulação neutralizada de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl 4. Neste estudo, [89Zr]Zr-DBN foi sintetizado em ≥97% de pureza radioquímica. - Preparar DFO-Bn-NCS 5,0 mM fresco em DMSO anidro (3,76 mg/mL) e adicionar 4,0 μL de 5,0 mM DFO-Bn-NCS (20 nmol ou 15 μg) a ~285 μL de [89Zr]Zr(HPO4)2 (10-25 MBq) neutralizado a partir do Passo 1.2 e misturar a solução por pipetagem. Manter a concentração final de DMSO na mistura quelante abaixo de 2% do volume total.
- Para obter a quantidade adequada de DFO-Bn-NCS para as etapas 1.2.2 ou 1.3.1 para diferentes formulações de 89 Zr com uma atividade específica aparente variada de 89 Zr, execute um conjunto de reações de quelação usando um volume fixo de uma formulação neutralizada de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl4 com uma faixa de DFO-Bn-NCS (7,5-15 μg). No caso de [89Zr]Zr(HPO4)2, incubar a reação de quelação a 37 °C em um agitador a ~550 rpm por 60 min. Considerando que, no caso de [89Zr]ZrCl4, incubar a reação de quelação a 25 °C em um agitador a ~550 rpm por 30 min. Descarte a reação quelante que se mostra precipitada durante ou no final da incubação. Ao final da incubação, realizar cromatografia em camada delgada radioativa (rad-TLC) com 100 mM de pentaacetato de dietilenotriamina (DTPA), pH 7,0, como fase móvel para estimar a eficiência de quelação do DFO-Bn-NCS para cada reação quelante, conforme discutido a seguir na etapa 1.5.
- Pegue ~180 μL de [89 Zr]ZrCl 4 formulado em HCl 0,1 N (40-80 MBq) da etapa 1.1.2.4 e neutralize a solução resultante para atingir pH 7,5-8,0 com ~25 μL de 1,0 M Na2CO3.
- Preparar 2,5 mM DFO-Bn-NCS fresco em dimetilsulfóxido anidro (DMSO) (1,88 mg/mL) e adicionar 4,0 μL de 2,5 mM DFO-Bn-NCS (10 nmol ou 7,5 μg) a ~205 μL de [89 Zr]ZrCl4 neutralizado (40-80 MBq) a partir da etapa 1.3. Misture a solução por pipetagem. Manter a concentração final de DMSO na mistura quelante abaixo de 2% do volume total.
- Proceder à quelação de 89 Zr a 37 °C num agitador a ~550 rpm durante 60 min no caso de [89 Zr]Zr(HPO 4)2, ou a 25 °C num agitador a ~550 rpm durante 30 min no caso de [89Zr]ZrCl4.
- Determinar a eficiência de quelação de 89Zr por rad-TLC com DTPA 100 mM (pH 7,0) como solvente móvel rad-TLC. Espere que [89 Zr]Zr-DBN mostre um R f de ~0,021-0,035, [89 Zr]ZrCl 4 mostre um R f de ~1,0 e [89Zr]Zr(HPO4)2 mostre um R f de ~1,0. Calcule a eficiência de quelação (%) usando a equação (1):
Porcentagem de 89 Zr quelatizados em DFO-NCS para formar [89 Zr]Zr-DBN = [ (Radioatividade em R f de [89 Zr]Zr - DBN) / (Soma das Radioatividades em R f de [89 Zr]Zr - DBN e em R f de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl4) ] × 100 (1)
NOTA: A eficiência aceitável da quelação de 89Zr para prosseguir com a radiomarcação celular, determinada por rad-TLC, é de ≥97%. A pureza radioquímica sugerida de ≥97% de [89Zr]Zr-DBN foi definida de acordo com o requisito de pureza radioquímica padrão para outros radiofármacos usados no campo. Veja o rad-TLC representativo na Figura Suplementar S1 e na Figura Suplementar S2.

Figura 1: Esquema da preparação de [89Zr]Zr-DBN. Para a preparação de [89 Zr]Zr-DBN, neutralize [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl4 pré-formulado a um pH de 7,5-8,0. Incubar a solução neutralizada com DFO-Bn-NCS. Verificar a eficiência de quelação de 89Zr para DFO-Bn-NCS por rad-TLC. Clique aqui para ver uma versão maior desta figura.
2. Formulação biocompatível de [ 89Zr ]Zr-DBN para marcação radiocelular (Figura 2)
Tempo: ~35 min
NOTA: Dado o tempo que leva para a preparação das células na etapa 3, inicie a etapa 3 aproximadamente 20 minutos antes do início da etapa 2 para uma incubação de ~30 min. Isso permite que a marcação radiográfica celular na etapa 4 comece dentro de ~5-10 minutos após a conclusão das etapas 2-3.2.2.
- Para a formulação de [89 Zr]Zr-DBN feita a partir do [89 Zr]ZrCl 4, adicionar 50,0 μL de uma mistura compatível com células compreendendo ~27,0 μL de 1,2 M K 2 HPO 4/KH2PO 4 (pH 3,5) + ~23,0 μL de tampão 1,0 M HEPES-KOH (pH 7,5) a 50,0 μL de [89 Zr]Zr-DBN. Incubar a mistura compatível com [89Zr]Zr-DBN durante ~30 minutos à temperatura ambiente (25 °C).
NOTA: A formulação [89 Zr]Zr-DBN feita de [89Zr]Zr(HPO4)2 é biocompatível para a marcação radioativa de células e não requer a etapa 2.
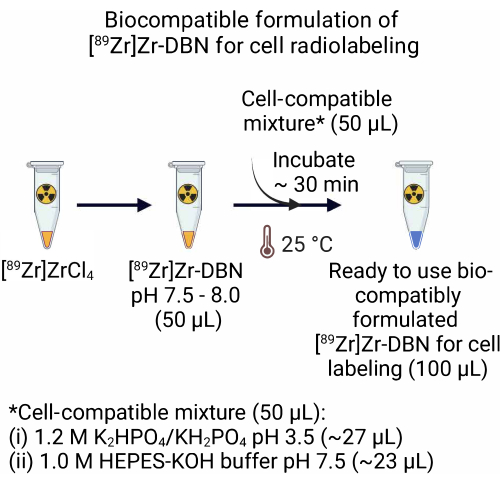
Figura 2: Preparação da formulação biocompatível do [89Zr]Zr-DBN para marcação radiocelular celular. Para a preparação de uma formulação biocompatível pronta a utilizar do sintetizador de marcação radioactiva, adicionar um volume igual de mistura compatível com células, compreendendo 1,2 M K 2 HPO 4/KH2PO4 (pH 3,5) + 1,0 M HEPES-KOH a um volume igual de [89Zr]Zr-DBN. Incubar a 25 °C por ~30 min. Clique aqui para ver uma versão maior desta figura.
3. Preparação das células para radiomarcação
Tempo: ~40-50 min
- Tripsinize ~12 × 106 células aderentes (células-tronco, células cancerosas de melanoma, células-tronco cardiopoéticas, células dendríticas ou hepatócitos) e centrifugar as células em um tubo de centrífuga cônica de 15,0 mL a ~96 × g por 10 min a 4 °C.
- Descarte o sobrenadante, ressuspenda o pellet de células em ~500 μL de PBS e transfira a suspensão celular para um tubo de microcentrífuga de 1,5 mL. Centrifugar as células em uma microcentrífuga a ~96 × g por 10 min a 4 °C.
- Descarte o sobrenadante e ressuspenda o pellet de célula em ~500 μL de H-HBSS. Centrifugar as células numa microcentrífuga de 1,5 ml a ~96 × g durante 10 min a 4 °C. Repita o passo 3.1.2 mais uma vez e prossiga para o passo 4.1.1.
NOTA: H-HBSS é uma solução salina balanceada de Hanks com 0,01 M HEPES (pH 8,0).
- No caso de células não aderentes, como glóbulos brancos humanos (glóbulos brancos humanos recém-isolados do sangue), pule a tripsinização e centrifugar a suspensão celular contendo ~12 × 106 células em uma microcentrífuga de 1,5 mL a ~96 × g por 10 min a 4 °C.
- Descarte o sobrenadante, ressuspenda a pastilha de células em ~500 μL de PBS e centrifugue as células em uma microcentrífuga de 1,5 mL a ~96 × g por 10 min a 4 °C.
- Descarte o sobrenadante e ressuspenda o pellet de célula em ~500 μL de H-HBSS. Centrifugar as células numa microcentrífuga de 1,5 ml a ~96 × g durante 10 min a 4 °C. Repita o passo 3.2.2 mais uma vez e prossiga para o passo 4.1.1.
4. Radiomarcação de células
Tempo: ~125-155 min
- Início da marcação radiocelular (Figura 3)
- Use a suspensão celular da etapa 3.1.2 ou da etapa 3.2.2 para preparar uma suspensão celular de ~500 μL com aproximadamente ~6 × 106 células em ~500 μL de H-HBSS em pH 7,5-8,0 em um tubo de microcentrífuga de 1,5 mL.
- Para isso, adicione ~100 μL do [89Zr]Zr-DBN biocompatível formulado a partir da etapa 2.
- Incubação celular para marcação radioativa (Figura 4)
- Misture a [89 Zr]Zr-DBN formulada biocompativelmente e a suspensão celular pipetando suavemente para cima e para baixo com uma micropipeta regulada em ~500 μL. Meça a quantidade de radioatividade no tubo de incubação usando um calibrador de dose de radioatividade na configuração 489 para oisótopo 89Zr16.
- Incubar as células e a mistura [89Zr]Zr-DBN em um agitador a ~550 rpm a 25-37 °C por 30-45 min para marcação celular.
NOTA: A temperatura da incubação irá variar dependendo dos tipos celulares utilizados para a marcação radiológica, como mostra a Tabela 1. - Após a incubação na etapa 4.2.2, realizar rad-TLC na reação de radiomarcação celular usando solvente rad-TLC recém-preparado (citrato de sódio 20 mM [pH 4,9-5,1]:metanol [1:1, V:V]). Após a corrida rad-TLC, procure [89 Zr]Zr-DBN e [89 Zr]ZrCl4 em torno de R f = ~0,73-0,81 e R f = ~0,01-0,02 para as células radiomarcadas. Calcular a porcentagem de radioatividade em Rf = ~0,01-0,02 usando a equação (2).
Porcentagem de radioatividade em R f = ~0,01-0,02 = [ (Radioatividade em R f = ~0,01 - 0,02) / (Soma das Radioatividades em R f = ~0,01 - 0,02 e R f = ~0,73 - 0,81) ] × 100 (2)
NOTA: Para entender os picos visualizados em R f = ~0,01-0,02 e R f = ~0,73-0,81, consulte o rad-TLC para reação de radiomarcação de glóbulos brancos na Figura Suplementar S3. - Em um tubo de microcentrífuga separado de 1,5 mL, misture ~100 μL do [89Zr]Zr-DBN formulado biocompatível com ~500 μL de H-HBSS em pH 7,5-8,0 para uso como um controle sem célula para correção de fundo na etapa 4.2.5. Após a incubação a uma temperatura e a um tempo semelhantes aos utilizados no passo 4.2.2, efectuar a CCD-rad. Após a execução rad-TLC, procure por [89 Zr]Zr-DBN e [89 Zr]ZrCl4 em torno de Rf = ~0,73-0,81. Calcular a porcentagem de radioatividade em Rf = ~0,01-0,02 usando a equação (3).
Radioatividade em R f = ~0,01-0,02 = [ (Radioatividade em R f = ~0,01 - 0,02) / (Soma das Radioatividades em R f = ~0,01 - 0,02 e R f = ~0,73 - 0,81) ] × 100 (3)
NOTA: Para entender os picos visualizados em Rf = ~0,01-0,02 e ~0,73-0,81, veja o rad-TLC da reação de controle sem célula na Figura Suplementar S4. - Calcular a radiomarcação celular efetiva (%) subtraindo a porcentagem de radioatividade em R f = ~0,01-0,02 (de rad-TLC da etapa 4.2.4) da porcentagem de radioatividade em R f = ~0,01-0,02 (de rad-TLC da etapa 4.2.3).
- Têmpera da marcação radioativa e lavagem celular (Figura 5)
- Após confirmar a conclusão da radiomarcação por rad-TLC na etapa 4.2.5, realizar a supressão da reação de radiomarcação pela adição de ~600 μL de meio completo refrigerado e apropriado para a célula, ou pela adição de H-HBSS, como mostrado na Tabela 1.
- Centrifugar as células em uma microcentrífuga a ~96 × g por 10 min a 4 °C. Descarte o sobrenadante.
- Ressuspender suavemente as células peletizadas em ~500 μL de meio resfriado (meio águia modificado de Dulbecco (DMEM) + 10% de soro fetal bovino + 5% de penicilina/estreptomicina ou Roswell Park Memorial Institute-1640 (RPMI-1640) + 10% de soro fetal bovino + 5% de penicilina/estreptomicina ou H-HBSS para um determinado tipo celular, conforme mostrado na Tabela 1. Execute a ressuspensão do pellet de célula pipetando suavemente para cima e para baixo com uma micropipeta ajustada em ~500 μL.
- Centrifugar as células numa microcentrífuga a ~96 × g durante 10 min a 4 °C.
- Repita os passos 4.3.2-4.3.4 duas vezes para lavar a radioactividade não ligada.
- Transferir o pellet para um tubo de microcentrífuga fresco de 1,5 mL com DMEM + 10% de soro fetal bovino + 5% de penicilina/estreptomicina no caso de células-tronco ou H-HBSS e medir a radioatividade no pellet celular usando um calibrador de dose no ajuste 489 para o isótopo 89Zr16.
- Calcular a eficiência de marcação radiológica final após todas as lavagens usando a equação (4).
Eficiência de radiomarcação = [(Radioatividade corrigida por decaimento em pastilha de célula na etapa 4.3.6) / (Radioatividade corrigida por decaimento na pastilha de célula e H-HBSS na etapa 4.2.1) ] × 100 (4) - Para garantir a qualidade das células radiomarcadas, primeiro inspecione visualmente a suspensão final das células radiomarcadas para a presença de quaisquer aglomerados. Se não houver aglomerações, prossiga com essa suspensão final para a próxima etapa. Se houver grumos, mas eles podem ser ressuspensos por pipetagem ou por agitação suave, faça-o e prossiga para a próxima etapa, pois esta passa pela inspeção visual. No entanto, se as touceiras não forem ressuspensas por pipetagem ou agitação suave, descarte a suspensão e comece de novo.
- Se a inspeção visual for aprovada, realizar um teste de viabilidade de exclusão do azul de tripano usando solução de azul de tripano a 0,4% preparada em PBS dentro de 1 h após a marcação radiológica e as etapas de lavagem (4.3.3-4.3.7) para avaliar a viabilidade celular das células radiomarcadas.
- Para realizar o teste, adicionar 10,0 μL de solução de azul de tripano a 0,4% à suspensão de células de 10,0 μL de células radiomarcadas e não marcadas e misturá-las pipetando a suspensão de células azuis de tripano para cima e para baixo com micropipeta regulada para 10,0 μL.
- Coloque um hemacitômetro com ~10,0 μL da mistura de suspensão de células azuis de tripano, conte imediatamente o número de células coradas com azul e o número total de células no hemacitômetro sob um microscópio em baixa ampliação ou usando um contador de células automatizado. Calcular a porcentagem de células viáveis usando a equação (5).
Porcentagem de células viáveis = 100 - [(Número de células azuis coradas) / (Número de células totais)] × 100 (5)
- Use as células radiomarcadas se não houver mudança na porcentagem de células viáveis na suspensão de células radiomarcadas em comparação com a contraparte não marcada. Descarte as células radiomarcadas se a porcentagem de células viáveis for menor que a contraparte não marcada.
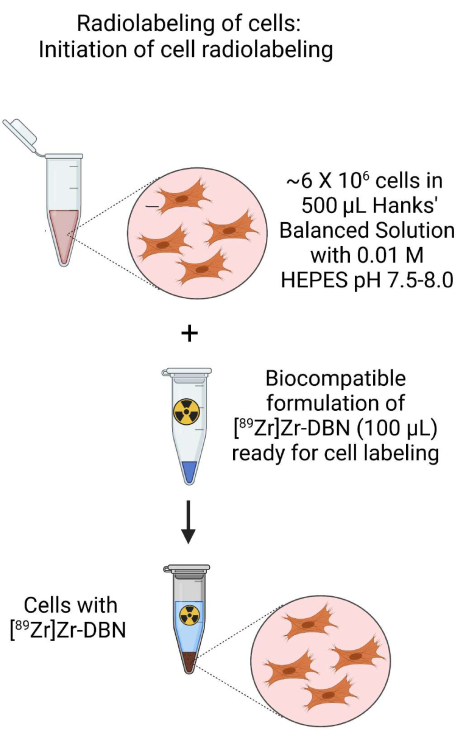
Figura 3: Esquema do início da radiomarcação celular. Iniciar a radiomarcação de células pela adição do [89Zr]Zr-DBN formulado biocompatível à suspensão celular preparada em solução salina balanceada Hanks tamponada com HEPES. Clique aqui para ver uma versão maior desta figura.
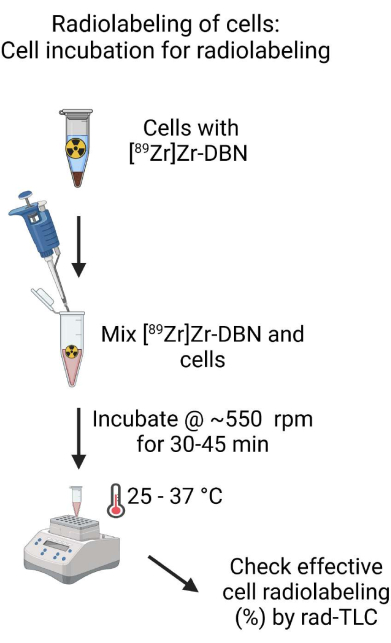
Figura 4: Esquema de incubação celular para radiomarcação. Misture completamente o [89Zr]Zr-DBN formulado biocompatível com a suspensão de células e incube a suspensão de células em um bloco de aquecimento com temperatura controlada em um agitador por 30-60 min. Clique aqui para ver uma versão maior desta figura.
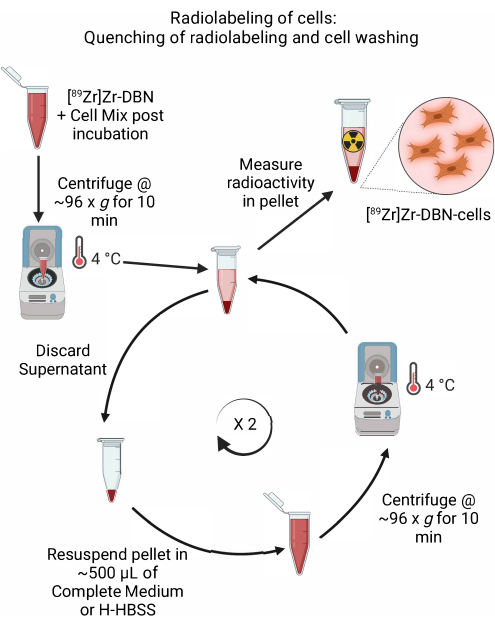
Figura 5: Esquema da têmpera da radiomarcação e lavagem celular. Extinguir a marcação radioativa das células pela adição de meio celular resfriado ou H-HBSS, seguido de centrifugação a 4 °C. Para a lavagem celular, descarte o sobrenadante e ressuspenda o pellet de células em ~500 μL de meio celular resfriado ou H-HBSS. Repita o ciclo de descarte do sobrenadante e ressuspensão do pellet de células em meio fresco para remover qualquer sintetizador de radiomarcação não ligado. Clique aqui para ver uma versão maior desta figura.
Resultados
Os resultados representativos apresentados neste manuscrito foram compilados dos estudos prévios de síntese de [89Zr]Zr-DBN e radiomarcação celular 18,19,22,23,24,25. Em resumo, 89Zr podem ser complexados com sucesso com DFO-Bn-NCS em ~30-60 min a 25-37 °C usando 7,5-15 μg de DFO-Bn-NCS (Ta...
Discussão
A seguir estão etapas críticas no protocolo que precisam de otimização para uma marcação radiográfica celular eficaz. Nas etapas 1.2 e 1.3 do protocolo, dependendo do volume de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl4 empregado, um volume apropriado (microlitros) de base deve ser usado; A solução 1,0 M K2 CO 3 deve ser usada para a neutralização da solução de [89 Zr]Zr(HPO 4)2 e 1,0 M Na2 CO3 para a neutralização de ...
Divulgações
Os autores não têm interesse financeiro concorrente, mas são os inventores desta tecnologia (Patente # US20210330823A1).
Agradecimentos
Este trabalho foi apoiado por NIH 5R21HL127389-02, NIH 4T32HL007111-39, NIH R01HL134664 e DOE DE-SC0008947 grants, Agência Internacional de Energia Atômica, Viena, Mayo Clinic Division of Nuclear Medicine, Department of Radiology, e Mayo Clinic Center for Regenerative Medicine, Rochester, MN. Todas as figuras foram criadas usando BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A996-4 | |
| Alpha Minimum Essential Medium | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 12571063 | |
| Anion exchange column | Macherey-Nagel, Inc., Düren, Germany | 731876 | Chromafix 30-PS-HCO3 SPE 45 mg cartridge |
| Conical centrifuge tubes (15 mL) | Corning Inc., Glendale, AZ, USA | 352096 | Falcon 15 mL high-clarity polypropylene (PP) conical centrifuge tubes |
| Dendritic cells | The American Type Culture Collection, Manassas, VA, USA | CRL-11904 | |
| DFO-Bn-NCS | Macrocyclics, Inc., Plano, TX, USA | B-705 | p-SCN-Bn-Deferoxamine |
| DMSO | Sigma-Aldrich, Inc., St. Louis, MO | 276855 | |
| Dose calibrator | Mirion Technologies (Capintec), Inc., Florham Park, NJ, USA | 5130-3234 | CRC -55tR Dose Calibrator |
| Dulbecco’s modified Eagle’s medium | The American Type Culture Collection, Manassas, VA, USA | 30-2002 | |
| Fetal Bovine Serum (FBS) | The American Type Culture Collection, Manassas, VA, USA | 30-2020 | |
| Hanks Balanced Salt solution (HBSS) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 14025092 | For preparation of H-HBSS |
| Hydrochloric Acid (trace metal basis grade) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A508P212 | |
| Melanoma cells | The American Type Culture Collection, Manassas, VA, USA | CRL-6475 | |
| Methanol | Sigma-Aldrich, Inc., St. Louis, MO | 34860 | |
| Microcentrifuge tube | Eppendorf, Hamburg, Germany | 30108442 | Protein LoBind microcentrifuge tube |
| Murine GM-CSF | R&D Systems, Inc., Minneapolis, MN USA | 415-ML-010 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 15140-122 | |
| Phosphate Buffered Saline without Ca2+ and Mg2+ | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 10010023 | For washing cells |
| Saline | Covidien LLC, Mansfield, MA, USA | 1020 | 0.9% Sterile Saline Solution |
| Shaker | Eppendorf, Hamburg, Germany | T1317 | Thermomixer |
| Silica gel-rad-TLC paper sheet | Agilent Technologies Inc., Santa Clara, CA, USA | SGI0001 | iTLC-SG |
Referências
- Bhawnani, N., et al. Effectiveness of stem cell therapies in improving clinical outcomes in patients with heart failure. Cureus. 13 (8), e17236 (2021).
- Zakrzewski, W., Dobrzynski, M., Szymonowicz, M., Rybak, Z. Stem cells: past, present, and future. Stem Cell Research & Therapy. 10 (1), 68 (2019).
- Bukhari, A. B., Dutta, S., De, A. Image guidance in stem cell therapeutics: unfolding the blindfold. Current Drug Targets. 16 (6), 658-671 (2015).
- Momeni, A., Neelamegham, S., Parashurama, N. Current challenges for the targeted delivery and molecular imaging of stem cells in animal models. Bioengineered. 8 (4), 316-324 (2017).
- Gnecchi, M., Zhang, Z., Ni, A., Dzau, V. J. Paracrine mechanisms in adult stem cell signaling and therapy. Circulation Research. 103 (11), 1204-1219 (2008).
- D'Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282 (2018).
- Zhang, Q., et al. CAR-T cell therapy in cancer: tribulations and road ahead. Journal of Immunology Research. 2020, 1924379 (2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Shao, F., et al. Radionuclide-based molecular imaging allows CAR-T cellular visualization and therapeutic monitoring. Theranostics. 11 (14), 6800-6817 (2021).
- Sakemura, R., Can, I., Siegler, E. L., Kenderian, S. S. In vivo CART cell imaging: Paving the way for success in CART cell therapy. Molecular Therapy Oncolytics. 20, 625-633 (2021).
- Wang, Y., et al. Dendritic cell biology and its role in tumor immunotherapy. Journal of Hematology & Oncology. 13 (1), 107 (2020).
- Bulte, J. W. M., Shakeri-Zadeh, A. In vivo MRI tracking of tumor vaccination and antigen presentation by dendritic cells. Molecular Imaging and Biology. 24 (2), 198-207 (2022).
- Holland, J. P., Sheh, Y., Lewis, J. S. Standardized methods for the production of high specific-activity zirconium-89. Nuclear Medicine and Biology. 36 (7), 729-739 (2009).
- Larenkov, A., et al. Preparation of zirconium-89 solutions for radiopharmaceutical purposes: interrelation between formulation, radiochemical purity, stability and biodistribution. Molecules. 24 (8), 1534 (2019).
- Pandey, M. K., et al. A new solid target design for the production of 89Zr and radiosynthesis of high molar activity [89Zr]Zr-DBN. American Journal of Nuclear Medicine and Molecular Imaging. 12 (1), 15-24 (2022).
- Pandey, M. K., et al. Improved production and processing of 89Zr using a solution target. Nuclear Medicine and Biology. 43 (1), 97-100 (2016).
- Pandey, M. K., Engelbrecht, H. P., Byrne, J. P., Packard, A. B., DeGrado, T. R. Production of 89Zr via the 89Y(p,n)89Zr reaction in aqueous solution: effect of solution composition on in-target chemistry. Nuclear Medicine and Biology. 41 (4), 309-316 (2014).
- Bansal, A., et al. Novel 89Zr cell labeling approach for PET-based cell trafficking studies. EJNMMI Research. 5, 19 (2015).
- Bansal, A., et al. 89Zr]Zr-DBN labeled cardiopoietic stem cells proficient for heart failure. Nuclear Medicine and Biology. 90-91, 23-30 (2020).
- Friberger, I., et al. Optimisation of the synthesis and cell labelling conditions for [89Zr]Zr-oxine and [89Zr]Zr-DFO-NCS: a direct in vitro comparison in cell types with distinct therapeutic applications. Molecular Imaging and Biology. 23 (6), 952-962 (2021).
- Lee, S. H., et al. Feasibility of real-time in vivo 89Zr-DFO-labeled CAR T-cell trafficking using PET imaging. PLoS One. 15 (1), e0223814 (2020).
- Nicolas, C. T., et al. Hepatocyte spheroids as an alternative to single cells for transplantation after ex vivo gene therapy in mice and pig models. Surgery. 164 (3), 473-481 (2018).
- Yang, B., et al. Tracking and therapeutic value of human adipose tissue-derived mesenchymal stem cell transplantation in reducing venous neointimal hyperplasia associated with arteriovenous fistula. Radiology. 279 (2), 513-522 (2016).
- Nicolas, C. T., et al. Ex vivo cell therapy by ectopic hepatocyte transplantation treats the porcine tyrosinemia model of acute liver failure. Molecular Therapy. Methods & Clinical Development. 18, 738-750 (2020).
- Bansal, A., Sharma, S., Klasen, B., Rosch, F., Pandey, M. K. Evaluation of different 89Zr-labeled synthons for direct labeling and tracking of white blood cells and stem cells in healthy athymic mice. Scientific Reports. 12 (1), 15646 (2022).
- Behfar, A., et al. Guided cardiopoiesis enhances therapeutic benefit of bone marrow human mesenchymal stem cells in chronic myocardial infarction. Journal of the American College of Cardiology. 56 (9), 721-734 (2010).
- Charoenphun, P., et al. 89Zr]oxinate4 for long-term in vivo cell tracking by positron emission tomography. European Journal of Nuclear Medicine and Molecular Imaging. 42 (2), 278-287 (2015).
- Sato, N., et al. In vivo tracking of adoptively transferred natural killer cells in rhesus macaques using 89zirconium-oxine cell labeling and PET imaging. Clinical Cancer Research. 26 (11), 2573-2581 (2020).
- Volpe, A., Pillarsetty, N. V. K., Lewis, J. S., Ponomarev, V. Applications of nuclear-based imaging in gene and cell therapy: probe considerations. Molecular Therapy Oncolytics. 20, 447-458 (2021).
- Fogli, L. K., et al. Challenges and next steps in the advancement of immunotherapy: summary of the 2018 and 2020 National Cancer Institute workshops on cell-based immunotherapy for solid tumors. Journal for Immunotherapy of Cancer. 9 (7), e003048 (2021).
- Li, X., Hacker, M. Molecular imaging in stem cell-based therapies of cardiac diseases. Advanced Drug Delivery Reviews. 120, 71-88 (2017).
- Puges, M., et al. Retrospective study comparing WBC scan and 18F-FDG PET/CT in patients with suspected prosthetic vascular graft infection. European Journal of Vascular and Endovascular Surgery. 57 (6), 876-884 (2019).
- Butterfield, L. H. Dendritic cells in cancer immunotherapy clinical trials: are we making progress. Frontiers in Immunology. 4, 454 (2013).
- de Vries, I. J. M., et al. Magnetic resonance tracking of dendritic cells in melanoma patients for monitoring of cellular therapy. Nature Biotechnology. 23 (11), 1407-1413 (2005).
- Gosmann, D., et al. Promise and challenges of clinical non-invasive T-cell tracking in the era of cancer immunotherapy. EJNMMI Research. 12 (1), 5 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados