需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
细胞运输的正电子发射断层扫描成像:一种细胞放射性标记方法
摘要
这里介绍的是使用即用型放射性标记合成子[89Zr]Zr-p-异硫氰酸基苄基-去铁胺([89Zr]Zr-DBN)用正电子发射断层扫描(PET)放射性同位素89Zr(t1/2 78.4 h)对细胞进行放射性标记的方案。用 [89Zr]Zr-DBN 放射性标记细胞允许在给药后长达 7 天内对体内 PET 中施用的放射性标记细胞进行无创跟踪和成像。
摘要
干细胞和嵌合抗原受体(CAR)T细胞疗法正在成为器官再生的有前途的疗法和各种癌症的免疫疗法。尽管在这些领域取得了重大进展,但仍需学习更多知识,以更好地了解生命系统中施用治疗细胞的药代动力学和药效学。对于使用正电子发射断层扫描 (PET) 对细胞进行非侵入性体内追踪,已经开发了一种利用 89 Zr (t1/2 78.4 h) 的新型 [89Zr]Zr-p-异硫氰酸基苄基-去铁胺 ([89Zr]Zr-DBN) 介导的细胞放射性标记方法。本方案描述了一种[89Zr]Zr-DBN介导的即用型放射性标记合成子,用于直接放射性标记各种细胞,包括间充质干细胞、谱系引导的造心干细胞、肝脏再生肝细胞、白细胞、黑色素瘤细胞和树突状细胞。所开发的方法能够在给药后长达 7 天内对细胞运输进行无创 PET 成像,而不会影响放射性标记细胞的性质或功能。此外,该协议描述了[89Zr]Zr-DBN的放射合成,[89Zr]Zr-DBN的生物相容性制剂,用于放射性标记的细胞的制备,以及最后用[89Zr]Zr-DBN对细胞进行放射性标记的逐步方法,包括成功放射性标记细胞所需的所有复杂细节。
引言
干细胞和嵌合抗原受体 (CAR) T 细胞疗法越来越受欢迎,并正在积极研究用于治疗各种疾病,例如心肌衰竭1,2、视网膜变性 2、黄斑变性 2、糖尿病 2、心肌梗塞3、4、5 和癌症6、7、8、9,10.在干细胞疗法的两种合理方法中,干细胞可以直接移植到疾病部位引起治疗反应,也可以引起疾病部位微环境的变化而不粘附在疾病部位以启动间接治疗反应。间接治疗反应可以通过释放修复或治疗疾病的因子来引起疾病部位微环境的变化5.这些干细胞治疗方法可以通过放射性标记干细胞的无创成像来评估。无创成像可以将疾病部位放射性标记细胞的摄取与治疗反应相关联,以破译直接与间接治疗反应。
此外,基于免疫细胞的疗法正在开发中,以使用 CAR T 细胞6、7、8、9、10 和树突状细胞免疫疗法11,12 治疗各种癌症。从机制上讲,在CAR T细胞免疫疗法6,7,8,9,10中,T细胞被设计为表达与需要治疗的肿瘤上的特定抗原结合的表位。这些工程化的CAR T细胞在给药时,通过表位-抗原相互作用与肿瘤细胞上存在的特异性抗原结合。结合后,结合的CAR T细胞发生激活,然后增殖并释放细胞因子,细胞因子向宿主的免疫系统发出信号,攻击表达特异性抗原的肿瘤。相反,在树突状细胞疗法11,12的情况下,树突状细胞被设计成在其表面呈递特定的癌症抗原。这些经过工程改造的树突状细胞在给药时是淋巴结的家园,并与淋巴结中的T细胞结合。T细胞在与施用的树突状细胞上的特定癌症抗原结合后,发生激活/增殖,并启动宿主对表达该特定抗原的肿瘤的免疫反应。因此,通过对放射性标记的CAR T细胞和树突状细胞进行成像来评估给药的CAR T细胞向肿瘤部位的运输9,10以及树突状细胞归巢到淋巴结11,12以确定免疫疗法的疗效。此外,非侵入性细胞运输可以帮助更好地了解治疗潜力,阐明直接与间接治疗反应,并预测和监测干细胞和基于免疫细胞的疗法的治疗反应。
已经探索了细胞运输的不同成像方式 3,4,9,10,12,包括光学成像、磁共振成像 (MRI)、单光子发射计算机断层扫描 (SPECT) 和正电子发射断层扫描 (PET)。这些技术中的每一种都有自己的优点和缺点。其中,PET因其定量性和高灵敏度而成为最有前途的方法,这对于基于成像的细胞运输中的细胞可靠定量至关重要3,4,9,10。
正电子发射放射性同位素89Zr,半衰期为78.4 h,适用于细胞标记。它允许对细胞运输进行 PET 成像超过 1 周,并且很容易由广泛使用的低能量医用回旋加速器13、14、15、16、17 产生。此外,市售的对异硫氰酸基苄基去铁胺 (DFO-Bn-NCS) 螯合剂可用于合成 89 Zr 标记的即用型细胞标记合成子 [89 Zr]Zr-p-异硫氰酸基苄基去铁胺,也称为 [89Zr]Zr-DBN 18,19,20,21,22,23,24,25.[89Zr]Zr-DBN 介导的细胞标记原理基于细胞膜蛋白的伯胺与 [89Zr]Zr-DBN 的异硫氰酸酯 (NCS) 部分之间的反应,以产生稳定的共价硫脲键。
[89锆]基于 Zr-DBN 的细胞标记和成像已发表,用于追踪各种不同的细胞,包括干细胞 18、23、25、树突状细胞18、造心干细胞19、蜕膜基质细胞 20、骨髓来源的巨噬细胞 20、外周血单核细胞 20、Jurkat/CAR T 细胞 21、肝细胞22、24 和白细胞 25.以下方案提供了使用[89Zr]Zr-DBN制备和细胞放射性标记的分步方法,并描述了特定细胞类型的放射性标记方案中可能需要的变化。为了更清楚起见,这里介绍的细胞放射性标记方法分为四个部分。第一部分涉及通过将 89Zr 与 DFO-Bn-NCS 螯合来制备 [89Zr]Zr-DBN。第二部分描述了[89Zr]Zr-DBN的生物相容性制剂的制备,该制剂可以很容易地用于细胞放射性标记。第三部分介绍了用于放射性标记的细胞预处理所需的步骤。细胞的预处理包括用无蛋白磷酸盐缓冲盐水 (PBS) 和 HEPES 缓冲的 Hanks 平衡盐溶液 (H-HBSS) 洗涤细胞,以去除外部蛋白质,这些蛋白质可能会干扰或竞争 [89Zr]Zr-DBN 与细胞表面蛋白质上存在的伯胺的反应在放射性标记过程中。最后一部分提供了细胞实际放射性标记和质量控制分析所涉及的步骤。
研究方案
树突状细胞和黑色素瘤细胞在商业上获得18.腹腔镜肝部分切除术后从猪肝脏中分离肝细胞22,24。从骨髓抽吸物中分离干细胞18,19,26。脂肪组织来源的干细胞购自梅奥诊所罗切斯特院区的人类细胞治疗实验室23。从妙佑医疗国际罗切斯特输血医学科采集的血液中分离出人白细胞25。根据机构动物护理和使用委员会、妙佑医疗国际干细胞研究监督小组委员会、输血医学部研究委员会、机构生物安全委员会和辐射安全委员会推荐的指南,获得和使用用于放射性标记的各种细胞。
1.[89Zr]Zr-p-异硫氰酸基苄基去铁胺([89Zr ]Zr-DBN)的制备
定时:~160-220 分钟
注:为了制备[89 Zr]Zr-DBN,以[89 Zr]Zr-磷酸氢盐([89Zr]Zr(HPO 4)2)或[89 Zr]Zr-氯化物([89 Zr]ZrCl4)的形式分离89Zr,如步骤1.1所述。
- 使用已建立的基于异羟肟酸盐树脂的纯化方法13,17从母体89 Y中分离89Zr。简而言之,首先用 ~100 mg 羟肟酸盐树脂制备色谱柱,然后用 8.0 mL 纯无水乙腈洗涤色谱柱,然后用 5.0-6.0 mL 空气冲洗,从而活化羟肟酸盐树脂。然后,用 15 mL 去离子水洗涤色谱柱,然后用 5.0-6.0 mL 空气再次冲洗,然后通过 2.0 mL 的 0.50 N HCl(痕量金属基级),然后再用 5.0-6.0 mL 空气冲洗。接下来,将含有 89Zr 和 89 Y 的溶液缓慢加载到异羟肟酸盐树脂中,并用 20 mL 的 2.0 N HCl 洗涤异羟肟酸盐树脂中未结合的 89Y,然后用 10 mL 去离子水和 5.0-6.0 mL 空气冲洗。
注:用空气冲洗后,可以如下图所示进行 89Zr的洗脱。- 为了以[89Zr]Zr(HPO 4)2的形式洗脱89 Zr,首先从步骤1.1中向色谱柱中加入0.50 mL 1.2 M K 2 HPO 4/KH 2 PO 4缓冲液(pH 3.5),并使其在色谱柱上静置30分钟,以促进89Zr作为[89Zr]Zr(HPO 4)2从树脂中释放出来。然后,用另外 1.50 mL 的 1.2 M K 2 HPO 4/KH2PO4 缓冲液 (pH 3.5) 洗脱色谱柱中的 89Zr。洗脱[89Zr]Zr(HPO 4)2后,按照步骤1.2、1.2.1和1.2.2使用[89Zr]Zr(HPO4)2制备[89Zr]Zr-DBN,如图1所示。
- 为了获得 89Zr 作为 [89 Zr]ZrCl4,首先洗脱 89 Zr 作为 [89Zr]Zr-草酸盐。
- 为了以[89Zr]Zr-草酸盐的形式洗脱89Zr,从步骤1.1中向色谱柱中加入0.50 mL 1.0 M草酸,并使其在色谱柱上静置1分钟,以促进89 Zr作为[89Zr]-草酸盐从树脂中释放出来。然后,用另外 2.50 mL 的 1.0 M 草酸(总共 3.0 mL)17 洗脱色谱柱中的 89Zr。
- 如Larenkov等人14所述,要使用阴离子交换柱将[89Zr]Zr-草酸盐转化为[89Zr]ZrCl4,首先用6.0 mL乙腈洗涤活化柱,然后用5.0-6.0 mL空气冲洗。然后,用 10.0 mL 生理盐水洗涤色谱柱,然后再用 5.0-6.0 mL 空气冲洗。最后,通过 10.0 mL 去离子水,然后用 5.0-6.0 mL 空气冲洗。
- 将含有[89Zr]Zr-草酸盐的3.0 mL溶液缓慢加载到活化的阴离子交换柱上,然后冲洗5.0-6.0 mL空气。然后,用 50.0 mL 去离子水洗涤负载 89Zr 的色谱柱以除去未结合的草酸根离子,然后用 5.0-6.0 mL 空气冲洗。
- 为了洗脱 [89 Zr]ZrCl4 形式的 89Zr,向色谱柱中加入 0.10 mL 的 1.0 N HCl,使其在色谱柱上静置 1.0 分钟,以促进 89 Zr 作为 [89 Zr]ZrCl4 从树脂中释放出来,然后用另外 0.40 mL 的 1.0 N HCl(总共 0.5 mL)洗脱色谱柱中的 89Zr。将洗脱的[89Zr] ZrCl4置于V形小瓶中,将其置于65°C的加热块中,在稳定的氮气流下干燥10-30分钟。干燥后,将干燥的[89 Zr]ZrCl 4放入水中重新配制,并按照步骤1.3和1.3.1使用[89Zr]ZrCl4制备[89Zr]Zr-DBN,如图1所示。
- 从步骤1.1.1中取~120μL的[89Zr]Zr(HPO 4)2,配制在1.2M K 2 HPO 4/KH 2 PO4(pH 3.5)(10-25 MBq)中,并用~100 μL的1.0 M HEPES-KOH(pH 7.5)和~65 μL 的1.0 M K 2 CO3中和溶液达到pH 7.5-8.0。
- 为了获得步骤1.2.2或1.3.1中具有不同89Zr表观比活性的不同89Zr制剂的适当量的DFO-Bn-NCS,使用固定体积的中和制剂[89Zr]Zr(HPO 4)2或[89Zr]ZrCl4与一系列DFO-Bn-NCS(7.5-15μg)进行螯合反应。在[89Zr]Zr(HPO4)2的情况下,将螯合反应在37°C的振荡器中以~550rpm孵育60分钟。然而,在[89Zr]ZrCl4的情况下,将螯合反应在25°C下在振荡器中以~550rpm孵育30分钟。丢弃在孵育期间或孵育结束时显示沉淀的螯合反应。在孵育结束时,用pH 7.0的100mM二乙烯三胺五乙酸酯(DTPA)作为流动相进行放射性薄层色谱(rad-TLC),以估计DFO-Bn-NCS对每个螯合反应的螯合效率,如下文步骤1.5所述。
注:基于螯合效率,在步骤1.2.2或1.3.1中使用最少量的DFO-Bn-NCS,以实现≥97%的螯合效率,而不会在[89 Zr]Zr(HPO 4)2或[89Zr]ZrCl4的中和制剂中引起DFO-Bn-NCS沉淀。本文合成的[89Zr]Zr-DBN的放射化学纯度为≥97%。 - 在无水DMSO(3.76mg / mL)中制备新鲜的5.0mM DFO-Bn-NCS,并将4.0μL的5.0mM DFO-Bn-NCS(20nmol或15μg)加入到~285μL中和的[89Zr]Zr(HPO4)2 (10-25MBq)中,并通过移液混合溶液。将螯合混合物中的最终DMSO浓度保持在总体积的2%以下。
- 为了获得步骤1.2.2或1.3.1中具有不同89Zr表观比活性的不同89Zr制剂的适当量的DFO-Bn-NCS,使用固定体积的中和制剂[89Zr]Zr(HPO 4)2或[89Zr]ZrCl4与一系列DFO-Bn-NCS(7.5-15μg)进行螯合反应。在[89Zr]Zr(HPO4)2的情况下,将螯合反应在37°C的振荡器中以~550rpm孵育60分钟。然而,在[89Zr]ZrCl4的情况下,将螯合反应在25°C下在振荡器中以~550rpm孵育30分钟。丢弃在孵育期间或孵育结束时显示沉淀的螯合反应。在孵育结束时,用pH 7.0的100mM二乙烯三胺五乙酸酯(DTPA)作为流动相进行放射性薄层色谱(rad-TLC),以估计DFO-Bn-NCS对每个螯合反应的螯合效率,如下文步骤1.5所述。
- 从步骤1.1.2.4中取~180μL在0.1N HCl(40-80MBq)中配制的[89Zr]ZrCl4 ,并用~25μL的1.0M Na2CO3中和所得溶液至pH 7.5-8.0。
- 在无水二甲基亚砜(DMSO)(1.88mg / mL)中制备新鲜的2.5mM DFO-Bn-NCS,并将4.0μL的2.5mM DFO-Bn-NCS(10nmol或7.5μg)加入到~205μL中和的[89Zr]ZrCl4(40-80MBq)中。通过移液混合溶液。将螯合混合物中的最终DMSO浓度保持在总体积的2%以下。
- 在[89Zr]Zr(HPO 4)2的情况下,在37°C下在~550rpm的振荡器中螯合89Zr60分钟,或在25°C下在~550rpm的振荡器中螯合30分钟在[89Zr] ZrCl4的情况下。
- 通过 rad-TLC 测定 89Zr 螯合效率,其中 100 mM DTPA (pH 7.0) 作为 rad-TLC 移动溶剂。预计 [89Zr]Zr-DBN 的 R f 为 ~0.021-0.035,[89 Zr]ZrCl 4 的 R f 为 ~1.0,[89Zr]Zr(HPO 4)2 的 R f 为 ~1.0。使用公式(1)计算螯合效率(%):
89Zr 与 DFO-NCS 螯合形成 [89 Zr]Zr-DBN 的百分比 = [ (R f 时的放射性为 [89Zr]Zr - DBN) / (Rf 为 [89 Zr]Zr - DBN 时的放射性总和和 [89 Zr]Zr(HPO 4)2 或 [ 89Zr]ZrCl4) ] × 100 (1)
注:通过 rad-TLC 确定的进行细胞放射性标记的可接受 89Zr 螯合效率为 ≥97%。建议的 [89 Zr]Zr-DBN 的 ≥97% 放射化学纯度是根据现场使用的其他放射性药物的标准放射化学纯度要求设定的。参见补充图S1和补充图S2中的代表rad-TLC。

图1:[89Zr]Zr-DBN制备示意图。 为了制备[89 Zr]Zr-DBN,将预先配制的[89Zr]Zr(HPO 4)2或[89Zr]ZrCl4中和至pH值为7.5-8.0。将中和溶液与DFO-Bn-NCS一起孵育。通过 rad-TLC 检查 89Zr 对 DFO-Bn-NCS 的螯合效率。请点击这里查看此图的较大版本.
2. 用于细胞放射性标记的 [ 89Zr ]Zr-DBN 的生物相容性配方 (图 2)
时间:~35分钟
注意:鉴于步骤3中制备细胞所需的时间,在步骤2开始前约20分钟开始步骤3,孵育~30分钟。这允许步骤 4 中的细胞放射性标记在步骤 2-3.2.2 完成后的 ~5-10 分钟内开始。
- 对于由 [89 Zr]ZrCl 4 制成的 [89 Zr]Zr-DBN 制剂,向 50.0 μL 的细胞相容性混合物中加入 50.0 μL,包括 ~27.0 μL 的 1.2 M K2 HPO 4/KH2PO 4 (pH 3.5) + ~23.0 μL 的 1.0 M HEPES-KOH 缓冲液 (pH 7.5) 到 50.0 μL 的 [89 Zr]Zr-DBN 中。 将[89Zr]Zr-DBN细胞相容混合物在室温(25°C)下孵育~30分钟。
注:由 [89Zr]Zr(HPO4)2 制成的 [89Zr]Zr-DBN 制剂对细胞的放射性标记具有生物相容性,不需要步骤 2。
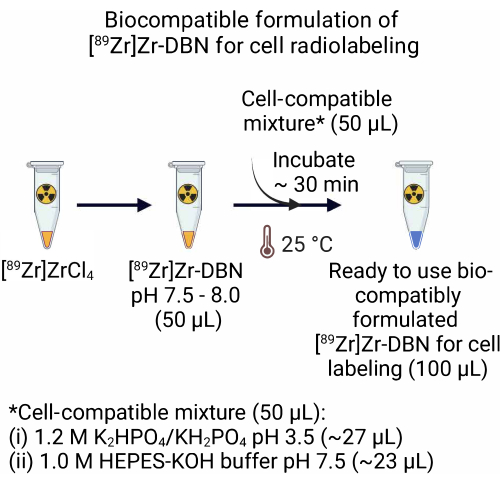
图 2:用于细胞放射性标记的 [89Zr]Zr-DBN 生物相容性制剂的制备。 为了制备放射性标记合成子的即用型生物相容性制剂,加入等体积的细胞相容性混合物,包括 1.2 M K 2 HPO 4/KH2PO4 (pH 3.5) + 1.0 M HEPES-KOH 至等体积的 [89Zr]Zr-DBN。 在25°C孵育~30分钟。 请点击这里查看此图的较大版本.
3. 放射性标记细胞的制备
时间:~40-50分钟
- 胰蛋白酶消化~12×106 个贴壁细胞(干细胞,黑色素瘤癌细胞,造心干细胞,树突状细胞或肝细胞),并在4°C下将细胞在15.0mL锥形离心管中以~96× g 离心10分钟。
- 弃去上清液,将细胞沉淀重悬于~500μL的PBS中,并将细胞悬液转移到1.5mL微量离心管中。在4°C下以~96× g 离心微量离心机中的细胞10分钟。
- 弃去上清液,将细胞沉淀重悬于~500μL的H-HBSS中。在4°C下以~96× g 离心1.5mL微量离心机中的细胞10分钟。 再次重复步骤 3.1.2 并继续执行步骤 4.1.1。
注意:H-HBSS是具有0.01M HEPES(pH 8.0)的Hanks平衡盐溶液。
- 在非贴壁细胞的情况下,例如人白细胞(从血液中新鲜分离的人白细胞),跳过胰蛋白酶消化,并将含有~12×106 个细胞的细胞悬液在1.5mL微量离心机中以~96× g 在4°C下离心10分钟。
- 弃去上清液,将细胞沉淀重悬于~500μL的PBS中,并在4°C下以~96× g 离心1.5mL微量离心机中的细胞10分钟。
- 弃去上清液,将细胞沉淀重悬于~500μL的H-HBSS中。在1.5mL微量离心机中以~96× g 离心细胞,在4°C下离心10分钟。 再次重复步骤 3.2.2 并继续执行步骤 4.1.1。
4. 细胞的放射性标记
定时:~125-155 分钟
- 细胞放射性标记的开始(图3)
- 使用步骤3.1.2或步骤3.2.2中的细胞悬液在pH 7.5-8.0的~500μL微量离心管中制备~500μL细胞悬液,其中约~6×106 个细胞在pH 7.5-8.0的H-HBSS中。
- 为此,加入~100μL来自步骤2的生物相容性配制的[89Zr]Zr-DBN。
- 用于放射性标记的细胞孵育(图4)
- 用设置为~500μL的微量移液器轻轻上下移液,将生物相容性配制的[89Zr]Zr-DBN和细胞悬液混合。 使用放射性剂量校准器在489设置下测量孵育管中的放射性量,用于 89Zr-同位素16。
- 将细胞和[89Zr]Zr-DBN混合物在振荡器中以~550rpm在25-37°C下孵育30-45分钟用于细胞标记。
注:孵育温度将根据用于放射性标记的细胞类型而变化,如 表1所示。 - 在步骤4.2.2中孵育后,使用新鲜制备的rad-TLC溶剂(20mM柠檬酸钠[pH 4.9-5.1]:甲醇[1:1,V:V])对细胞放射性标记反应进行rad-TLC。 在 rad-TLC 运行后,寻找 [89 Zr]Zr-DBN 和 [89 Zr]ZrCl4,围绕 R f = ~0.73-0.81 和 R f = ~0.01-0.02 的放射性标记细胞。使用公式(2)计算Rf = ~0.01-0.02时的放射性百分比。
R f = ~0.01-0.02 = [ (R f= ~0.01 - 0.02) / (R f = ~0.01 - 0.02 和 R f= ~0.73 - 0.81 时的放射性总和) ] × 100 (2)
注:要了解在 R f = ~0.01-0.02 和 R f = ~0.73-0.81 处可视化的峰,请参阅补充图 S3 中白细胞放射性标记反应的 rad-TLC。 - 在单独的 1.5 mL 微量离心管中,将 ~100 μL 生物相容性配制的 [89Zr]Zr-DBN 与 pH 7.5-8.0 的 ~500 μL H-HBSS 混合,用作步骤 4.2.5 中背景校正的无细胞对照。在与步骤4.2.2中使用的相似温度和时间孵育后,进行rad-TLC。rad-TLC 运行后,在 Rf = ~0.73-0.81 附近查找 [89Zr]Zr-DBN 和 [89Zr]ZrCl4。使用公式(3)计算Rf = ~0.01-0.02时的放射性百分比。
R f = ~0.01-0.02 = [ (R f= ~0.01 - 0.02) / (R f= ~0.01 - 0.02 和 R f= ~0.73 - 0.81 时的放射性总和) ] × 100 (3)
注:要了解 在Rf = ~0.01-0.02和~0.73-0.81处可视化的峰,请参阅 补充图S4中无细胞对照反应的rad-TLC。 - 通过从R f = ~0.01-0.02(来自步骤4.2.3的rad-TLC)中减去R f = ~0.01-0.02(来自步骤4.2.3的rad-TLC)的放射性百分比来计算有效细胞放射性标记(%)。
- 放射性标记和细胞洗涤的淬灭(图5)
- 在步骤4.2.5中通过rad-TLC确认放射性标记完成后,通过加入~600μL冷却的,适合细胞的完全培养基或通过添加H-HBSS来执行放射性标记反应的淬灭,如 表1所示。
- 在4°C下以~96× g 离心微量离心机中的细胞10分钟。 弃去上清液。
- 轻轻地将沉淀的细胞重悬于~500μL冷冻培养基(Dulbecco改良的eagle培养基(DMEM)+ 10%胎牛血清+ 5%青霉素/链霉素或罗斯威尔公园纪念研究所-1640(RPMI-1640)+ 10%胎牛血清+ 5%青霉素/链霉素或H-HBSS中,如 表1所示。通过用设置为~500μL的微量移液器轻轻上下移液来重悬细胞沉淀。
- 在4°C下以~96× g 离心微量离心机中的细胞10分钟。
- 重复步骤4.3.2-4.3.4两次,洗去未结合的放射性。
- 在干细胞或H-HBSS的情况下,将沉淀转移到含有DMEM + 10%胎牛血清+ 5%青霉素/链霉素的新鲜1.5mL微量离心管中,并使用剂量校准器在489设置下测量细胞沉淀中的放射性 89Zr-同位素16。
- 使用公式(4)计算所有洗涤后的最终放射性标记效率。
放射性标记效率 = [(步骤 4.3.6 中细胞沉淀中的衰变校正放射性)/(步骤 4.2.1 中细胞沉淀和 H-HBSS 中的衰变校正放射性)] × 100 (4) - 为确保放射性标记细胞的质量,首先目视检查放射性标记细胞的最终悬浮液是否存在任何团块。如果没有结块,请继续进行最后的悬浮,进入下一步。如果有结块,但可以通过移液或轻轻摇晃重新悬浮,请这样做并继续下一步,因为这通过了目视检查。但是,如果团块没有通过移液或轻轻摇晃重新悬浮,请丢弃悬浮液并重新开始。
- 如果目视检查通过,则在放射性标记后1小时内使用在PBS中制备的0.4%台盼蓝溶液进行台盼蓝排阻性活力试验,并执行洗涤步骤(4.3.3-4.3.7)以评估放射性标记细胞的细胞活力。
- 为了进行测试,将 10.0 μL 的 0.4% 台盼蓝溶液加入到放射性标记和未标记细胞的 10.0 μL 细胞悬浮液中,并通过用设置为 10.0 μL 的微量移液器上下移液台盼蓝细胞悬浮液来混合它们。
- 用~10.0μL台盼蓝细胞悬浮液混合物加载血细胞计数器,立即在显微镜下以低放大倍率或使用自动细胞计数仪计数血细胞计数器中计数蓝色染色的细胞数和细胞总数。使用公式(5)计算活细胞的百分比。
活细胞百分比 = 100 - [(蓝色染色细胞数)/(总细胞数)] × 100 (5)
- 如果与未标记的对应物相比,放射性标记的细胞悬液中活细胞的百分比没有变化,则使用放射性标记的细胞。如果活细胞的百分比小于未标记的对应物,则丢弃放射性标记的细胞。
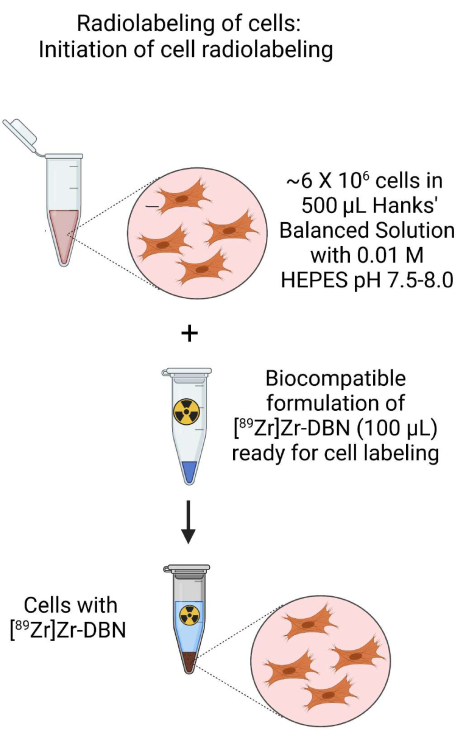
图 3:细胞放射性标记开始示意图。 通过将生物相容性配制的[89Zr]Zr-DBN添加到在HEPES缓冲的Hanks平衡盐溶液中制备的细胞悬液中来启动细胞的放射性标记。 请点击这里查看此图的较大版本.
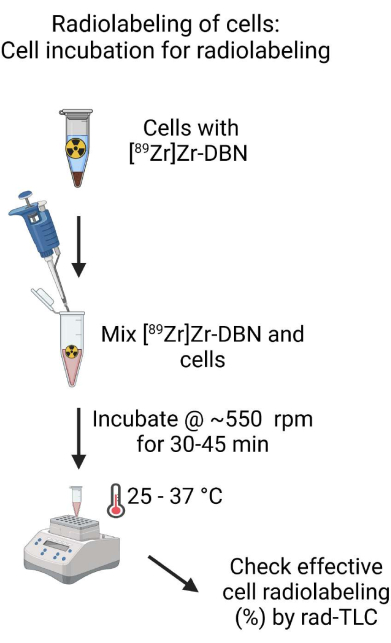
图 4:用于放射性标记的细胞孵育示意图。 将生物相容性配制的[89Zr]Zr-DBN与细胞悬液充分混合,并将细胞悬液在振荡器上的温控加热块中孵育30-60分钟。 请点击这里查看此图的较大版本.
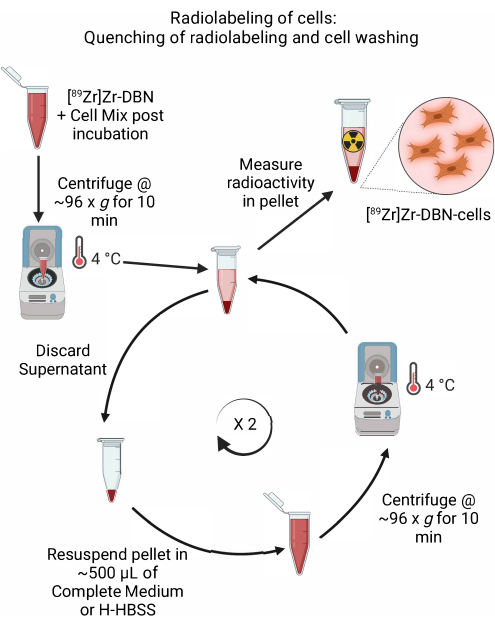
图 5:放射性标记和细胞洗涤的淬灭示意图。 通过加入冷冻细胞培养基或H-HBSS淬灭细胞的放射性标记,然后在4°C下离心。 对于细胞洗涤,弃去上清液并将细胞沉淀重悬于 ~500 μL 冷冻细胞培养基或 H-HBSS 中。重复丢弃上清液并将细胞沉淀重悬于新鲜培养基中的循环,以去除任何未结合的放射性标记合成子。 请点击这里查看此图的较大版本.
结果
本手稿中提出的代表性结果来自先前的 [89Zr]Zr-DBN 合成和细胞放射性标记研究 18,19,22,23,24,25。简而言之,使用7.5-15μgDFO-Bn-NCS,在25-37°C下,89Zr可以在~30-60分钟内与DFO-Bn-NCS成功络合(表2)。细胞放射性标记效率在洗涤后?...
讨论
以下是方案中需要优化以实现有效细胞放射性标记的关键步骤。在方案步骤1.2和1.3中,根据所采用的[89Zr]Zr(HPO4)2或[89Zr]ZrCl4的体积,必须使用适当体积(微升)的碱;1.0 M K 2CO 3 溶液必须用于中和 [89 Zr]Zr(HPO 4)2,1.0 M Na2CO 3 溶液用于中和 [89Zr]ZrCl4,以达到 7.5-8.0 的 pH 范围。在步骤2...
披露声明
作者没有经济竞争利益,但都是这项技术的发明者(专利#US20210330823A1)。
致谢
这项工作得到了 NIH 5R21HL127389-02、NIH 4T32HL007111-39、NIH R01HL134664 和 DOE DE-SC0008947 资助、维也纳国际原子能机构、妙佑医疗国际核医学科放射科和明尼苏达州罗切斯特梅奥诊所再生医学中心的支持。所有数字都是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A996-4 | |
| Alpha Minimum Essential Medium | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 12571063 | |
| Anion exchange column | Macherey-Nagel, Inc., Düren, Germany | 731876 | Chromafix 30-PS-HCO3 SPE 45 mg cartridge |
| Conical centrifuge tubes (15 mL) | Corning Inc., Glendale, AZ, USA | 352096 | Falcon 15 mL high-clarity polypropylene (PP) conical centrifuge tubes |
| Dendritic cells | The American Type Culture Collection, Manassas, VA, USA | CRL-11904 | |
| DFO-Bn-NCS | Macrocyclics, Inc., Plano, TX, USA | B-705 | p-SCN-Bn-Deferoxamine |
| DMSO | Sigma-Aldrich, Inc., St. Louis, MO | 276855 | |
| Dose calibrator | Mirion Technologies (Capintec), Inc., Florham Park, NJ, USA | 5130-3234 | CRC -55tR Dose Calibrator |
| Dulbecco’s modified Eagle’s medium | The American Type Culture Collection, Manassas, VA, USA | 30-2002 | |
| Fetal Bovine Serum (FBS) | The American Type Culture Collection, Manassas, VA, USA | 30-2020 | |
| Hanks Balanced Salt solution (HBSS) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 14025092 | For preparation of H-HBSS |
| Hydrochloric Acid (trace metal basis grade) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A508P212 | |
| Melanoma cells | The American Type Culture Collection, Manassas, VA, USA | CRL-6475 | |
| Methanol | Sigma-Aldrich, Inc., St. Louis, MO | 34860 | |
| Microcentrifuge tube | Eppendorf, Hamburg, Germany | 30108442 | Protein LoBind microcentrifuge tube |
| Murine GM-CSF | R&D Systems, Inc., Minneapolis, MN USA | 415-ML-010 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 15140-122 | |
| Phosphate Buffered Saline without Ca2+ and Mg2+ | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 10010023 | For washing cells |
| Saline | Covidien LLC, Mansfield, MA, USA | 1020 | 0.9% Sterile Saline Solution |
| Shaker | Eppendorf, Hamburg, Germany | T1317 | Thermomixer |
| Silica gel-rad-TLC paper sheet | Agilent Technologies Inc., Santa Clara, CA, USA | SGI0001 | iTLC-SG |
参考文献
- Bhawnani, N., et al. Effectiveness of stem cell therapies in improving clinical outcomes in patients with heart failure. Cureus. 13 (8), e17236 (2021).
- Zakrzewski, W., Dobrzynski, M., Szymonowicz, M., Rybak, Z. Stem cells: past, present, and future. Stem Cell Research & Therapy. 10 (1), 68 (2019).
- Bukhari, A. B., Dutta, S., De, A. Image guidance in stem cell therapeutics: unfolding the blindfold. Current Drug Targets. 16 (6), 658-671 (2015).
- Momeni, A., Neelamegham, S., Parashurama, N. Current challenges for the targeted delivery and molecular imaging of stem cells in animal models. Bioengineered. 8 (4), 316-324 (2017).
- Gnecchi, M., Zhang, Z., Ni, A., Dzau, V. J. Paracrine mechanisms in adult stem cell signaling and therapy. Circulation Research. 103 (11), 1204-1219 (2008).
- D'Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282 (2018).
- Zhang, Q., et al. CAR-T cell therapy in cancer: tribulations and road ahead. Journal of Immunology Research. 2020, 1924379 (2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Shao, F., et al. Radionuclide-based molecular imaging allows CAR-T cellular visualization and therapeutic monitoring. Theranostics. 11 (14), 6800-6817 (2021).
- Sakemura, R., Can, I., Siegler, E. L., Kenderian, S. S. In vivo CART cell imaging: Paving the way for success in CART cell therapy. Molecular Therapy Oncolytics. 20, 625-633 (2021).
- Wang, Y., et al. Dendritic cell biology and its role in tumor immunotherapy. Journal of Hematology & Oncology. 13 (1), 107 (2020).
- Bulte, J. W. M., Shakeri-Zadeh, A. In vivo MRI tracking of tumor vaccination and antigen presentation by dendritic cells. Molecular Imaging and Biology. 24 (2), 198-207 (2022).
- Holland, J. P., Sheh, Y., Lewis, J. S. Standardized methods for the production of high specific-activity zirconium-89. Nuclear Medicine and Biology. 36 (7), 729-739 (2009).
- Larenkov, A., et al. Preparation of zirconium-89 solutions for radiopharmaceutical purposes: interrelation between formulation, radiochemical purity, stability and biodistribution. Molecules. 24 (8), 1534 (2019).
- Pandey, M. K., et al. A new solid target design for the production of 89Zr and radiosynthesis of high molar activity [89Zr]Zr-DBN. American Journal of Nuclear Medicine and Molecular Imaging. 12 (1), 15-24 (2022).
- Pandey, M. K., et al. Improved production and processing of 89Zr using a solution target. Nuclear Medicine and Biology. 43 (1), 97-100 (2016).
- Pandey, M. K., Engelbrecht, H. P., Byrne, J. P., Packard, A. B., DeGrado, T. R. Production of 89Zr via the 89Y(p,n)89Zr reaction in aqueous solution: effect of solution composition on in-target chemistry. Nuclear Medicine and Biology. 41 (4), 309-316 (2014).
- Bansal, A., et al. Novel 89Zr cell labeling approach for PET-based cell trafficking studies. EJNMMI Research. 5, 19 (2015).
- Bansal, A., et al. 89Zr]Zr-DBN labeled cardiopoietic stem cells proficient for heart failure. Nuclear Medicine and Biology. 90-91, 23-30 (2020).
- Friberger, I., et al. Optimisation of the synthesis and cell labelling conditions for [89Zr]Zr-oxine and [89Zr]Zr-DFO-NCS: a direct in vitro comparison in cell types with distinct therapeutic applications. Molecular Imaging and Biology. 23 (6), 952-962 (2021).
- Lee, S. H., et al. Feasibility of real-time in vivo 89Zr-DFO-labeled CAR T-cell trafficking using PET imaging. PLoS One. 15 (1), e0223814 (2020).
- Nicolas, C. T., et al. Hepatocyte spheroids as an alternative to single cells for transplantation after ex vivo gene therapy in mice and pig models. Surgery. 164 (3), 473-481 (2018).
- Yang, B., et al. Tracking and therapeutic value of human adipose tissue-derived mesenchymal stem cell transplantation in reducing venous neointimal hyperplasia associated with arteriovenous fistula. Radiology. 279 (2), 513-522 (2016).
- Nicolas, C. T., et al. Ex vivo cell therapy by ectopic hepatocyte transplantation treats the porcine tyrosinemia model of acute liver failure. Molecular Therapy. Methods & Clinical Development. 18, 738-750 (2020).
- Bansal, A., Sharma, S., Klasen, B., Rosch, F., Pandey, M. K. Evaluation of different 89Zr-labeled synthons for direct labeling and tracking of white blood cells and stem cells in healthy athymic mice. Scientific Reports. 12 (1), 15646 (2022).
- Behfar, A., et al. Guided cardiopoiesis enhances therapeutic benefit of bone marrow human mesenchymal stem cells in chronic myocardial infarction. Journal of the American College of Cardiology. 56 (9), 721-734 (2010).
- Charoenphun, P., et al. 89Zr]oxinate4 for long-term in vivo cell tracking by positron emission tomography. European Journal of Nuclear Medicine and Molecular Imaging. 42 (2), 278-287 (2015).
- Sato, N., et al. In vivo tracking of adoptively transferred natural killer cells in rhesus macaques using 89zirconium-oxine cell labeling and PET imaging. Clinical Cancer Research. 26 (11), 2573-2581 (2020).
- Volpe, A., Pillarsetty, N. V. K., Lewis, J. S., Ponomarev, V. Applications of nuclear-based imaging in gene and cell therapy: probe considerations. Molecular Therapy Oncolytics. 20, 447-458 (2021).
- Fogli, L. K., et al. Challenges and next steps in the advancement of immunotherapy: summary of the 2018 and 2020 National Cancer Institute workshops on cell-based immunotherapy for solid tumors. Journal for Immunotherapy of Cancer. 9 (7), e003048 (2021).
- Li, X., Hacker, M. Molecular imaging in stem cell-based therapies of cardiac diseases. Advanced Drug Delivery Reviews. 120, 71-88 (2017).
- Puges, M., et al. Retrospective study comparing WBC scan and 18F-FDG PET/CT in patients with suspected prosthetic vascular graft infection. European Journal of Vascular and Endovascular Surgery. 57 (6), 876-884 (2019).
- Butterfield, L. H. Dendritic cells in cancer immunotherapy clinical trials: are we making progress. Frontiers in Immunology. 4, 454 (2013).
- de Vries, I. J. M., et al. Magnetic resonance tracking of dendritic cells in melanoma patients for monitoring of cellular therapy. Nature Biotechnology. 23 (11), 1407-1413 (2005).
- Gosmann, D., et al. Promise and challenges of clinical non-invasive T-cell tracking in the era of cancer immunotherapy. EJNMMI Research. 12 (1), 5 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。