Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie par tomographie par émission de positons du trafic cellulaire : une méthode de radiomarquage cellulaire
Dans cet article
Résumé
Nous présentons ici un protocole de radiomarquage des cellules avec un radio-isotope de tomographie par émission de positons (TEP), 89 Zr (t1/2 78,4 h), à l’aide d’un synthétison de radiomarquage prêt à l’emploi, [89 Zr]Zr-p-isothiocyanatobenzyl-desferrioxamine ([89Zr]Zr-DBN). Le radiomarquage des cellules avec [89Zr]Zr-DBN permet un suivi et une imagerie non invasifs des cellules radiomarquées administrées dans le corps par TEP jusqu’à 7 jours après l’administration.
Résumé
Les thérapies à base de cellules souches et de récepteurs antigéniques chimériques (CAR) à cellules T apparaissent comme des thérapies prometteuses pour la régénération des organes et comme immunothérapie pour divers cancers. Malgré des progrès significatifs dans ces domaines, il reste encore beaucoup à apprendre pour mieux comprendre la pharmacocinétique et la pharmacodynamique des cellules thérapeutiques administrées dans le système vivant. Pour le suivi non invasif in vivo des cellules par tomographie par émission de positons (TEP), une nouvelle méthode de radiomarquage cellulaire médiée par [89 Zr]Zr-p-isothiocyanatobenzyl-desferrioxamine ([89 Zr]Zr-DBN) a été mise au point en utilisant 89Zr (t1/2 78,4 h). Le présent protocole décrit un synthétison de radiomarquage [89Zr]Zr-DBN, prêt à l’emploi, pour le radiomarquage direct de diverses cellules, y compris les cellules souches mésenchymateuses, les cellules souches cardiopoïétiques guidées par la lignée, les hépatocytes régénérant le foie, les globules blancs, les cellules de mélanome et les cellules dendritiques. La méthodologie développée permet une imagerie TEP non invasive du trafic cellulaire jusqu’à 7 jours après l’administration sans affecter la nature ou la fonction des cellules radiomarquées. De plus, ce protocole décrit une méthode par étapes pour la radiosynthèse du [89 Zr]Zr-DBN, la formulation biocompatible du [89 Zr]Zr-DBN, la préparation des cellules pour le radiomarquage, et enfin le radiomarquage des cellules avec le [89Zr]Zr-DBN, y compris tous les détails complexes nécessaires à la réussite du radiomarquage des cellules.
Introduction
Les thérapies à base de cellules souches et de récepteurs antigéniques chimériques (CAR) à base de cellules T gagnent en popularité et font l’objet d’études actives pour le traitement de diverses maladies, telles que l’insuffisance myocardique1,2, la dégénérescence rétinienne 2, la dégénérescence maculaire 2, le diabète 2, l’infarctus du myocarde 3,4,5 et les cancers 6,7,8,9.10. Parmi les deux approches plausibles des thérapies à base de cellules souches, les cellules souches peuvent soit être directement greffées sur le site de la maladie pour provoquer une réponse thérapeutique, soit provoquer des changements dans le microenvironnement du site de la maladie sans adhérer au site de la maladie pour initier une réponse thérapeutique indirecte. Une réponse thérapeutique indirecte pourrait provoquer des changements dans le microenvironnement du site de la maladie en libérant des facteurs qui répareraient ou traiteraient la maladie5. Ces approches de thérapies à base de cellules souches pourraient être évaluées par imagerie non invasive de cellules souches radiomarquées. L’imagerie non invasive pourrait corréler l’absorption des cellules radiomarquées sur le site de la maladie avec une réponse thérapeutique pour déchiffrer la réponse thérapeutique directe par rapport à la réponse thérapeutique indirecte.
De plus, des thérapies à base de cellules immunitaires sont en cours de développement pour traiter divers cancers à l’aide des cellules CAR-T 6,7,8,9,10 et de l’immunothérapie par cellules dendritiques 11,12. D’un point de vue mécanistique, dans l’immunothérapie par cellules CAR-T 6,7,8,9,10, les cellules T sont modifiées pour exprimer un épitope qui se lie à un antigène spécifique sur les tumeurs qui doivent être traitées. Ces cellules CAR-T modifiées, lors de l’administration, se lient à l’antigène spécifique présent sur les cellules tumorales par une interaction épitope-antigène. Après s’être liés, les cellules CAR-T liées subissent une activation, puis prolifèrent et libèrent des cytokines, ce qui signale au système immunitaire de l’hôte d’attaquer la tumeur exprimant l’antigène spécifique. En revanche, dans le cas des thérapies cellulaires dendritiques11,12, les cellules dendritiques sont modifiées pour présenter un antigène cancéreux spécifique à leur surface. Ces cellules dendritiques modifiées, lorsqu’elles sont administrées, abritent les ganglions lymphatiques et se lient aux lymphocytes T dans les ganglions lymphatiques. Les lymphocytes T, lorsqu’ils se lient aux antigènes cancéreux spécifiques sur les cellules dendritiques administrées, subissent une activation/prolifération et initient une réponse immunitaire de l’hôte contre la tumeur exprimant cet antigène spécifique. Par conséquent, l’évaluation du trafic des cellules CAR-T administrées vers un site tumoral9,10 et de la localisation des cellules dendritiques vers les ganglions lymphatiques11,12 est possible par imagerie de cellules CAR-T et de cellules dendritiques radiomarquées pour déterminer l’efficacité de l’immunothérapie. De plus, le trafic cellulaire non invasif peut aider à mieux comprendre le potentiel thérapeutique, à clarifier la réponse thérapeutique directe par rapport à la réponse thérapeutique indirecte, et à prédire et surveiller la réponse thérapeutique des thérapies à base de cellules souches et de cellules immunitaires.
Différentes modalités d’imagerie pour le trafic cellulaire ont été explorées 3,4,9,10,12, notamment l’imagerie optique, l’imagerie par résonance magnétique (IRM), la tomographie par émission monophotonique (SPECT) et la tomographie par émission de positons (TEP). Chacune de ces techniques a ses propres avantages et inconvénients. Parmi celles-ci, la TEP est la modalité la plus prometteuse en raison de sa nature quantitative et de sa haute sensibilité, qui sont essentielles pour la quantification fiable des cellules dans le trafic cellulaire basé sur l’imagerie 3,4,9,10.
Le radio-isotope émetteur de positons 89Zr, d’une demi-vie de 78,4 h, est adapté au marquage cellulaire. Il permet l’imagerie TEP du trafic cellulaire pendant plus d’une semaine et est facilement produit par des cyclotrons médicaux à faible consommation d’énergielargement disponibles 13,14,15,16,17. De plus, un chélateur p-isothiocyanatobenzyl-desferrioxamine (DFO-Bn-NCS) fonctionnalisé de manière appropriée est disponible dans le commerce pour la synthèse d’un synthon de marquage cellulaire prêt à l’emploi et marqué au 89 Zr, [89 Zr]Zr-p-isothiocyanatobenzyl-desferrioxamine, également connu sous le nom de [89Zr]Zr-DBN 18,19,20,21,22,23,24,25. Le principe du marquage cellulaire médié par [89 Zr]Zr-DBN est basé sur une réaction entre les amines primaires des protéines de la membrane cellulaire et la fraction isothiocyanate (NCS) de [89Zr]Zr-DBN pour produire une liaison thiourée covalente stable.
[89Zr] Le marquage et l’imagerie cellulaires basés sur Zr-DBN ont été publiés pour suivre une variété de cellules différentes, y compris les cellules souches 18,23,25, les cellules dendritiques18, les cellules souches cardiopoïétiques19, les cellules stromales déciduales 20, les macrophages dérivés de la moelle osseuse 20, les cellules mononucléées du sang périphérique 20, les cellules Jurkat/CAR-T 21, les hépatocytes 22,24 et les globules blancs 25. Le protocole suivant fournit des méthodes étape par étape de préparation et de radiomarquage cellulaire avec [89Zr]Zr-DBN et décrit les modifications qui peuvent être nécessaires dans le protocole de radiomarquage pour un type cellulaire spécifique. Pour plus de clarté, la méthode de radiomarquage cellulaire présentée ici est divisée en quatre sections. La première section traite de la préparation de [89 Zr]Zr-DBN par chélation de 89Zr avec le MPO-Bn-NCS. La deuxième section décrit la préparation d’une formulation biocompatible de [89Zr]Zr-DBN qui peut être facilement utilisée pour le radiomarquage cellulaire. La troisième section couvre les étapes nécessaires au préconditionnement des cellules pour le radiomarquage. Le préconditionnement des cellules consiste à laver les cellules avec une solution saline tamponnée au phosphate (PBS) sans protéines et une solution saline équilibrée de Hanks tamponnée HEPES (H-HBSS) pour éliminer les protéines externes, qui pourraient interférer ou entrer en compétition avec la réaction du [89Zr]Zr-DBN avec les amines primaires présentes sur les protéines de surface cellulaires pendant le radiomarquage. La dernière section présente les étapes du radiomarquage proprement dit des cellules et de l’analyse du contrôle de la qualité.
Access restricted. Please log in or start a trial to view this content.
Protocole
Des cellules dendritiques et des cellules de mélanome ont été obtenues commercialement18. Des hépatocytes ont été isolés du foie de porcs après hépatectomie partielle laparoscopique22,24. Des cellules souches ont été isolées à partir d’échantillons de moelle osseuse18,19,26. Les cellules souches dérivées du tissu adipeux ont été obtenues au laboratoire de thérapie cellulaire humaine, Mayo Clinic Rochester23. Des globules blancs humains ont été isolés à partir du sang recueilli reçu de la Division de médecine transfusionnelle, Mayo Clinic Rochester25. Diverses cellules utilisées pour le radiomarquage ont été obtenues et utilisées conformément aux lignes directrices recommandées par le Comité institutionnel sur les soins et l’utilisation des animaux, le Sous-comité de surveillance de la recherche sur les cellules souches de la Mayo Clinic, le Comité de recherche de la Division de la médecine transfusionnelle, le Comité de biosécurité institutionnel et le Comité de radioprotection.
1. Préparation de [ 89 Zr ]Zr-p-isothiocyanatobenzyl-desferrioxamine ([ 89Zr ]Zr-DBN)
Durée : ~160-220 min
REMARQUE : Pour la préparation du [89 Zr]Zr-DBN, isoler le 89 Zr sous forme de phosphate d’hydrogène [89 Zr]Zr ([89Zr]Zr(HPO 4)2) ou de chlorure de [89 Zr]Zr ([89Zr]ZrCl4), comme mentionné à l’étape 1.1.
- Isolez 89 Zr du parent 89Y à l’aide d’une méthode de purification à base de résine d’hydroxamate13,17. En bref, préparez d’abord une colonne avec ~100 mg de résine d’hydroxamate, puis activez la résine d’hydroxamate en lavant la colonne avec 8,0 mL d’acétonitrile anhydre pur, suivi d’un rinçage avec 5,0-6,0 mL d’air. Ensuite, lavez la colonne avec 15 mL d’eau déminéralisée, suivie d’une autre chasse d’eau avec 5,0 à 6,0 mL d’air, puis passez 2,0 mL de HCl 0,50 N (grade de base de métaux traces) suivie d’une chasse supplémentaire avec 5,0 à 6,0 mL d’air. Ensuite, chargez lentement la solution contenant à la fois 89 Zr et 89 Y dans la résine d’hydroxamate et lavez le 89Y non lié de la résine d’hydroxamate avec 20 mL de HCl 2,0 N, suivi de 10 mL d’eau déminéralisée et d’un rinçage avec 5,0 à 6,0 mL d’air.
REMARQUE : Après le rinçage à l’air, l’élution de 89Zr peut être effectuée comme indiqué ci-dessous.- Pour éluer 89 Zr sous forme de [89 Zr]Zr(HPO 4)2, ajoutez d’abord 0,50 mL de tampon 1,2 M K 2 HPO 4/KH 2 PO 4 (pH 3,5) dans la colonne de l’étape 1.1 et laissez-le reposer sur la colonne pendant 30 min pour favoriser la libération de 89 Zr en tant que [89Zr]Zr(HPO 4)2 à partir de la résine. Ensuite, éluer le 89Zr de la colonne avec 1,50 mL supplémentaire de tampon 1,2 M K 2 HPO 4/KH2PO4 (pH 3,5). Après l’élution de [89 Zr]Zr(HPO 4)2, suivez les étapes 1.2, 1.2.1 et 1.2.2 pour la préparation de [89Zr]Zr-DBN à l’aide de [89Zr]Zr(HPO4)2, comme illustré à la figure 1.
- Pour obtenir 89 Zr sous la forme [89 Zr]ZrCl4, la première élue est 89 Zr sous la forme de l’oxalate de [89Zr]Zr.
- Pour éluer 89 Zr sous forme d’oxalate de [89 Zr]Zr, ajouter 0,50 mL d’acide oxalique 1,0 M à la colonne à partir de l’étape 1.1 et le laisser reposer sur la colonne pendant 1 min pour favoriser la libération de 89 Zr sous forme d’oxalate de [89Zr] à partir de la résine. Ensuite, éluez les 89Zr de la colonne avec 2,50 mL supplémentaires d’acide oxalique 1,0 M (total de 3,0 mL)17.
- Pour convertir l’oxalate de [89 Zr]Zr en [89Zr]ZrCl4 à l’aide d’une colonne d’échange d’anions, comme décrit par Larenkov et al.14, activez d’abord la colonne en lavant avec 6,0 mL d’acétonitrile, suivi d’un rinçage avec 5,0-6,0 mL d’air. Ensuite, lavez la colonne avec 10,0 mL de solution saline, suivie d’une autre chasse d’eau de 5,0 à 6,0 mL d’air. Enfin, passez 10,0 mL d’eau déminéralisée, suivie d’une chasse d’eau avec 5,0 à 6,0 mL d’air.
- Charger lentement la solution de 3,0 mL contenant de l’oxalate de [89Zr]Zr sur la colonne d’échange d’anions activée, suivie d’un rinçage de 5,0 à 6,0 mL d’air. Ensuite, lavez la colonne chargée en 89Zr avec 50,0 mL d’eau déminéralisée pour éliminer l’ion oxalate non lié, suivi d’un rinçage avec 5,0 à 6,0 mL d’air.
- Pour éluer 89 Zr sous la forme de [89 Zr]ZrCl 4, ajouter 0,10 mL de HCl 1,0 N dans la colonne, laisser reposer sur la colonne pendant 1,0 min pour favoriser la libération de 89 Zr sous forme de [89 Zr]ZrCl4 à partir de la résine, et éluer le 89Zr de la colonne avec 0,40 mL supplémentaire de HCl 1,0 N (total de 0,5 mL). Séchez le [89Zr]ZrCl4 élué dans un flacon en V en le plaçant dans un bloc chauffant à 65 °C sous un flux constant d’azote gazeux pendant 10 à 30 min. Après séchage, reconstituer le [89 Zr]ZrCl 4 séché dans de l’eau et suivre les étapes 1.3 et 1.3.1 pour la préparation du [89 Zr]Zr-DBN en utilisant le [89Zr]ZrCl4, comme le montre la figure 1.
- Prendre ~120 μL de [89Zr]Zr(HPO 4)2, formulé dans 1,2 M K 2 HPO 4/KH 2 PO4 (pH 3,5) (10-25 MBq) de l’étape 1.1.1, et neutraliser la solution pour atteindre un pH de 7,5 à 8,0 avec ~100 μL de 1,0 M HEPES-KOH (pH 7,5) et ~65 μL de 1,0 M K 2 CO3.
- Pour obtenir la quantité appropriée de DFO-Bn-NCS pour les étapes 1.2.2 ou 1.3.1 pour différentes formulations de 89 Zr ayant une activité spécifique apparente variée de 89 Zr, effectuer une série de réactions de chélation en utilisant un volume fixe d’une formulation neutralisée de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl4 avec une plage de DFO-Bn-NCS (7,5-15 μg). Dans le cas de [89Zr]Zr(HPO4)2, incuber la réaction de chélation à 37 °C dans un agitateur à ~550 tr/min pendant 60 min. Alors que, dans le cas de [89Zr]ZrCl4, incuber la réaction de chélation à 25 °C dans un agitateur à ~550 tr/min pendant 30 min. Éliminez la réaction de chélation qui montre précipité pendant ou à la fin de l’incubation. À la fin de l’incubation, effectuer une chromatographie radioactive sur couche mince (rad-TLC) avec 100 mM de pentaacétate de diéthylènetriamine (DTPA), pH 7,0, en phase mobile pour estimer l’efficacité de chélation du DFO-Bn-NCS pour chaque réaction de chélation, comme indiqué ci-dessous à l’étape 1.5.
NOTA : En fonction de l’efficacité de la chélation, utiliser la quantité minimale de DFO-Bn-NCS aux étapes 1.2.2 ou 1.3.1 nécessaire pour obtenir une efficacité de chélation de ≥97 % sans provoquer de précipitation de DFO-Bn-NCS dans la formulation neutralisée de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl 4. Ici, le [89Zr]Zr-DBN a été synthétisé dans une pureté radiochimique de ≥97 %. - Préparer 5,0 mM de DFO-Bn-NCS frais dans du DMSO anhydre (3,76 mg/mL) et ajouter 4,0 μL de 5,0 mM de DFO-Bn-NCS (20 nmol ou 15 μg) à ~285 μL de [89Zr]Zr(HPO4)2 (10-25 MBq) neutralisé à partir de l’étape 1.2 et mélanger la solution par pipetage. Maintenir la concentration finale de DMSO dans le mélange chélateur en dessous de 2 % du volume total.
- Pour obtenir la quantité appropriée de DFO-Bn-NCS pour les étapes 1.2.2 ou 1.3.1 pour différentes formulations de 89 Zr ayant une activité spécifique apparente variée de 89 Zr, effectuer une série de réactions de chélation en utilisant un volume fixe d’une formulation neutralisée de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl4 avec une plage de DFO-Bn-NCS (7,5-15 μg). Dans le cas de [89Zr]Zr(HPO4)2, incuber la réaction de chélation à 37 °C dans un agitateur à ~550 tr/min pendant 60 min. Alors que, dans le cas de [89Zr]ZrCl4, incuber la réaction de chélation à 25 °C dans un agitateur à ~550 tr/min pendant 30 min. Éliminez la réaction de chélation qui montre précipité pendant ou à la fin de l’incubation. À la fin de l’incubation, effectuer une chromatographie radioactive sur couche mince (rad-TLC) avec 100 mM de pentaacétate de diéthylènetriamine (DTPA), pH 7,0, en phase mobile pour estimer l’efficacité de chélation du DFO-Bn-NCS pour chaque réaction de chélation, comme indiqué ci-dessous à l’étape 1.5.
- Prendre ~180 μL de [89 Zr]ZrCl 4 formulé dans 0,1 N HCl (40-80 MBq) à partir de l’étape 1.1.2.4 et neutraliser la solution résultante pour atteindre un pH de 7,5-8,0 avec ~25 μL de 1,0 M Na2CO3.
- Préparer 2,5 mM de DFO-Bn-NCS frais dans du diméthylsulfoxyde anhydre (DMSO) (1,88 mg/mL) et ajouter 4,0 μL de DFO-Bn-NCS 2,5 mM (10 nmol ou 7,5 μg) à ~205 μL de [89 Zr]ZrCl4 neutralisé (40-80 MBq) à partir de l’étape 1.3. Mélangez la solution par pipetage. Maintenir la concentration finale de DMSO dans le mélange chélateur en dessous de 2 % du volume total.
- Procéder à la chélation de 89 Zr à 37 °C dans un agitateur à ~550 tr/min pendant 60 min dans le cas de [89 Zr]Zr(HPO 4)2, ou à 25 °C dans un agitateur à ~550 tr/min pendant 30 min dans le cas de [89Zr]ZrCl4.
- Déterminer l’efficacité de chélation de 89Zr par rad-TLC avec 100 mM DTPA (pH 7,0) comme solvant mobile rad-TLC. Attendez-vous à ce que [89 Zr]Zr-DBN affiche un R f de ~0,021-0,035, [89 Zr]ZrCl 4 affiche un R f de ~1,0 et [89Zr]Zr(HPO4)2 affiche un R f de ~1,0. Calculer l’efficacité de chélation (%) à l’aide de l’équation (1) :
Pourcentage de 89 Zr chélatés au MPO-NCS pour former [89 Zr]Zr-DBN = [ (Radioactivité à R f de [89 Zr]Zr - DBN) / (Somme des radioactivités à R f de [89 Zr]Zr - DBN et à R f de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl4) ] × 100 (1)
REMARQUE : L’efficacité de chélation acceptable de 89Zr pour procéder au radiomarquage cellulaire, telle que déterminée par rad-TLC, est de ≥97 %. La pureté radiochimique suggérée de ≥97 % de [89Zr]Zr-DBN a été établie conformément à l’exigence standard de pureté radiochimique pour les autres produits radiopharmaceutiques utilisés sur le terrain. Voir le rad-TLC représentatif dans la figure supplémentaire S1 et la figure supplémentaire S2.

Figure 1 : Schéma de préparation du [89Zr]Zr-DBN. Pour la préparation de [89 Zr]Zr-DBN, neutraliser le [89 Zr]Zr(HPO 4)2 ou le [89Zr]ZrCl4 préformulé à un pH de 7,5 à 8,0. Incuber la solution neutralisée avec DFO-Bn-NCS. Vérifier l’efficacité de chélation de 89Zr à DFO-Bn-NCS par rad-TLC. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Formulation biocompatible de [ 89Zr ]Zr-DBN pour le radiomarquage cellulaire (Figure 2)
Durée : ~35 min
REMARQUE : Compte tenu du temps nécessaire à la préparation des cellules à l’étape 3, commencez l’étape 3 environ 20 minutes avant le début de l’étape 2 pour une incubation de ~30 minutes. Cela permet au radiomarquage cellulaire de l’étape 4 de commencer dans les ~5 à 10 minutes suivant l’achèvement des étapes 2-3.2.2.
- Pour la formulation [89 Zr]Zr-DBN fabriquée à partir du [89 Zr]ZrCl 4, ajouter 50,0 μL d’un mélange compatible avec les cellules comprenant ~27,0 μL de 1,2 M K 2 HPO 4/KH2PO 4 (pH 3,5) + ~23,0 μL de tampon HEPES-KOH à 1,0 M (pH 7,5) à 50,0 μL de [89 Zr]Zr-DBN. Incuber le mélange compatible avec les cellules [89Zr]Zr-DBN pendant ~30 min à température ambiante (25 °C).
REMARQUE : La formulation [89 Zr]Zr-DBN à base de [89Zr]Zr(HPO4)2 est biocompatible pour le radiomarquage des cellules et ne nécessite pas l’étape 2.
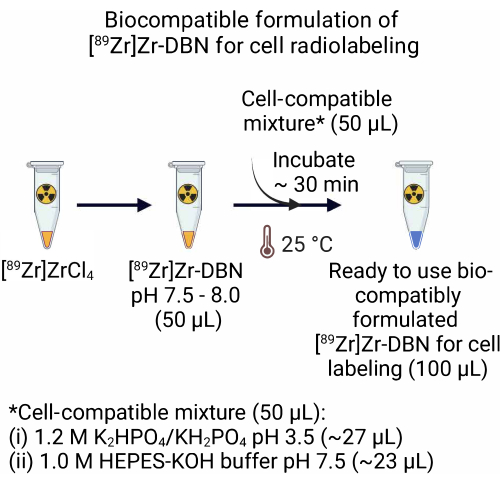
Figure 2 : Préparation de la formulation biocompatible du [89Zr]Zr-DBN pour le radiomarquage cellulaire. Pour la préparation d’une formulation biocompatible prête à l’emploi du synthon radiomarquant, ajouter un volume égal de mélange compatible avec les cellules, comprenant 1,2 M K 2 HPO 4/KH2PO 4 (pH 3,5) + 1,0 M HEPES-KOH à un volume égal de [89Zr]Zr-DBN. Incuber à 25 °C pendant ~30 min. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparation des cellules pour le radiomarquage
Durée : ~40-50 min
- Trypsiniser ~12 × 106 cellules adhérentes (cellules souches, cellules cancéreuses de mélanome, cellules souches cardiopoïétiques, cellules dendritiques ou hépatocytes) et centrifuger les cellules dans un tube à centrifuger conique de 15,0 mL à ~96 × g pendant 10 min à 4 °C.
- Jeter le surnageant, remettre en suspension la pastille cellulaire dans ~500 μL de PBS et transférer la suspension cellulaire dans un tube de microcentrifugation de 1,5 mL. Centrifuger les cellules dans une microcentrifugeuse à ~96 × g pendant 10 min à 4 °C.
- Jeter le surnageant et remettre en suspension la pastille cellulaire dans ~500 μL de H-HBSS. Centrifuger les cellules dans une microcentrifugeuse de 1,5 mL à ~96 × g pendant 10 min à 4 °C. Répétez l’étape 3.1.2 une fois de plus et passez à l’étape 4.1.1.
REMARQUE : H-HBSS est une solution saline équilibrée de Hanks avec 0,01 M HEPES (pH 8,0).
- Dans le cas de cellules non adhérentes, telles que les globules blancs humains (globules blancs humains fraîchement isolés du sang), sauter la trypsinisation et centrifuger la suspension cellulaire contenant ~12 × 106 cellules dans une microcentrifugeuse de 1,5 mL à ~96 × g pendant 10 min à 4 °C.
- Jeter le surnageant, remettre en suspension la pastille cellulaire dans ~500 μL de PBS et centrifuger les cellules dans une microcentrifugeuse de 1,5 mL à ~96 × g pendant 10 min à 4 °C.
- Jeter le surnageant et remettre en suspension la pastille cellulaire dans ~500 μL de H-HBSS. Centrifuger les cellules dans une microcentrifugeuse de 1,5 mL à ~96 × g pendant 10 min à 4 °C. Répétez l’étape 3.2.2 une fois de plus et passez à l’étape 4.1.1.
4. Radiomarquage des cellules
Durée : ~125-155 min
- Initiation du radiomarquage cellulaire (Figure 3)
- Utilisez la suspension cellulaire de l’étape 3.1.2 ou de l’étape 3.2.2 pour préparer une suspension cellulaire de ~500 μL avec environ ~6 × 106 cellules dans ~500 μL de H-HBSS à pH 7,5-8,0 dans un tube de microcentrifugation de 1,5 mL.
- À cela, ajoutez ~100 μL de [89Zr]Zr-DBN formulé de manière biocompatible à partir de l’étape 2.
- Incubation cellulaire pour le radiomarquage (Figure 4)
- Mélanger le [89Zr]Zr-DBN formulé de manière biocompatible et la suspension cellulaire en pipetant doucement de haut en bas à l’aide d’une micropipette réglée à ~500 μL. Mesurer la quantité de radioactivité dans le tube d’incubation à l’aide d’un calibrateur de dose de radioactivité au réglage 489 pour l’isotope 16 89Zr.
- Incuber les cellules et le mélange [89Zr]Zr-DBN dans un agitateur à ~550 tr/min à 25-37 °C pendant 30-45 min pour le marquage des cellules.
REMARQUE : La température d’incubation varie en fonction des types de cellules utilisées pour le radiomarquage, comme indiqué dans le tableau 1. - Après l’incubation à l’étape 4.2.2, effectuer la radio-CCM sur la cellule à l’aide d’un solvant rad-TLC fraîchement préparé (20 mM de citrate de sodium [pH 4,9-5,1] :méthanol [1 :1, V :V]). Après l’exécution rad-TLC, recherchez [89 Zr]Zr-DBN et [89 Zr]ZrCl4 autour de R f = ~0,73-0,81 et R f = ~0,01-0,02 pour les cellules radiomarquées. Calculer le pourcentage de radioactivité à Rf = ~0,01-0,02 à l’aide de l’équation (2).
Pourcentage de radioactivité à R f = ~0,01-0,02 = [ (Radioactivité à R f = ~0,01 - 0,02) / (Somme des radioactivités à R f = ~0,01 - 0,02 et R f = ~0,73 - 0,81) ] × 100 (2)
NOTE : Pour comprendre les pics visualisés à R f = ~0,01-0,02 et R f = ~0,73-0,81, voir la CCM-rad pour la réaction de radiomarquage des globules blancs dans la figure supplémentaire S3. - Dans un tube de microcentrifugation séparé de 1,5 mL, mélanger ~100 μL de [89Zr]Zr-DBN formulé de manière biocompatible avec ~500 μL de H-HBSS à pH 7,5-8,0 pour l’utiliser comme témoin sans cellule pour la correction du bruit de fond à l’étape 4.2.5. Après l’incubation à une température et un temps similaires à ceux utilisés à l’étape 4.2.2, effectuez le rad-TLC. Après l’exécution de rad-TLC, recherchez [89 Zr]Zr-DBN et [89 Zr]ZrCl4 autour de Rf = ~0,73-0,81. Calculer le pourcentage de radioactivité à Rf = ~0,01-0,02 à l’aide de l’équation (3).
Radioactivité à R f = ~0,01-0,02 = [ (Radioactivité à R f= ~0,01 - 0,02) / (Somme des radioactivités à R f = ~0,01 - 0,02 et R f= ~0,73 - 0,81) ] × 100 (3)
NOTE : Pour comprendre les pics visualisés à Rf = ~0,01-0,02 et ~0,73-0,81, voir la CCM-rad de la réaction de contrôle sans cellule dans la figure supplémentaire S4. - Calculer le radiomarquage cellulaire effectif (%) en soustrayant le pourcentage de radioactivité à R f = ~0,01-0,02 (de rad-TLC à partir de l’étape 4.2.4) du pourcentage de radioactivité à R f = ~0,01-0,02 (à partir de rad-TLC à partir de l’étape 4.2.3).
- Trempe du radiomarquage et lavage des cellules (Figure 5)
- Après avoir confirmé l’achèvement du radiomarquage par rad-TLC à l’étape 4.2.5, effectuer la trempe de la réaction de radiomarquage par addition de ~600 μL de milieu complet réfrigéré adapté à la cellule, ou par ajout de H-HBSS, comme indiqué dans le tableau 1.
- Centrifuger les cellules dans une microcentrifugeuse à ~96 × g pendant 10 min à 4 °C. Jeter le surnageant.
- Remettre doucement les cellules en granulés dans ~500 μL de milieu réfrigéré (milieu d’aigle modifié de Dulbecco (DMEM) + 10 % de sérum de veau fœtal + 5 % de pénicilline/streptomycine ou Roswell Park Memorial Institute-1640 (RPMI-1640) + 10 % de sérum de veau fœtal + 5 % de pénicilline/streptomycine ou H-HBSS pour un type de cellule particulier, comme indiqué dans le tableau 1. Effectuez une remise en suspension de la pastille cellulaire en pipetant doucement de haut en bas à l’aide d’une micropipette réglée à ~500 μL.
- Centrifuger les cellules dans une microcentrifugeuse à ~96 × g pendant 10 min à 4 °C.
- Répétez deux fois les étapes 4.3.2 à 4.3.4 pour éliminer la radioactivité non liée.
- Transférez la pastille dans un tube de microcentrifugation frais de 1,5 mL avec DMEM + 10 % de sérum de veau fœtal + 5 % de pénicilline/streptomycine dans le cas de cellules souches ou de H-HBSS et mesurez la radioactivité dans la pastille cellulaire à l’aide d’un calibrateur de dose au réglage 489 pour l’isotope16 de 89Zr.
- Calculer l’efficacité finale du radiomarquage après tous les lavages à l’aide de l’équation (4).
Efficacité du radiomarquage = [(Radioactivité corrigée de la désintégration dans la pastille cellulaire à l’étape 4.3.6) / (Radioactivité corrigée de la désintégration dans la pastille cellulaire et H-HBSS à l’étape 4.2.1) ] × 100 (4) - Pour s’assurer de la qualité des cellules radiomarquées, inspectez d’abord visuellement la suspension finale des cellules radiomarquées pour détecter la présence d’amas. S’il n’y a pas de grumeaux, passez à l’étape suivante. S’il y a des grumeaux, mais qu’ils peuvent être remis en suspension par pipetage ou par agitation douce, faites-le et passez à l’étape suivante, car cela passe l’inspection visuelle. Cependant, si les grumeaux ne sont pas remis en suspension par pipetage ou par agitation douce, jetez la suspension et recommencez.
- Si l’inspection visuelle est réussie, effectuer un essai de viabilité d’exclusion du bleu de trypan à l’aide d’une solution de bleu de trypan à 0,4 % préparée dans du PBS dans l’heure suivant le radiomarquage et les étapes de lavage (4.3.3-4.3.7) pour évaluer la viabilité cellulaire des cellules radiomarquées.
- Pour effectuer l’essai, ajouter 10,0 μL de solution de bleu de trypan à 0,4 % à la suspension cellulaire de 10,0 μL de cellules radiomarquées et non marquées et les mélanger en pipetant la suspension de cellules bleues de trypan de haut en bas avec une micropipette réglée à 10,0 μL.
- Chargez un hémacytomètre avec ~10,0 μL du mélange de suspension trypan de globules bleus, comptez immédiatement le nombre de cellules colorées en bleu et le nombre total de cellules dans l’hémacytomètre sous un microscope à faible grossissement ou à l’aide d’un compteur de cellules automatisé. Calculez le pourcentage de cellules viables à l’aide de l’équation (5).
Pourcentage de cellules viables = 100 - [(Nombre de cellules colorées en bleu) / (Nombre total de cellules)] × 100 (5)
- Utilisez les cellules radiomarquées s’il n’y a pas de changement dans le pourcentage de cellules viables dans la suspension cellulaire radiomarquée par rapport à la contrepartie non marquée. Jeter les cellules radiomarquées si le pourcentage de cellules viables est inférieur à celui de leurs homologues non marqués.
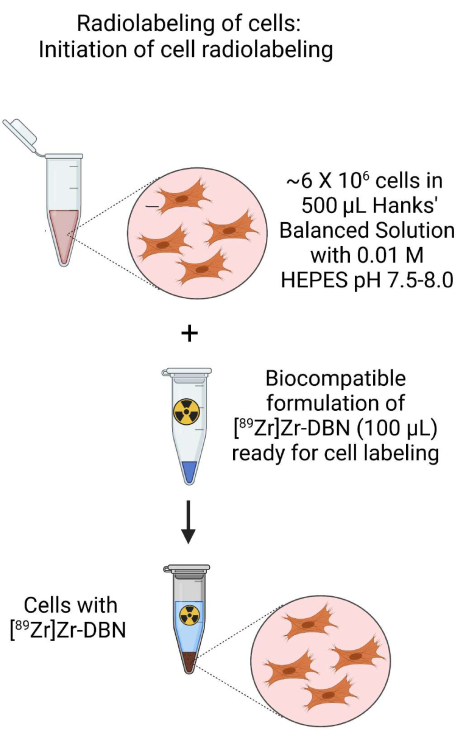
Figure 3 : Schéma de l’initiation du radiomarquage cellulaire. Initier le radiomarquage des cellules par l’ajout de la formule biocompatible [89Zr]Zr-DBN à la suspension cellulaire préparée dans une solution saline équilibrée de Hanks tamponnée HEPES. Veuillez cliquer ici pour voir une version agrandie de cette figure.
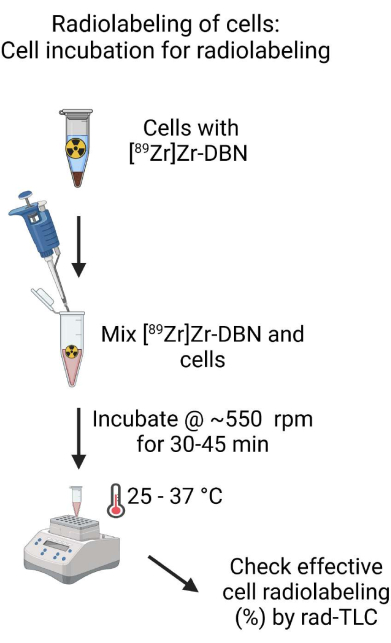
Figure 4 : Schéma de l’incubation cellulaire pour le radiomarquage. Mélangez soigneusement le [89Zr]Zr-DBN formulé de manière biocompatible avec la suspension cellulaire et incubez la suspension cellulaire dans un bloc chauffant à température contrôlée sur un agitateur pendant 30 à 60 minutes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
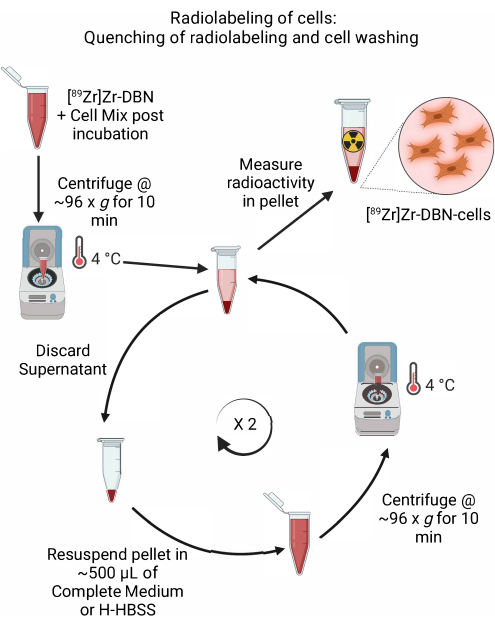
Figure 5 : Schéma de l’extinction du radiomarquage et du lavage des cellules. Tremper le radiomarquage des cellules par l’ajout d’un milieu cellulaire réfrigéré ou H-HBSS, suivi d’une centrifugation à 4 °C. Pour le lavage cellulaire, jeter le surnageant et remettre en suspension la pastille cellulaire dans ~500 μL de milieu cellulaire réfrigéré ou H-HBSS. Répétez le cycle d’élimination du surnageant et de remise en suspension de la pastille cellulaire dans un milieu frais pour éliminer tout synthon de radiomarquage non lié. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les résultats représentatifs présentés dans ce manuscrit ont été compilés à partir des études précédentes de synthèse [89Zr]Zr-DBN et de radiomarquage cellulaire 18,19,22,23,24,25. En bref, le 89Zr peut être complexé avec succès avec le DFO-Bn-NCS en ~30 à 60 min à 25-37 °C en utilisant...
Access restricted. Please log in or start a trial to view this content.
Discussion
Voici les étapes critiques du protocole qui doivent être optimisées pour un radiomarquage cellulaire efficace. Aux étapes 1.2 et 1.3 du protocole, en fonction du volume de [89 Zr]Zr(HPO 4)2 ou [89Zr]ZrCl4 utilisé, un volume approprié (microlitres) de base doit être utilisé ; La solution de CO 3 1,0 MK2 doit être utilisée pour la neutralisation de la solution de [89 Zr]Zr(HPO 4)2 et la solution de 1,0 M Na2 CO
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêt financier concurrent mais sont les inventeurs de cette technologie (Brevet # US20210330823A1).
Remerciements
Ce travail a été soutenu par les subventions NIH 5R21HL127389-02, NIH 4T32HL007111-39, NIH R01HL134664 et DOE DE-SC0008947, Agence internationale de l’énergie atomique, Vienne, Mayo Clinic Division of Nuclear Medicine, Département de radiologie, et Mayo Clinic Center for Regenerative Medicine, Rochester, MN. Toutes les figures ont été créées à l’aide de BioRender.com.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A996-4 | |
| Alpha Minimum Essential Medium | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 12571063 | |
| Anion exchange column | Macherey-Nagel, Inc., Düren, Germany | 731876 | Chromafix 30-PS-HCO3 SPE 45 mg cartridge |
| Conical centrifuge tubes (15 mL) | Corning Inc., Glendale, AZ, USA | 352096 | Falcon 15 mL high-clarity polypropylene (PP) conical centrifuge tubes |
| Dendritic cells | The American Type Culture Collection, Manassas, VA, USA | CRL-11904 | |
| DFO-Bn-NCS | Macrocyclics, Inc., Plano, TX, USA | B-705 | p-SCN-Bn-Deferoxamine |
| DMSO | Sigma-Aldrich, Inc., St. Louis, MO | 276855 | |
| Dose calibrator | Mirion Technologies (Capintec), Inc., Florham Park, NJ, USA | 5130-3234 | CRC -55tR Dose Calibrator |
| Dulbecco’s modified Eagle’s medium | The American Type Culture Collection, Manassas, VA, USA | 30-2002 | |
| Fetal Bovine Serum (FBS) | The American Type Culture Collection, Manassas, VA, USA | 30-2020 | |
| Hanks Balanced Salt solution (HBSS) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 14025092 | For preparation of H-HBSS |
| Hydrochloric Acid (trace metal basis grade) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A508P212 | |
| Melanoma cells | The American Type Culture Collection, Manassas, VA, USA | CRL-6475 | |
| Methanol | Sigma-Aldrich, Inc., St. Louis, MO | 34860 | |
| Microcentrifuge tube | Eppendorf, Hamburg, Germany | 30108442 | Protein LoBind microcentrifuge tube |
| Murine GM-CSF | R&D Systems, Inc., Minneapolis, MN USA | 415-ML-010 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 15140-122 | |
| Phosphate Buffered Saline without Ca2+ and Mg2+ | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 10010023 | For washing cells |
| Saline | Covidien LLC, Mansfield, MA, USA | 1020 | 0.9% Sterile Saline Solution |
| Shaker | Eppendorf, Hamburg, Germany | T1317 | Thermomixer |
| Silica gel-rad-TLC paper sheet | Agilent Technologies Inc., Santa Clara, CA, USA | SGI0001 | iTLC-SG |
Références
- Bhawnani, N., et al. Effectiveness of stem cell therapies in improving clinical outcomes in patients with heart failure. Cureus. 13 (8), e17236(2021).
- Zakrzewski, W., Dobrzynski, M., Szymonowicz, M., Rybak, Z. Stem cells: past, present, and future. Stem Cell Research & Therapy. 10 (1), 68(2019).
- Bukhari, A. B., Dutta, S., De, A. Image guidance in stem cell therapeutics: unfolding the blindfold. Current Drug Targets. 16 (6), 658-671 (2015).
- Momeni, A., Neelamegham, S., Parashurama, N. Current challenges for the targeted delivery and molecular imaging of stem cells in animal models. Bioengineered. 8 (4), 316-324 (2017).
- Gnecchi, M., Zhang, Z., Ni, A., Dzau, V. J. Paracrine mechanisms in adult stem cell signaling and therapy. Circulation Research. 103 (11), 1204-1219 (2008).
- D'Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282(2018).
- Zhang, Q., et al. CAR-T cell therapy in cancer: tribulations and road ahead. Journal of Immunology Research. 2020, 1924379(2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69(2021).
- Shao, F., et al. Radionuclide-based molecular imaging allows CAR-T cellular visualization and therapeutic monitoring. Theranostics. 11 (14), 6800-6817 (2021).
- Sakemura, R., Can, I., Siegler, E. L., Kenderian, S. S. In vivo CART cell imaging: Paving the way for success in CART cell therapy. Molecular Therapy Oncolytics. 20, 625-633 (2021).
- Wang, Y., et al. Dendritic cell biology and its role in tumor immunotherapy. Journal of Hematology & Oncology. 13 (1), 107(2020).
- Bulte, J. W. M., Shakeri-Zadeh, A. In vivo MRI tracking of tumor vaccination and antigen presentation by dendritic cells. Molecular Imaging and Biology. 24 (2), 198-207 (2022).
- Holland, J. P., Sheh, Y., Lewis, J. S. Standardized methods for the production of high specific-activity zirconium-89. Nuclear Medicine and Biology. 36 (7), 729-739 (2009).
- Larenkov, A., et al. Preparation of zirconium-89 solutions for radiopharmaceutical purposes: interrelation between formulation, radiochemical purity, stability and biodistribution. Molecules. 24 (8), 1534(2019).
- Pandey, M. K., et al. A new solid target design for the production of 89Zr and radiosynthesis of high molar activity [89Zr]Zr-DBN. American Journal of Nuclear Medicine and Molecular Imaging. 12 (1), 15-24 (2022).
- Pandey, M. K., et al. Improved production and processing of 89Zr using a solution target. Nuclear Medicine and Biology. 43 (1), 97-100 (2016).
- Pandey, M. K., Engelbrecht, H. P., Byrne, J. P., Packard, A. B., DeGrado, T. R. Production of 89Zr via the 89Y(p,n)89Zr reaction in aqueous solution: effect of solution composition on in-target chemistry. Nuclear Medicine and Biology. 41 (4), 309-316 (2014).
- Bansal, A., et al. Novel 89Zr cell labeling approach for PET-based cell trafficking studies. EJNMMI Research. 5, 19(2015).
- Bansal, A., et al. 89Zr]Zr-DBN labeled cardiopoietic stem cells proficient for heart failure. Nuclear Medicine and Biology. 90-91, 23-30 (2020).
- Friberger, I., et al. Optimisation of the synthesis and cell labelling conditions for [89Zr]Zr-oxine and [89Zr]Zr-DFO-NCS: a direct in vitro comparison in cell types with distinct therapeutic applications. Molecular Imaging and Biology. 23 (6), 952-962 (2021).
- Lee, S. H., et al. Feasibility of real-time in vivo 89Zr-DFO-labeled CAR T-cell trafficking using PET imaging. PLoS One. 15 (1), e0223814(2020).
- Nicolas, C. T., et al. Hepatocyte spheroids as an alternative to single cells for transplantation after ex vivo gene therapy in mice and pig models. Surgery. 164 (3), 473-481 (2018).
- Yang, B., et al. Tracking and therapeutic value of human adipose tissue-derived mesenchymal stem cell transplantation in reducing venous neointimal hyperplasia associated with arteriovenous fistula. Radiology. 279 (2), 513-522 (2016).
- Nicolas, C. T., et al. Ex vivo cell therapy by ectopic hepatocyte transplantation treats the porcine tyrosinemia model of acute liver failure. Molecular Therapy. Methods & Clinical Development. 18, 738-750 (2020).
- Bansal, A., Sharma, S., Klasen, B., Rosch, F., Pandey, M. K. Evaluation of different 89Zr-labeled synthons for direct labeling and tracking of white blood cells and stem cells in healthy athymic mice. Scientific Reports. 12 (1), 15646(2022).
- Behfar, A., et al. Guided cardiopoiesis enhances therapeutic benefit of bone marrow human mesenchymal stem cells in chronic myocardial infarction. Journal of the American College of Cardiology. 56 (9), 721-734 (2010).
- Charoenphun, P., et al. 89Zr]oxinate4 for long-term in vivo cell tracking by positron emission tomography. European Journal of Nuclear Medicine and Molecular Imaging. 42 (2), 278-287 (2015).
- Sato, N., et al. In vivo tracking of adoptively transferred natural killer cells in rhesus macaques using 89zirconium-oxine cell labeling and PET imaging. Clinical Cancer Research. 26 (11), 2573-2581 (2020).
- Volpe, A., Pillarsetty, N. V. K., Lewis, J. S., Ponomarev, V. Applications of nuclear-based imaging in gene and cell therapy: probe considerations. Molecular Therapy Oncolytics. 20, 447-458 (2021).
- Fogli, L. K., et al. Challenges and next steps in the advancement of immunotherapy: summary of the 2018 and 2020 National Cancer Institute workshops on cell-based immunotherapy for solid tumors. Journal for Immunotherapy of Cancer. 9 (7), e003048(2021).
- Li, X., Hacker, M. Molecular imaging in stem cell-based therapies of cardiac diseases. Advanced Drug Delivery Reviews. 120, 71-88 (2017).
- Puges, M., et al. Retrospective study comparing WBC scan and 18F-FDG PET/CT in patients with suspected prosthetic vascular graft infection. European Journal of Vascular and Endovascular Surgery. 57 (6), 876-884 (2019).
- Butterfield, L. H. Dendritic cells in cancer immunotherapy clinical trials: are we making progress. Frontiers in Immunology. 4, 454(2013).
- de Vries, I. J. M., et al. Magnetic resonance tracking of dendritic cells in melanoma patients for monitoring of cellular therapy. Nature Biotechnology. 23 (11), 1407-1413 (2005).
- Gosmann, D., et al. Promise and challenges of clinical non-invasive T-cell tracking in the era of cancer immunotherapy. EJNMMI Research. 12 (1), 5(2022).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon