Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Позитронно-эмиссионная томография клеточного транспорта: метод радиомечения клеток
В этой статье
Резюме
Здесь представлен протокол радиоактивного мечения клеток радиоизотопом позитронно-эмиссионной томографии (ПЭТ) 89 Zr (t1/2 78,4 ч) с использованием готового к использованию синтона радиомечения, [89 Zr]Zr-p-изотиоцианатобензил-десферриоксамин ([89Zr]Zr-DBN). Радиоактивное мечение клеток с помощью [89Zr]Zr-DBN позволяет неинвазивно отслеживать и визуализировать введенные радиоактивно меченные клетки в организме с помощью ПЭТ в течение 7 дней после введения.
Аннотация
Т-клеточная терапия стволовыми клетками и химерными антигенными рецепторами (CAR) становится перспективной терапией для регенерации органов и иммунотерапии различных видов рака. Несмотря на значительный прогресс, достигнутый в этих областях, еще многое предстоит узнать, чтобы лучше понять фармакокинетику и фармакодинамику вводимых терапевтических клеток в живой системе. Для неинвазивного отслеживания клеток in vivo с помощью позитронно-эмиссионной томографии (ПЭТ) был разработан новый [89 Zr]Zr-p-изотиоцианатобензил-десферриоксамин ([89 Zr]Zr-DBN)-опосредованный метод радиомечения клеток с использованием 89Zr (t1/2 78,4 ч). В настоящем протоколе описан [89Zr]Zr-DBN-опосредованный, готовый к использованию, радиомечущий синтон для прямого радиоактивного мечения различных клеток, включая мезенхимальные стволовые клетки, кардиопоэтические стволовые клетки, управляемые линией, регенерирующие гепатоциты печени, лейкоциты, клетки меланомы и дендритные клетки. Разработанная методика позволяет проводить неинвазивную ПЭТ-визуализацию клеточного транспорта в течение 7 дней после введения, не влияя на природу или функцию радиоактивно меченных клеток. Кроме того, в этом протоколе описывается поэтапный метод радиосинтеза [89 Zr]Zr-DBN, биосовместимая формулировка [89 Zr]Zr-DBN, подготовка клеток к радиоактивному мечению и, наконец, радиомечение клеток с помощью [89Zr]Zr-DBN, включая все сложные детали, необходимые для успешного радиомечения клеток.
Введение
Т-клеточная терапия стволовыми клетками и химерными антигенными рецепторами (CAR) набирает популярность и активно исследуется для лечения различных заболеваний, таких как недостаточность миокарда1,2, дегенерация сетчатки 2, дегенерация желтого пятна 2, диабет 2, инфаркт миокарда 3,4,5 и рак 6,7,8,9,10. Среди двух вероятных подходов терапии стволовыми клетками стволовые клетки могут быть либо непосредственно приживлены к очагу заболевания, чтобы вызвать терапевтический ответ, либо вызвать изменения в микроокружении очага заболевания без прилипания к очагу заболевания, чтобы инициировать непрямой терапевтический ответ. Непрямой терапевтический ответ может вызвать изменения в микроокружении очага заболевания путем высвобождения факторов, которые могут восстанавливать или лечить заболевание5. Эти подходы к лечению стволовыми клетками могут быть оценены с помощью неинвазивной визуализации радиомеченных стволовых клеток. Неинвазивная визуализация может соотнести поглощение радиоактивно меченных клеток в очаге заболевания с терапевтическим ответом, чтобы расшифровать прямой и непрямой терапевтический ответ.
Кроме того, для лечения различных видов рака разрабатывается терапия на основе иммунных клеток с использованием CAR-T-клеток 6,7,8,9,10 и иммунотерапии дендритными клетками 11,12. Механистически при CAR-Т-клеточной иммунотерапии 6,7,8,9,10 Т-клетки сконструированы таким образом, чтобы экспрессировать эпитоп, который связывается со специфическим антигеном на опухолях, которые необходимо лечить. Эти сконструированные CAR-Т-клетки при введении связываются со специфическим антигеном, присутствующим в опухолевых клетках, посредством взаимодействия эпитоп-антиген. После связывания связанные CAR-Т-клетки подвергаются активации, а затем пролиферируют и высвобождают цитокины, которые сигнализируют иммунной системе хозяина атаковать опухоль, экспрессирующую специфический антиген. В отличие от этого, в случае терапии дендритными клетками11,12 дендритные клетки сконструированы таким образом, чтобы представлять на своей поверхности специфический раковый антиген. Эти сконструированные дендритные клетки при введении оседают в лимфатических узлах и связываются с Т-клетками в лимфатических узлах. Т-клетки, связываясь со специфическими раковыми антигенами на введенных дендритных клетках, подвергаются активации/пролиферации и инициируют иммунный ответ хозяина против опухоли, экспрессирующей этот специфический антиген. Таким образом, оценка транспорта введенных CAR-Т-клеток к опухолевому очагу9,10 и хоминг дендритных клеток к лимфатическим узлам11,12 возможна с помощью визуализации радиоактивно меченных CAR T-клеток и дендритных клеток для определения эффективности иммунотерапии. Кроме того, неинвазивный транспорт клеток может помочь лучше понять терапевтический потенциал, прояснить прямой и непрямой терапевтический ответ, а также прогнозировать и контролировать терапевтический ответ как на терапию стволовыми клетками, так и на основе иммунных клеток.
Были изучены различные методы визуализации для транспортировки клеток 3,4,9,10,12, включая оптическую визуализацию, магнитно-резонансную томографию (МРТ), однофотонную эмиссионную компьютерную томографию (ОФЭКТ) и позитронно-эмиссионную томографию (ПЭТ). Каждая из этих методик имеет свои преимущества и недостатки. Среди них ПЭТ является наиболее перспективным методом благодаря своей количественной природе и высокой чувствительности, которые необходимы для надежного количественного определения клеток при транспортировке клеток на основе визуализации 3,4,9,10.
Позитронно-излучающий радиоизотоп 89Zr с периодом полураспада 78,4 ч пригоден для мечения клеток. Он позволяет проводить ПЭТ-визуализацию клеток в течение более 1 недели и легко производится с помощью широко доступных низкоэнергетических медицинских циклотронов 13,14,15,16,17. Кроме того, коммерчески доступен соответствующим образом функционализированный хелатор-изотиоцианатобензилдесфериоксамина (DFO-Bn-NCS) для синтеза 89-Zr-меченного, готового к использованию синтона, мечущего клетки, [89 Zr]Zr-p-изотиоцианатобензил-деферриоксамин, также известного как [89Zr]Zr-DBN 18,19,20,21,22,23,24 ,25. Принцип [89 Zr]Zr-DBN-опосредованного мечения клеток основан на реакции между первичными аминами белков клеточной мембраны и изотиоцианатным (NCS) фрагментом [89Zr]Zr-DBN с образованием стабильной ковалентной тиомочевинной связи.
[89зр] Для отслеживания различных клеток, включая стволовые клетки 18,23,25, дендритные клетки18, кардиопоэтические стволовые клетки19, децидуальные стромальные клетки 20, макрофаги костного мозга 20, мононуклеарные клетки периферической крови 20, Т-клетки21, гепатоциты22,24 и лейкоциты 25. В следующем протоколе представлены пошаговые методы подготовки и радиоактивного мечения клеток с помощью [89Zr]Zr-DBN и описаны изменения, которые могут потребоваться в протоколе радиомечения для конкретного типа клеток. Для большей наглядности представленный здесь метод радиомечения клеток разделен на четыре раздела. Первый раздел посвящен получению [89 Zr]Zr-DBN путем хелатирования 89Zr с DFO-Bn-NCS. Во втором разделе описывается приготовление биосовместимой формулы [89Zr]Zr-DBN, которая может быть легко использована для мечения клеток радиотерапией. В третьем разделе описываются этапы, необходимые для предварительной подготовки клеток к радиоактивному мечению. Предварительное кондиционирование клеток включает в себя промывание клеток безбелковым фосфатно-солевым буфером (PBS) и сбалансированным солевым раствором HEPES (H-HBSS) для удаления внешних белков, которые могут мешать или конкурировать с реакцией [89Zr]Zr-DBN с первичными аминами, присутствующими на белках клеточной поверхности во время радиоактивного мечения. В заключительном разделе описаны этапы, связанные с фактическим радиоактивным мечением клеток и анализом контроля качества.
протокол
Дендритные клетки и клетки меланомы были получены коммерчески18. Гепатоциты выделяли из печени свиней после лапароскопической частичной гепатэктомии22,24. Стволовые клетки выделяли из аспиратов костного мозга18,19,26. Стволовые клетки, полученные из жировой ткани, были получены из Лаборатории клеточной терапии человека, клиника Майо, Рочестер23. Лейкоциты человека были выделены из собранной крови, полученной из отделения трансфузионной медицины, клиники Майо Рочестер25. Различные клетки, используемые для радиоактивного мечения, были получены и использованы в соответствии с рекомендациями, рекомендованными Комитетом по уходу за животными и их использованием, Подкомитетом по надзору за исследованиями стволовых клеток клиники Майо, Комитетом по исследованиям в области трансфузионной медицины, Институциональным комитетом по биобезопасности и Комитетом по радиационной безопасности.
1. Получение [ 89 Zr ]Zr-p-изотиоцианатобензилдесферриоксамин ([ 89Zr ]Zr-DBN)
Хронометраж: ~160-220 мин
ПРИМЕЧАНИЕ: Для получения [89 Zr]Zr-DBN изолируйте 89 Zr в форме [89 Zr]Zr-гидрофосфата ([89 Zr]Zr(HPO 4)2) или [89 Zr]Zr-хлорида ([89Zr]ZrCl4), как указано на этапе 1.1.
- Изолируют 89 Zr от родительского 89Y, используя установленный метод очистки на основе гидроксаматной смолы13,17. Вкратце, сначала приготовьте колонку с ~100 мг гидроксаматной смолы, затем активируйте гидроксаматную смолу, промыв колонку 8,0 мл чистого безводного ацетонитрила, а затем промыв 5,0-6,0 мл воздуха. Затем промывают колонку 15 мл деионизированной воды, после чего проводят еще одну промывку 5,0-6,0 мл воздуха, а затем 2,0 мл 0,50 N HCl (следы металлов на основе) с последующей дополнительной промывкой 5,0-6,0 мл воздуха. Затем медленно загружают раствор, содержащий 89Zr и 89 Y, в гидроксаматную смолу и промывают несвязанный 89Y от гидроксаматной смолы 20 мл 2,0 N HCl, затем 10 мл деионизированной воды и промывают 5,0-6,0 мл воздуха.
ПРИМЕЧАНИЕ: После промывки воздухом элюирование 89Zr можно выполнить, как показано ниже.- Для элюирования 89 Zr в форме [89 Zr]Zr(HPO 4)2 сначала добавьте 0,50 мл буфера 1,2 M K 2 HPO 4/KH 2 PO 4 (pH 3,5) в колонку изшага 1.1 и дайте ей постоять на колонке в течение 30 мин, чтобы способствовать высвобождению 89 Zr в виде [89Zr]Zr(HPO 4)2 из смолы. Затем элюируют 89Zr из колонки с дополнительными 1,50 мл буфера 1,2 M K 2 HPO 4/KH2PO4 (pH 3,5). После элюирования [89 Zr]Zr(HPO 4)2 выполните шаги 1.2, 1.2.1 и 1.2.2 для получения [89 Zr]Zr-DBN с использованием [89Zr]Zr(HPO4)2, как показано на рисунке 1.
- Для получения 89 Zr в виде [89 Zr]ZrCl4 сначала элюируют 89 Zr в виде [89Zr]Zr-оксалата.
- Для элюирования 89 Zr в форме [89 Zr]Zr-оксалата добавьте 0,50 мл 1,0 M щавелевой кислоты в колонку из шага 1.1 и дайте ей постоять на колонке в течение 1 мин, чтобы способствовать высвобождению 89 Zr в виде [89Zr]-оксалата из смолы. Затем элюируют 89Zr из колонки с дополнительными 2,50 мл 1,0 М щавелевой кислоты (всего 3,0 мл)17.
- Для превращения [89 Zr]Zr-оксалата в [89Zr]ZrCl4 с помощью анионообменной колонки, как описано Larenkov et al.14, сначала активируют колонку промывкой 6,0 мл ацетонитрила, а затем промывают 5,0-6,0 мл воздуха. Затем промойте колонку 10,0 мл физиологического раствора, после чего еще раз промойте 5,0-6,0 мл воздуха. Наконец, пропустите 10,0 мл деионизированной воды, а затем промойте 5,0-6,0 мл воздуха.
- Медленно загружают 3,0 мл раствора, содержащего [89Zr]Zr-оксалат, на активированную анионообменную колонку, после чего продувают 5,0-6,0 мл воздуха. Затем промывают колонку, загруженную 89Zr, 50,0 мл деионизированной воды для удаления несвязанного оксалат-иона, после чего промывают 5,0-6,0 мл воздуха.
- Для элюирования 89 Zr в форме [89 Zr]ZrCl 4 добавьте 0,10 мл 1,0 N HCl в колонку, дайте ей постоять на колонке в течение 1,0 мин, чтобы способствовать высвобождению 89 Zr в виде [89 Zr]ZrCl4 из смолы, и элюируйте 89Zr из колонки с дополнительными 0,40 мл 1,0 N HCl (всего 0,5 мл). Элюированный [89Zr]ZrCl4 высушить в V-образном флаконе, поместив его в нагревательный блок при 65 °C под постоянным потоком газообразного азота в течение 10-30 мин. После высыхания восстановите высушенный [89 Zr]ZrCl 4 в воде и выполните шаги 1.3 и 1.3.1 для приготовления [89 Zr]Zr-DBN с использованием [89Zr]ZrCl4, как показано на рисунке 1.
- Возьмите ~120 мкл [89Zr]Zr(HPO 4)2, разработанного в 1,2 M K 2 HPO 4/KH 2 PO 4 (pH 3,5) (10-25 MBq) из стадии 1.1.1, и нейтрализуйте раствор для достижения pH 7,5-8,0 с ~100 мкл 1,0 M HEPES-KOH (pH 7,5) и ~65 мкл 1,0 M K2CO3.
- Для получения соответствующего количества DFO-Bn-NCS для стадий 1.2.2 или 1.3.1 для различных рецептур 89 Zr с различной кажущейся удельной активностью 89 Zr проводят набор хелатных реакций с использованием фиксированного объема нейтрализованной рецептуры [89 Zr]Zr(HPO 4)2 или [89Zr]ZrCl4 с диапазоном DFO-Bn-NCS (7,5-15 мкг). В случае [89Zr]Zr(HPO4)2 инкубируют реакцию хелатирования при 37 °C в шейкере при ~550 об/мин в течение 60 мин. Принимая во внимание, что в случае [89Zr]ZrCl4 реакцию хелатирования инкубируют при 25 °C в шейкере при ~550 об/мин в течение 30 мин. Откажитесь от хелатной реакции, которая выпадает в осадок во время или в конце инкубации. В конце инкубации проводят радиоактивную тонкослойную хроматографию (rad-TLC) с 100 мМ диэтилентриамина пентаацетатом (ДТПА), рН 7,0, в качестве подвижной фазы, чтобы оценить эффективность хелатирования DFO-Bn-NCS для каждой хелатной реакции, как описано ниже на шаге 1.5.
ПРИМЕЧАНИЕ: Исходя из эффективности хелатирования, используйте минимальное количество DFO-Bn-NCS на этапах 1.2.2 или 1.3.1, необходимое для достижения эффективности хелатирования ≥97%, не вызывая осаждения DFO-Bn-NCS в нейтрализованном составе [89 Zr]Zr(HPO 4)2 или [89Zr]ZrCl4. При этом синтезирован [89Zr]Zr-DBN с радиохимической чистотой ≥97%. - Приготовьте свежий 5,0 мМ DFO-Bn-NCS в безводном ДМСО (3,76 мг/мл) и добавьте 4,0 мкл 5,0 мМ DFO-Bn-NCS (20 нмоль или 15 мкг) к ~285 мкл нейтрализованного [89Zr]Zr(HPO4)2 (10-25 MBq) из стадии 1.2 и перемешайте раствор путем пипетирования. Конечную концентрацию ДМСО в хелатной смеси следует держать ниже 2% от общего объема.
- Для получения соответствующего количества DFO-Bn-NCS для стадий 1.2.2 или 1.3.1 для различных рецептур 89 Zr с различной кажущейся удельной активностью 89 Zr проводят набор хелатных реакций с использованием фиксированного объема нейтрализованной рецептуры [89 Zr]Zr(HPO 4)2 или [89Zr]ZrCl4 с диапазоном DFO-Bn-NCS (7,5-15 мкг). В случае [89Zr]Zr(HPO4)2 инкубируют реакцию хелатирования при 37 °C в шейкере при ~550 об/мин в течение 60 мин. Принимая во внимание, что в случае [89Zr]ZrCl4 реакцию хелатирования инкубируют при 25 °C в шейкере при ~550 об/мин в течение 30 мин. Откажитесь от хелатной реакции, которая выпадает в осадок во время или в конце инкубации. В конце инкубации проводят радиоактивную тонкослойную хроматографию (rad-TLC) с 100 мМ диэтилентриамина пентаацетатом (ДТПА), рН 7,0, в качестве подвижной фазы, чтобы оценить эффективность хелатирования DFO-Bn-NCS для каждой хелатной реакции, как описано ниже на шаге 1.5.
- Возьмите ~180 мкл [89Zr]ZrCl 4, разработанного в 0,1 N HCl (40-80 MBq) из стадии 1.1.2.4, и нейтрализуйте полученный раствор для достижения pH 7,5-8,0 с ~25 мкл 1,0 M Na2CO3.
- Приготовьте свежий 2,5 мМ DFO-Bn-NCS в безводном диметилсульфоксиде (ДМСО) (1,88 мг/мл) и добавьте 4,0 мкл 2,5 мМ DFO-Bn-NCS (10 нмоль или 7,5 мкг) к ~205 мкл нейтрализованного [89 Zr]ZrCl4 (40-80 MBq) из этапа 1.3. Перемешайте раствор пипетированием. Конечную концентрацию ДМСО в хелатной смеси следует держать ниже 2% от общего объема.
- Продолжайте хелатирование 89 Zr при 37 °C в шейкере при ~550 об/мин в течение 60 мин в случае [89 Zr]Zr(HPO 4)2 или при 25 °C в шейкере при ~550 об/мин в течение 30 мин в случае [89Zr]ZrCl4.
- Определяют эффективность хелатирования 89Zr с помощью rad-TLC с DTPA 100 мМ (pH 7,0) в качестве мобильного растворителя rad-TLC. Ожидается, что [89 Zr]Zr-DBN покажет R f ~0,021-0,035, [89 Zr]ZrCl 4 покажет R f ~1,0, а [89Zr]Zr(HPO4)2 покажет R f ~1,0. Рассчитайте эффективность хелатирования (%) по уравнению (1):
Процентное содержание 89 Zr, хелатированного к DFO-NCS с образованием [89 Zr]Zr-DBN = [ (Радиоактивность при R f [89 Zr]Zr - DBN) / (Сумма радиоактивностей при R f [89 Zr]Zr - DBN и при R f [89 Zr]Zr(HPO 4)2 или [89Zr]ZrCl4) ] × 100 (1)
ПРИМЕЧАНИЕ: Приемлемая эффективность хелатирования 89Zr для продолжения радиоактивного мечения клеток, определяемая с помощью rad-TLC, составляет ≥97%. Рекомендуемая радиохимическая чистота [89Zr]Zr-DBN ≥97% была установлена в соответствии со стандартными требованиями к радиохимической чистоте для других радиофармацевтических препаратов, используемых в полевых условиях. Репрезентативный rad-TLC см. на дополнительном рисунке S1 и дополнительном рисунке S2.

Рисунок 1: Схема получения [89Zr]Zr-DBN. Для получения [89 Zr]Zr-DBN нейтрализуют предварительно приготовленный [89 Zr]Zr(HPO 4)2 или [89Zr]ZrCl4 до рН 7,5-8,0. Инкубируют нейтрализованный раствор с ДФО-Бн-НКС. Проверьте эффективность хелатирования 89Zr к DFO-Bn-NCS с помощью rad-TLC. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Биосовместимая формула [ 89Zr ]Zr-DBN для клеточного радиомечения (рис. 2)
Хронометраж: ~35 мин
ПРИМЕЧАНИЕ: Учитывая время, необходимое для подготовки клеток на этапе 3, начните шаг 3 примерно за 20 минут до начала шага 2 для инкубации ~30 минут. Это позволяет начать радиомечение клеток на шаге 4 в течение ~5-10 минут после завершения шагов 2-3.2.2.
- Для состава [89 Zr]Zr-DBN, изготовленного из [89 Zr]ZrCl 4, добавьте 50,0 мкл совместимой с клеткой смеси, содержащей ~27,0 мкл 1,2 М К 2 HPO 4/KH2PO 4 (рН 3,5) + ~23,0 мкл 1,0 м буфера HEPES-KOH (PH 7,5) к 50,0 мкл [89 Zr]Zr-DBN. Инкубируйте смесь, совместимую с клетками [89Zr]Zr-DBN, в течение ~30 мин при комнатной температуре (25 °C).
ПРИМЕЧАНИЕ: Препарат [89 Zr]Zr-DBN, изготовленный из [89Zr]Zr(HPO4)2, является биосовместимым для радиомечения клеток и не требует шага 2.
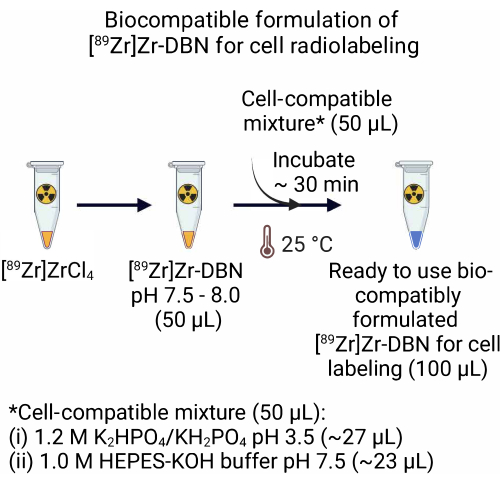
Рисунок 2: Приготовление биосовместимой формулы [89Zr]Zr-DBN для мечения клеточной радиометки. Для приготовления готовой к использованию биосовместимой формулы радиомеченого синтона добавьте равный объем совместимой с клеткой смеси, содержащей 1,2 М К 2 ГПО 4/КХ2РО4 (рН 3,5) + 1,0 М ГЕПЕС-КОУ до равного объема [89Zr]Zr-DBN. Инкубировать при 25 °C ~30 мин. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Подготовка клеток к радиоактивному мечению
Хронометраж: ~40-50 мин
- Трипсинизировать ~12 × 106 адгезивных клеток (стволовые клетки, клетки рака меланомы, кардиопоэтические стволовые клетки, дендритные клетки или гепатоциты) и центрифугировать клетки в конической центрифужной пробирке объемом 15,0 мл при ~96 × g в течение 10 мин при 4 °C.
- Выбросьте надосадочную жидкость, повторно суспендируйте клеточную гранулу в ~500 мкл PBS и перенесите клеточную суспензию в микроцентрифужную пробирку объемом 1,5 мл. Центрифугируют клетки в микроцентрифуге при температуре ~96 × g в течение 10 мин при 4 °C.
- Выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в ~500 мкл H-HBSS. Центрифугируют клетки в микроцентрифуге объемом 1,5 мл при температуре ~96 × г в течение 10 мин при 4 °C. Повторите шаг 3.1.2 еще раз и перейдите к шагу 4.1.1.
ПРИМЕЧАНИЕ: H-HBSS - это сбалансированный раствор соли Хэнкса с 0,01 М HEPES (pH 8,0).
- В случае неадгезивных клеток, таких как лейкоциты человека (свежевыделенные лейкоциты человека из крови), пропускают трипсинизацию и центрифугируют клеточную суспензию, содержащую ~12 × 106 клеток, в микроцентрифуге объемом 1,5 мл при ~96 × г в течение 10 мин при 4 °C.
- Выбросьте надосадочную жидкость, повторно суспендируйте клеточную гранулу в ~500 мкл PBS и центрифугируйте клетки в микроцентрифуге объемом 1,5 мл при ~96 × g в течение 10 мин при 4 °C.
- Выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в ~500 мкл H-HBSS. Центрифугируют клетки в микроцентрифуге объемом 1,5 мл при температуре ~96 × г в течение 10 мин при 4 °C. Повторите шаг 3.2.2 еще раз и перейдите к шагу 4.1.1.
4. Радиомечение клеток
Хронометраж: ~125-155 мин
- Начало радиоактивного мечения клеток (рис. 3)
- Используйте клеточную суспензию из этапа 3.1.2 или этапа 3.2.2 для приготовления клеточной суспензии ~500 мкл примерно с ~6 × 106 клеток в ~500 мкл H-HBSS при pH 7,5-8,0 в пробирке микроцентрифуги объемом 1,5 мл.
- К этому добавьте ~100 мкл биосовместимого [89Zr]Zr-DBN из шага 2.
- Клеточная инкубация для радиоактивного мечения (рис. 4)
- Смешайте биосовместимую формулу [89 Zr]Zr-DBN и клеточную суспензию, осторожно пипетируя вверх и вниз с помощью микропипетки, установленной на ~500 мкл. Измерьте количество радиоактивности в инкубационной пробирке с помощью калибратора дозы радиоактивности при настройке 489 для изотопа 89Zr16.
- Инкубируют клетки и смесь [89Zr]Zr-DBN в шейкере при ~550 об/мин при 25-37 °C в течение 30-45 мин для мечения клеток.
ПРИМЕЧАНИЕ: Температура инкубации будет варьироваться в зависимости от типа клеток, используемых для радиоактивного мечения, как показано в таблице 1. - После инкубации на стадии 4.2.2 проводят рад-ТСХ на клеточной реакции радиоактивного мечения с использованием свежеприготовленного растворителя рад-ТСХ (20 мМ цитрата натрия [рН 4,9-5,1]:метанол [1:1, V:V]). После прогона rad-TLC ищите [89 Zr]Zr-DBN и [89 Zr]ZrCl4 вокруг R f = ~0,73-0,81 и Rf = ~0,01-0,02 для радиоактивно меченных клеток. Рассчитайте процент радиоактивности при Rf = ~0,01-0,02 по уравнению (2).
Процент радиоактивности при R f = ~0,01-0,02 = [ (Радиоактивность при R f= ~0,01 - 0,02) / (Сумма радиоактивностей при R f = ~0,01 - 0,02 и R f= ~0,73 - 0,81) ] × 100 (2)
ПРИМЕЧАНИЕ: Чтобы понять пики, визуализированные при R f = ~0,01-0,02 и Rf = ~0,73-0,81, см. rad-TLC для реакции радиоактивного мечения лейкоцитов на дополнительном рисунке S3. - В отдельной пробирке для микроцентрифуги объемом 1,5 мл смешайте ~100 мкл биосовместимого [89Zr]Zr-DBN с ~500 мкл H-HBSS при pH 7,5-8,0 для использования в качестве бесклеточного контроля для коррекции фона на этапе 4.2.5. После инкубации при температуре и времени, аналогичных тем, которые использовались на этапе 4.2.2, проводят рад-ТСХ. После прогона rad-TLC ищите [89 Zr]Zr-DBN и [89 Zr]ZrCl4 в районе Rf = ~0,73-0,81. Рассчитайте процент радиоактивности при Rf = ~0,01-0,02 по уравнению (3).
Радиоактивность при R f = ~0,01-0,02 = [ (Радиоактивность при R f= ~0,01 - 0,02) / (Сумма радиоактивностей при R f= ~0,01 - 0,02 и R f= ~0,73 - 0,81) ] × 100 (3)
ПРИМЕЧАНИЕ: Чтобы понять пики, визуализируемые при Rf = ~0,01-0,02 и ~0,73-0,81, см. rad-TLC реакции бесклеточного контроля на дополнительном рисунке S4. - Рассчитайте эффективное радиоактивное мечение клеток (%) путем вычитания процента радиоактивности при R f = ~0,01-0,02 (из rad-TLC из шага 4.2.4) из процента радиоактивности при R f = ~0,01-0,02 (из rad-TLC из шага 4.2.3).
- Тушение радиоактивного мечения и промывка ячеек (рис. 5)
- После подтверждения завершения радиоактивного мечения с помощью rad-TLC на этапе 4.2.5 проводят гашение реакции радиоактивного мечения путем добавления ~600 мкл охлажденной, соответствующей клетке полной среды или путем добавления H-HBSS, как показано в таблице 1.
- Центрифугируют клетки в микроцентрифуге при температуре ~96 × g в течение 10 мин при 4 °C. Выбросьте надосадочную жидкость.
- Осторожно ресуспендируйте гранулированные клетки в ~500 мкл охлажденной среды (модифицированная орлиная среда (DMEM) Дульбекко + 10% фетальной бычьей сыворотки + 5% пенициллин/стрептомицин или Roswell Park Memorial Institute-1640 (RPMI-1640) + 10% фетальной бычьей сыворотки + 5% пенициллина/стрептомицина или H-HBSS для конкретного типа клеток, как показано в таблице 1. Выполните ресуспендирование клеточной гранулы, осторожно пипетируя вверх и вниз с помощью микропипетки, установленной на ~500 мкл.
- Центрифугируют клетки в микроцентрифуге при температуре ~96 × g в течение 10 мин при 4 °C.
- Повторите шаги 4.3.2-4.3.4 дважды, чтобы смыть несвязанную радиоактивность.
- Переложите гранулу в свежую микроцентрифужную пробирку объемом 1,5 мл с DMEM + 10% фетальной бычьей сыворотки + 5% пенициллина/стрептомицина в случае стволовых клеток или H-HBSS и измерьте радиоактивность в клеточной грануле с помощью калибратора дозы при настройке 489 для 89Zr-изотопа16.
- Рассчитайте окончательную эффективность радиомечения после всех промывок, используя уравнение (4).
Эффективность радиоактивного мечения = [(Радиоактивность в гранулах с поправкой на распад на этапе 4.3.6) / (Радиоактивность с поправкой на распад в гранулах и H-HBSS на этапе 4.2.1) ] × 100 (4) - Чтобы убедиться в качестве радиоактивно меченных клеток, сначала визуально осмотрите окончательную суспензию радиоактивно меченных клеток на наличие каких-либо скоплений. Если комков нет, переходите от этой окончательной подвески к следующему шагу. Если есть комки, но их можно повторно суспендировать пипеткой или легким встряхиванием, сделайте это и переходите к следующему этапу, так как он пройдет визуальный осмотр. Однако, если комки не были ресуспендированы ни пипетированием, ни легким встряхиванием, выбросьте суспензию и начните сначала.
- Если визуальный осмотр пройден, проводят тест на эксклюзионную жизнеспособность трипанового синего с использованием 0,4% раствора трипанового синего, приготовленного в PBS, в течение 1 ч после радиоактивного мечения и этапов промывки (4.3.3-4.3.7) для оценки жизнеспособности радиоактивно меченных клеток.
- Для проведения теста добавляют 10,0 мкл 0,4% раствора трипанового синего к 10,0 мкл клеточной суспензии как радиоактивно меченных, так и немеченых клеток и перемешивают их путем пипетирования суспензии трипановых синих клеток вверх и вниз с помощью микропипетки, установленной на 10,0 мкл.
- Загрузите в гемацитометр ~10,0 мкл трипановой суспензионной суспензии синих клеток, сразу подсчитают количество окрашенных синим цветом клеток и общее количество клеток в гемацитометре под микроскопом при малом увеличении или с помощью автоматизированного счетчика клеток. Рассчитайте процент жизнеспособных клеток, используя уравнение (5).
Процент жизнеспособных клеток = 100 - [(Количество клеток, окрашенных синим цветом) / (Общее количество клеток)] × 100 (5)
- Используйте радиоактивно меченные клетки, если процентное соотношение жизнеспособных клеток в радиоактивно меченной клеточной суспензии не изменилось по сравнению с немеченым аналогом. Отбракуйте радиоактивно меченные клетки, если процент жизнеспособных клеток меньше, чем у немеченых аналогов.
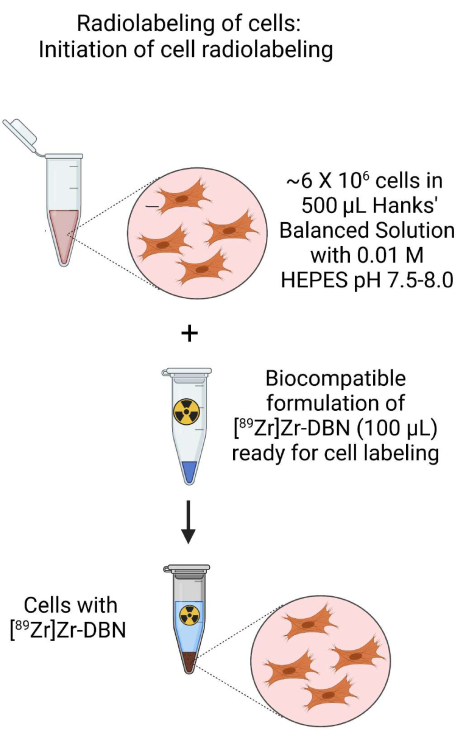
Рисунок 3: Схема инициирования радиоактивного мечения клеток. Инициируйте радиоактивное мечение клеток путем добавления биосовместимого [89Zr]Zr-DBN к клеточной суспензии, приготовленной в сбалансированном растворе соли HEPES с буфером Хэнкса. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
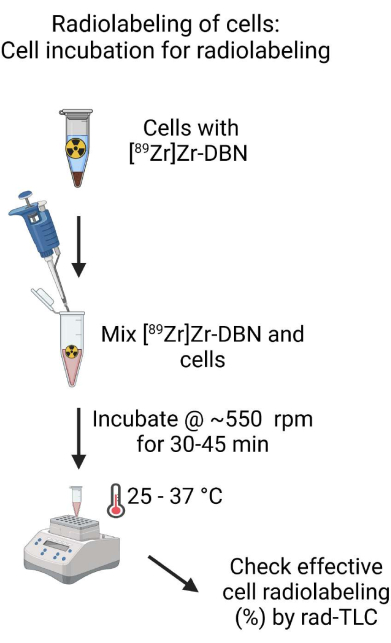
Рисунок 4: Схема клеточной инкубации для радиомечения. Тщательно перемешайте биосовместимую формулу [89Zr]Zr-DBN с клеточной суспензией и инкубируйте клеточную суспензию в нагревательном блоке с регулируемой температурой на шейкере в течение 30-60 минут. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
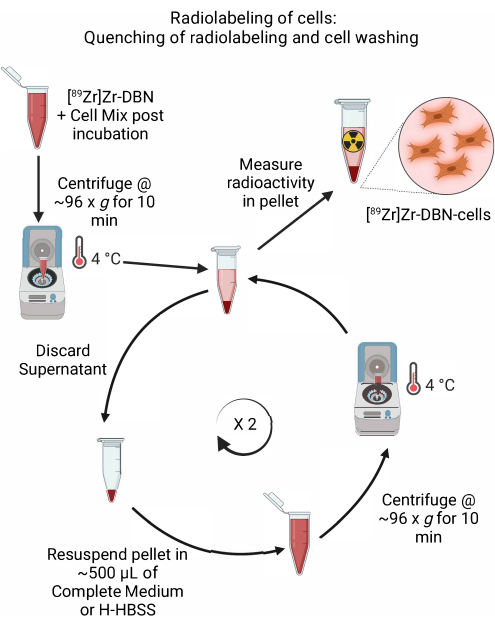
Рисунок 5: Схема тушения радиоактивного мечения и промывки клеток. Погасить радиоактивное мечение клеток путем добавления охлажденной клеточной среды или H-HBSS с последующим центрифугированием при 4 °C. Для промывки клеток выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в ~500 мкл охлажденной клеточной среды или H-HBSS. Повторите цикл выброса надосадочной жидкости и повторного суспендирования клеточной гранулы в свежей среде, чтобы удалить несвязанный синтон, мечущий радио. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
Репрезентативные результаты, представленные в этой рукописи, были собраны из предыдущих исследований [89Zr]Zr-DBN по синтезу и радиоактивному мечению клеток 18,19,22,23,24,25. Короче г...
Обсуждение
Ниже приведены важнейшие этапы протокола, которые необходимо оптимизировать для эффективного клеточного радиомечения. На этапах протокола 1.2 и 1.3, в зависимости от используемого объема [89 Zr]Zr(HPO 4)2 или [89Zr]ZrCl4, необходимо использовать соответствующий объем (микрол?...
Раскрытие информации
Авторы не имеют финансового конкурентного интереса, но являются изобретателями этой технологии (Патент # US20210330823A1).
Благодарности
Эта работа была поддержана грантами NIH 5R21HL127389-02, NIH 4T32HL007111-39, NIH R01HL134664 и DOE DE-SC0008947, Международным агентством по атомной энергии, Вена, Отделением ядерной медицины клиники Майо, отделением радиологии, и Центром регенеративной медицины клиники Майо, Рочестер, Миннесота. Все фигуры были созданы с использованием BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A996-4 | |
| Alpha Minimum Essential Medium | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 12571063 | |
| Anion exchange column | Macherey-Nagel, Inc., Düren, Germany | 731876 | Chromafix 30-PS-HCO3 SPE 45 mg cartridge |
| Conical centrifuge tubes (15 mL) | Corning Inc., Glendale, AZ, USA | 352096 | Falcon 15 mL high-clarity polypropylene (PP) conical centrifuge tubes |
| Dendritic cells | The American Type Culture Collection, Manassas, VA, USA | CRL-11904 | |
| DFO-Bn-NCS | Macrocyclics, Inc., Plano, TX, USA | B-705 | p-SCN-Bn-Deferoxamine |
| DMSO | Sigma-Aldrich, Inc., St. Louis, MO | 276855 | |
| Dose calibrator | Mirion Technologies (Capintec), Inc., Florham Park, NJ, USA | 5130-3234 | CRC -55tR Dose Calibrator |
| Dulbecco’s modified Eagle’s medium | The American Type Culture Collection, Manassas, VA, USA | 30-2002 | |
| Fetal Bovine Serum (FBS) | The American Type Culture Collection, Manassas, VA, USA | 30-2020 | |
| Hanks Balanced Salt solution (HBSS) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 14025092 | For preparation of H-HBSS |
| Hydrochloric Acid (trace metal basis grade) | Thermo Fisher Scientific, Inc., Waltham, MA, USA | A508P212 | |
| Melanoma cells | The American Type Culture Collection, Manassas, VA, USA | CRL-6475 | |
| Methanol | Sigma-Aldrich, Inc., St. Louis, MO | 34860 | |
| Microcentrifuge tube | Eppendorf, Hamburg, Germany | 30108442 | Protein LoBind microcentrifuge tube |
| Murine GM-CSF | R&D Systems, Inc., Minneapolis, MN USA | 415-ML-010 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 15140-122 | |
| Phosphate Buffered Saline without Ca2+ and Mg2+ | Thermo Fisher Scientific, Inc., Waltham, MA, USA | 10010023 | For washing cells |
| Saline | Covidien LLC, Mansfield, MA, USA | 1020 | 0.9% Sterile Saline Solution |
| Shaker | Eppendorf, Hamburg, Germany | T1317 | Thermomixer |
| Silica gel-rad-TLC paper sheet | Agilent Technologies Inc., Santa Clara, CA, USA | SGI0001 | iTLC-SG |
Ссылки
- Bhawnani, N., et al. Effectiveness of stem cell therapies in improving clinical outcomes in patients with heart failure. Cureus. 13 (8), e17236 (2021).
- Zakrzewski, W., Dobrzynski, M., Szymonowicz, M., Rybak, Z. Stem cells: past, present, and future. Stem Cell Research & Therapy. 10 (1), 68 (2019).
- Bukhari, A. B., Dutta, S., De, A. Image guidance in stem cell therapeutics: unfolding the blindfold. Current Drug Targets. 16 (6), 658-671 (2015).
- Momeni, A., Neelamegham, S., Parashurama, N. Current challenges for the targeted delivery and molecular imaging of stem cells in animal models. Bioengineered. 8 (4), 316-324 (2017).
- Gnecchi, M., Zhang, Z., Ni, A., Dzau, V. J. Paracrine mechanisms in adult stem cell signaling and therapy. Circulation Research. 103 (11), 1204-1219 (2008).
- D'Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282 (2018).
- Zhang, Q., et al. CAR-T cell therapy in cancer: tribulations and road ahead. Journal of Immunology Research. 2020, 1924379 (2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Shao, F., et al. Radionuclide-based molecular imaging allows CAR-T cellular visualization and therapeutic monitoring. Theranostics. 11 (14), 6800-6817 (2021).
- Sakemura, R., Can, I., Siegler, E. L., Kenderian, S. S. In vivo CART cell imaging: Paving the way for success in CART cell therapy. Molecular Therapy Oncolytics. 20, 625-633 (2021).
- Wang, Y., et al. Dendritic cell biology and its role in tumor immunotherapy. Journal of Hematology & Oncology. 13 (1), 107 (2020).
- Bulte, J. W. M., Shakeri-Zadeh, A. In vivo MRI tracking of tumor vaccination and antigen presentation by dendritic cells. Molecular Imaging and Biology. 24 (2), 198-207 (2022).
- Holland, J. P., Sheh, Y., Lewis, J. S. Standardized methods for the production of high specific-activity zirconium-89. Nuclear Medicine and Biology. 36 (7), 729-739 (2009).
- Larenkov, A., et al. Preparation of zirconium-89 solutions for radiopharmaceutical purposes: interrelation between formulation, radiochemical purity, stability and biodistribution. Molecules. 24 (8), 1534 (2019).
- Pandey, M. K., et al. A new solid target design for the production of 89Zr and radiosynthesis of high molar activity [89Zr]Zr-DBN. American Journal of Nuclear Medicine and Molecular Imaging. 12 (1), 15-24 (2022).
- Pandey, M. K., et al. Improved production and processing of 89Zr using a solution target. Nuclear Medicine and Biology. 43 (1), 97-100 (2016).
- Pandey, M. K., Engelbrecht, H. P., Byrne, J. P., Packard, A. B., DeGrado, T. R. Production of 89Zr via the 89Y(p,n)89Zr reaction in aqueous solution: effect of solution composition on in-target chemistry. Nuclear Medicine and Biology. 41 (4), 309-316 (2014).
- Bansal, A., et al. Novel 89Zr cell labeling approach for PET-based cell trafficking studies. EJNMMI Research. 5, 19 (2015).
- Bansal, A., et al. 89Zr]Zr-DBN labeled cardiopoietic stem cells proficient for heart failure. Nuclear Medicine and Biology. 90-91, 23-30 (2020).
- Friberger, I., et al. Optimisation of the synthesis and cell labelling conditions for [89Zr]Zr-oxine and [89Zr]Zr-DFO-NCS: a direct in vitro comparison in cell types with distinct therapeutic applications. Molecular Imaging and Biology. 23 (6), 952-962 (2021).
- Lee, S. H., et al. Feasibility of real-time in vivo 89Zr-DFO-labeled CAR T-cell trafficking using PET imaging. PLoS One. 15 (1), e0223814 (2020).
- Nicolas, C. T., et al. Hepatocyte spheroids as an alternative to single cells for transplantation after ex vivo gene therapy in mice and pig models. Surgery. 164 (3), 473-481 (2018).
- Yang, B., et al. Tracking and therapeutic value of human adipose tissue-derived mesenchymal stem cell transplantation in reducing venous neointimal hyperplasia associated with arteriovenous fistula. Radiology. 279 (2), 513-522 (2016).
- Nicolas, C. T., et al. Ex vivo cell therapy by ectopic hepatocyte transplantation treats the porcine tyrosinemia model of acute liver failure. Molecular Therapy. Methods & Clinical Development. 18, 738-750 (2020).
- Bansal, A., Sharma, S., Klasen, B., Rosch, F., Pandey, M. K. Evaluation of different 89Zr-labeled synthons for direct labeling and tracking of white blood cells and stem cells in healthy athymic mice. Scientific Reports. 12 (1), 15646 (2022).
- Behfar, A., et al. Guided cardiopoiesis enhances therapeutic benefit of bone marrow human mesenchymal stem cells in chronic myocardial infarction. Journal of the American College of Cardiology. 56 (9), 721-734 (2010).
- Charoenphun, P., et al. 89Zr]oxinate4 for long-term in vivo cell tracking by positron emission tomography. European Journal of Nuclear Medicine and Molecular Imaging. 42 (2), 278-287 (2015).
- Sato, N., et al. In vivo tracking of adoptively transferred natural killer cells in rhesus macaques using 89zirconium-oxine cell labeling and PET imaging. Clinical Cancer Research. 26 (11), 2573-2581 (2020).
- Volpe, A., Pillarsetty, N. V. K., Lewis, J. S., Ponomarev, V. Applications of nuclear-based imaging in gene and cell therapy: probe considerations. Molecular Therapy Oncolytics. 20, 447-458 (2021).
- Fogli, L. K., et al. Challenges and next steps in the advancement of immunotherapy: summary of the 2018 and 2020 National Cancer Institute workshops on cell-based immunotherapy for solid tumors. Journal for Immunotherapy of Cancer. 9 (7), e003048 (2021).
- Li, X., Hacker, M. Molecular imaging in stem cell-based therapies of cardiac diseases. Advanced Drug Delivery Reviews. 120, 71-88 (2017).
- Puges, M., et al. Retrospective study comparing WBC scan and 18F-FDG PET/CT in patients with suspected prosthetic vascular graft infection. European Journal of Vascular and Endovascular Surgery. 57 (6), 876-884 (2019).
- Butterfield, L. H. Dendritic cells in cancer immunotherapy clinical trials: are we making progress. Frontiers in Immunology. 4, 454 (2013).
- de Vries, I. J. M., et al. Magnetic resonance tracking of dendritic cells in melanoma patients for monitoring of cellular therapy. Nature Biotechnology. 23 (11), 1407-1413 (2005).
- Gosmann, D., et al. Promise and challenges of clinical non-invasive T-cell tracking in the era of cancer immunotherapy. EJNMMI Research. 12 (1), 5 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены