A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جمع وصيانة النمل القاطع للأوراق (عطا) على المدى الطويل في ظروف المختبر
In This Article
Summary
هنا ، يتم وصف بروتوكول لجمع والحفاظ بنجاح على مستعمرات النمل عطا (غشائيات الأجنحة: Formicidae) صحية في ظروف المختبر. بالإضافة إلى ذلك ، يتم تفصيل أنواع وتكوينات العش المختلفة جنبا إلى جنب مع الإجراءات التجريبية الممكنة.
Abstract
النمل هي واحدة من أكثر مجموعات الحيوانات تنوعا بيولوجيا على هذا الكوكب وتعيش في بيئات مختلفة. إن الحفاظ على مستعمرات النمل في البيئات الخاضعة للرقابة يتيح فهما غنيا لبيولوجيتها التي يمكن أن تسهم في البحوث التطبيقية. عادة ما تستخدم هذه الممارسة في دراسات التحكم في أعداد الأنواع التي تسبب خسارة اقتصادية ، مثل نمل عطا . لزراعة الفطريات المتبادلة ، يقوم النمل القاطع للأوراق بجمع الأوراق ولهذا تعتبر آفات زراعية موزعة على نطاق واسع في جميع أنحاء القارة الأمريكية. إنهم منظمون اجتماعيا للغاية ويسكنون أعشاشا تحت الأرض مكونة من مجموعة متنوعة من الغرف. تعتمد صيانتها في بيئة خاضعة للرقابة على روتين يومي من العديد من الإجراءات والرعاية المتكررة الموضحة هنا. يبدأ بجمع الملكات خلال موسم الإنجاب (أي رحلة الزواج) ، والتي يتم نقلها بعد ذلك بشكل فردي إلى حاويات بلاستيكية. نظرا لارتفاع معدل وفيات الملكات ، يمكن إجراء مجموعة ثانية بعد حوالي 6 أشهر من رحلة الزواج ، عندما يتم حفر الأعشاش الأولية مع الفطريات المتقدمة ، وانتقائها يدويا ، ووضعها في حاويات بلاستيكية. في المختبر ، يتم توفير الأوراق يوميا للمستعمرات المنشأة ، ويتم إزالة النفايات المنتجة من النمل أسبوعيا مع المواد النباتية الجافة المتبقية. مع استمرار نمو حديقة الفطريات ، يتم نقل المستعمرات إلى أنواع مختلفة من الحاويات وفقا للغرض التجريبي. يتم وضع مستعمرات النمل القاطعة للأوراق في حاويات مترابطة ، تمثل النظام التنظيمي مع غرف وظيفية بناها تلك الحشرات في الطبيعة. يعد هذا الإعداد مثاليا لمراقبة عوامل مثل كمية النفايات وصحة حديقة الفطريات وسلوك العمال والملكة. يعتبر جمع البيانات الميسر والملاحظات الأكثر تفصيلا أكبر ميزة للحفاظ على مستعمرات النمل في ظروف خاضعة للرقابة.
Introduction
يشكل النمل مجموعة متنوعة من الأفراد الذين يمارسون تأثيرا على معظم البيئات الأرضية1. وهي تعمل كمشتتات فعالة2،3،4 ، والحيوانات المفترسة5 ومهندسي النظام البيئي6،7،8،9،10 ، مما يسلط الضوء على أهميتها ونجاحها البيئي على النظم الإيكولوجية الطبيعية. تصنف جميع أنواع النمل على أنها حشرات اجتماعية. ومع ذلك ، فإن تنظيمهم الاجتماعي يختلف اختلافا كبيرا بين مجموعات الأنواع المختلفة ، أي أنظمة تقسيم العمل ، والمجموعات الوظيفية ، والتواصل بين الأفراد ، وتنظيم الأعلاف ، ومؤسسة المستعمرة ، وعملية التكاثر11. كمجموعة متنوعة للغاية ، يلجأون إلى العديد من الموارد الغذائية وسلوكيات التغذية المتخصصة. في الواقع ، لم تكن الزراعة خطوة كبيرة للحضارة الإنسانية فحسب ، بل كانت أيضا لأنواع النمل. ما يقرب من 55 إلى 65 Ma منذ12 ، بدأ النمل attine في زراعة الفطريات ودمجها في نظام غذائي حصري تقريبا. أصبحوا متخصصين لدرجة أنهم طوروا تفاعلات صارمة ومعتمدة وإلزامية تصنف على أنها تكافل ، حيث لا يعيش فرد واحد دون الآخر.
يقوم النمل الأقل نموا للفطريات بجمع ومعالجة المواد العضوية الميتة ، مثل شظايا الأوراق المتعفنة ، لزراعة الفطريات المتبادلة. بينما يحصد النمل الذي ينمو الفطريات العالية المواد النباتية الطازجة ، مما يشكل أحد أنجح الأنظمة الطبيعية التكافلية13. سمحت لهم هذه التقنية الزراعية عالية التخصص بالاستيلاء على مكانة جديدة. يتكون النمل الأتين الأعلى من النمل القاطع للأوراق ، وهي مجموعة أحادية اللون تثير ما بين 19 Ma (15-24 Ma) و 18 Ma (14-22 Ma)14،15،16 تتكون من أربعة أجناس صالحة: عطا فابريسيوس ، أكروميرمكس ماير ، أمويميرمكس كريستيانو ، و Pseudoatta Gallardo. تطور نظام الزراعة القاطع للأوراق الذي يؤديه النمل القاطع للأوراق من أنظمة الزراعة المشتقة17. تستغل معظم هذه الأنواع حصريا أنواع الفطريات المتبادلة Leucoagaricus gongylophorus Singer 18 (وتسمى أيضا Leucocoprinus gongylophorus Heim 19) ، مما يمثل انتقالا تطوريا مهما 11. تنتقل الأصناف الفطرية عموديا ، من الأعشاش الأصلية إلى النسل ، مما يشير إلى أنها تنتشر بشكل مستنسخ20.
ومن اللافت للنظر أن مجتمعات عطا طورت هيكلا تنظيميا معقدا ذا أهمية كبيرة في بيئتها وذات أهمية كبيرة لأخصائيي علم الحشرات. يمكن أن يتكون سكانها من ملايين الأفراد ، معظمهم من العاملات العقيمات اللواتي يظهرن تعدد الأشكال البارز ، أي الحجم المتميز والتشكل التشريحي. يتميز السكان بالطوائف حسب العمر والحالة الفسيولوجية والنوع المورفولوجي والسلوكيات والأنشطة المتخصصة في المستعمرة21. يمكن التمييز بين العمال في البستانيين والممرضات ، والعموميين داخل العش ، والباحثين عن الطعام والحفارات ، والمدافعين أو الجنود21. تسمح هذه المنظمة بأداء المهام بالتعاون ونظام التنظيم الذاتي الذي يمكن أن ينتج سلوكيات جماعية منظمة للغاية ، مما يسمح لهم بالاستجابة بكفاءة للاضطرابات البيئية22.
تلعب دور تجديد السكان ملكة واحدة (أي أحادية الجنس) ، طالما أنها تعيش ، وتشكل الطبقة الإنجابية الدائمة22. من المعروف أن ملكات عطا تعيش لأكثر من 20 عاما ، وتضع البيض طوال عمرها23. نظرا لأن الملكة لا يمكن الاستغناء عنها ، فإن قدرتها على التحمل أمر بالغ الأهمية لبقاء المستعمرة13،20،23،24. ومع ذلك ، يمكن العثور على الآلاف من الإناث والذكور التناسلية المجنحة في العش خلال مواسم التكاثر ، ولكن لا يبقى أي منها في العش الأصلي ، ويشكل طبقة مؤقتة22. في مستعمرات عطا سيكسدنز ، يتم إنتاج ما يقرب من 3000 أنثى تناسلية و 14000 ذكر تناسلي25. يحدث عندما تصل المستعمرة إلى مرحلة النضج الجنسي ، حوالي 38 شهرا من تنفيذها ، وتتكرر سنويا منذ ذلك الحين حتى يتم إخمادها23,25. يتم إنشاء مستعمرات عطا الجديدة من خلال هابلوميتروسيس ، حيث تبدأ ملكة واحدة عشا جديدا.
عندما تكون الظروف البيئية مواتية ، يغادر المستنسخون العش تحت الأرض لبدء رحلة الزواج. تختلف فترة حدوثه حسب المنطقة ، وتتراوح على مدار العام في جميع أنحاء الأراضي البرازيلية اعتمادا على الأنواع. ومع ذلك ، يبدو أن الحدث يسبقه هطول الأمطار وارتفاع الرطوبة26 ، والذي يمكن أن يكون مرتبطا بتسهيل الحفر بسبب رطوبة التربة22. في كثير من الأحيان ، قبل 1-5 أسابيع من رحلة الزواج ، يتم توسيع مداخل وقنوات العش لتسهيل مغادرة الأفراد الإنجابيين. قبل مغادرة مستعمراتها الأم ، تقوم الإناث المجنحة بجمع وتخزين جزء من الفطريات المتبادلة20,27 في تجويف تحت الرحم. يتم إجراء جماعات متعددة في منتصف الرحلة ، ويتم حساب أنه يمكن تلقيح ملكة واحدة من قبل ثلاثة إلى ثمانية ذكور (أي تعدد الأزواج) في بعض الأنواع28 ، مما يضمن التباين الجيني29. بعد ذلك ، تنتقل الملكات إلى التربة ، مع إعطاء الأفضلية للمواقع التي لا تحتوي على نباتات أو قليلة25 ، حيث تزيل أجنحتها وتحفر أول غرفة عش لها. هذه هي الفترة الوحيدة التي يمكن فيها رؤية الملكات خارج العش. على الرغم من أن أفراد الطبقة المؤقتة شوهدوا في أعشاش اصطناعية ، فمن غير المعروف ما إذا كان أي جماع ناجح (أي رحلة الزواج) قد تم إجراؤه في ظروف المختبر24.
يتوافق بناء العش الأولي مع الفترة الأكثر أهمية في المستعمرة ، والتي يمكن أن تستمر من 6 ساعات إلى 8 ساعات23,25. في هذه اللحظة ، تقوم الملكة بنفسها في الغرفة الأولية ، وفي غضون أيام ، يبدأ وضع البيض. يتم تغذية البيض الأول إلى الفطريات التي تتقيأها الملكة ، مما يمثل بداية حديقة الفطريات في المستعمرة. تظهر اليرقات الأولى في حوالي 25 يوما22 ، وفي نهاية الشهر الأول تقريبا ، تتكون المستعمرة من حصيرة من الفطريات المتكاثرة ، حيث تتداخل غير الناضجة (البيض واليرقات والشرانق) ، والملكة ، التي تربي نسلها الأولي في عزلة23. البيض هو أيضا المورد الغذائي لليرقات الأولى وتستهلك بشكل كبير من قبل الملكة13. بالإضافة إلى ذلك ، تحافظ الملكة على نفسها باحتياطيات الجسم الدهنية وتقويض عضلات الجناح التي لم تعد تستخدم13. لا يتم استهلاك ثقافة الفطريات الأولية لأن بقاء المستعمرة يعتمد على تطورها ، وخلال هذه الفترة ، تقوم الملكة بتخصيبها بالسائل البرازي13. بعد أيام من ظهورها ، يفتح العمال الأوائل مدخل العش ويبدأون نشاطا للبحث عن الطعام في المنطقة المجاورة للعش13. أنها تدمج المواد التي تم جمعها كركيزة لحديقة الفطريات ، والتي تعمل الآن كغذاء للعمال13,22. قبل إضافتها إلى ثقافة الفطريات ، يتم تقطيع المواد النباتية التي يحملها العمال إلى قطع صغيرة وترطيبها بسائل البراز13. يتلاعب النمل بلقاح الفطريات لزيادة نموه والتحكم فيه ، والذي سيعمل على تقسيم غرف التربة الكبيرة المحفورة ، والمتخصصة في تكييف الحديقة13،22،25.
بعد حوالي 6 أشهر من رحلة الزواج ، تحتوي أعشاش A. sexdens على غرفة فطريات وعدد قليل من القنوات. يعمل التخصص الكبير في بناء أعشاش النمل القاطعة للأوراق كآلية دفاعية ضد الأعداء الطبيعيين والعوامل البيئية غير المواتية22. من المعروف أن النمل القاطع للأوراق يتفتت حديقة الفطريات وينقلها إلى غرف ذات رطوبة عالية عندما تبدأ الغرف في الجفاف13. وهكذا ، على الرغم من أن حفر العش له تكلفة طاقة كبيرة ، فإن الطاقة المستثمرة تنعكس في فوائد للمستعمرة نفسها22. مع استثناءات قليلة ، تصنع أنواع عطا أيضا غرفا متخصصة لنفايات المستعمرة ، مصنوعة في الغالب من ركيزة الفطريات المستنفدة وجثث النمل الميت ، وتعزلها عن بقية العش ، وتضع استراتيجية مناعة اجتماعية مهمة30. بالإضافة إلى ذلك ، تقوم مجموعة متميزة من العمال بمعالجة النفايات مباشرة ، لتجنب تلوث الأفراد الآخرين. يتغذى العمال باستمرار لرعاية الفطريات ، وهي المورد الغذائي الرئيسي للمستعمرة. ومع ذلك ، يمكن أن تتغذى على عصارة النبات أيضا أثناء قطع الشظايا. يتم اختيار المواد النباتية بعناية لصيانة حديقة الفطريات وتتأثر بالعديد من العوامل مثل سمات الأوراق وخصائص النظام البيئي13.
إن استراتيجية البحث عن الطعام للنمل القاطع للأوراق للحصول على مواد طازجة معقدة للغاية ، وإلى جانب ارتفاع الطلب على الحصاد في المستعمرات القائمة ، تؤدي إلى خسارة اقتصادية كبيرة للمنتجين الزراعيين وتعرض مناطق استعادة الغاباتللخطر 22,31. لذلك ، يمكن تصنيف هذه النمل على أنها آفات في معظم المناطق التي قد تصادف فيها ، بدءا من جنوب الولايات المتحدة إلى شمال شرق الأرجنتين11،13،22،32. يمثل إطفاء المستعمرات الإشكالية تحديا بسبب سلسلة التكيفات المتأصلة في بيولوجيا هذه الحشرات (أي التنظيم الاجتماعي ، والبحث عن الطعام ، وزراعة الفطريات ، والنظافة ، وهياكل الأعشاش المعقدة)33. ومن ثم ، فإن استراتيجيات التحكم في السكان تختلف عن تلك المطبقة عموما على الآفات الحشرية الأخرى ، وتلجأ بشكل أساسي إلى عروض الطعم الملوثة الجذابة33,34. ومع ذلك ، نظرا لأن هذه النمل يمكنها رفض المواد الضارة لكل من الفطريات وأفراد المستعمرة ، وتعريض الحقول المزروعة للخطر 33 ، يتم اختبار المركبات الطبيعية الجديدة وبدائل التحكم باستمرار33،35،36. نظرا لأنه لا يمكن مراقبة نتائج التجارب على المستعمرات التي تم اختبارها ميدانيا ، يتم إجراء المقالات الأولية في بيئة خاضعة للرقابة.
وبالتالي ، يجب تكييف البروتوكولات التجريبية مع مجموعات الاهتمام بالنظر إلى نمط الحياة غير المتجانس للنمل ، ودعم الدراسات على مستوى الأنواع ، وحساب المستعمرات كوحدات تشغيلية ، حيث تكون نملة واحدة عنصرا من الكائنات الحية الفائقة المعقدة11. جعلت التقارير التي تم جمعها حتى الآن فيما يتعلق بجنس عطا من الممكن جمع المستعمرات والحفاظ عليها بنجاح في ظروف المختبر والاعتراف باحتياجاتها الأساسية وأدائها العام. بناء على عملياتها الطبيعية مثل التكاثر وتأسيس المستعمرات وسلوكيات التغذية ، تم تطوير روتين من الممارسات التي تسمح بإنشاء مستعمرات طويلة الأجل في أنواع مختلفة من الأعشاش. هنا ، يتم وصف بروتوكول إجرائي للحفاظ على النمل القاطع للأوراق في المختبر ويسلط الضوء على البحث العام المحتمل لأغراض تجريبية متميزة والتوعية العلمية.
Protocol
1. مجموعة من الملكات
- ابحث في الأدبيات عن فترة عطا الموسم التناسلي في المنطقة محل الاهتمام. يختلف حدوث موسم الإنجاب وتواتره ووقت النهار لرحلات الزواج وفقا للظروف المناخية الإقليمية (الجدول 1). على الرغم من أنه يحدث بشكل عام في الربيع ، يجب جمع هذه المعلومات للموقع الذي من المفترض أن يحدث فيه الجمع37،38،39،40،41،42،43،44،45،46.
- تحديد وتمييز المواقع مع أعشاش عطا التي تعتبر مناطق محتملة لجمع الملكات والمستعمرات الصغيرة. أثناء رحلات الزواج ، تنتشر الملكات حول مواقع العش. لذلك ، فإن المناطق التي بها عدد أكبر من المستعمرات لديها فرص أكبر للحصول على أماكن هبوط كوين حيث تبدأ حفريات عش جديدة.
- تحقق من المناطق التي تم اختيارها مسبقا بحثا عن علامات هروب الزواج خلال موسم تكاثر النمل عطا . تتبع الظروف البيئية لأيام طيران الزواج ، مثل الطقس الحار وهطول الأمطار.
- حدد أعشاش النمل القاطعة للأوراق في المناطق المحددة مسبقا وابحث عن الميزات الخارجية التي تشير إلى المغادرة القادمة للنمل المجنح التناسلي. تشمل ميزات العش توسيع مداخل الأنفاق (الشكل 1) ، وزيادة تدفق العمال الذين يظهرون سلوكا أكثر عدوانية تجاه الحيوانات المفترسة المحتملة والنمل المجنح الذي يظهر عند مداخل الأنفاق (الشكل 1). احذر من أيام الرطوبة العالية التي تلي هطول الأمطار ، لأنها تسبق رحلات الزواج بشكل عام.
- قم بإعداد حاويات ذات غطاء بلاستيكي بطبقة سفلية من الجص للاحتفاظ بالملكات بشكل فردي. تأكد من أن حجم الحاوية حوالي 200 مل ، وأن طبقة الجص في الأسفل يبلغ ارتفاعها حوالي 1 سم وأنها عالية الامتصاص للتحكم في الرطوبة.
ملاحظة: لتحضير قاعدة الجص ، اتبع تعليمات الشركة المصنعة. - قم بإعداد بيئة ذات درجة حرارة ثابتة تبلغ 23 ± 1 درجة مئوية وحوالي 70٪ ± 10٪ من الرطوبة النسبية. اختر موقعا بدون أنشطة مكثفة وتدفق عال للأشخاص لتجنب الاهتزازات والإزعاج. استخدم منتجات التنظيف ذات العطور المحايدة لمنع أي تدخل في سلوك النمل.
ملاحظة: يمكن أن تتسبب التقلبات في الظروف البيئية المحددة في تكثيف المياه أو فقدان الرطوبة ، وتعريض حديقة الفطريات للخطر. - بعد رحلة الزواج ، اجمع الملكات غير المجنحة التي بدأت حفر العش ، وضعها بعناية في الحاويات البلاستيكية المعدة بطبقة من الجص ، بشكل فردي. تجنب لمس الملكات بأيد عارية واستخدم قفازات اللاتكس أو ملاقط الحشرات.
ملاحظة: تشير إزالة الجناح وسلوك حفر التربة إلى الإناث الإنجابية التي تم تزاوجها بالفعل ، وبالتالي فهي قادرة على بدء مستعمرة جديدة. يتم التعامل مع مجموعة كوينز أيضا على أنها المجموعة الأولى في هذا العمل. - انقل الحاويات التي تحمل الملكات إلى الموقع مع بيئة خاضعة للرقابة محددة مسبقا. قم بنقل الملكات بأقصى درجات الحذر ، وتجنب الكثير من الإزعاج والحفاظ على الحد الأدنى من ثبات درجة الحرارة.
- لا تتلاعب أو تحرك الملكات لمدة 3 أيام تقريبا بعد الجمع لتجنب الإجهاد.

الشكل 1. اتسع مدخل العش مع إعادة إنتاج النمل المجنح والعمال. مداخل الأنفاق الموسعة هي واحدة من ميزات الأعشاش التي تشير إلى حدوث رحلات زواج عطا . الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
2. صيانة الملكات
- في البداية ، أضف 2.5 مل من الماء إلى طبقة الجص للمتلقي كل يومين بمساعدة حقنة إبرة.
- بدلا من فتح المستلم ، قم بثقب أغطية الحاوية بعناية بالإبرة لتجنب الإزعاج بسبب التلاعب. يمكن استخدام نفس الثقب خلال هذه الفترة. تأكد من أن الماء المضاف لا ينقع طبقة الجص. تجنب سقي الملكة مباشرة ، وإسفنجة الفطريات الأولية ، وأي غير ناضجة. طالما أن حديقة الفطريات تظهر جانبا جافا مع غياب الماء ، قم بري طبقة الجص.
- بعد أسبوعين من المجموعة ، تحقق مما إذا كانت الفطريات قد تم تقيؤها من قبل الملكات. إذا لم يكن هناك فطر ، فقم بنقل حوالي 2 غرام من الفطريات التي تم الحصول عليها من مستعمرة ثابتة. أيضا ، نفذ هذه الخطوة إذا لم تتطور الفطريات.
ملاحظة: لنقل الفطريات ، من الضروري جمع الفطريات الصحية من مستعمرة قائمة وإزالة جميع النمل الذي قد يكون عليها. استخدم ملعقة كبيرة وملاقط حشرية وقفازات لاتكس للتلاعب بالفطريات. - بعد ظهور العمال الأوائل ، ابدأ في تقديم شظايا من الأوراق الصغيرة والرقيقة بانتظام ، وفقا لنشاط قطع المستعمرة. تأكد من أن الأوراق المعروضة صحية ، وأن النباتات لم تتم معالجتها بالمبيدات الحشرية أو المواد الكيميائية الأخرى. في المراحل المبكرة ، تأكد من أن شظايا الأوراق لا تزيد عن 4 سم.
ملاحظة: عندما يبدأ العمال الأوائل في البحث عن الأوراق ، يجب تقديم المواد النباتية بعد ظهورها. يعتمد تكرار العرض على خفة الحركة التي يدمج بها العمال المواد النباتية على الفطريات ولكن يمكن أن تتراوح إلى 2-3 أيام في الأسبوع. يمكن أيضا تقديم رقائق الشوفان ورقائق الذرة ولكن يجب أن تتناوب مع الأوراق لتجنب جفاف الفطريات. - عند تقديم أوراق جديدة ، قم بإزالة نفايات المستعمرات وشظايا الأوراق الجافة. تجنب استخدام العطور أو المرطبات أو الكريمات أو أي مادة ذات رائحة قوية عند التلاعب بالملكات. بالإضافة إلى ذلك ، استخدم قفازات اللاتكس أثناء جميع العمليات.
- اتبع تطور المستعمرة ، وعندما تصل حديقة الفطريات إلى نصف حجم الحاوية على الأقل ، انقل المستعمرة إلى عش اصطناعي دائم.
ملاحظة: نظرا لأن معدل التطوير متأصل لكل مستعمرة ، فلا يوجد وقت تقديري لنقل المستعمرة. عادة ، يتم نقل المستعمرات من المجموعة الأولى إلى أعشاش مع غرفة حديقة الفطريات من حجم 1L كحد أقصى ، بسبب حديقة الفطريات الصغيرة.
3. مجموعة من المستعمرات الشابة
- الحصول على حاويات بلاستيكية بحجم 500 مل تقريبا.
- بعد حوالي 6 أشهر من رحلة الزواج ، حدد التلال الإرشادية على شكل برج مع جزيئات التربة المحببة (الشكل 1) لأعشاش عطا الأولية (الشكل 2) في المواقع التي حدث فيها النمل القاطع للأوراق المحدد مسبقا.
ملاحظة: بعد ستة أشهر من رحلة الزواج ، يقدر عمق أعشاش المستعمرات الصغيرة بما يصل إلى 1 متر في التربة. يشار إلى مجموعة جديدة في هذه الفترة لتحقيق فرص أعلى للمستعمرات الناجحة والدائمة بكميات كبيرة. - باستخدام مجرفة الحديقة ، قم بحفر مدخل العش حتى تصل إلى الغرفة التي تحتوي على مستعمرة صغيرة. اجمع الملكة وحديقة الفطريات وغير الناضجة والعمال الشباب وضعها في الحاوية البلاستيكية. قم بإجراء عملية التجميع برفق قدر الإمكان.
ملاحظة: بطبيعة الحال ، سيتم جمع كمية كبيرة من التربة أيضا ويجب إزالتها تدريجيا في إجراءات الصيانة المستقبلية في المختبر. - انقل الحاويات ذات الغطاء البلاستيكي التي تحمل المستعمرات إلى البيئة الخاضعة للرقابة المحددة. قم بنقل المستعمرات الصغيرة بحذر شديد ، وتجنب الكثير من الاضطرابات والحفاظ على الحد الأدنى من ثبات درجة الحرارة. الامتناع عن التلاعب أو تحريك المستعمرات لمدة 3 أيام تقريبا لتجنب الإجهاد. إذا كانت الغرفة تحتوي على روتين نشط ، فيمكن وضع قطعة قماش داكنة فوق المستعمرات.

الشكل 2. تل تربة على شكل برج. يشير التل المميز على شكل برج إلى وجود مستعمرات أولية من Atta sexdens و Atta laevigata. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
4. صيانة المستعمرات الشابة
- توفير أوراق الشباب رقيقة 3 مرات في الأسبوع.
- تأكد من أن الأوراق المعروضة صحية وأن النباتات لم تتم معالجتها بالمبيدات الحشرية أو المواد الكيميائية الأخرى. في هذه المرحلة ، تأكد من أن شظايا الأوراق لا يقل طولها عن 7 سم.
ملاحظة: يمكن أيضا تقديم رقائق الشوفان ورقائق الذرة ولكن يجب أن تتناوب مع الأوراق لتجنب جفاف الفطريات. - يعتمد تردد العرض على خفة الحركة التي يدمج بها العمال المواد النباتية على الفطريات. مع تكثيف نشاط القطع ، قم بزيادة العرض مرتين في اليوم ثلاث مرات في الأسبوع أو 5 أيام في الأسبوع.
- تأكد من أن الأوراق المعروضة صحية وأن النباتات لم تتم معالجتها بالمبيدات الحشرية أو المواد الكيميائية الأخرى. في هذه المرحلة ، تأكد من أن شظايا الأوراق لا يقل طولها عن 7 سم.
- عند تقديم أوراق جديدة ، قم بإزالة نفايات المستعمرة ، بما في ذلك بقايا التربة ، بمساعدة ملعقة. استخدم قفازات اللاتكس أثناء جميع العمليات. عند التلاعب بالمستعمرات الصغيرة تجنب استخدام العطور أو المرطبات أو الكريمات أو أي مادة ذات رائحة قوية.
ملاحظة: سيقوم العمال أنفسهم بفصل التربة والنفايات عن الفطريات. - اتبع تطور المستعمرة ، وعندما تصل حديقة الفطريات إلى نصف حجم الحاوية على الأقل ، انقل المستعمرة إلى عش اصطناعي دائم.
ملاحظة: نظرا لأن معدل التطوير متأصل لكل مستعمرة ، فلا يوجد وقت تقديري لنقل المستعمرة.
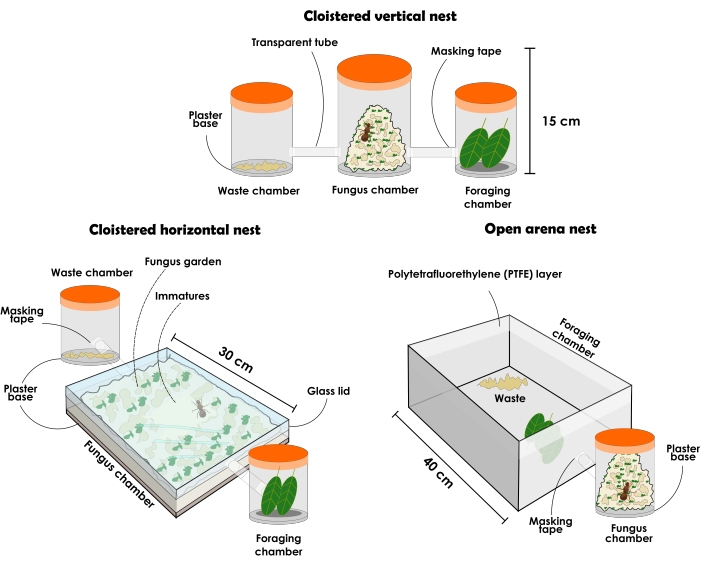
الشكل 3: أنواع الأعشاش الاصطناعية لعقد مستعمرات عطا سيكسدينس وعطا لايفيغاتا. رسم توضيحي للأعشاش الاصطناعية الدائمة للنمل القاطع للأوراق: إعداد العش الرأسي المنعزل ، وإعداد العش الأفقي المنعزل ، وإعداد عش الساحة المفتوحة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
5. أعشاش اصطناعية دائمة
- قم بإعداد عش عمودي منعزل كما هو موضح أدناه (الشكل 3 والشكل 4).
ملاحظة: يجب أن تحتوي تكوينات العش المنعزل دائما على مستلمين مختلفين لوضعهم بشكل منفصل على أنهم (1) غرفة حديقة الفطريات ، (2) غرفة التخلص من النفايات و (3) غرفة البحث عن الطعام. في البداية ، يجب أن تبدأ بثلاث حاويات ، ولكن يمكن إضافة المزيد من المستلمين لزيادة حديقة الفطريات. قد تختلف الأعشاش في الحجم والمواد وفقا لغرضها التجريبي ، على الرغم من أنه يتم وصفها هنا والتوصية باستخدام المواد الشفافة. يجب أن تكون الحاويات بدون فتحات ، وإلا سيهرب النمل. يمكن استخدام نوع العش كما هو موضح أدناه للبحث العام ، ولكن لا ينصح به جيدا لجمع النمل الحازم بسبب الاضطراب الناجم عند إزالة الغطاء ، مما يؤدي إلى إثارة كبيرة بين الأفراد. ومع ذلك ، نظرا لشفافية المواد ، من الممكن تحديد موقع الملكة وطبقات النمل المختلفة حتى عندما تملأ حديقة الفطريات الحاوية بأكملها. نظرا لأنه ميل ، فمن المفترض دائما أن غير الناضجة موجودة في وسط حديقة الفطريات عندما تشغل معظم المساحة المتاحة في حاويات عمودية.- حدد حاوية ذات غطاء شفاف تبلغ حوالي 1 لتر وأضف طبقة 1 سم من قاعدة الجص عالية الامتصاص. ستكون هذه غرفة حديقة الفطريات. حدد حاويتين شفافتين بغطاء تبلغ سعة كل منهما حوالي 500 مل لتكون غرف للتخلص من النفايات والعلف. سيختار النمل الغرفة التي ستكون لكل منها ، وبعد ذلك ، تأكد من عدم تبادلها.
ملاحظة: لتحضير قاعدة الجص ، اتبع تعليمات الشركة المصنعة. - ثقب وتوصيل الحاويات الثلاث مع أنبوب شفاف أو خرطوم. إذا لزم الأمر ، ضع شريطا لاصقا على حدود الأنابيب لضمان اتصال الفخذ بالحاويات وتجنب هروب النمل. ضع حاوية قاعدة الجص في المنتصف والحاويات الأخرى على جوانب متقابلة.
- انقل بعناية إسفنجة الفطريات من المستعمرات المختارة (انظر الخطوة 2.5 والخطوة 4.3) جنبا إلى جنب مع الملكة والعمال وغير الناضجين إلى حاوية قاعدة الجص. قبل النقل ، تأكد من سقي قاعدة الجص. استخدم قفازات اللاتكس.
- حدد حاوية ذات غطاء شفاف تبلغ حوالي 1 لتر وأضف طبقة 1 سم من قاعدة الجص عالية الامتصاص. ستكون هذه غرفة حديقة الفطريات. حدد حاويتين شفافتين بغطاء تبلغ سعة كل منهما حوالي 500 مل لتكون غرف للتخلص من النفايات والعلف. سيختار النمل الغرفة التي ستكون لكل منها ، وبعد ذلك ، تأكد من عدم تبادلها.
- قم بإعداد عش أفقي منعزل كما هو موضح أدناه (الشكل 3 والشكل 4).
ملاحظة: تسمح الأعشاش ذات التكوين الأفقي بالمراقبة الدقيقة لحديقة الفطريات وأنشطة العمال تجاهها. نظرا لأن الأجزاء الأصغر سنا من حديقة الفطريات موجودة في الأعلى ، فمن الممكن ملاحظة الركائز المعروضة مؤخرا والتي يتم دمجها من قبل العمال. يمكن رصد أجزاء جديدة من الفطريات من خلال لونها ، والذي سيكون مشابها للون المورد الأخير المقدم ، في حين أن الأجزاء القديمة عادة ما تحمل لونا بيجا. يمكن أيضا تحديد موقع النسل والملكة بسهولة ، كما هو الحال في الحاويات الأفقية التي عادة ما تكون في الجزء العلوي من حديقة الفطريات ، حتى عندما تشغل معظم المساحة. يمكن استخدام هذا التكوين لأغراض البحث الذي يركز على السلوك وأخذ العينات البؤرية والتواصل العلمي ، لأنه يعطي تصورا للمنظمة داخل العش.- احصل على حاوية بغطاء شفاف بأبعاد 31 سم × 21 سم × 4.5 سم تقريبا ، وأضف طبقة 1 سم من قاعدة الجص عالية الامتصاص. ستكون هذه غرفة حديقة الفطريات. حدد حاويتين شفافتين بغطاء تبلغ سعة كل منهما حوالي 500 مل لتكون غرف للتخلص من النفايات والعلف. سيختار النمل الغرفة التي ستكون لكل منها ، وبعد ذلك ، تأكد من عدم تبادلها.
ملاحظة: لتحضير قاعدة الجص ، اتبع تعليمات الشركة المصنعة. إذا لزم الأمر ، أغلق المساحة الصغيرة بين الغطاء والحاوية بشريط لاصق لمنع النمل من الهروب. - ثقب وتوصيل الحاويات مع أنبوب شفاف أو خرطوم. إذا لزم الأمر ، ضع شريطا لاصقا على حدود الأنابيب لضمان اتصال الفخذ بالحاويات وتجنب هروب النمل. ضع حاوية قاعدة الجص في المنتصف والحاويات الأخرى على جوانب متقابلة.
- انقل بعناية إسفنجة الفطريات من المستعمرات المختارة (انظر الخطوة 2.5 والخطوة 4.3) جنبا إلى جنب مع الملكة والعمال وغير الناضجين إلى حاوية قاعدة الجص. قبل النقل ، تأكد من سقي قاعدة الجص. استخدم قفازات اللاتكس.
- احصل على حاوية بغطاء شفاف بأبعاد 31 سم × 21 سم × 4.5 سم تقريبا ، وأضف طبقة 1 سم من قاعدة الجص عالية الامتصاص. ستكون هذه غرفة حديقة الفطريات. حدد حاويتين شفافتين بغطاء تبلغ سعة كل منهما حوالي 500 مل لتكون غرف للتخلص من النفايات والعلف. سيختار النمل الغرفة التي ستكون لكل منها ، وبعد ذلك ، تأكد من عدم تبادلها.
- قم بإعداد عش الساحة المفتوحة كما هو موضح أدناه (الشكل 3 والشكل 5).
ملاحظة: تسمح أعشاش الساحة المفتوحة بجمع النمل دون إزعاج كبير وتحليل سلوك البحث عن الطعام. يمكنهم أيضا توفير تمثيل موثوق لمستعمرة موجودة في الطبيعة لأغراض التوعية العلمية.- حدد حاوية ذات غطاء شفاف تبلغ حوالي 1 لتر وأضف طبقة 1 سم من قاعدة طبقة الجص عالية الامتصاص. ستكون هذه غرفة حديقة الفطريات.
ملاحظة: يوصى بالبدء بحاويات سعة 1 لتر ونقلها تدريجيا إلى حاويات ذات أحجام أكبر لحديقة فطريات أكبر. ومع ذلك ، يجب ألا تتغلب الحاويات على حجم 5 لتر. أضف العديد من الحاويات حسب الضرورة. - حدد ساحة مفتوحة. يمكن أن يختلف حجم الساحة وفقا لأغراض الدراسة. إذا تم اختيار ساحة كبيرة ، ضع الحاويات التي تحمل حديقة الفطريات في داخلها (الشكل 5). في حالة وجود ساحة صغيرة ، قم بتوصيلها بحاوية حديقة الفطريات بخرطوم أو أنبوب شفاف (الشكل 3). ستكون الساحة بمثابة غرفة للبحث عن الطعام والتخلص من النفايات ، لذا تأكد من أنها ليست صغيرة جدا.
- ضع طبقة واحدة من سائل بولي تترافلورو إيثيلين في حركة واحدة على حدود الساحة لاحتواء النمل. استخدم قطنا منقوعا بالسائل وقفاز النتريل.
تنبيه: تجنب الاستنشاق ولمس الجلد أثناء استخدام سائل بولي تترافلورو إيثيلين. - انقل بعناية إسفنجة الفطريات من المستعمرات المختارة (انظر الخطوة 2.5 والخطوة 4.3) جنبا إلى جنب مع الملكة والعمال وغير الناضجين إلى حاوية قاعدة الجص. قبل النقل ، تأكد من سقي قاعدة الجص. استخدم قفازات اللاتكس.
- حدد حاوية ذات غطاء شفاف تبلغ حوالي 1 لتر وأضف طبقة 1 سم من قاعدة طبقة الجص عالية الامتصاص. ستكون هذه غرفة حديقة الفطريات.

الشكل 4: أعشاش اصطناعية منعزلة للنمل القاطع للأوراق عطا سيكسدنز وعطا لايفيجاتا. أعلى إعداد العش العمودي المنعزل (A) والمنظر الجانبي (B) ؛ أعلى إعداد العش الأفقي المنعزل (C) والمنظر الجانبي (D). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: عش الساحة المفتوحة الاصطناعية للنمل القاطع للأوراق عطا سيكسدنز وعطا لايفيجاتا. افتح إعداد عش الساحة ل Atta sexdens أعلى (A) ومنظر جانبي (B). 1) غرف حديقة الفطريات. 2) النفايات. 3) شرائح البرتقال. 4) زجاج بطبقة بولي تترافلور إيثيلين (PTFE). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
6. صيانة المستعمرات المتقدمة
- قدم يوميا ورقة كبيرة واحدة على الأقل في غرفة البحث عن الطعام لكل مستعمرة مع 1 لتر من حديقة الفطريات. إذا كان نشاط قطع النمل شديدا ، فقم بزيادة عدد الأوراق. إذا كانت الفطريات جافة ، فقم بترطيب الأوراق مسبقا لتوفير رطوبة إضافية. في الأعشاش المنعزلة ، قم بإجراء التقدمة بسرعة لتجنب هروب النمل من غرفة البحث عن الطعام.
ملاحظة: هنا ، يتم جمع الأوراق من أنواع نباتية مثل التوت (Morus nigra) ، والمانجو (Mangifera indica) ، والأوكالبتوس (Eucalyptus sp.) ، و jambolan (Syzygium cumini) ، والكركديه (Hibiscus sp.) ، و acalypha (Acalypha wilkesiana) ، و ligustrum (Ligustrum lucidum).- قدم الفواكه مثل البرتقال والتفاح ورقائق الشوفان والذرة لتنويع واستكمال النظام الغذائي. إلى المستعمرات الكبيرة ذات النشاط المكثف للبحث عن الطعام ، قدم رقائق الشوفان ورقائق الذرة يوميا والفواكه مرة واحدة في الأسبوع. إذا لم يكن الأمر كذلك ، فقم بتقديم رقائق بالتناوب مع الأوراق ، ولكن ليس أكثر من ثلاث مرات في الأسبوع ، والفواكه مرة أو مرتين في الشهر. اضبط كمية وتواتر كل طعام وفقا لنشاط البحث عن الطعام للنمل.
- إذا لم تكن الخيارات الموضحة أعلاه متوفرة ، فحدد تفضيل النمل للبحث عن الطعام بين أوراق الأشجار والشجيرات الإقليمية والزهور والفواكه ، أو حتى الخضروات والحبوب والرقائق الأخرى التجارية. تجنب تقديم الموارد مع المركبات الكيميائية الدفاعية والمبيدات الحشرية.
- إزالة كل محتوى غرفة النفايات كل 2 أسابيع من جميع المستعمرات. إزالة العمال أيضا لأغراض السيطرة على السكان. إذا قام العمال بنقل الفطريات الصحية إلى غرفة النفايات ، فتأكد من عدم وجود الملكة عليها وإزالتها. إذا كانت كمية النفايات التي يتم التخلص منها عالية أو كانت رطبة جدا ، فقم بإزالتها مرة واحدة في الأسبوع.
- قم بإزالة المواد التي لم يأخذها النمل من غرفة البحث عن الطعام عند تقديم مواد جديدة وتأكد من نظافتها دائما.
- إذا قام العمال بنقل الفطريات الصحية إلى غرفة البحث عن الطعام ، فقم بإزعاجها ، واترك غطاء الحاوية مفتوحا وقم بتطبيق بودرة التلك المحايدة على سطح هامش الغرفة. نفذ هذا الإجراء فقط إذا كان لا يزال هناك بعض المساحة في غرفة الفطريات ، وبهذه الطريقة سينقل العمال الفطريات مرة أخرى إلى الحاوية دون فقدها أو أي غير ناضجة.
- إذا كانت هناك حاجة إلى المزيد من حديقة الفطريات ، أضف حاوية أخرى ملصقة ، وانقل جزءا من إسفنجة الفطريات إليها. حتى تصل الفطريات إلى نصف الحاوية ، أضف الأوراق في غرفة الفطريات. يجب أن يحدث نمو حديقة الفطريات تدريجيا حتى لا يضر بتوازن المستعمرة. إذا كانت هناك حاجة إلى حاوية أكبر ، فتأكد من ترك الفطريات تشغل المساحة الكاملة لأصغر الحاويات قبل نقلها. لا ينبغي ترك نفايات المستعمرات والأوراق الجافة تتراكم في غرفة حديقة الفطريات.
- افحص قاعدة الجص من الحاويات ، كما هو الحال مع الوقت ، قد تكتسب لونا بنيا داكنا وتصبح غير فعالة بسبب إفراز النمل ونقل النفايات وتركيز الرطوبة العالي. أيضا ، قد تقطع بعض المستعمرات الطبقة وتتخلص منها. في هذه الحالات ، انقل حديقة الفطريات إلى حاوية جديدة ملصقة.
النتائج
يوضح الشكل 6 مخططا انسيابيا يوضح عملية جمع النمل. هنا ، يتم عرض بعض النتائج التي تم الحصول عليها باستخدام بروتوكول الجمع والصيانة وإعدادات العش الموضحة أعلاه.
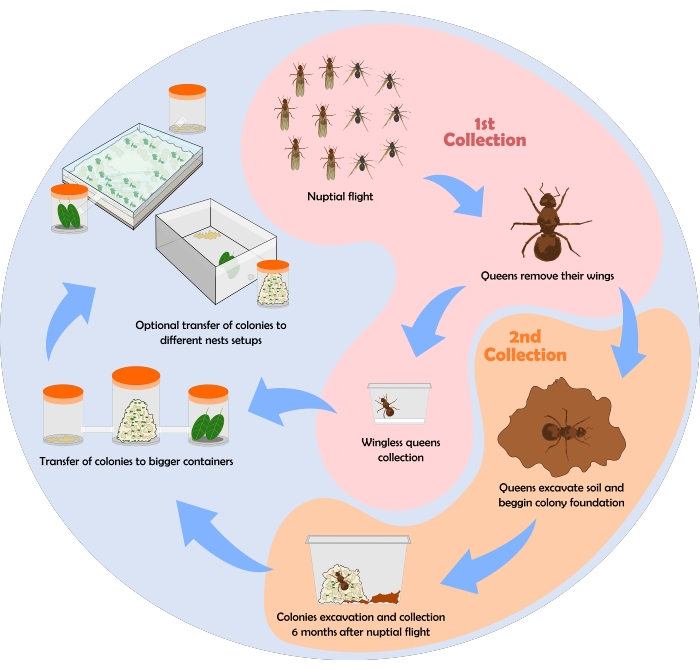
الشكل 6:...
Discussion
تم تطوير البروتوكول الموصوف هنا للحفاظ على مستعمرات النمل القاطعة للأوراق وتطبيقه لأكثر من ثلاثة عقود بطريقة حازمة وقابلة للتكرار. سمح بتطوير البحوث التي ستكون محدودة بسبب الظروف الميدانية. وبالتالي ، أصبح النمل والمستعمرات السليمة متاحة للبحث في العديد من المجالات مثل التشكل المقارن ،...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
مكرسة لماريو أوتوري (في ذكرى) ووالتر هوغو دي أندرادي كونها الذين ساهموا بشكل كبير في دراسات النمل قطع الأوراق. نحن نعترف بدعم جامعة ولاية ساو باولو ومعهد العلوم البيولوجية. وقد مولت هذه الدراسة جزئيا من قبل هيئة تنسيق الشؤون المالية العليا في البرازيل (CAPES) - قانون المالية رقم 001، والمجلس الوطني للتنمية العلمية والتكنولوجيا (CNPq)، ومؤسسة إنفاذ الحقوق الدستورية في ولاية ساو باولو، ومؤسسة التنمية من أجل التنمية في ولاية ساو باولو، ومؤسسة التنمية في UNESP.
Materials
| Name | Company | Catalog Number | Comments |
| Entomologic forceps | N/A | N/A | N/A |
| Glass tank | N/A | N/A | Tempered glass, custom made |
| Hose | N/A | N/A | Transparent, PVC 1/2 Inch x 2,0 mm |
| Latex gloves | Descarpack | 550301 | N/A |
| Nitrile gloves | Descarpack | 433301 | N/A |
| Open arena | N/A | N/A | Polypropylene crate |
| Plaster pouder | N/A | N/A | Plaster pouder used in construction, must be absorbant |
| Plastic Containers for collection | Prafesta | Natural Cód.: 8231/Natural Cód.: 8262 | Lidded, transparent , polypropylene |
| Plastic containers for nests | Prafesta | Discontinued | Polystyrene, hermetic |
| Teflon | Dupont | N/A | Polytetrafluoroethylene liquid (PTFE Dispertion 30) |
References
- Wilson, E. O. . The Insect Societies. , (1971).
- Ortiz, D. P., Elizalde, L., Pirk, G. I. Role of ants as dispersers of native and exotic seeds in an understudied dryland. Ecological Entomology. 46 (3), 626-636 (2021).
- Christianini, A. V., Oliveira, P. S. Birds and ants provide complementary seed dispersal in a neotropical savanna. Journal of Ecology. 98 (3), 573-582 (2010).
- Camargo, P. H. S. A., Martins, M. M., Feitosa, R. M., Christianini, A. V. Bird and ant synergy increases the seed dispersal effectiveness of an ornithochoric shrub. Oecologia. 181 (2), 507-518 (2016).
- Sanders, D., van Veen, F. J. F. Ecosystem engineering and predation: the multi-trophic impact of two ant species. Journal of Animal Ecology. 80 (3), 569-576 (2011).
- Swanson, A. C., et al. Welcome to the Atta world: A framework for understanding the effects of leaf-cutter ants on ecosystem functions. Functional Ecology. 33 (8), 1386-1399 (2019).
- Meyer, S. T., et al. Leaf-cutting ants as ecosystem engineers: topsoil and perturbations around Atta cephalotes nests reduce nutrient availability. Ecological Entomology. 38 (5), 497-504 (2013).
- Sosa, B., Brazeiro, A. Positive ecosystem engineering effects of the ant Atta vollenweideri on the shrub Grabowskia duplicata. Journal of Vegetation Science. 21 (3), 597-605 (2010).
- De Almeida, T., et al. Above- and below-ground effects of an ecosystem engineer ant in Mediterranean dry grasslands. Proceedings of the Royal Society B: Biological Sciences. 287 (1935), 20201840 (2020).
- Folgarait, P. J. Ant biodiversity and its relationship to ecosystem functioning: a review. Biodiversity & Conservation. 7 (9), 1221-1244 (1998).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Barrera, C. A., Sosa-Calvo, J., Schultz, T. R., Rabeling, C., Bacci, M. Phylogenomic reconstruction reveals new insights into the evolution and biogeography of Atta leaf-cutting ants (Hymenoptera: Formicidae). Systematic Entomology. 47 (1), 13-35 (2021).
- Hölldobler, B., Wilson, E. O. . The Leafcutter Ants: Civilization By Instinct. , (2011).
- Branstetter, M. G., et al. Dry habitats were crucibles of domestication in the evolution of agriculture in ants. Proceedings of the Royal Society B: Biological Sciences. 284 (1852), 20170095 (2017).
- Solomon, S. E., et al. The molecular phylogenetics of Trachymyrmex Forel ants and their fungal cultivars provide insights into the origin and coevolutionary history of ‘higher-attine’ ant agriculture. Systematic Entomology. 44 (4), 939-956 (2019).
- Cristiano, M. P., Cardoso, D. C., Sandoval-Gómez, V. E., Simões-Gomes, F. C. Amoimyrmex Cristiano, Cardoso & Sandoval, gen. nov. (Hymenoptera: Formicidae): a new genus of leaf-cutting ants revealed by multilocus molecular phylogenetic and morphological analyses. Austral Entomology. 59 (4), 643-676 (2020).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences of the United States of America. 105 (14), 5435-5440 (2008).
- Mueller, U. G., et al. Phylogenetic patterns of ant–fungus associations indicate that farming strategies, not only a superior fungal cultivar, explain the ecological success of leafcutter ants. Molecular Ecology. 27 (10), 2414-2434 (2018).
- Mueller, U. G., et al. Biogeography of mutualistic fungi cultivated by leafcutter ants. Molecular Ecology. 26 (24), 6921-6937 (2017).
- Weber, N. A. The fungus-culturing behavior of ants. American Zoologist. 12 (3), 577-587 (1972).
- Wilson, E. O. Caste and division of labor in leaf-cutter ants (Hymenoptera: Formicidae: Atta). Behavioral Ecology and Sociobiology. 7 (2), 157-165 (1980).
- Della Lucia, T. M. C. Formigas cortadeiras: da bioecologia ao manejo. Viçosa Editora UFV. 421, (2011).
- Autuori, M. Contribuição para o conhecimento da saúva (Atta spp). I. Evolução do sauveiro (Atta sex dens rubolpilosa Forel, 1908). Arquivos do Instituto Biologico Saul Paulo. 12, 197-228 (1941).
- Bueno, O. C., Hebling, M. J. A., Schneider, M. O., Pagnocca, F. C. Ocorrência de formas aladas de Atta sexdens rubropilosa Forel (Hymenoptera: Formicidae) em colônias de laboratório. Neotropical Entomology. 31 (3), 469-473 (2002).
- Mariconi, F. A. M. Biologo. As Saúvas. , (2021).
- Bento, J. M. S. . Condições climáticas para o vôo nupcial e reconhecimento dos indivíduos em Atta sexdens rubropilosa (Hymenoptera: Formicidae). , (1993).
- Little, A. E. F., Murakami, T., Mueller, U. G., Currie, C. R. The infrabuccal pellet piles of fungus-growing ants. Naturwissenschaften. 90 (12), 558-562 (2003).
- Kerr, W. E. Acasalamento de rainhas com vários machos em duas espécies da tribo Attini. Revista Brasileira de Biologia. 21, 45-48 (1961).
- Kerr, W. E. Tendências evolutivas na reprodução dos himenópteros sociais. Arquivos do Museu Nacional. 52, (1962).
- Cremer, S., Armitage, S. A. O., Schmid-Hempel, P. Social immunity. Current Biology. 17 (16), 693-702 (2007).
- Hernández, J. V., Jaffé, K. Dano econômico causado por populações de formigas Atta laevigata (F. Smith) em plantações de Pinus caribaea (Mor.) e elementos para o manejo da praga. Anais da Sociedade Entomológica do Brasil. 24 (2), 287-298 (1995).
- Kempf, W. W. Catálogo abreviado das formigas da Região Neotropical Studia Entomologica. antbase.org. 15, 3 (1972).
- Della Lucia, T. M. C., Gandra, L. C., Guedes, R. N. C. Managing leaf-cutting ants: peculiarities, trends and challenges. Pest Management Science. 70 (1), 14-23 (2013).
- Boaretto, M. A. C., Forti, L. C. Perspectivas no controle de formigas-cortadeiras. Série Técnica IPEF. 11 (30), 31-46 (1997).
- Folgarait, P. J., Goffré, D. Conidiobolus lunulus, a newly discovered entomophthoralean species, pathogenic and specific to leaf-cutter ants. Journal of Invertebrate Pathology. 186, 107685 (2021).
- Cardoso, S. R. S., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Pathogenicity of filamentous fungi towards Atta sexdens rubropilosa (Hymenoptera: Formicidae). International Journal of Tropical Insect Science. 42 (2), 1215-1223 (2022).
- Ichinose, K., Rinaldi, I., Forti, L. C. Winged leaf-cutting ants on nuptial flights used as transport by Attacobius spiders for dispersal. Ecological Entomology. 29 (5), 628-631 (2004).
- Pagnocca, F. C., Rodrigues, A., Nagamoto, N. S., Bacci, M. Yeasts and filamentous fungi carried by the gynes of leaf-cutting ants. Antonie Van Leeuwenhoek. 94 (4), 517-526 (2008).
- Attili-Angelis, D., et al. Novel Phialophora species from leaf-cutting ants (tribe Attini). Fungal Diversity. 65 (1), 65-75 (2014).
- Delabie, J. H. C., do Nascimento, I. C., Mariano, C. S. F. Estratégias de reprodução e dispersão em formigas attines, com exemplos do sul da Bahia. XIX Congresso Brasileiro de Entomologia. , 16-21 (2002).
- Fjerdingstad, E. J., Boomsma, J. J. Variation in size and sperm content of sexuals in the leafcutter ant Atta colombica. Insectes Sociaux. 44 (3), 209-218 (1997).
- Currie, C. R., Mueller, U. G., Malloch, D. The agricultural pathology of ant fungus gardens. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7998-8002 (1999).
- Moser, J. C., et al. Eye size and behaviour of day-and night-flying leafcutting ant alates. Journal of Zoology. 264 (1), 69-75 (2004).
- Moreira, S. M., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Absence of the parasite Escovopsis in fungus garden pellets carried by gynes of Atta sexdens. Sociobiology. 62 (1), 34-38 (2015).
- Arcuri, S. L., et al. Yeasts found on an ephemeral reproductive caste of the leaf-cutting ant Atta sexdens rubropilosa. Antonie Van Leeuwenhoek. 106 (3), 475-487 (2014).
- Staab, M., Kleineidam, C. J. Initiation of swarming behavior and synchronization of mating flights in the leaf-cutting ant Atta vollenweideri FOREL, 1893 (Hymenoptera: Formicidae). Myrmecol. News. 19, 93-102 (2014).
- Gálvez, D., Chapuisat, M. Immune priming and pathogen resistance in ant queens. Ecology and Evolution. 4 (10), 1761-1767 (2014).
- Baer, B., Armitage, S. A. O., Boomsma, J. J. Sperm storage induces an immunity cost in ants. Nature. 441 (7095), 872-875 (2006).
- Carlos, A. A. . Semioquímicos e comunicação sonora em formigas cortadeiras (Hymenoptera: Formicidae). , (2013).
- Veja um FORMIGUEIRO por DENTRO. Boravê Available from: https://youtu.be/sN99x_Rjf90 (2021)
- Ortiz, G., Vieira, A. S., Bueno, O. C. Toxicological and morphological comparative studies of insecticides action in leaf-cutting ants. International Journal of Agriculture Innovations and Research. 6 (3), 516-522 (2017).
- Decio, P., Silva-Zacarin, E. C. M., Bueno, F. C., Bueno, O. C. Toxicological and histopathological effects of hydramethylnon on Atta sexdens rubropilosa (Hymenoptera: Formicidae) workers. Micron. 45, 22-31 (2013).
- Vieira, A. S., Morgan, E. D., Drijfhout, F. P., Camargo-Mathias, M. I. Chemical composition of metapleural gland secretions of fungus-growing and non-fungus-growing ants. Journal of Chemical Ecology. 38 (10), 1289-1297 (2012).
- Vieira, A. S., Ramalho, M. O., Martins, C., Martins, V. G., Bueno, O. C. Microbial communities in different tissues of Atta sexdens rubropilosa leaf-cutting ants. Current Microbiology. 74 (10), 1216-1225 (2017).
- Ramalho, M. d. e. O., Martins, C., Morini, M. S. C., Bueno, O. C. What can the bacterial community of Atta sexdens (Linnaeus, 1758) tell us about the habitats in which this ant species evolves. Insects. 11 (6), 332 (2020).
- Machado, L. M., et al. Attractivity or repellence: relation between the endophytic fungi of Acalypha, Colocasia and the leaf-cutting ants—Atta sexdens. Advances in Entomology. 9 (2), 85-99 (2021).
- Moreira, A., Forti, L. C., Andrade, A. P., Boaretto, M. A., Lopes, J. Nest architecture of Atta laevigata (F. Smith, 1858) (Hymenoptera: Formicidae). Studies on Neotropical Fauna and Environment. 39 (2), 109-116 (2004).
- Della Lucia, T. M. C., Moreira, D. D. O., Oliveira, M. A., Araújo, M. S. Perda de peso de rainhas de Atta durante a fundação e o estabelecimento das colônias. Revista Brasileira de Biologia. 55 (4), 533-536 (1995).
- Fujihara, R. T., Camargo, R. d. a. S., Forti, L. C. Lipid and energy contents in the bodies of queens of Atta sexdens rubropilosa Forel (Hymenoptera, Formicidae): pre-and post-nuptial flight. Revista Brasileira de Entomologia. 56 (1), 73-75 (2012).
- da Silva Camargo, R., Forti, L. C. Queen lipid content and nest growth in the leaf cutting ant (Atta sexdens rubropilosa) (Hymenoptera: Formicidae). Journal of Natural History. 47, 65-73 (2013).
- Camargo, R. S., Forti, L. C., Fujihara, R. T., Roces, F. Digging effort in leaf-cutting ant queens (Atta sexdens rubropilosa) and its effects on survival and colony growth during the claustral phase. Insectes Sociaux. 58 (1), 17-22 (2011).
- Mota Filho, T. M. M., Garcia, R. D. M., Camargo, R. S., Stefanelli, L. E. P., Forti, L. C. Observations about founding queens (Atta sexdens) and their unusual behavior. International Journal of Agriculture Innovations and Research. 9, 352-357 (2021).
- Barcoto, M. O., Pedrosa, F., Bueno, O. C., Rodrigues, A. Pathogenic nature of Syncephalastrum in Atta sexdens rubropilosa fungus gardens. Pest Management Science. 73 (5), 999-1009 (2017).
- Silva, A., Bacci, M., Pagnocca, F. C., Bueno, O. C., Hebling, M. J. A. Production of polysaccharidases in different carbon sources by Leucoagaricus gongylophorus Möller (Singer), the symbiotic fungus of the leaf-cutting ant Atta sexdens Linnaeus. Curr. Microbiology. 53 (1), 68-71 (2006).
- Majoe, M., Libbrecht, R., Foitzik, S., Nehring, V. Queen loss increases worker survival in leaf-cutting ants under paraquat-induced oxidative stress. Philosophical Transactions of the Royal Society B. 376 (1823), 20190735 (2021).
- Della Lucia, T. M. C., Peternelli, E. F. O., Lacerda, F. G., Peternelli, L. A., Moreira, D. D. O. Colony behavior of Atta sexdens rubropilosa (Hymenoptera: Formicidae) in the absence of the queen under laboratory conditions. Behavioural Processes. 64 (1), 49-55 (2003).
- Sales, T. A., Toledo, A. M. O., Zimerer, A., Lopes, J. F. S. Foraging for the fungus: why do Acromyrmex subterraneus (Formicidae) queens need to forage during the nest foundation phase. Ecological Entomology. 46 (6), 1364-1372 (2021).
- Forti, L. C., et al. Do workers from subspecies Acromyrmex subterraneus prepare leaves and toxic baits in similar ways for their fungus garden. Neotropical Entomology. 49 (1), 12-23 (2020).
- Dorigo, A. S., et al. Projeto Primeiros Passos na Ciência: rompendo barreiras sociais e estreitando laços entre a comunidade acadêmica e o ensino médio público. Revista Brasileira de Extensão Universitária. 11 (1), 47-59 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved