È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Raccolta e mantenimento a lungo termine delle formiche tagliafoglie (Atta) in condizioni di laboratorio
In questo articolo
Riepilogo
Qui, viene descritto un protocollo per raccogliere e mantenere con successo colonie di formiche Atta (Hymenoptera: Formicidae) sane in condizioni di laboratorio. Inoltre, diversi tipi e configurazioni di nidificazione sono dettagliati insieme a possibili procedure sperimentali.
Abstract
Le formiche sono uno dei gruppi di animali più ricchi di biodiversità del pianeta e abitano ambienti diversi. Il mantenimento delle colonie di formiche in ambienti controllati consente una comprensione arricchita della loro biologia che può contribuire alla ricerca applicata. Questa pratica è solitamente impiegata negli studi di controllo della popolazione di specie che causano perdite economiche, come le formiche Atta . Per coltivare il loro fungo mutualistico, queste formiche tagliafoglie raccolgono foglie e per questo sono considerate parassiti agricoli ampiamente distribuiti in tutto il continente americano. Sono altamente organizzati socialmente e abitano nidi sotterranei elaborati composti da una varietà di camere. Il loro mantenimento in un ambiente controllato dipende da una routine quotidiana di diverse procedure e cure frequenti che sono descritte qui. Inizia con la raccolta delle regine durante la stagione riproduttiva (cioè il volo nuziale), che vengono poi trasferite individualmente in contenitori di plastica. A causa dell'alto tasso di mortalità delle regine, una seconda raccolta può essere effettuata circa 6 mesi dopo il volo nuziale, quando i nidi incipienti con batuffolo fungino sviluppato vengono scavati, raccolti a mano e collocati in contenitori di plastica. Nel laboratorio, le foglie vengono fornite quotidianamente alle colonie stabilite e i rifiuti prodotti dalle formiche vengono rimossi settimanalmente insieme al materiale vegetale secco rimanente. Mentre il giardino dei funghi continua a crescere, le colonie vengono trasferite in diversi tipi di contenitori in base allo scopo sperimentale. Le colonie di formiche tagliafoglie sono collocate in contenitori interconnessi, che rappresentano il sistema organizzativo con camere funzionali costruite da quegli insetti in natura. Questa configurazione è ideale per monitorare fattori quali la quantità di rifiuti, la salute del giardino dei funghi e il comportamento dei lavoratori e della regina. La raccolta facilitata dei dati e le osservazioni più dettagliate sono considerate il più grande vantaggio di mantenere le colonie di formiche in condizioni controllate.
Introduzione
Le formiche compongono un gruppo eterogeneo di individui che esercitano un'influenza sulla maggior parte degli ambienti terrestri1. Agiscono come efficienti dispersori 2,3,4, predatori5 e ingegneri ecosistemici 6,7,8,9,10, evidenziando la loro importanza e successo ecologico sugli ecosistemi naturali. Tutte le specie di formiche sono classificate come insetti eusociali; Tuttavia, la loro organizzazione sociale varia notevolmente tra i diversi gruppi di specie, cioè i sistemi di divisione del lavoro, i gruppi funzionali, la comunicazione tra gli individui, l'organizzazione del foraggio, la fondazione della colonia e il processo di riproduzione11. Come gruppo altamente diversificato, ricorrono a diverse risorse alimentari e comportamenti alimentari specializzati. È un dato di fatto, l'agricoltura non è stata solo un enorme passo per la civiltà umana, ma anche per le specie di formiche. Circa 55-65 Mafa 12, le formiche attine hanno iniziato a coltivare funghi e incorporarli in una dieta quasi esclusiva. Sono diventati così specializzati che hanno sviluppato interazioni rigorose, dipendenti e obbligatorie classificate come simbiosi, in cui un individuo non sopravvive senza l'altro.
Le formiche che crescono funghi inferiori raccolgono e trattano la materia organica morta, come frammenti di foglie in decomposizione, per far crescere il loro fungo mutualistico; mentre le formiche più alte che crescono funghi raccolgono materiale vegetale fresco, componendo uno dei sistemi naturali simbiotici di maggior successo13. Questa tecnica agricola altamente specializzata ha permesso loro di cogliere una nuova nicchia. Le formiche attine superiori comprendono le formiche tagliafoglie, un gruppo monofiletico che suscita tra 19 Ma (15-24 Ma) e 18 Ma (14-22 Ma)14,15,16 composto da quattro generi validi: Atta Fabricius, Acromyrmex Mayr, Amoimyrmex Cristiano e Pseudoatta Gallardo. Il sistema di agricoltura tagliafoglie eseguito dalle formiche tagliafoglie, si è evoluto dai sistemi agricoli derivati17. La maggior parte di queste specie sfrutta esclusivamente la specie fungina mutualistica Leucoagaricus gongylophorus Singer18 (chiamata anche Leucocoprinus gongylophorus Heim 19), segnando una significativa transizione evolutiva11. Le cultivar fungine sono trasmesse verticalmente, dai nidi originali alla prole, suggerendo che siano clonalmente propagate20.
Sorprendentemente, le società Atta svilupparono una complessa struttura organizzativa di enorme importanza nel loro ambiente e di grande interesse per i mirmecologi. La loro popolazione può essere composta da milioni di individui, la maggior parte dei quali operaie sterili che mostrano un accentuato polimorfismo, cioè dimensioni e morfologia anatomica distinte. La popolazione si distingue per caste in base all'età, allo stato fisiologico, al tipo morfologico, ai comportamenti e alle attività specializzate nella colonia21. I lavoratori possono essere discriminati in giardinieri e infermieri, generalisti all'interno del nido, raccoglitori ed escavatori, difensori o soldati21. Questa organizzazione consente l'esecuzione di compiti in cooperazione e un sistema auto-organizzante in grado di produrre comportamenti collettivi altamente strutturati, consentendo loro di rispondere in modo efficiente ai disturbi ambientali22.
Il ruolo di rinnovamento della popolazione è svolto da una singola regina (cioè monogina), per tutto il tempo in cui vive, costituendo la casta riproduttiva permanente22. Le regine Atta sono note per vivere per più di 20 anni, deponendo le uova per tutta la loro durata di vita23. Poiché la regina è insostituibile, la sua resistenza è cruciale per la sopravvivenza della colonia 13,20,23,24. Tuttavia, migliaia di femmine e maschi riproduttivi alati possono essere trovati nel nido durante le stagioni riproduttive, ma nessuno rimane nel nido originale, formando una casta temporanea22. Nelle colonie di Atta sexdens, quasi 3.000 femmine riproduttive e 14.000 maschi riproduttivi ne producono25. Si verifica quando una colonia raggiunge la maturità sessuale, circa 38 mesi dalla sua realizzazione, e si ripete annualmente da allora fino a quando non si estingue23,25. Le nuove colonie di Atta si stabiliscono attraverso l'aplometrosi, dove una regina inizia un nuovo nido.
Quando le condizioni ambientali sono favorevoli, i riproduttori lasciano il nido sotterraneo per iniziare il volo nuziale. Il periodo della sua presenza differisce da regione a regione, variando lungo l'anno in tutto il territorio brasiliano a seconda della specie. Tuttavia, l'evento sembra essere preceduto da precipitazioni e umidità26, che possono essere correlate alla facilitazione dello scavo dovuta all'umidità del suolo22. Frequentemente, 1-5 settimane prima del volo nuziale, gli ingressi e i canali del nido vengono allargati per facilitare la partenza degli individui riproduttivi. Prima di lasciare le loro colonie madri, le femmine alate raccolgono e immagazzinano, in una cavità infrabuccale, una porzione del fungo mutualistico20,27. Copulazioni multiple vengono eseguite a metà volo, e si calcola che una regina possa essere inseminata da tre a otto maschi (cioè poliandria) in alcune specie28, garantendo la variabilità genetica29. In seguito, le regine procedono verso il suolo, dando la preferenza a luoghi con poca o nessuna vegetazione25, dove rimuovono le ali e scavano la loro prima camera di nido. Questo è l'unico periodo in cui le regine possono essere viste al di fuori del nido. Sebbene gli individui della casta temporanea siano stati visti in nidi artificiali, non è noto se una copulazione riuscita (cioè il volo nuziale) sia stata eseguita in condizionidi laboratorio 24.
La costruzione iniziale del nido corrisponde al periodo più cruciale della colonia, che può durare da 6 h a 8 h23,25. In questo momento, la regina si chiude nella camera iniziale e, nel giro di pochi giorni, inizia l'ovideposizione. Le prime uova vengono somministrate al miceliale che la regina rigurgita, segnando l'inizio del giardino dei funghi della colonia. Le prime larve compaiono in circa 25 giorni22, e quasi alla fine del primo mese, la colonia consiste in un tappeto di funghi proliferanti, dove sono annidati gli immaturi (uova, larve e pupe) e la regina, che alleva la sua prole iniziale in isolamento23. Le uova sono anche la risorsa alimentare delle prime larve e molto consumate dalla regina13. Inoltre, la regina si sostiene con riserve di corpo grasso e catabolizzando i muscoli delle ali che non sono più utili13. La coltura fungina iniziale non viene consumata poiché la sopravvivenza della colonia dipende dal suo sviluppo e, durante questo periodo, la regina la fertilizza con liquido fecale13. Giorni dopo essere emerse, le prime operaie aprono l'ingresso del nido e iniziano un'attività di foraggiamento nelle immediate vicinanze del nido13. Incorporano il materiale raccolto come substrato del giardino dei funghi, che ora serve come cibo per i lavoratori13,22. Prima di essere aggiunto alla coltura fungina, il materiale vegetale trasportato dai lavoratori viene tagliato in piccoli pezzi e inumidito con liquido fecale13. Le formiche manipolano l'inoculo fungino per aumentarne e controllarne la crescita, che servirà per la suddivisione delle grandi camere scavate del terreno, specializzate nel condizionamento del giardino 13,22,25.
Circa 6 mesi dopo il volo nuziale, i nidi di A. sexdens contengono una camera fungina e alcuni canali. La grande specializzazione nella costruzione di nidi di formiche tagliafoglie funziona come meccanismo di difesa contro i nemici naturali e fattori ambientali sfavorevoli22. Le formiche tagliafoglie sono note per frammentare il giardino dei funghi e trasporlo in camere con elevata umidità quando le camere iniziano ad asciugarsi13. Così, nonostante lo scavo del nido abbia un costo energetico considerevole, l'energia investita viene invertita in benefici per la colonia stessa22. Con poche eccezioni, le specie Atta creano anche camere specializzate per i rifiuti della colonia, fatte principalmente di substrato fungino impoverito e corpi di formiche morte, isolandolo dal resto del nido e stabilendo un'importante strategia di immunità sociale30. Inoltre, un gruppo distinto di lavoratori manipola direttamente i rifiuti, per evitare la contaminazione di altri individui. I lavoratori si nutrono costantemente del fungo, che è la principale risorsa nutrizionale della colonia. Tuttavia, possono nutrirsi anche di linfa delle piante mentre tagliano frammenti. Il materiale vegetale è accuratamente selezionato per la manutenzione del giardino dei funghi e influenzato da molti fattori come i tratti fogliari e le proprietà dell'ecosistema13.
La strategia di foraggiamento delle formiche tagliafoglie per ottenere materiale fresco è molto complessa e, combinata con l'elevata domanda di raccolto delle colonie stabilite, comporta notevoli perdite economiche per i produttori agricoli e mette a repentaglio le aree di ripristino forestale22,31. Pertanto, queste formiche possono essere classificate come parassiti nella maggior parte delle aree in cui possono essere incontrate, che vanno dagli Stati Uniti meridionali all'Argentina nord-orientale 11,13,22,32. L'estinzione delle colonie problematiche è difficile a causa della serie di adattamenti inerenti alla biologia di questi insetti (cioè organizzazione sociale, foraggiamento, coltivazione di funghi, igiene e strutture complesse del nido)33. Pertanto, le strategie di controllo della popolazione sono distinte da quelle generalmente applicate ad altri insetti nocivi e ricorrono principalmente a interessanti offerte di esche contaminate33,34. Tuttavia, poiché queste formiche possono respingere le sostanze nocive sia per il fungo che per gli individui della colonia e compromettere i campi coltivati 33, nuovi composti naturali e alternative di controllo vengono costantemente testati33,35,36. Poiché i risultati degli esperimenti difficilmente possono essere monitorati su colonie testate sul campo, i saggi preliminari sono condotti in un ambiente controllato.
Pertanto, i protocolli sperimentali devono essere adattati ai gruppi di interesse considerando lo stile di vita eterogeneo delle formiche, sostenendo studi a livello di specie e tenendo conto delle colonie come unità operative, dove una formica è un elemento di un superorganismo complesso11. I rapporti raccolti finora riguardanti il genere Atta hanno reso possibile raccogliere e mantenere con successo le colonie in condizioni di laboratorio e riconoscere i loro bisogni di base e il loro funzionamento generale. Sulla base dei loro processi naturali come la riproduzione, la fondazione di colonie e i comportamenti alimentari, è stata sviluppata una routine di pratiche che consente la creazione a lungo termine di colonie in diversi tipi di nidi. Qui, viene descritto un protocollo procedurale per mantenere le formiche tagliafoglie in laboratorio ed evidenzia possibili ricerche generali con scopi di sperimentazione distinti e divulgazione scientifica.
Protocollo
1. Collezione di regine
- Cerca in letteratura il periodo della stagione riproduttiva di Atta nella regione di interesse. La frequenza della stagione riproduttiva, la frequenza e l'ora diurna dei voli nuziali variano a seconda delle condizioni climatiche regionali (Tabella 1). Sebbene si svolga generalmente in primavera, queste informazioni devono essere raccolte per il luogo in cui è prevista la raccolta 37,38,39,40,41,42,43,44,45,46.
- Identificare e contrassegnare i luoghi con i nidi di Atta considerati come possibili aree per la raccolta di regine e giovani colonie. Durante i voli nuziali, le regine sono disperse intorno ai luoghi del nido; Pertanto, le aree con un numero maggiore di colonie hanno maggiori possibilità di avere punti di atterraggio della regina dove iniziare nuovi scavi di nidi.
- Controllare le aree selezionate in precedenza per segni di volo nuziale durante la stagione riproduttiva delle formiche Atta . Tieni traccia delle condizioni ambientali dei giorni di volo nuziale, come il caldo e il tempo piovoso.
- Identificare i nidi di formiche tagliafoglie nelle aree selezionate in precedenza e cercare caratteristiche esterne che indichino l'imminente partenza delle formiche riproduttive alate. Le caratteristiche del nido includono ingressi del tunnel allargati (Figura 1), aumento del flusso di lavoratori che mostrano un comportamento più aggressivo nei confronti di possibili predatori e formiche riproduttive alate che appaiono agli ingressi del tunnel (Figura 1). Attenzione ai giorni di alta umidità che seguono le precipitazioni, poiché generalmente precedono i voli nuziali.
- Preparare contenitori con coperchio di plastica con uno strato di intonaco inferiore per trattenere le regine individualmente. Assicurarsi che il volume del contenitore sia di circa 200 ml e che lo strato di gesso nella parte inferiore sia alto circa 1 cm e sia altamente assorbente per il controllo dell'umidità.
NOTA: Per preparare la base in gesso, seguire le istruzioni del produttore. - Preparare un ambiente con una temperatura costante di 23 ± 1 °C e circa il 70% ± il 10% di umidità relativa. Scegli una location senza attività intense e un elevato flusso di persone per evitare vibrazioni e disturbi. Utilizzare prodotti per la pulizia di fragranza neutra per evitare interferenze nel comportamento delle formiche.
NOTA: Le fluttuazioni delle condizioni ambientali specificate possono causare condensa dell'acqua o perdita di umidità e compromettere il giardino dei funghi. - Dopo il volo nuziale, raccogli le regine senza ali che hanno iniziato lo scavo del nido e mettile con cura nei contenitori di plastica preparati con uno strato di gesso, individualmente. Evitare di toccare le regine a mani nude e utilizzare guanti in lattice o pinzette entomologiche.
NOTA: La rimozione delle ali e il comportamento di scavo del suolo indicano femmine riproduttive che hanno già copulato e, quindi, sono in grado di iniziare una nuova colonia. Anche la collezione Queens è considerata la prima collezione di questo lavoro. - Spostare i contenitori contenenti le regine nella posizione con un ambiente controllato precedentemente selezionato. Eseguire il trasporto delle regine con la massima cautela, evitando troppi disturbi e mantenendo una temperatura minima di costanza.
- Non manipolare o spostare le regine per circa 3 giorni dopo la raccolta per evitare lo stress.

Figura 1. Ingresso del nido allargato con riproduttori di formiche alate e operaie. Gli ingressi dei tunnel allargati sono una delle caratteristiche del nido che indica l'occorrenza dei voli nuziali di Atta . Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Manutenzione delle regine
- Inizialmente, aggiungere 2,5 ml di acqua allo strato di gesso del destinatario ogni 2 giorni con l'aiuto di una siringa ad ago.
- Invece di aprire il recipiente, forare accuratamente i coperchi del contenitore con l'ago per evitare disturbi dovuti alla manipolazione. Lo stesso foro può essere utilizzato durante questo periodo. Assicurarsi che l'acqua aggiunta non impregni lo strato di intonaco. Evitare di annaffiare direttamente la regina, la spugna fungina iniziale e gli eventuali immaturi. Finché il giardino dei funghi presenta un aspetto secco con assenza di acqua, irrigare lo strato di intonaco.
- Due settimane dopo la raccolta, controlla se il fungo è stato rigurgitato dalle regine. Se non ci sono funghi, trasferire circa 2 g di fungo ottenuto da una colonia stabilita. Inoltre, eseguire questo passaggio se il fungo non si sviluppa.
NOTA: Per il trasferimento di funghi, è necessario raccogliere funghi sani da una colonia stabilita e rimuovere tutte le formiche che potrebbero essere su di esso. Usa un cucchiaio, pinzette entomologiche e guanti in lattice per manipolare il fungo. - Dopo la comparsa dei primi operai, inizia a offrire regolarmente frammenti di foglie giovani e sottili, secondo l'attività di taglio della colonia. Assicurarsi che le foglie offerte siano sane e che le piante non siano state trattate con insetticidi o altre sostanze chimiche. Nelle fasi iniziali, assicurarsi che i frammenti fogliari non superino i 4 cm.
NOTA: Quando i primi lavoratori iniziano il foraggiamento delle foglie, il materiale vegetale deve essere offerto dopo la loro comparsa. La frequenza dell'offerta dipende dall'agilità con cui i lavoratori incorporano il materiale vegetale sul fungo, ma può variare fino a 2-3 giorni alla settimana. Possono essere offerti anche fiocchi d'avena e fiocchi di mais, ma dovrebbero essere alternati con foglie per evitare la secchezza dei funghi. - Quando offri nuove foglie, rimuovi i rifiuti di colonia e i frammenti di foglie secche. Evitare l'uso di profumi, creme idratanti, creme o qualsiasi sostanza con un forte odore quando si manipolano le regine. Inoltre, utilizzare guanti in lattice durante tutti i processi.
- Segui lo sviluppo della colonia e quando il giardino dei funghi raggiunge almeno la metà del volume del contenitore, trasferisci la colonia in un nido perresistente artificiale.
NOTA: Poiché il tasso di sviluppo è inerente a ciascuna colonia, non esiste un tempo stimato per il trasferimento della colonia. Di solito, le colonie della prima raccolta vengono trasferite in nidi con camera da giardino fungina di massimo 1 L, a causa del piccolo giardino dei funghi.
3. Raccolta di giovani colonie
- Acquistare contenitori di plastica di circa 500 ml di volume.
- Circa 6 mesi dopo il volo nuziale, identificare i tumuli indicativi a forma di torre con particelle di terreno granulato (Figura 1) dei nidi incipienti di Atta (Figura 2) sui luoghi con presenza di formiche tagliafoglie precedentemente marcate.
NOTA: Sei mesi dopo il volo nuziale, si stima che i nidi delle giovani colonie siano profondi fino a 1 m nel terreno. Una nuova collezione è indicata in questo periodo per ottenere maggiori possibilità di colonie di successo e durature in grandi quantità. - Con una zappa da giardino, scavare l'ingresso del nido fino a raggiungere la camera che ospita la giovane colonia. Raccogli la regina, il giardino dei funghi, gli immaturi e i giovani lavoratori e mettili nel contenitore di plastica. Eseguire il processo di raccolta nel modo più delicato possibile.
NOTA: Naturalmente, verrà raccolta anche una grande quantità di terreno che dovrebbe essere rimossa gradualmente nelle future procedure di manutenzione in laboratorio. - Spostare i contenitori con coperchio di plastica che contengono le colonie nell'ambiente controllato designato. Eseguire il trasporto di giovani colonie con la massima cautela, evitando troppi disturbi e mantenendo una costanza termica minima. Astenersi manipolando o spostando le colonie per circa 3 giorni per evitare lo stress. Se la stanza ha una routine attiva, un panno scuro può essere messo sopra le colonie.

Figura 2. Tumulo di terra a forma di torre. Il caratteristico tumulo a forma di torre indica la presenza di colonie incipienti di Atta sexdens e Atta laevigata. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Mantenimento di giovani colonie
- Fornire foglie giovani sottili 3 volte a settimana.
- Assicurarsi che le foglie offerte siano sane e che le piante non siano state trattate con insetticidi o altre sostanze chimiche. In questa fase, assicurarsi che i frammenti fogliari siano lunghi almeno 7 cm.
NOTA: Possono essere offerti anche fiocchi d'avena e fiocchi di mais, ma devono essere alternati con foglie per evitare la secchezza dei funghi. - La frequenza di offerta dipende dall'agilità con cui i lavoratori incorporano il materiale vegetale sul fungo. Con l'attività di taglio intensa, aumentare l'offerta due volte al giorno tre volte alla settimana o 5 giorni alla settimana.
- Assicurarsi che le foglie offerte siano sane e che le piante non siano state trattate con insetticidi o altre sostanze chimiche. In questa fase, assicurarsi che i frammenti fogliari siano lunghi almeno 7 cm.
- Quando offri nuove foglie, rimuovi i rifiuti della colonia, compresi i resti del suolo, con l'aiuto di un cucchiaio. Utilizzare guanti in lattice durante tutti i processi. Quando si manipolano le giovani colonie evitare l'uso di profumi, creme idratanti, creme o qualsiasi sostanza con un forte odore.
NOTA: I lavoratori stessi separeranno il terreno e i rifiuti dal fungo. - Segui lo sviluppo della colonia e quando il giardino dei funghi raggiunge almeno la metà del volume del contenitore, trasferisci la colonia in un nido perresistente artificiale.
NOTA: Poiché il tasso di sviluppo è inerente a ciascuna colonia, non esiste un tempo stimato per il trasferimento della colonia.
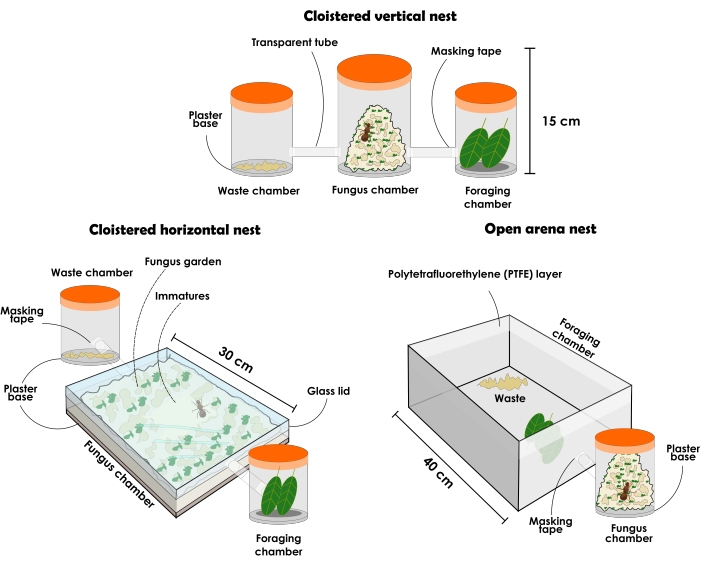
Figura 3: Tipi di nidi artificiali per contenere le colonie di Atta sexden e Atta laevigata . Illustrazione di nidi artificiali perdurevoli di formiche tagliafoglie: configurazione del nido verticale di clausura, configurazione del nido orizzontale di clausura e configurazione del nido dell'arena aperta. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Nidi artificiali perdurevoli
- Preparare una configurazione verticale di clausura del nido come descritto di seguito (Figura 3 e Figura 4).
NOTA: Le configurazioni di nido di clausura dovrebbero sempre avere destinatari diversi per posare separatamente come (1) camera da giardino dei funghi, (2) camera di smaltimento dei rifiuti e (3) camera di foraggiamento. Inizialmente, dovrebbe iniziare con tre contenitori, ma è possibile aggiungere più destinatari per aumentare il giardino dei funghi. I nidi possono variare per dimensioni e materiale in base al loro scopo sperimentale, anche se qui è descritto e raccomandato l'uso di materiali trasparenti. I contenitori devono essere senza aperture, altrimenti le formiche sfuggiranno. Il tipo di nido descritto di seguito può essere utilizzato per la ricerca generale, ma non è ben raccomandato per la raccolta di formiche assertive a causa del disturbo causato durante la rimozione del coperchio, con conseguente grande agitazione tra gli individui. Tuttavia, a causa della trasparenza del materiale, è possibile individuare la regina e le diverse caste di formiche anche quando il giardino dei funghi ha riempito l'intero contenitore. Poiché si tratta di una tendenza, si presume sempre che gli immaturi siano al centro del giardino dei funghi quando ha occupato la maggior parte dello spazio disponibile in contenitori verticali.- Selezionare un contenitore con coperchio trasparente di circa 1 L e aggiungere uno strato di 1 cm di base in gesso altamente assorbente. Questa sarà la camera del giardino dei funghi. Selezionare due contenitori trasparenti con coperchio di circa 500 ml ciascuno come camere di smaltimento dei rifiuti e di foraggiamento. Le formiche sceglieranno quale camera sarà ciascuna e, successivamente, si assicureranno che non siano scambiate.
NOTA: Per preparare la base in gesso, seguire le istruzioni del produttore. - Forare e collegare i tre contenitori con un tubo trasparente o un tubo. Se necessario, applicare del nastro adesivo sul bordo dei tubi per garantire un collegamento della coscia con i contenitori ed evitare la fuoriuscita delle formiche. Posizionare il contenitore di base in gesso al centro e gli altri contenitori sui lati opposti.
- Trasferire con cautela la spugna fungina di colonie selezionate (vedi punto 2.5 e punto 4.3) insieme alla regina, alle operaie e agli immaturi nel contenitore della base di gesso. Prima del trasferimento, assicurarsi che la base di gesso sia annaffiata. Utilizzare guanti in lattice.
- Selezionare un contenitore con coperchio trasparente di circa 1 L e aggiungere uno strato di 1 cm di base in gesso altamente assorbente. Questa sarà la camera del giardino dei funghi. Selezionare due contenitori trasparenti con coperchio di circa 500 ml ciascuno come camere di smaltimento dei rifiuti e di foraggiamento. Le formiche sceglieranno quale camera sarà ciascuna e, successivamente, si assicureranno che non siano scambiate.
- Preparare una configurazione orizzontale di clausura del nido come descritto di seguito (Figura 3 e Figura 4).
NOTA: I nidi con configurazione orizzontale consentono un'attenta osservazione del giardino dei funghi e delle attività dei lavoratori verso di esso. Poiché le porzioni più giovani del giardino dei funghi sono in cima, è possibile osservare i substrati recentemente offerti incorporati dai lavoratori. Nuove porzioni del fungo possono essere individuate dal suo colore, che sarà simile al colore dell'ultima risorsa offerta, mentre le porzioni più vecchie di solito portano un colore beige. Anche i figli e la regina possono essere facilmente individuati, poiché nei contenitori orizzontali di solito si trovano nella parte superiore del giardino dei funghi, anche quando ha occupato la maggior parte dello spazio. Questa configurazione può essere utilizzata per la ricerca focalizzata sul comportamento, il campionamento focale e scopi di divulgazione scientifica, in quanto fornisce la percezione dell'organizzazione all'interno del nido.- Acquistare un contenitore con coperchio trasparente con dimensioni di circa 31 cm x 21 cm x 4,5 cm e aggiungere uno strato di 1 cm di base in gesso altamente assorbente. Questa sarà la camera del giardino dei funghi. Selezionare due contenitori trasparenti con coperchio di circa 500 ml ciascuno come camere di smaltimento dei rifiuti e di foraggiamento. Le formiche sceglieranno quale camera sarà ciascuna e, successivamente, si assicureranno che non siano scambiate.
NOTA: Per preparare la base in gesso, seguire le istruzioni del produttore. Se necessario, chiudere il poco spazio tra il coperchio e il contenitore con del nastro adesivo per evitare che le formiche fuoriescano. - Perforare e collegare i contenitori con un tubo trasparente o un tubo. Se necessario, applicare del nastro adesivo sul bordo dei tubi per garantire un collegamento della coscia con i contenitori ed evitare la fuoriuscita delle formiche. Posizionare il contenitore di base in gesso al centro e gli altri contenitori sui lati opposti.
- Trasferire con cautela la spugna fungina di colonie selezionate (vedi punto 2.5 e punto 4.3) insieme alla regina, alle operaie e agli immaturi nel contenitore della base di gesso. Prima del trasferimento, assicurarsi che la base di gesso sia annaffiata. Utilizzare guanti in lattice.
- Acquistare un contenitore con coperchio trasparente con dimensioni di circa 31 cm x 21 cm x 4,5 cm e aggiungere uno strato di 1 cm di base in gesso altamente assorbente. Questa sarà la camera del giardino dei funghi. Selezionare due contenitori trasparenti con coperchio di circa 500 ml ciascuno come camere di smaltimento dei rifiuti e di foraggiamento. Le formiche sceglieranno quale camera sarà ciascuna e, successivamente, si assicureranno che non siano scambiate.
- Preparare una configurazione di nido dell'arena aperta come descritto di seguito (Figura 3 e Figura 5).
NOTA: I nidi dell'arena aperta consentono la raccolta di formiche senza grandi disturbi e l'analisi del comportamento di foraggiamento. Possono anche fornire una rappresentazione affidabile di una colonia trovata in natura per scopi di divulgazione scientifica.- Selezionare un contenitore con coperchio trasparente di circa 1 L e aggiungere uno strato di 1 cm di base di intonaco altamente assorbente. Questa sarà la camera del giardino dei funghi.
NOTA: Si consiglia di iniziare con contenitori da 1 litro e passare gradualmente a contenitori con volumi più elevati per un giardino di funghi più grande. Tuttavia, i contenitori non devono superare un volume di 5 L. Aggiungere tutti i contenitori necessari. - Seleziona un'arena aperta. Le dimensioni dell'arena possono variare in base agli scopi di studio. Se viene selezionata un'arena di grandi dimensioni, posizionare i contenitori che contengono il giardino dei funghi al suo interno (Figura 5). Nel caso di una piccola arena, collegarla al contenitore del giardino dei funghi con un tubo o un tubo trasparente (Figura 3). L'arena fungerà da camera di foraggiamento e smaltimento dei rifiuti, quindi assicurati che non sia troppo piccola.
- Applicare uno strato di liquido in politetrafluoroetilene in un unico movimento sul bordo dell'arena per contenere le formiche. Utilizzare un cotone imbevuto di liquido e un guanto di nitrile.
ATTENZIONE: Evitare l'inalazione e il contatto con la pelle durante l'utilizzo di liquido di politetrafluoroetilene. - Trasferire con cautela la spugna fungina di colonie selezionate (vedi punto 2.5 e punto 4.3) insieme alla regina, alle operaie e agli immaturi nel contenitore della base di gesso. Prima del trasferimento, assicurarsi che la base di gesso sia annaffiata. Utilizzare guanti in lattice.
- Selezionare un contenitore con coperchio trasparente di circa 1 L e aggiungere uno strato di 1 cm di base di intonaco altamente assorbente. Questa sarà la camera del giardino dei funghi.

Figura 4: Nidi artificiali di clausura delle formiche tagliafoglie Atta sexdens e Atta laevigata. Allestimento verticale del nido di clausura superiore (A) e vista laterale (B); nido orizzontale di clausura superiore (C) e vista laterale (D). Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Nido artificiale ad arena aperta delle formiche tagliafoglie Atta sexdens e Atta laevigata. Configurazione del nido dell'arena aperta della parte superiore (A) e della vista laterale (B) dei sexden di Atta. 1) Camere da giardino fungine; 2) Rifiuti; 3) Fette d'arancia; 4) Vetro con strato di politetrafluoretilene (PTFE). Fare clic qui per visualizzare una versione ingrandita di questa figura.
6. Mantenimento delle colonie sviluppate
- Offri quotidianamente almeno una foglia grande nella camera di foraggiamento per colonia con 1 L di giardino di funghi. Se l'attività di taglio delle formiche è intensa, aumentare il numero di foglie. Se il fungo è secco, pre-inumidire le foglie per fornire umidità extra. Nei nidi di clausura, eseguire rapidamente l'offerta per evitare che le formiche fuoriescano dalla camera di foraggiamento.
NOTA: Qui, le foglie sono raccolte da specie vegetali come gelso (Morus nigra), mango (Mangifera indica), eucalipto (Eucalyptus sp.), jambolan (Syzygium cumini), ibisco (Hibiscus sp.), acalypha (Acalypha wilkesiana) e ligustrum (Ligustrum lucidum).- Offri frutta come arancia e mela, avena e corn flakes per diversificare e completare la dieta. Alle grandi colonie con intensa attività di foraggiamento, offri fiocchi d'avena e fiocchi di mais ogni giorno e frutta una volta alla settimana. Se non è il caso, offri fiocchi alternativamente con foglie, ma non più di tre volte a settimana e frutta una o due volte al mese. Regolare la quantità e la frequenza di ciascun alimento in base all'attività di foraggiamento delle formiche.
- Se le opzioni sopra descritte non sono disponibili, identificare la preferenza di foraggiamento delle formiche tra foglie, fiori e frutti di alberi e arbusti regionali, o anche verdure, cereali e altri fiocchi commercializzati. Evita di offrire risorse con composti chimici difensivi e pesticidi.
- Rimuovere tutto il contenuto della camera di scarico ogni 2 settimane da tutte le colonie. Rimuovere anche i lavoratori per scopi di controllo della popolazione. Se i lavoratori trasferiscono funghi sani nella camera dei rifiuti, assicurarsi che la regina non sia su di esso e rimuoverlo. Se la quantità di rifiuti smaltiti è elevata o è troppo umida, rimuoverla una volta alla settimana.
- Rimuovere il materiale non prelevato dalle formiche dalla camera di foraggiamento ogni volta che ne offrono di nuovi e assicurarsi che sia sempre pulito.
- Se i lavoratori trasferiscono funghi sani nella camera di foraggiamento, disturbarla, lasciare aperto il coperchio del contenitore e applicare talco neutro sulla superficie del margine della camera. Eseguire questa procedura solo se c'è ancora spazio sulla camera del fungo, in questo modo i lavoratori trasferiranno il fungo nel contenitore senza perderlo o eventuali immaturi.
- Se si desidera più giardino di funghi, aggiungere un altro contenitore intonacato e spostare una parte della spugna fungina in esso. Fino a quando il fungo raggiunge la metà del contenitore, aggiungere foglie nella camera del fungo. La crescita del giardino dei funghi dovrebbe avvenire gradualmente per non compromettere l'equilibrio della colonia. Se si desidera un contenitore più grande, assicurarsi di lasciare che il fungo occupi l'intero spazio dei contenitori più piccoli prima di trasferirlo. I rifiuti di colonia e le foglie secche non devono essere lasciati accumulare nella camera del giardino dei funghi.
- Controllare la base di gesso dai contenitori, poiché con il tempo potrebbe acquisire un colore marrone scuro e diventare inefficace a causa dell'escrezione delle formiche, del trasporto di materiali di scarto e dell'alta concentrazione di umidità. Inoltre, alcune colonie possono tagliare lo strato e smaltirlo. In questi casi, trasferire il giardino dei funghi in un nuovo contenitore intonacato.
Risultati
Un diagramma di flusso che illustra il processo di raccolta delle formiche è mostrato nella Figura 6. Qui vengono mostrati alcuni risultati ottenuti utilizzando il protocollo di raccolta, manutenzione e configurazioni del nido sopra descritto.
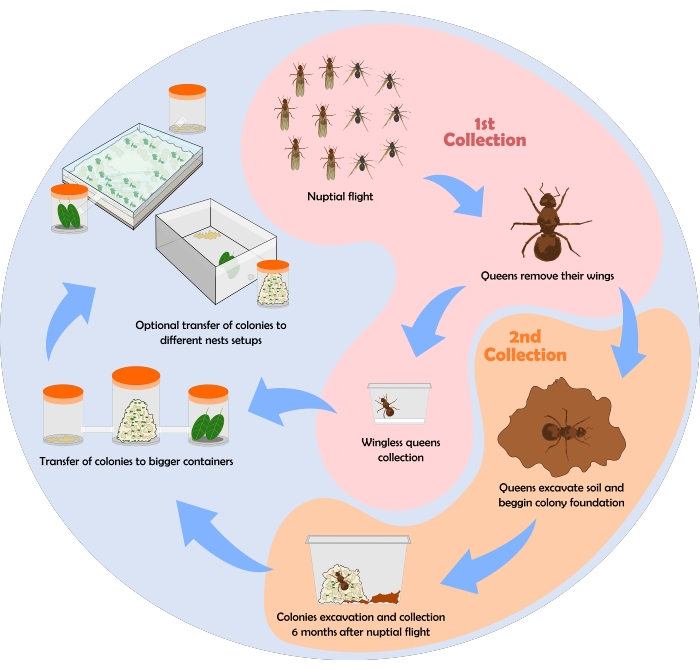
Figura 6: Diagramma di flusso per la raccolta delle colo...
Discussione
Il protocollo qui descritto per mantenere le colonie di formiche tagliafoglie è stato sviluppato e applicato per oltre tre decenni in modo assertivo e replicabile. Ha permesso lo sviluppo di ricerche che sarebbero state limitate dalle condizioni del campo. In tal modo, formiche e colonie sane sono diventate disponibili per la ricerca in diverse aree come morfologia comparativa, tossicologia 51,52, istologia53 e microbiologia54,55,56<...
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Dedicato a Mario Autuori (in memoriam) e Walter Hugo de Andrade Cunha che hanno contribuito notevolmente agli studi sulle formiche tagliafoglie. Riconosciamo il sostegno dell'Università Statale di San Paolo e dell'Istituto di Bioscienze. Questo studio è stato in parte finanziato dal Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES) - Codice finanziario 001, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) e Fundação para o Desenvolvimento da UNESP (Fundunesp).
Materiali
| Name | Company | Catalog Number | Comments |
| Entomologic forceps | N/A | N/A | N/A |
| Glass tank | N/A | N/A | Tempered glass, custom made |
| Hose | N/A | N/A | Transparent, PVC 1/2 Inch x 2,0 mm |
| Latex gloves | Descarpack | 550301 | N/A |
| Nitrile gloves | Descarpack | 433301 | N/A |
| Open arena | N/A | N/A | Polypropylene crate |
| Plaster pouder | N/A | N/A | Plaster pouder used in construction, must be absorbant |
| Plastic Containers for collection | Prafesta | Natural Cód.: 8231/Natural Cód.: 8262 | Lidded, transparent , polypropylene |
| Plastic containers for nests | Prafesta | Discontinued | Polystyrene, hermetic |
| Teflon | Dupont | N/A | Polytetrafluoroethylene liquid (PTFE Dispertion 30) |
Riferimenti
- Wilson, E. O. . The Insect Societies. , (1971).
- Ortiz, D. P., Elizalde, L., Pirk, G. I. Role of ants as dispersers of native and exotic seeds in an understudied dryland. Ecological Entomology. 46 (3), 626-636 (2021).
- Christianini, A. V., Oliveira, P. S. Birds and ants provide complementary seed dispersal in a neotropical savanna. Journal of Ecology. 98 (3), 573-582 (2010).
- Camargo, P. H. S. A., Martins, M. M., Feitosa, R. M., Christianini, A. V. Bird and ant synergy increases the seed dispersal effectiveness of an ornithochoric shrub. Oecologia. 181 (2), 507-518 (2016).
- Sanders, D., van Veen, F. J. F. Ecosystem engineering and predation: the multi-trophic impact of two ant species. Journal of Animal Ecology. 80 (3), 569-576 (2011).
- Swanson, A. C., et al. Welcome to the Atta world: A framework for understanding the effects of leaf-cutter ants on ecosystem functions. Functional Ecology. 33 (8), 1386-1399 (2019).
- Meyer, S. T., et al. Leaf-cutting ants as ecosystem engineers: topsoil and perturbations around Atta cephalotes nests reduce nutrient availability. Ecological Entomology. 38 (5), 497-504 (2013).
- Sosa, B., Brazeiro, A. Positive ecosystem engineering effects of the ant Atta vollenweideri on the shrub Grabowskia duplicata. Journal of Vegetation Science. 21 (3), 597-605 (2010).
- De Almeida, T., et al. Above- and below-ground effects of an ecosystem engineer ant in Mediterranean dry grasslands. Proceedings of the Royal Society B: Biological Sciences. 287 (1935), 20201840 (2020).
- Folgarait, P. J. Ant biodiversity and its relationship to ecosystem functioning: a review. Biodiversity & Conservation. 7 (9), 1221-1244 (1998).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Barrera, C. A., Sosa-Calvo, J., Schultz, T. R., Rabeling, C., Bacci, M. Phylogenomic reconstruction reveals new insights into the evolution and biogeography of Atta leaf-cutting ants (Hymenoptera: Formicidae). Systematic Entomology. 47 (1), 13-35 (2021).
- Hölldobler, B., Wilson, E. O. . The Leafcutter Ants: Civilization By Instinct. , (2011).
- Branstetter, M. G., et al. Dry habitats were crucibles of domestication in the evolution of agriculture in ants. Proceedings of the Royal Society B: Biological Sciences. 284 (1852), 20170095 (2017).
- Solomon, S. E., et al. The molecular phylogenetics of Trachymyrmex Forel ants and their fungal cultivars provide insights into the origin and coevolutionary history of ‘higher-attine’ ant agriculture. Systematic Entomology. 44 (4), 939-956 (2019).
- Cristiano, M. P., Cardoso, D. C., Sandoval-Gómez, V. E., Simões-Gomes, F. C. Amoimyrmex Cristiano, Cardoso & Sandoval, gen. nov. (Hymenoptera: Formicidae): a new genus of leaf-cutting ants revealed by multilocus molecular phylogenetic and morphological analyses. Austral Entomology. 59 (4), 643-676 (2020).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences of the United States of America. 105 (14), 5435-5440 (2008).
- Mueller, U. G., et al. Phylogenetic patterns of ant–fungus associations indicate that farming strategies, not only a superior fungal cultivar, explain the ecological success of leafcutter ants. Molecular Ecology. 27 (10), 2414-2434 (2018).
- Mueller, U. G., et al. Biogeography of mutualistic fungi cultivated by leafcutter ants. Molecular Ecology. 26 (24), 6921-6937 (2017).
- Weber, N. A. The fungus-culturing behavior of ants. American Zoologist. 12 (3), 577-587 (1972).
- Wilson, E. O. Caste and division of labor in leaf-cutter ants (Hymenoptera: Formicidae: Atta). Behavioral Ecology and Sociobiology. 7 (2), 157-165 (1980).
- Della Lucia, T. M. C. Formigas cortadeiras: da bioecologia ao manejo. Viçosa Editora UFV. 421, (2011).
- Autuori, M. Contribuição para o conhecimento da saúva (Atta spp). I. Evolução do sauveiro (Atta sex dens rubolpilosa Forel, 1908). Arquivos do Instituto Biologico Saul Paulo. 12, 197-228 (1941).
- Bueno, O. C., Hebling, M. J. A., Schneider, M. O., Pagnocca, F. C. Ocorrência de formas aladas de Atta sexdens rubropilosa Forel (Hymenoptera: Formicidae) em colônias de laboratório. Neotropical Entomology. 31 (3), 469-473 (2002).
- Mariconi, F. A. M. Biologo. As Saúvas. , (2021).
- Bento, J. M. S. . Condições climáticas para o vôo nupcial e reconhecimento dos indivíduos em Atta sexdens rubropilosa (Hymenoptera: Formicidae). , (1993).
- Little, A. E. F., Murakami, T., Mueller, U. G., Currie, C. R. The infrabuccal pellet piles of fungus-growing ants. Naturwissenschaften. 90 (12), 558-562 (2003).
- Kerr, W. E. Acasalamento de rainhas com vários machos em duas espécies da tribo Attini. Revista Brasileira de Biologia. 21, 45-48 (1961).
- Kerr, W. E. Tendências evolutivas na reprodução dos himenópteros sociais. Arquivos do Museu Nacional. 52, (1962).
- Cremer, S., Armitage, S. A. O., Schmid-Hempel, P. Social immunity. Current Biology. 17 (16), 693-702 (2007).
- Hernández, J. V., Jaffé, K. Dano econômico causado por populações de formigas Atta laevigata (F. Smith) em plantações de Pinus caribaea (Mor.) e elementos para o manejo da praga. Anais da Sociedade Entomológica do Brasil. 24 (2), 287-298 (1995).
- Kempf, W. W. Catálogo abreviado das formigas da Região Neotropical Studia Entomologica. antbase.org. 15, 3 (1972).
- Della Lucia, T. M. C., Gandra, L. C., Guedes, R. N. C. Managing leaf-cutting ants: peculiarities, trends and challenges. Pest Management Science. 70 (1), 14-23 (2013).
- Boaretto, M. A. C., Forti, L. C. Perspectivas no controle de formigas-cortadeiras. Série Técnica IPEF. 11 (30), 31-46 (1997).
- Folgarait, P. J., Goffré, D. Conidiobolus lunulus, a newly discovered entomophthoralean species, pathogenic and specific to leaf-cutter ants. Journal of Invertebrate Pathology. 186, 107685 (2021).
- Cardoso, S. R. S., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Pathogenicity of filamentous fungi towards Atta sexdens rubropilosa (Hymenoptera: Formicidae). International Journal of Tropical Insect Science. 42 (2), 1215-1223 (2022).
- Ichinose, K., Rinaldi, I., Forti, L. C. Winged leaf-cutting ants on nuptial flights used as transport by Attacobius spiders for dispersal. Ecological Entomology. 29 (5), 628-631 (2004).
- Pagnocca, F. C., Rodrigues, A., Nagamoto, N. S., Bacci, M. Yeasts and filamentous fungi carried by the gynes of leaf-cutting ants. Antonie Van Leeuwenhoek. 94 (4), 517-526 (2008).
- Attili-Angelis, D., et al. Novel Phialophora species from leaf-cutting ants (tribe Attini). Fungal Diversity. 65 (1), 65-75 (2014).
- Delabie, J. H. C., do Nascimento, I. C., Mariano, C. S. F. Estratégias de reprodução e dispersão em formigas attines, com exemplos do sul da Bahia. XIX Congresso Brasileiro de Entomologia. , 16-21 (2002).
- Fjerdingstad, E. J., Boomsma, J. J. Variation in size and sperm content of sexuals in the leafcutter ant Atta colombica. Insectes Sociaux. 44 (3), 209-218 (1997).
- Currie, C. R., Mueller, U. G., Malloch, D. The agricultural pathology of ant fungus gardens. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7998-8002 (1999).
- Moser, J. C., et al. Eye size and behaviour of day-and night-flying leafcutting ant alates. Journal of Zoology. 264 (1), 69-75 (2004).
- Moreira, S. M., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Absence of the parasite Escovopsis in fungus garden pellets carried by gynes of Atta sexdens. Sociobiology. 62 (1), 34-38 (2015).
- Arcuri, S. L., et al. Yeasts found on an ephemeral reproductive caste of the leaf-cutting ant Atta sexdens rubropilosa. Antonie Van Leeuwenhoek. 106 (3), 475-487 (2014).
- Staab, M., Kleineidam, C. J. Initiation of swarming behavior and synchronization of mating flights in the leaf-cutting ant Atta vollenweideri FOREL, 1893 (Hymenoptera: Formicidae). Myrmecol. News. 19, 93-102 (2014).
- Gálvez, D., Chapuisat, M. Immune priming and pathogen resistance in ant queens. Ecology and Evolution. 4 (10), 1761-1767 (2014).
- Baer, B., Armitage, S. A. O., Boomsma, J. J. Sperm storage induces an immunity cost in ants. Nature. 441 (7095), 872-875 (2006).
- Carlos, A. A. . Semioquímicos e comunicação sonora em formigas cortadeiras (Hymenoptera: Formicidae). , (2013).
- Veja um FORMIGUEIRO por DENTRO. Boravê Available from: https://youtu.be/sN99x_Rjf90 (2021)
- Ortiz, G., Vieira, A. S., Bueno, O. C. Toxicological and morphological comparative studies of insecticides action in leaf-cutting ants. International Journal of Agriculture Innovations and Research. 6 (3), 516-522 (2017).
- Decio, P., Silva-Zacarin, E. C. M., Bueno, F. C., Bueno, O. C. Toxicological and histopathological effects of hydramethylnon on Atta sexdens rubropilosa (Hymenoptera: Formicidae) workers. Micron. 45, 22-31 (2013).
- Vieira, A. S., Morgan, E. D., Drijfhout, F. P., Camargo-Mathias, M. I. Chemical composition of metapleural gland secretions of fungus-growing and non-fungus-growing ants. Journal of Chemical Ecology. 38 (10), 1289-1297 (2012).
- Vieira, A. S., Ramalho, M. O., Martins, C., Martins, V. G., Bueno, O. C. Microbial communities in different tissues of Atta sexdens rubropilosa leaf-cutting ants. Current Microbiology. 74 (10), 1216-1225 (2017).
- Ramalho, M. d. e. O., Martins, C., Morini, M. S. C., Bueno, O. C. What can the bacterial community of Atta sexdens (Linnaeus, 1758) tell us about the habitats in which this ant species evolves. Insects. 11 (6), 332 (2020).
- Machado, L. M., et al. Attractivity or repellence: relation between the endophytic fungi of Acalypha, Colocasia and the leaf-cutting ants—Atta sexdens. Advances in Entomology. 9 (2), 85-99 (2021).
- Moreira, A., Forti, L. C., Andrade, A. P., Boaretto, M. A., Lopes, J. Nest architecture of Atta laevigata (F. Smith, 1858) (Hymenoptera: Formicidae). Studies on Neotropical Fauna and Environment. 39 (2), 109-116 (2004).
- Della Lucia, T. M. C., Moreira, D. D. O., Oliveira, M. A., Araújo, M. S. Perda de peso de rainhas de Atta durante a fundação e o estabelecimento das colônias. Revista Brasileira de Biologia. 55 (4), 533-536 (1995).
- Fujihara, R. T., Camargo, R. d. a. S., Forti, L. C. Lipid and energy contents in the bodies of queens of Atta sexdens rubropilosa Forel (Hymenoptera, Formicidae): pre-and post-nuptial flight. Revista Brasileira de Entomologia. 56 (1), 73-75 (2012).
- da Silva Camargo, R., Forti, L. C. Queen lipid content and nest growth in the leaf cutting ant (Atta sexdens rubropilosa) (Hymenoptera: Formicidae). Journal of Natural History. 47, 65-73 (2013).
- Camargo, R. S., Forti, L. C., Fujihara, R. T., Roces, F. Digging effort in leaf-cutting ant queens (Atta sexdens rubropilosa) and its effects on survival and colony growth during the claustral phase. Insectes Sociaux. 58 (1), 17-22 (2011).
- Mota Filho, T. M. M., Garcia, R. D. M., Camargo, R. S., Stefanelli, L. E. P., Forti, L. C. Observations about founding queens (Atta sexdens) and their unusual behavior. International Journal of Agriculture Innovations and Research. 9, 352-357 (2021).
- Barcoto, M. O., Pedrosa, F., Bueno, O. C., Rodrigues, A. Pathogenic nature of Syncephalastrum in Atta sexdens rubropilosa fungus gardens. Pest Management Science. 73 (5), 999-1009 (2017).
- Silva, A., Bacci, M., Pagnocca, F. C., Bueno, O. C., Hebling, M. J. A. Production of polysaccharidases in different carbon sources by Leucoagaricus gongylophorus Möller (Singer), the symbiotic fungus of the leaf-cutting ant Atta sexdens Linnaeus. Curr. Microbiology. 53 (1), 68-71 (2006).
- Majoe, M., Libbrecht, R., Foitzik, S., Nehring, V. Queen loss increases worker survival in leaf-cutting ants under paraquat-induced oxidative stress. Philosophical Transactions of the Royal Society B. 376 (1823), 20190735 (2021).
- Della Lucia, T. M. C., Peternelli, E. F. O., Lacerda, F. G., Peternelli, L. A., Moreira, D. D. O. Colony behavior of Atta sexdens rubropilosa (Hymenoptera: Formicidae) in the absence of the queen under laboratory conditions. Behavioural Processes. 64 (1), 49-55 (2003).
- Sales, T. A., Toledo, A. M. O., Zimerer, A., Lopes, J. F. S. Foraging for the fungus: why do Acromyrmex subterraneus (Formicidae) queens need to forage during the nest foundation phase. Ecological Entomology. 46 (6), 1364-1372 (2021).
- Forti, L. C., et al. Do workers from subspecies Acromyrmex subterraneus prepare leaves and toxic baits in similar ways for their fungus garden. Neotropical Entomology. 49 (1), 12-23 (2020).
- Dorigo, A. S., et al. Projeto Primeiros Passos na Ciência: rompendo barreiras sociais e estreitando laços entre a comunidade acadêmica e o ensino médio público. Revista Brasileira de Extensão Universitária. 11 (1), 47-59 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon