A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
איסוף ותחזוקה ארוכת טווח של נמלים חותכות עלים (Atta) בתנאי מעבדה
In This Article
Summary
כאן מתואר פרוטוקול לאיסוף ושמירה על מושבות נמלים בריאות מסוג Atta (Hymenoptera: Formicidae) בתנאי מעבדה. בנוסף, סוגי קנים ותצורות שונות מפורטים יחד עם הליכים ניסיוניים אפשריים.
Abstract
נמלים הן אחת הקבוצות המגוונות ביותר מבחינה ביולוגית של בעלי חיים על פני כדור הארץ ומאכלסות סביבות שונות. תחזוקת מושבות נמלים בסביבות מבוקרות מאפשרת הבנה מועשרת של הביולוגיה שלהן שיכולה לתרום למחקר יישומי. נוהג זה משמש בדרך כלל במחקרי בקרת אוכלוסייה של מינים הגורמים להפסד כלכלי, כגון נמלי אטא. כדי לטפח את הפטרייה ההדדית שלהם, נמלים חותכות עלים אלה אוספות עלים ולשם כך נחשבות למזיקים חקלאיים הנפוצים ברחבי יבשת אמריקה. הם מאורגנים חברתית מאוד ומאכלסים קנים תת-קרקעיים מורכבים המורכבים ממגוון תאים. תחזוקתם בסביבה מבוקרת תלויה בשגרה יומית של מספר נהלים וטיפול תכוף המתוארים כאן. זה מתחיל עם אוסף של מלכות במהלך עונת הרבייה (כלומר, טיסת נישואין), אשר מועברים בנפרד למכלי פלסטיק. בשל שיעור התמותה הגבוה של מלכות, איסוף שני יכול להתבצע כ -6 חודשים לאחר טיסת הנישואין, כאשר קינים עם פטריות מפותחות נחפרים, נקטפים ביד ומונחים במיכלי פלסטיק. במעבדה, עלים מסופקים מדי יום למושבות מבוססות, ופסולת המיוצרת על ידי נמלים מוסרת מדי שבוע יחד עם שאריות חומר צמחי יבש. ככל שגינת הפטריות ממשיכה לגדול, מושבות מועברות לסוגים שונים של מכולות בהתאם למטרת הניסוי. מושבות נמלים חותכות עלים ממוקמות במיכלים מחוברים, המייצגים את המערכת הארגונית עם תאים פונקציונליים שנבנו על ידי אותם חרקים בטבע. מערך זה אידיאלי לניטור גורמים כגון כמות פסולת, בריאות פטריות בגינה והתנהגות העובדים והמלכה. איסוף נתונים קל ותצפיות מפורטות יותר נחשבים ליתרון הגדול ביותר של שמירה על מושבות נמלים בתנאים מבוקרים.
Introduction
נמלים מרכיבות קבוצה מגוונת של פרטים המשפיעים על רוב הסביבות היבשתיות1. הם פועלים כמפזרים יעילים 2,3,4, טורפים5 ומהנדסי מערכות אקולוגיות 6,7,8,9,10, ומדגישים את חשיבותם והצלחתם האקולוגית במערכות אקולוגיות טבעיות. כל מיני הנמלים מסווגים כחרקים אאוסוציאליים; עם זאת, הארגון החברתי שלהם משתנה מאוד בין קבוצות מינים שונות, כלומר, מערכות חלוקת עבודה, קבוצות פונקציונליות, תקשורת בין פרטים, ארגון מספוא, יסוד מושבה ותהליך רבייה11. כקבוצה מגוונת מאוד, הם פונים למספר משאבי מזון והתנהגויות האכלה מיוחדות. לאמיתו של דבר, החקלאות לא היתה רק צעד ענק עבור הציוויליזציה האנושית, אלא גם עבור מיני נמלים. לפניכ-55 עד 65 מא לפני 12, נמלי אטין החלו להתרבות פטריות ולשלב אותן בתזונה כמעט בלעדית. הם התמחו עד כדי כך שהם פיתחו אינטראקציות קפדניות, תלויות ומחייבות המסווגות כסימביוזה, שבה אדם אחד אינו שורד ללא השני.
נמלים שמגדלות פטריות נמוכות יותר אוספות ומעבדות חומר אורגני מת, כגון שברי עלים נרקבים, כדי לגדל את הפטרייה ההדדית שלהן; בעוד נמלים הגדלות פטריות גבוהות יותר קוטפות חומר צמחי טרי, ומרכיבות את אחת המערכות הטבעיות הסימביוטיות המוצלחות ביותר13. טכניקה חקלאית מיוחדת זו אפשרה להם לתפוס נישה חדשה. נמלי האטין הגבוהות יותר כוללות את הנמלים חותכות העלים, קבוצה מונופילטית המעוררת בין 19 מא (15-24 מא) ו-18 מא (14-22 מא)14,15,16 המורכבת מארבעה סוגים תקפים: אטא פבריציוס, אקרומירמקס מאייר, אמוימירמקס כריסטיאנו ופסאודוטה גאלארדו. מערכת החקלאות חותכת העלים המבוצעת על ידי הנמלים חותכות העלים, התפתחה ממערכות חקלאות נגזרות17. רוב המינים הללו מנצלים באופן בלעדי את מין הפטרייה ההדדית Leucoagaricus gongylophorus Singer18 (נקרא גם Leucocoprinus gongylophorus Heim 19), מה שמסמן מעבר אבולוציוני משמעותי 11. זני הפטריות מועברים אנכית, מקינים מקוריים לצאצאים, מה שמרמז על כך שהם מופצים באופן משובט20.
למרבה הפלא, חברות עטא פיתחו מבנה ארגוני מורכב בעל חשיבות עצומה בסביבתן ועניין רב למירמקולוגים. אוכלוסייתן יכולה להיות מורכבת ממיליוני פרטים, רובם עובדות סטריליות המציגות פולימורפיזם מודגש, כלומר גודל מובחן ומורפולוגיה אנטומית. האוכלוסייה נבדלת על ידי קאסטות על פי גיל, מצב פיזיולוגי, סוג מורפולוגי, התנהגויות ופעילויות מיוחדות במושבה21. ניתן להפלות את העובדים לגננים ואחיות, גנרלים בתוך הקן, מגדלים וחופרים, ומגינים או חיילים21. ארגון זה מאפשר ביצוע משימות בשיתוף פעולה ומערכת ארגון עצמי שיכולה לייצר התנהגויות קולקטיביות מובנות מאוד, ומאפשרת להם להגיב ביעילות להפרעות סביבתיות22.
את תפקיד התחדשות האוכלוסייה ממלאת מלכה אחת (כלומר, מונוגנית), כל עוד היא חיה, המהווה את קאסטת הרבייה הקבועה22. ידוע כי מלכות אטא חיות יותר מ-20 שנה, ומטלות ביצים לאורך כל תוחלת החיים שלהן23. מכיוון שלמלכה אין תחליף, הסיבולת שלה חיונית להישרדותה של המושבה 13,20,23,24. עם זאת, אלפי נקבות וזכרים בעלי כנף נמצאים בקן בעונות הרבייה, אך אף אחד מהם לא נשאר בקן המקורי, ויוצר קאסטהזמנית 22. במושבות Atta sexdens מיוצרים כמעט 3,000 נקבות רבייה ו-14,000 זכרי רבייה25. היא מתרחשת כאשר מושבה מגיעה לבגרות מינית, כ-38 חודשים מיישומה, וחוזרת על עצמה מדי שנה מאז ועד לכיבויה23,25. מושבות אטא חדשות מוקמות באמצעות הפלומטרוזיס, שם מלכה אחת מתחילה קן חדש.
כאשר התנאים הסביבתיים נוחים, המשכפלים עוזבים את הקן התת-קרקעי כדי להתחיל את טיסת הנישואין. תקופת התרחשותו משתנה לפי אזור, ונעה לאורך השנה ברחבי השטח הברזילאי בהתאם למין. עם זאת, נראה כי לאירוע קדמו גשמים וגובה לחות26, אשר יכול להיות קשור להקלה על החפירה בשל לחות הקרקע22. לעתים קרובות, 1-5 שבועות לפני טיסת הנישואין, כניסות הקן ותעלות מורחבות כדי להקל על הרבייה לעזוב. לפני שהן עוזבות את מושבות האם שלהן, הנקבות המכונפות אוספות ומאחסנות, בחלל תת-קרקעי, חלק מהפטרייה ההדדית20,27. מספר רב של זיווגים מבוצעים באמצע הטיסה, ומחושב כי מלכה אחת יכולה להיות מוזרעת על ידי שלושה עד שמונה זכרים (כלומר, פוליאנדריה) במינים מסוימים28, מה שמבטיח שונות גנטית29. לאחר מכן, המלכות ממשיכות לאדמה, תוך מתן עדיפות למקומות ללא או מעט צמחייה25, שם הן מסירות את כנפיהן וחופרות את חדר הקן הראשון שלהן. זו התקופה היחידה שבה ניתן לראות מלכות מחוץ לקן. אף על פי שפרטים מהקאסטה הזמנית נראו בקנים מלאכותיים, לא ידוע אם כל התנגשות מוצלחת (כלומר, טיסת נישואין) בוצעה בתנאי מעבדה24.
בניית הקן הראשונית תואמת את התקופה הקריטית ביותר של המושבה, שיכולה להימשך בין 6 שעות ל 8 שעות23,25. ברגע זה, המלכה cloisters עצמה בחדר הראשוני, ובתוך ימים ספורים, oviposition מתחיל. הביצים הראשונות מוזנות לתפטיר שהמלכה משחזרת, ומסמן את תחילתו של גן הפטריות של המושבה. הזחלים הראשונים מופיעים בערך 25 ימים22, וכמעט בסוף החודש הראשון, המושבה מורכבת מחצלת של פטריות מתרבות, שבה מקננים לא בוגרים (ביצים, זחלים וגלמים), והמלכה, שמגדלת את צאצאיה הראשונים בבידוד23. ביצים הן גם משאב המזון של הזחלים הראשונים ונצרכים מאוד על ידי המלכה13. בנוסף, המלכה מקיימת את עצמה עם עתודות שומן בגוף ושרירי כנף קטבולים שכבר אינם בשימוש13. תרבות הפטרייה הראשונית אינה נצרכת שכן הישרדות המושבה תלויה בהתפתחותה, ובתקופה זו המלכה מפרה אותה בנוזל צואה13. ימים ספורים לאחר ההתעוררות, העובדים הראשונים פותחים את הכניסה לקן ומתחילים בפעילות זיוף באזור המיידי של הקן13. הם משלבים את החומר שנאסף כמצע של גן הפטריות, המשמש כיום כמזון לעובדים13,22. לפני שמוסיפים אותו לתרבית הפטריות, החומר הצמחי שמכניסים העובדים נחתך לחתיכות קטנטנות ומרטיב בנוזל צואה13. הנמלים מתמרנות את הפטרייה כדי להגביר ולשלוט בצמיחתה, אשר תשמש לחלוקת תאים גדולים שנחפרו באדמה, המתמחה במיזוג הגן 13,22,25.
כ-6 חודשים לאחר טיסת הנישואין, קינים של A. sexdens מכילים תא פטריות וכמה ערוצים. ההתמחות הגדולה בבניית קני נמלים חותכות עלים פועלת כמנגנון הגנה מפני אויבים טבעיים וגורמים סביבתיים שליליים22. ידוע כי נמלים חותכות עלים קוטעות את גינת הפטריות ומעבירות אותה לתאים בלחות גבוהה כאשר התאים מתחילים להתייבש13. כך, למרות שלחפירת הקן יש עלות אנרגיה ניכרת, האנרגיה המושקעת מתהפכת בתועלות עבור המושבה עצמה22. למעט כמה יוצאים מן הכלל, מיני אטא גם מייצרים תאים מיוחדים לפסולת המושבה, העשויים בעיקר ממצע פטריות מדולדל ומגופות של נמלים מתות, מבודדים אותה משאר הקן, ומבססים אסטרטגיית חסינות חברתית חשובה30. בנוסף, קבוצה מובחנת של עובדים לתמרן את הפסולת ישירות, כדי למנוע זיהום של אנשים אחרים. העובדים כל הזמן מספוא כדי לטפח את הפטרייה, שהיא המשאב התזונתי העיקרי של המושבה. עם זאת, הם יכולים להיזון גם מוהל צמחים תוך חיתוך שברים. החומר הצמחי נבחר בקפידה לתחזוקת גינת הפטריות ומושפע מגורמים רבים כגון תכונות העלים ותכונות המערכת האקולוגית13.
אסטרטגיית הזיוף של נמלים חותכות עלים כדי להשיג חומר טרי היא מורכבת ביותר, ובשילוב עם הביקוש הגבוה לקציר של מושבות מבוססות, גורמים להפסד כלכלי ניכר ליצרנים החקלאיים ומסכנים את שטחי שיקום היערות22,31. לכן, נמלים אלה ניתן לסווג כמזיקים ברוב האזורים שבהם הם עשויים להיתקל, החל מדרום ארצות הברית לצפון מזרח ארגנטינה 11,13,22,32. כיבוין של מושבות בעייתיות הוא מאתגר בשל סדרת ההתאמות הטבועות בביולוגיה של חרקים אלה (כלומר, ארגון חברתי, הזדקנות, גידול פטריות, היגיינה ומבני קן מורכבים)33. לפיכך, אסטרטגיות בקרת האוכלוסייה נבדלות מאלו המיושמות בדרך כלל על מזיקים חרקים אחרים, ונוקטות בעיקר בהצעות אטרקטיביות של פיתיונות מזוהמים33,34. עם זאת, מכיוון שנמלים אלה יכולות לדחות חומרים מזיקים הן לפטרייה והן לפרטי המושבה, ולפגוע בשדות מעובדים 33, תרכובות טבעיות חדשות וחלופות של הדברה נבדקות כל הזמן33,35,36. מכיוון שקשה לעקוב אחר תוצאות הניסויים במושבות שנבדקו בשטח, מאמרים ראשוניים נערכים בסביבה מבוקרת.
לפיכך, פרוטוקולים ניסיוניים חייבים להיות מותאמים לקבוצות עניין בהתחשב באורח החיים ההטרוגני של נמלים, לתמוך במחקרים ברמת המין, ולקחת בחשבון מושבות כיחידות מבצעיות, שבהן נמלה אחת היא מרכיב של סופר-אורגניזם מורכב11. הדיווחים שנאספו עד כה בנוגע לסוג עטא אפשרו לאסוף ולתחזק בהצלחה מושבות בתנאי מעבדה ולהכיר בצרכים הבסיסיים שלהן ובתפקודן הכללי. בהתבסס על התהליכים הטבעיים שלהם כגון רבייה, הקמת מושבות והתנהגויות האכלה, פותחה שגרה של פרקטיקות המאפשרות הקמה ארוכת טווח של מושבות בסוגים שונים של קינים. כאן מתואר פרוטוקול פרוצדורלי לשמירה על נמלים חותכות עלים במעבדה ומדגיש מחקר כללי אפשרי עם מטרות ניסוי שונות והסברה מדעית.
Protocol
1. אוסף מלכות
- חפש בספרות את תקופת עונת הרבייה של אטא באזור העניין. התרחשות עונת הרבייה, תדירותן ושעות היום של טיסות הנישואים, משתנות בהתאם לתנאי האקלים האזוריים (טבלה 1). למרות שבדרך כלל הוא מתרחש באביב, יש לאסוף מידע זה עבור המיקום שבו האיסוף אמור להתרחש 37,38,39,40,41,42,43,44,45,46.
- זהה וסמן מיקומים עם קיני אטא הנחשבים כאזורים אפשריים לאיסוף מלכות ומושבות צעירות. במהלך טיסות הנישואים, המלכות מתפזרות סביב מיקומי הקן; לכן, באזורים עם מספר גדול יותר של מושבות יש סיכויים גבוהים יותר לקבל נקודות נחיתה של המלכה שבהן הם יוזמים חפירות קן חדשות.
- בדוק את האזורים שנבחרו בעבר עבור סימנים של מעוף nuptial במהלך עונת הרבייה של נמלים Atta . עקוב אחר התנאים הסביבתיים של ימי טיסה, כגון מזג אוויר חם וגשמים.
- זהה קני נמלים חותכות עלים באזורים שנבחרו בעבר וחפש תכונות חיצוניות המעידות על עזיבתן הקרובה של נמלים מכונפות-רבייה. מאפייני הקן כוללים כניסות למנהרות שהורחבו (איור 1), זרימה מוגברת של עובדים שהראו התנהגות אגרסיבית יותר כלפי טורפים אפשריים ונמלים בעלות כנף רבייה המופיעות בכניסות למנהרות (איור 1). היזהרו מימים של לחות גבוהה שמצליחים לרדת גשם, שכן הם בדרך כלל מקדימים את טיסות הנישואים.
- הכינו מיכלי פלסטיק עם מכסה עם שכבת גבס תחתונה כדי לשמור על המלכות בנפרד. יש לוודא שנפח המיכל הוא כ-200 מ"ל, ושכבת הגבס בתחתית היא בגובה של כ-1 ס"מ ובעלת כושר ספיגה גבוה לבקרת לחות.
הערה: כדי להכין את בסיס הטיח, יש לפעול לפי הוראות היצרן. - הכן סביבה עם טמפרטורה קבועה של 23 ± 1 מעלות צלזיוס וכ 70% ± 10% של לחות יחסית. בחר מיקום ללא פעילויות אינטנסיביות וזרימה גבוהה של אנשים כדי למנוע רעידות והפרעות. השתמשו בחומרי ניקוי בעלי ניחוח נייטרלי כדי למנוע הפרעה להתנהגות הנמלים.
הערה: תנודות בתנאי סביבה מוגדרים עלולות לגרום לעיבוי מים או לאובדן לחות, ולפגוע בגינת הפטריות. - לאחר טיסת הנישואים, אספו מלכות חסרות כנפיים שיזמו את חפירת הקן, והניחו אותן בזהירות במיכלי הפלסטיק שהוכנו בשכבת טיח, בנפרד. הימנעו מלגעת במלכות בידיים חשופות והשתמשו בכפפות לטקס או בפינצטה אנטומולוגית.
הערה: הסרת כנפיים והתנהגות חפירה בקרקע מצביעות על נקבות רבייה שכבר התרבו, ולכן מסוגלות להקים מושבה חדשה. קולקציית קווינס נחשבת גם לקולקציה הראשונה ביצירה זו. - העבר את המכולות הנושאות את המלכות למיקום עם סביבה מבוקרת שנבחרה קודם לכן. בצעו את ההסעות של המלכות בזהירות מרבית, תוך הימנעות מהפרעות רבות מדי ושמירה על קביעות טמפרטורה מינימלית.
- אין לתמרן או להזיז את המלכות במשך כ -3 ימים לאחר האיסוף כדי למנוע מתח.

איור 1. הכניסה לקן התרחבה עם משחזרי נמלים מכונפים ועובדים. כניסות מנהרה מורחבות הן אחת מתכונות הקינים המצביעות על התרחשות טיסות Atta nuptial. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
2. תחזוקת קווינס
- בתחילה, להוסיף 2.5 מ"ל של מים לשכבת הגבס של הנמען כל 2 ימים בעזרת מזרק מחט.
- במקום לפתוח את הנמען, לנקב בזהירות את מכסי המיכל עם המחט כדי למנוע הפרעה עקב מניפולציה. ניתן להשתמש באותו חור בתקופה זו. יש לוודא שהמים שנוספו אינם משרים את שכבת הגבס. הימנעו מהשקיה ישירה של המלכה, ספוג הפטרייה הראשוני וכל מי שאינו בוגר. כל עוד גן הפטריות מפגין היבט יבש עם היעדר מים, להשקות את שכבת הטיח.
- שבועיים לאחר הקולקציה, בדקו אם הפטרייה הוחזרה על ידי המלכות. אם אין פטרייה, מעבירים כ-2 גרם פטרייה המתקבלת ממושבה מבוססת. כמו כן, בצע שלב זה אם הפטרייה אינה מתפתחת.
הערה: להעברת פטריות, יש צורך לאסוף פטרייה בריאה ממושבה מבוססת ולהסיר את כל הנמלים שעשויות להיות עליה. השתמשו בכף, בפינצטה אנטומולוגית ובכפפות לטקס כדי לתמרן את הפטרייה. - לאחר הופעתם של הפועלים הראשונים, להתחיל להציע שברי עלים צעירים ודקים באופן קבוע, על פי פעילות החתך של המושבה. ודא שהעלים המוצעים בריאים, והצמחים לא טופלו בקוטלי חרקים או בחומרים כימיים אחרים. בשלבים מוקדמים, ודא כי שברי העלה אינם מעל 4 ס"מ.
הערה: כאשר העובדים הראשונים יוזמים גידול עלים, יש להציע חומר צמחי לאחר הופעתם. תדירות ההנפקה תלויה בזריזות שבה העובדים משלבים את החומר הצמחי על הפטרייה אך יכולה לנוע עד 2-3 ימים בשבוע. ניתן להציע גם פתיתי שיבולת שועל ופתיתי תירס, אך יש להחליף אותם בעלים כדי למנוע יובש פטרייתי. - כאשר מציעים עלים חדשים, יש לפנות פסולת מושבה ושברי עלים יבשים. הימנע משימוש בשמים, קרם לחות, קרמים או כל חומר עם ריח חזק בעת מניפולציה של המלכות. בנוסף, יש להשתמש בכפפות לטקס במהלך כל התהליכים.
- עקבו אחר התפתחות המושבה, וכאשר גן הפטריות מגיע לפחות למחצית מנפח המיכל, העבירו את המושבה לקן מלאכותי עמיד.
הערה: מכיוון שקצב הפיתוח הוא אינהרנטי לכל מושבה, אין זמן משוער להעברת מושבה. בדרך כלל, מושבות מהאוסף הראשון מועברות לקינים עם תא גן פטריות של נפח 1L מקסימום, בשל גן הפטריות הקטן.
3. אוסף מושבות צעירות
- לרכוש מיכלי פלסטיק של כ 500 מ"ל נפח.
- כ-6 חודשים לאחר טיסת הנישואים, זהו תלוליות אינדיקטיביות בצורת מגדל עם חלקיקי אדמה מגורענים (איור 1) של קיני אטא (איור 2) על המקומות שבהם הופיעו נמלים חותכות עלים שסומנו קודם לכן.
הערה: שישה חודשים לאחר טיסת הנישואים, הקנים של מושבות צעירות מוערכים בעומק של עד מטר אחד בקרקע. אוסף חדש מצוין בתקופה זו כדי להשיג סיכויים גבוהים יותר של מושבות מוצלחות ומתמשכות בכמויות גדולות. - בעזרת מעדר גן, חפרו את פתח הקן עד שתגיעו לחדר המחזיק את המושבה הצעירה. אספו את המלכה, את גן הפטריות, את העובדים הבוגרים ואת העובדים הצעירים, והניחו אותם במיכל הפלסטיק. בצעו את תהליך האיסוף בעדינות רבה ככל האפשר.
הערה: באופן טבעי, כמות גדולה של אדמה תיאסף גם היא ויש להסיר אותה בהדרגה בהליכי תחזוקה עתידיים במעבדה. - הזיזו את מיכלי הפלסטיק המחזיקים את המושבות לסביבה המבוקרת המיועדת. בצע את הובלת המושבות הצעירות בזהירות מוחלטת, תוך הימנעות מהפרעות רבות מדי ושמירה על קביעות טמפרטורה מינימלית. הימנעו ממניפולציה או הזזת המושבות במשך כ-3 ימים כדי למנוע לחץ. אם בחדר יש שגרה פעילה, ניתן לשים מטלית כהה מעל המושבות.

איור 2. תלולית אדמה בצורת מגדל. התל האופייני בצורת מגדל מציין את נוכחותן של מושבות של אקטה סקסדן ואטא לביגאטה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. תחזוקת מושבות צעירות
- לספק עלים צעירים דקים 3 פעמים בשבוע.
- ודאו שהעלים המוצעים בריאים ושהצמחים לא טופלו בקוטלי חרקים או בחומרים כימיים אחרים. בשלב זה, יש לוודא ששברי העלים באורך של 7 ס"מ לפחות.
הערה: ניתן להציע גם פתיתי שיבולת שועל ופתיתי תירס, אך יש להחליף אותם בעלים כדי למנוע יובש פטרייתי. - תדירות ההנפקה תלויה בזריזות שבה העובדים משלבים את החומר הצמחי על הפטרייה. כאשר פעילות הקיצוץ היא אינטנסיבית, הגדילו את ההיצע פעמיים ביום שלוש פעמים בשבוע או 5 ימים בשבוע.
- ודאו שהעלים המוצעים בריאים ושהצמחים לא טופלו בקוטלי חרקים או בחומרים כימיים אחרים. בשלב זה, יש לוודא ששברי העלים באורך של 7 ס"מ לפחות.
- כאשר מציעים עלים חדשים, יש לפנות פסולת מושבה, כולל שרידי אדמה, בעזרת כפית. השתמש בכפפות לטקס במהלך כל התהליכים. בעת מניפולציה של המושבות הצעירות להימנע משימוש בשמים, קרם לחות, קרמים, או כל חומר עם ריח חזק.
הערה: העובדים עצמם יפרידו את האדמה והפסולת מהפטרייה. - עקבו אחר התפתחות המושבה, וכאשר גן הפטריות מגיע לפחות למחצית מנפח המיכל, העבירו את המושבה לקן מלאכותי עמיד.
הערה: מכיוון שקצב הפיתוח הוא אינהרנטי לכל מושבה, אין זמן משוער להעברת מושבה.
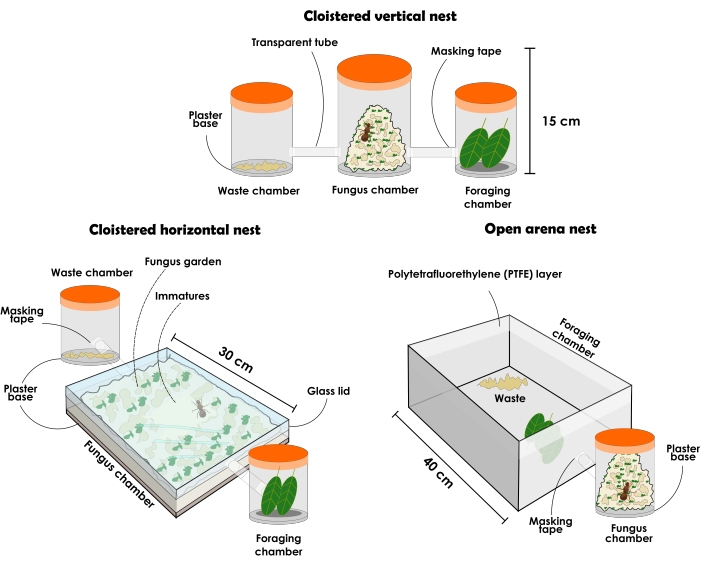
איור 3: סוגים של קינים מלאכותיים שמחזיקים מושבות אטא סקסדן ואטא לאביגטה. איור של קנים מלאכותיים עמידים של נמלים חותכות עלים: מערך קן אנכי קלוסטר, מערך קן אופקי קלוסטר, ומערך קן זירה פתוחה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
5. קנים מלאכותיים עמידים
- הכינו מערך קן אנכי סגור כמתואר להלן (איור 3 ואיור 4).
הערה: בתצורות של קנים סגורים צריכים להיות תמיד נמענים שונים כדי להתחזות בנפרד כ-(1) תא גן פטריות, (2) תא לסילוק פסולת ו-(3) תא זיוף. בתחילה, זה צריך להתחיל עם שלושה מכולות, אבל נמענים נוספים ניתן להוסיף כדי להגדיל את גן הפטריות. הקנים עשויים להשתנות בגודלם ובחומרם בהתאם למטרת הניסוי שלהם, אם כי כאן מתואר ומומלץ להשתמש בחומרים שקופים. המכלים חייבים להיות ללא פתחים, אחרת הנמלים יברחו. סוג הקן כמתואר להלן יכול לשמש למחקר כללי, אך הוא אינו מומלץ לאיסוף נמלים אסרטיביות בשל ההפרעה הנגרמת בעת הסרת המכסה, וכתוצאה מכך תסיסה רבה בקרב הפרטים. עם זאת, בשל השקיפות החומרית, ניתן לאתר את המלכה ואת קאסטות הנמלים השונות גם כאשר גן הפטריות מילא את כל המיכל. מכיוון שמדובר בנטייה, תמיד מניחים כי הבוגרים נמצאים במרכז גן הפטריות כאשר הוא תפס את רוב השטח הזמין במיכלים אנכיים.- בחרו מיכל מכסה שקוף של כ-1 ליטר והוסיפו שכבה של 1 ס"מ של בסיס טיח בעל ספיגה גבוהה. זה יהיה חדר גן הפטריות. בחר שני מיכלים שקופים עם מכסה של כ-500 מ"ל כל אחד כדי שישמשו לסילוק פסולת ותאי זיוף. הנמלים יבחרו איזה תא יהיה כל אחת, ולאחר מכן, יבטיחו שהן לא יוחלפו.
הערה: כדי להכין את בסיס הטיח, יש לפעול לפי הוראות היצרן. - נקבו וחברו את שלושת המכלים באמצעות צינור שקוף או צינור. במידת הצורך, יש למרוח סרט מיסוך על גבול הצינורות כדי להבטיח חיבור ירכיים עם המכלים ולהימנע מבריחת נמלים. מניחים את מיכל בסיס הגבס באמצע ואת שאר המכלים בצדדים מנוגדים.
- העבירו בזהירות את ספוג הפטרייה של מושבות נבחרות (ראו שלב 2.5 ושלב 4.3) יחד עם המלכה, העובדים והלא בוגרים למיכל בסיס הגבס. לפני ההעברה, יש לוודא שבסיס הגבס מושקה. השתמש בכפפות לטקס.
- בחרו מיכל מכסה שקוף של כ-1 ליטר והוסיפו שכבה של 1 ס"מ של בסיס טיח בעל ספיגה גבוהה. זה יהיה חדר גן הפטריות. בחר שני מיכלים שקופים עם מכסה של כ-500 מ"ל כל אחד כדי שישמשו לסילוק פסולת ותאי זיוף. הנמלים יבחרו איזה תא יהיה כל אחת, ולאחר מכן, יבטיחו שהן לא יוחלפו.
- הכינו מערך קן אופקי סגור כמתואר להלן (איור 3 ואיור 4).
הערה: קינים בעלי תצורה אופקית מאפשרים תצפית צמודה על גינת הפטריות ועל פעילות העובדים לקראתה. מכיוון שחלקים צעירים יותר של גן הפטריות נמצאים בחלק העליון, ניתן לראות מצעים שהוצעו לאחרונה משולבים על ידי העובדים. חלקים חדשים של הפטרייה ניתן לזהות על ידי צבעה, אשר יהיה דומה לצבע של המשאב האחרון המוצע, בעוד החלקים הישנים בדרך כלל נושאים צבע בז '. צאצאים ומלכה יכולים גם להיות ממוקמים בקלות, כמו במיכלים אופקיים הם נמצאים בדרך כלל בחלק העליון של גן הפטריות, גם כאשר הוא תפס את רוב החלל. תצורה זו יכולה לשמש למחקר ממוקד התנהגות, דגימה ממוקדת ומטרות הסברה מדעיות, מכיוון שהיא נותנת תפיסה של הארגון בתוך הקן.- רכשו מיכל מכסה שקוף במידות של כ-31 ס"מ על 21 ס"מ על 4.5 ס"מ, והוסיפו שכבה של 1 ס"מ של בסיס טיח בעל ספיגה גבוהה. זה יהיה חדר גן הפטריות. בחר שני מיכלים שקופים עם מכסה של כ-500 מ"ל כל אחד כדי שישמשו לסילוק פסולת ותאי זיוף. הנמלים יבחרו איזה תא יהיה כל אחת, ולאחר מכן, יבטיחו שהן לא יוחלפו.
הערה: כדי להכין את בסיס הטיח, יש לפעול לפי הוראות היצרן. במידת הצורך, סגרו את הרווח הקטן בין המכסה למיכל עם סרט מיסוך כדי למנוע מהנמלים לברוח. - לנקב ולחבר את המכלים עם צינור שקוף או צינור. במידת הצורך, יש למרוח סרט מיסוך על גבול הצינורות כדי להבטיח חיבור ירכיים עם המכלים ולהימנע מבריחת נמלים. מניחים את מיכל בסיס הגבס באמצע ואת שאר המכלים בצדדים מנוגדים.
- העבירו בזהירות את ספוג הפטרייה של מושבות נבחרות (ראו שלב 2.5 ושלב 4.3) יחד עם המלכה, העובדים והלא בוגרים למיכל בסיס הגבס. לפני ההעברה, יש לוודא שבסיס הגבס מושקה. השתמש בכפפות לטקס.
- רכשו מיכל מכסה שקוף במידות של כ-31 ס"מ על 21 ס"מ על 4.5 ס"מ, והוסיפו שכבה של 1 ס"מ של בסיס טיח בעל ספיגה גבוהה. זה יהיה חדר גן הפטריות. בחר שני מיכלים שקופים עם מכסה של כ-500 מ"ל כל אחד כדי שישמשו לסילוק פסולת ותאי זיוף. הנמלים יבחרו איזה תא יהיה כל אחת, ולאחר מכן, יבטיחו שהן לא יוחלפו.
- הכינו מערך קן זירה פתוח כמתואר להלן (איור 3 ואיור 5).
הערה: קיני זירה פתוחים מאפשרים איסוף של נמלים ללא הפרעה גדולה וניתוח התנהגות הזדקנות. הם יכולים גם לספק ייצוג אמין של מושבה שנמצאת בטבע למטרות הסברה מדעית.- בחרו מיכל מכסה שקוף של כ-1 ליטר והוסיפו שכבה של 1 ס"מ של בסיס שכבת טיח בעל ספיגה גבוהה. זה יהיה חדר גן הפטריות.
הערה: מומלץ להתחיל עם מיכלים של 1 ליטר ולעבור בהדרגה למכלים עם נפחים גבוהים יותר לגינת פטריות גדולה יותר. עם זאת, המכולות לא צריך להתגבר על נפח 5 L. הוסיפו כמה מכולות לפי הצורך. - בחר זירה פתוחה. גודל ההיכל יכול להשתנות בהתאם למטרות המחקר. אם נבחרה זירה גדולה, הניחו את המכלים המחזיקים את גינת הפטריות בחלקו הפנימי (איור 5). במקרה של זירה קטנה, חברו אותה למיכל גן הפטריות באמצעות צינור או צינור שקופים (איור 3). ההיכל ישמש כתא לזיוף ופינוי פסולת, ולכן, יש לוודא שהוא אינו קטן מדי.
- יש למרוח שכבה אחת של נוזל polytetrafluoroethylene בתנועה אחת לגבול הזירה כדי להכיל את הנמלים. השתמשו בכותנה ספוגה בנוזל וכפפת ניטריל.
אזהרה: יש להימנע משאיפה ונגיעה בעור בעת שימוש בנוזל פוליטטרפלואורואתילן. - העבירו בזהירות את ספוג הפטרייה של מושבות נבחרות (ראו שלב 2.5 ושלב 4.3) יחד עם המלכה, העובדים והלא בוגרים למיכל בסיס הגבס. לפני ההעברה, יש לוודא שבסיס הגבס מושקה. השתמש בכפפות לטקס.
- בחרו מיכל מכסה שקוף של כ-1 ליטר והוסיפו שכבה של 1 ס"מ של בסיס שכבת טיח בעל ספיגה גבוהה. זה יהיה חדר גן הפטריות.

איור 4: קינים מלאכותיים של הנמלים חותכות העלים Atta sexdens ו-Atta laevigata. החלק העליון של הגדרת הקן האנכי (A) והתצוגה הצדדית (B); החלק העליון של הגדרת הקן האופקי (C) והתצוגה הצדדית (D). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: קן זירה פתוח מלאכותי של הנמלים חותכות העלים Atta sexdens ו-Atta laevigata. מערך קן זירה פתוח של Atta sexdens למעלה (A) ומבט צדדי (B). 1) תאי גן פטריות; 2) פסולת; 3) פרוסות תפוז; 4) זכוכית עם שכבת פוליטטרפלואורתילן (PTFE). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
6. תחזוקת מושבות מפותחות
- מציעים מדי יום לפחות עלה אחד גדול לתוך תא ההזדווגות לכל מושבה עם 1 ליטר של גן פטריות. אם פעילות החיתוך של הנמלים היא אינטנסיבית, להגדיל את מספר העלים. אם הפטרייה יבשה, הרטיבו מראש את העלים כדי לספק לחות נוספת. בקנים סגורים, בצעו את המנחה במהירות כדי למנוע מהנמלים לברוח מתא ההזדווגות.
הערה: כאן, עלים נאספים ממיני צמחים כגון תות (Morus nigra), מנגו (Mangifera indica), אקליפטוס (אקליפטוס sp.), jambolan (Syzygium cumini), היביסקוס (Hibiscus sp.), אקליפה (Acalypha wilkesiana) ו ligustrum (Ligustrum lucidum).- הציעו פירות כמו תפוזים ותפוחים, ופתיתי שיבולת שועל ותירס כדי לגוון ולהשלים את הדיאטה. למושבות גדולות עם פעילות ציד אינטנסיבית, הציעו פתיתי שיבולת שועל ופתיתי תירס מדי יום, ופירות פעם בשבוע. אם זה לא המקרה, להציע פתיתים לסירוגין עם עלים, אבל לא יותר משלוש פעמים בשבוע, ופירות פעם או פעמיים בחודש. התאימו את הכמות והתדירות של כל מזון בהתאם לפעילות ההזדקנות של הנמלים.
- אם האפשרויות שתוארו לעיל אינן זמינות, זהה את העדפת ההזדקנות של הנמלים בין עלים, פרחים ופירות של עצים ושיחים אזוריים, או אפילו ירקות ממוסחרים, דגנים ופתיתים אחרים. הימנע מלהציע משאבים עם תרכובות כימיות הגנתיות וחומרי הדברה.
- הסר את כל התוכן של תא הפסולת כל שבועיים מכל המושבות. הסר עובדים גם למטרות בקרת אוכלוסייה. אם העובדים מעבירים פטריות בריאות לתא הפסולת, ודאו שהמלכה לא נמצאת עליו והוציאו אותה. אם כמות הפסולת המושלכת גבוהה או לחה מדי, יש להסיר אותה פעם בשבוע.
- הסירו את החומר שלא נלקח על ידי הנמלים מתא ההזדווגות בכל פעם שהן מציעות חדשים וודאו שהוא תמיד נקי.
- אם העובדים מעבירים פטריות בריאות לתא הזיוף, הפריעו לה, השאירו את מכסה המיכל פתוח ומרחו אבקת טלק ניטרלית על משטח שולי התא. בצע הליך זה רק אם עדיין יש מקום על תא הפטרייה, בדרך זו העובדים יעבירו את הפטרייה בחזרה למיכל מבלי לאבד אותה או כל בוגר.
- אם רוצים עוד גינת פטריות, מוסיפים עוד מיכל מטויח, ומעבירים לתוכו חלק מספוג הפטרייה. עד שהפטרייה מגיעה למחצית המיכל, מוסיפים עלים בתא הפטרייה. הצמיחה של גן הפטריות צריכה לקרות בהדרגה כדי לא לפגוע במאזן המושבה. אם רוצים מיכל גדול יותר, הקפידו לתת לפטרייה לתפוס את כל החלל של המכלים הקטנים ביותר לפני שאתם מעבירים אותה. אין לתת לפסולת המושבה ולעלים היבשים להצטבר בחדר הגן של הפטרייה.
- בדקו את בסיס הטיח מהמכלים, שכן עם הזמן הוא עלול לקבל צבע חום כהה ולהפוך ללא יעיל עקב הפרשת נמלים, הובלת חומרי פסולת וריכוז לחות גבוה. כמו כן, מושבות מסוימות עשויות לחתוך את השכבה ולהיפטר ממנה. במקרים אלה, מעבירים את גינת הפטריות למיכל מטויח חדש.
תוצאות
תרשים זרימה המתאר את תהליך איסוף הנמלים מוצג באיור 6. כאן מוצגות כמה תוצאות שהתקבלו תוך שימוש בפרוטוקול של איסוף, תחזוקה והגדרות קן שתוארו לעיל.
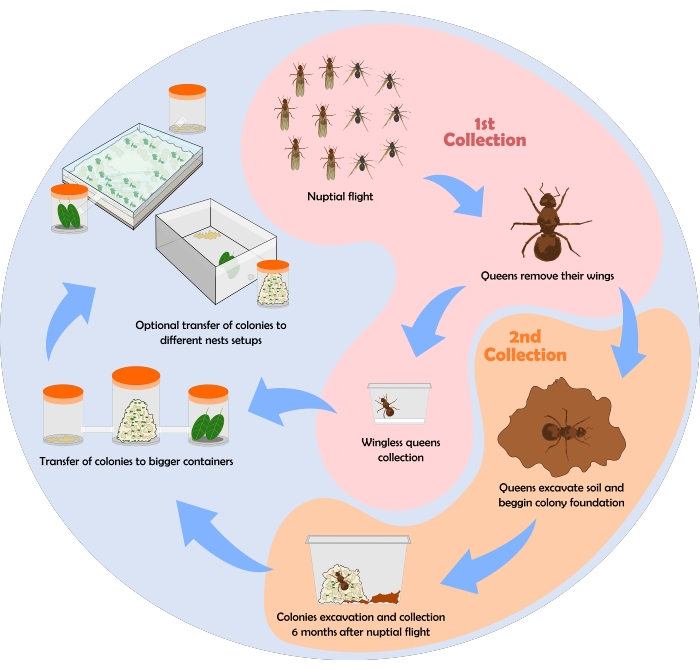
איור 6: תרשים זרימה לאי...
Discussion
הפרוטוקול המתואר כאן לשמירה על מושבות נמלים חותכות עלים פותח ויושם במשך למעלה משלושה עשורים בצורה אסרטיבית וניתנת לשכפול. היא אפשרה פיתוח מחקר שיהיה מוגבל על ידי תנאי שדה. לפיכך, נמלים ומושבות בריאות הפכו לזמינות למחקר במספר תחומים כגון מורפולוגיה השוואתית, טוקסיקולוגיה 51,52, היסטולוגיה
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
מוקדש למריו אוטואורי (לזכרו) ולוולטר הוגו דה אנדרדה קוניה שתרמו רבות למחקרי הנמלים חותכות העלים. אנו מכירים בתמיכתם של אוניברסיטת סאו פאולו והמכון למדעים ביולוגיים. מחקר זה מומן בחלקו על ידי Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES) - Finance Code 001, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), ו- Fundação para o Desenvolvimento da UNESP (Fundunesp).
Materials
| Name | Company | Catalog Number | Comments |
| Entomologic forceps | N/A | N/A | N/A |
| Glass tank | N/A | N/A | Tempered glass, custom made |
| Hose | N/A | N/A | Transparent, PVC 1/2 Inch x 2,0 mm |
| Latex gloves | Descarpack | 550301 | N/A |
| Nitrile gloves | Descarpack | 433301 | N/A |
| Open arena | N/A | N/A | Polypropylene crate |
| Plaster pouder | N/A | N/A | Plaster pouder used in construction, must be absorbant |
| Plastic Containers for collection | Prafesta | Natural Cód.: 8231/Natural Cód.: 8262 | Lidded, transparent , polypropylene |
| Plastic containers for nests | Prafesta | Discontinued | Polystyrene, hermetic |
| Teflon | Dupont | N/A | Polytetrafluoroethylene liquid (PTFE Dispertion 30) |
References
- Wilson, E. O. . The Insect Societies. , (1971).
- Ortiz, D. P., Elizalde, L., Pirk, G. I. Role of ants as dispersers of native and exotic seeds in an understudied dryland. Ecological Entomology. 46 (3), 626-636 (2021).
- Christianini, A. V., Oliveira, P. S. Birds and ants provide complementary seed dispersal in a neotropical savanna. Journal of Ecology. 98 (3), 573-582 (2010).
- Camargo, P. H. S. A., Martins, M. M., Feitosa, R. M., Christianini, A. V. Bird and ant synergy increases the seed dispersal effectiveness of an ornithochoric shrub. Oecologia. 181 (2), 507-518 (2016).
- Sanders, D., van Veen, F. J. F. Ecosystem engineering and predation: the multi-trophic impact of two ant species. Journal of Animal Ecology. 80 (3), 569-576 (2011).
- Swanson, A. C., et al. Welcome to the Atta world: A framework for understanding the effects of leaf-cutter ants on ecosystem functions. Functional Ecology. 33 (8), 1386-1399 (2019).
- Meyer, S. T., et al. Leaf-cutting ants as ecosystem engineers: topsoil and perturbations around Atta cephalotes nests reduce nutrient availability. Ecological Entomology. 38 (5), 497-504 (2013).
- Sosa, B., Brazeiro, A. Positive ecosystem engineering effects of the ant Atta vollenweideri on the shrub Grabowskia duplicata. Journal of Vegetation Science. 21 (3), 597-605 (2010).
- De Almeida, T., et al. Above- and below-ground effects of an ecosystem engineer ant in Mediterranean dry grasslands. Proceedings of the Royal Society B: Biological Sciences. 287 (1935), 20201840 (2020).
- Folgarait, P. J. Ant biodiversity and its relationship to ecosystem functioning: a review. Biodiversity & Conservation. 7 (9), 1221-1244 (1998).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Barrera, C. A., Sosa-Calvo, J., Schultz, T. R., Rabeling, C., Bacci, M. Phylogenomic reconstruction reveals new insights into the evolution and biogeography of Atta leaf-cutting ants (Hymenoptera: Formicidae). Systematic Entomology. 47 (1), 13-35 (2021).
- Hölldobler, B., Wilson, E. O. . The Leafcutter Ants: Civilization By Instinct. , (2011).
- Branstetter, M. G., et al. Dry habitats were crucibles of domestication in the evolution of agriculture in ants. Proceedings of the Royal Society B: Biological Sciences. 284 (1852), 20170095 (2017).
- Solomon, S. E., et al. The molecular phylogenetics of Trachymyrmex Forel ants and their fungal cultivars provide insights into the origin and coevolutionary history of ‘higher-attine’ ant agriculture. Systematic Entomology. 44 (4), 939-956 (2019).
- Cristiano, M. P., Cardoso, D. C., Sandoval-Gómez, V. E., Simões-Gomes, F. C. Amoimyrmex Cristiano, Cardoso & Sandoval, gen. nov. (Hymenoptera: Formicidae): a new genus of leaf-cutting ants revealed by multilocus molecular phylogenetic and morphological analyses. Austral Entomology. 59 (4), 643-676 (2020).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences of the United States of America. 105 (14), 5435-5440 (2008).
- Mueller, U. G., et al. Phylogenetic patterns of ant–fungus associations indicate that farming strategies, not only a superior fungal cultivar, explain the ecological success of leafcutter ants. Molecular Ecology. 27 (10), 2414-2434 (2018).
- Mueller, U. G., et al. Biogeography of mutualistic fungi cultivated by leafcutter ants. Molecular Ecology. 26 (24), 6921-6937 (2017).
- Weber, N. A. The fungus-culturing behavior of ants. American Zoologist. 12 (3), 577-587 (1972).
- Wilson, E. O. Caste and division of labor in leaf-cutter ants (Hymenoptera: Formicidae: Atta). Behavioral Ecology and Sociobiology. 7 (2), 157-165 (1980).
- Della Lucia, T. M. C. Formigas cortadeiras: da bioecologia ao manejo. Viçosa Editora UFV. 421, (2011).
- Autuori, M. Contribuição para o conhecimento da saúva (Atta spp). I. Evolução do sauveiro (Atta sex dens rubolpilosa Forel, 1908). Arquivos do Instituto Biologico Saul Paulo. 12, 197-228 (1941).
- Bueno, O. C., Hebling, M. J. A., Schneider, M. O., Pagnocca, F. C. Ocorrência de formas aladas de Atta sexdens rubropilosa Forel (Hymenoptera: Formicidae) em colônias de laboratório. Neotropical Entomology. 31 (3), 469-473 (2002).
- Mariconi, F. A. M. Biologo. As Saúvas. , (2021).
- Bento, J. M. S. . Condições climáticas para o vôo nupcial e reconhecimento dos indivíduos em Atta sexdens rubropilosa (Hymenoptera: Formicidae). , (1993).
- Little, A. E. F., Murakami, T., Mueller, U. G., Currie, C. R. The infrabuccal pellet piles of fungus-growing ants. Naturwissenschaften. 90 (12), 558-562 (2003).
- Kerr, W. E. Acasalamento de rainhas com vários machos em duas espécies da tribo Attini. Revista Brasileira de Biologia. 21, 45-48 (1961).
- Kerr, W. E. Tendências evolutivas na reprodução dos himenópteros sociais. Arquivos do Museu Nacional. 52, (1962).
- Cremer, S., Armitage, S. A. O., Schmid-Hempel, P. Social immunity. Current Biology. 17 (16), 693-702 (2007).
- Hernández, J. V., Jaffé, K. Dano econômico causado por populações de formigas Atta laevigata (F. Smith) em plantações de Pinus caribaea (Mor.) e elementos para o manejo da praga. Anais da Sociedade Entomológica do Brasil. 24 (2), 287-298 (1995).
- Kempf, W. W. Catálogo abreviado das formigas da Região Neotropical Studia Entomologica. antbase.org. 15, 3 (1972).
- Della Lucia, T. M. C., Gandra, L. C., Guedes, R. N. C. Managing leaf-cutting ants: peculiarities, trends and challenges. Pest Management Science. 70 (1), 14-23 (2013).
- Boaretto, M. A. C., Forti, L. C. Perspectivas no controle de formigas-cortadeiras. Série Técnica IPEF. 11 (30), 31-46 (1997).
- Folgarait, P. J., Goffré, D. Conidiobolus lunulus, a newly discovered entomophthoralean species, pathogenic and specific to leaf-cutter ants. Journal of Invertebrate Pathology. 186, 107685 (2021).
- Cardoso, S. R. S., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Pathogenicity of filamentous fungi towards Atta sexdens rubropilosa (Hymenoptera: Formicidae). International Journal of Tropical Insect Science. 42 (2), 1215-1223 (2022).
- Ichinose, K., Rinaldi, I., Forti, L. C. Winged leaf-cutting ants on nuptial flights used as transport by Attacobius spiders for dispersal. Ecological Entomology. 29 (5), 628-631 (2004).
- Pagnocca, F. C., Rodrigues, A., Nagamoto, N. S., Bacci, M. Yeasts and filamentous fungi carried by the gynes of leaf-cutting ants. Antonie Van Leeuwenhoek. 94 (4), 517-526 (2008).
- Attili-Angelis, D., et al. Novel Phialophora species from leaf-cutting ants (tribe Attini). Fungal Diversity. 65 (1), 65-75 (2014).
- Delabie, J. H. C., do Nascimento, I. C., Mariano, C. S. F. Estratégias de reprodução e dispersão em formigas attines, com exemplos do sul da Bahia. XIX Congresso Brasileiro de Entomologia. , 16-21 (2002).
- Fjerdingstad, E. J., Boomsma, J. J. Variation in size and sperm content of sexuals in the leafcutter ant Atta colombica. Insectes Sociaux. 44 (3), 209-218 (1997).
- Currie, C. R., Mueller, U. G., Malloch, D. The agricultural pathology of ant fungus gardens. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7998-8002 (1999).
- Moser, J. C., et al. Eye size and behaviour of day-and night-flying leafcutting ant alates. Journal of Zoology. 264 (1), 69-75 (2004).
- Moreira, S. M., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Absence of the parasite Escovopsis in fungus garden pellets carried by gynes of Atta sexdens. Sociobiology. 62 (1), 34-38 (2015).
- Arcuri, S. L., et al. Yeasts found on an ephemeral reproductive caste of the leaf-cutting ant Atta sexdens rubropilosa. Antonie Van Leeuwenhoek. 106 (3), 475-487 (2014).
- Staab, M., Kleineidam, C. J. Initiation of swarming behavior and synchronization of mating flights in the leaf-cutting ant Atta vollenweideri FOREL, 1893 (Hymenoptera: Formicidae). Myrmecol. News. 19, 93-102 (2014).
- Gálvez, D., Chapuisat, M. Immune priming and pathogen resistance in ant queens. Ecology and Evolution. 4 (10), 1761-1767 (2014).
- Baer, B., Armitage, S. A. O., Boomsma, J. J. Sperm storage induces an immunity cost in ants. Nature. 441 (7095), 872-875 (2006).
- Carlos, A. A. . Semioquímicos e comunicação sonora em formigas cortadeiras (Hymenoptera: Formicidae). , (2013).
- Veja um FORMIGUEIRO por DENTRO. Boravê Available from: https://youtu.be/sN99x_Rjf90 (2021)
- Ortiz, G., Vieira, A. S., Bueno, O. C. Toxicological and morphological comparative studies of insecticides action in leaf-cutting ants. International Journal of Agriculture Innovations and Research. 6 (3), 516-522 (2017).
- Decio, P., Silva-Zacarin, E. C. M., Bueno, F. C., Bueno, O. C. Toxicological and histopathological effects of hydramethylnon on Atta sexdens rubropilosa (Hymenoptera: Formicidae) workers. Micron. 45, 22-31 (2013).
- Vieira, A. S., Morgan, E. D., Drijfhout, F. P., Camargo-Mathias, M. I. Chemical composition of metapleural gland secretions of fungus-growing and non-fungus-growing ants. Journal of Chemical Ecology. 38 (10), 1289-1297 (2012).
- Vieira, A. S., Ramalho, M. O., Martins, C., Martins, V. G., Bueno, O. C. Microbial communities in different tissues of Atta sexdens rubropilosa leaf-cutting ants. Current Microbiology. 74 (10), 1216-1225 (2017).
- Ramalho, M. d. e. O., Martins, C., Morini, M. S. C., Bueno, O. C. What can the bacterial community of Atta sexdens (Linnaeus, 1758) tell us about the habitats in which this ant species evolves. Insects. 11 (6), 332 (2020).
- Machado, L. M., et al. Attractivity or repellence: relation between the endophytic fungi of Acalypha, Colocasia and the leaf-cutting ants—Atta sexdens. Advances in Entomology. 9 (2), 85-99 (2021).
- Moreira, A., Forti, L. C., Andrade, A. P., Boaretto, M. A., Lopes, J. Nest architecture of Atta laevigata (F. Smith, 1858) (Hymenoptera: Formicidae). Studies on Neotropical Fauna and Environment. 39 (2), 109-116 (2004).
- Della Lucia, T. M. C., Moreira, D. D. O., Oliveira, M. A., Araújo, M. S. Perda de peso de rainhas de Atta durante a fundação e o estabelecimento das colônias. Revista Brasileira de Biologia. 55 (4), 533-536 (1995).
- Fujihara, R. T., Camargo, R. d. a. S., Forti, L. C. Lipid and energy contents in the bodies of queens of Atta sexdens rubropilosa Forel (Hymenoptera, Formicidae): pre-and post-nuptial flight. Revista Brasileira de Entomologia. 56 (1), 73-75 (2012).
- da Silva Camargo, R., Forti, L. C. Queen lipid content and nest growth in the leaf cutting ant (Atta sexdens rubropilosa) (Hymenoptera: Formicidae). Journal of Natural History. 47, 65-73 (2013).
- Camargo, R. S., Forti, L. C., Fujihara, R. T., Roces, F. Digging effort in leaf-cutting ant queens (Atta sexdens rubropilosa) and its effects on survival and colony growth during the claustral phase. Insectes Sociaux. 58 (1), 17-22 (2011).
- Mota Filho, T. M. M., Garcia, R. D. M., Camargo, R. S., Stefanelli, L. E. P., Forti, L. C. Observations about founding queens (Atta sexdens) and their unusual behavior. International Journal of Agriculture Innovations and Research. 9, 352-357 (2021).
- Barcoto, M. O., Pedrosa, F., Bueno, O. C., Rodrigues, A. Pathogenic nature of Syncephalastrum in Atta sexdens rubropilosa fungus gardens. Pest Management Science. 73 (5), 999-1009 (2017).
- Silva, A., Bacci, M., Pagnocca, F. C., Bueno, O. C., Hebling, M. J. A. Production of polysaccharidases in different carbon sources by Leucoagaricus gongylophorus Möller (Singer), the symbiotic fungus of the leaf-cutting ant Atta sexdens Linnaeus. Curr. Microbiology. 53 (1), 68-71 (2006).
- Majoe, M., Libbrecht, R., Foitzik, S., Nehring, V. Queen loss increases worker survival in leaf-cutting ants under paraquat-induced oxidative stress. Philosophical Transactions of the Royal Society B. 376 (1823), 20190735 (2021).
- Della Lucia, T. M. C., Peternelli, E. F. O., Lacerda, F. G., Peternelli, L. A., Moreira, D. D. O. Colony behavior of Atta sexdens rubropilosa (Hymenoptera: Formicidae) in the absence of the queen under laboratory conditions. Behavioural Processes. 64 (1), 49-55 (2003).
- Sales, T. A., Toledo, A. M. O., Zimerer, A., Lopes, J. F. S. Foraging for the fungus: why do Acromyrmex subterraneus (Formicidae) queens need to forage during the nest foundation phase. Ecological Entomology. 46 (6), 1364-1372 (2021).
- Forti, L. C., et al. Do workers from subspecies Acromyrmex subterraneus prepare leaves and toxic baits in similar ways for their fungus garden. Neotropical Entomology. 49 (1), 12-23 (2020).
- Dorigo, A. S., et al. Projeto Primeiros Passos na Ciência: rompendo barreiras sociais e estreitando laços entre a comunidade acadêmica e o ensino médio público. Revista Brasileira de Extensão Universitária. 11 (1), 47-59 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved