JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
실험실 조건에서 잎 절단 개미 (Atta)의 수집 및 장기 유지 관리
요약
여기에서는 실험실 조건에서 건강한 Atta (Hymenoptera : Formicidae) 개미 식민지를 성공적으로 수집하고 유지하기위한 프로토콜이 설명됩니다. 또한 가능한 실험 절차와 함께 다양한 둥지 유형 및 구성이 자세히 설명되어 있습니다.
초록
개미는 지구상에서 가장 생물 다양성이 높은 동물 그룹 중 하나이며 다양한 환경에 서식합니다. 통제 된 환경에서 개미 식민지를 유지하면 응용 연구에 기여할 수있는 생물학에 대한 풍부한 이해가 가능합니다. 이 관행은 일반적으로 Atta 개미와 같이 경제적 손실을 초래하는 종의 인구 통제 연구에 사용됩니다. 그들의 상호 주의적 곰팡이를 재배하기 위해,이 잎사귀 개미는 잎을 모으고이를 위해 미국 대륙 전역에 널리 분포하는 농업 해충으로 간주됩니다. 그들은 고도로 사회적으로 조직되어 있으며 다양한 방으로 구성된 정교한 지하 둥지에 서식합니다. 통제 된 환경에서의 유지 관리는 여기에 설명 된 여러 절차와 빈번한 관리의 일상 생활에 달려 있습니다. 그것은 번식기 (즉, 결혼식 비행) 동안 여왕의 수집으로 시작하여 개별적으로 플라스틱 용기로 옮겨집니다. 여왕의 사망률이 높기 때문에 결혼식 비행 후 약 6 개월 후에 곰팡이 뭉치가 발달 한 초기 둥지를 발굴하고 손으로 골라 플라스틱 용기에 넣을 때 두 번째 수집을 수행 할 수 있습니다. 실험실에서는 잎이 매일 확립 된 식민지에 제공되고 개미가 생산 한 폐기물은 남아있는 건조한 식물 재료와 함께 매주 제거됩니다. 곰팡이 정원이 계속 자라면서 식민지는 실험 목적에 따라 다른 유형의 용기로 옮겨집니다. 잎을 자르는 개미 식민지는 상호 연결된 용기에 배치되어 자연에서 곤충이 만든 기능적인 챔버가있는 조직 시스템을 나타냅니다. 이 설정은 폐기물 양, 곰팡이 정원 건강, 작업자와 여왕의 행동과 같은 요소를 모니터링하는 데 이상적입니다. 촉진 된 데이터 수집과보다 상세한 관찰은 개미 식민지를 통제 된 상태로 유지하는 가장 큰 이점으로 간주됩니다.
서문
개미는 대부분의 육상 환경에 영향을 미치는 다양한 개체 그룹을 구성합니다1. 그들은 효율적인 분산기 2,3,4, 포식자5 및 생태계 엔지니어 6,7,8,9,10 역할을하여 자연 생태계에서의 중요성과 생태 학적 성공을 강조합니다. 모든 개미 종은 진사회적 곤충으로 분류됩니다. 그러나 그들의 사회 조직은 다른 종 그룹, 즉 노동 분업 시스템, 기능 그룹, 개인 간의 의사 소통, 사료 조직, 식민지 기초 및 번식 과정11에 따라 크게 다릅니다. 매우 다양한 그룹으로서 그들은 여러 식량 자원과 전문화 된 섭식 행동에 의존합니다. 사실, 농업은 인류 문명뿐만 아니라 개미 종에게도 큰 발걸음이었습니다. 대략 55 내지 65 Ma12 전, attine 개미는 곰팡이를 배양하여 거의 독점적 인 식단에 통합하기 시작했습니다. 그들은 너무 전문화되어 한 개인이 다른 사람 없이는 생존하지 못하는 공생으로 분류되는 엄격하고 의존적이며 의무적인 상호 작용을 개발했습니다.
낮은 곰팡이 성장 개미는 썩은 잎 조각과 같은 죽은 유기물을 수집하고 처리하여 상호 주의적 곰팡이를 성장시킵니다. 더 높은 곰팡이 성장 개미가 신선한 식물 재료를 수확하는 동안 가장 성공적인 공생 자연 시스템 중 하나를 구성합니다13. 이 고도로 전문화 된 농업 기술을 통해 새로운 틈새 시장을 확보 할 수있었습니다. 더 높은 attine 개미는 19 Ma (15-24 Ma)와 18 Ma (14-22 Ma) 사이에서 일어나는 단일 계통 그룹 인 잎 절단 개미로 구성됩니다.14,15,16 네 개의 유효한 속으로 구성됩니다 : Atta Fabricius, Acromyrmex Mayr, Amoimyrmex Cristiano 및 Pseudoatta Gallardo. 잎사귀 개미가 수행하는 잎사귀 농업 시스템은 파생 농업 시스템17에서 진화했습니다. 이 종의 대부분은 상호 주의적 곰팡이 종 Leucoagaricus gongylophorus Singer 18 (Leucocoprinus gongylophorus Heim19라고도 함)을 독점적으로 이용하며, 이는 중요한 진화 적 전환을 표시합니다11. 곰팡이 품종은 원래 둥지에서 자손으로 수직으로 전염되어 클론 적으로 번식 함을 시사합니다20.
놀랍게도, Atta 사회는 환경에서 매우 중요하고 myrmecologists에게 큰 관심을 끄는 복잡한 조직 구조를 개발했습니다. 그들의 인구는 수백만 명의 개인으로 구성 될 수 있으며, 대부분은 뚜렷한 다형성, 즉 뚜렷한 크기와 해부학 적 형태를 나타내는 무균 여성 근로자입니다. 인구는 연령, 생리적 상태, 형태 학적 유형, 행동 및 식민지의 특수 활동에 따라 카스트로 구별됩니다21. 작업자는 정원사와 간호사, 둥지 내 일반인, 수렵채집인과 굴착기, 방어자 또는 군인으로 차별될 수 있습니다21. 이 조직은 협력을 통한 작업 수행과 고도로 구조화 된 집단 행동을 생성 할 수있는 자기 조직화 시스템을 허용하여 환경 교란22에 효율적으로 대응할 수 있도록합니다.
인구 재생의 역할은 그녀가 살아있는 한 한 명의 여왕 (즉, 일부일처 제)에 의해 수행되며 영구 생식 카스트22를 구성합니다. Atta 여왕은 20 년 이상 살며 평생 동안 알을 낳는 것으로 알려져 있습니다23. 여왕은 대체 할 수 없기 때문에 지구력은 식민지 13,20,23,24의 생존에 매우 중요합니다. 그러나 번식기에는 수천 마리의 날개 달린 생식 암컷과 수컷이 둥지에서 발견 될 수 있지만 원래 둥지에 머무르는 사람은 아무도 없어 임시 카스트22를 형성합니다. Atta sexdens 식민지에서는 거의 3,000 명의 생식 암컷과 14,000 명의 생식 수컷이생산됩니다 25. 식민지가 시행 후 약 38 개월 후에 성적으로 성숙 할 때 발생하며 그 이후로 소멸 될 때까지 매년 반복됩니다23,25. 새로운 Atta 식민지는 한 여왕이 새로운 둥지를 시작하는 haplometrosis를 통해 형성됩니다.
환경 조건이 좋으면 재현자는 지하 둥지를 떠나 결혼식 비행을 시작합니다. 발생 기간은 종에 따라 브라질 영토 전체에 걸쳐 지역마다 다릅니다. 그러나, 이 사건은 강우 및 습도 상승(26)에 선행되는 것으로 보이며, 이는 토양 수분(22)으로 인한 굴착 촉진과 관련될 수 있다. 종종 결혼식 비행 1-5 주 전에 둥지 입구와 채널을 넓혀 생식 개체가 쉽게 출발 할 수 있습니다. 그들의 어머니 식민지를 떠나기 전에, 날개 달린 암컷은 상호 주의적 곰팡이20,27의 일부를 협측 하부 구멍에 모아서 저장합니다. 비행 중에 여러 번의 교미가 수행되며, 일부 종28에서는 한 마리의 여왕이 3-8 마리의 수컷 (즉, 일부다처제)에 의해 수정 될 수 있다고 계산되어 유전 적 다양성을 보장합니다 29. 그 후, 여왕은 토양으로 이동하여 초목이 없거나 거의없는 위치를 선호하며25 날개를 제거하고 첫 번째 둥지 방을 굴착합니다. 이것은 둥지 밖에서 여왕을 볼 수있는 유일한 기간입니다. 임시 카스트의 개체가 인공 둥지에서 관찰되었지만 실험실 조건에서 성공적인 교미 (즉, 결혼식 비행)가 수행되었는지 여부는 알려져 있지 않습니다24.
초기 둥지 건설은 식민지의 가장 중요한시기에 해당하며 6 시간에서 8 시간23,25까지 지속될 수 있습니다. 이 순간, 여왕은 초기 방에서 자신을 회랑하고, 며칠 만에 산란이 시작됩니다. 첫 번째 알은 여왕이 역류하는 균사체에 공급되어 식민지의 곰팡이 정원의 시작을 알립니다. 첫 번째 유충은 약 25 일22 일에 나타나며, 거의 첫 달 말에 식민지는 미성숙 (알, 유충 및 번데기)이 둥지를 틀고있는 증식하는 곰팡이 매트와 초기 자손을 고립시켜 키우는 여왕으로 구성됩니다23. 계란은 또한 첫 번째 유충의 식량 자원이며 여왕13에 의해 많이 소비됩니다. 또한 여왕은 더 이상 사용되지 않는 뚱뚱한 몸과 이화 날개 근육으로 자신을 유지합니다13. 초기 곰팡이 배양은 식민지 생존이 발달에 달려 있기 때문에 소비되지 않으며,이 기간 동안 여왕은 대변13으로 수정한다. 출현 후 며칠 후, 첫 번째 작업자는 둥지 입구를 열고 둥지13의 바로 옆 영역에서 채집 활동을 시작합니다. 그들은 곰팡이 정원의 기질로 수집 된 재료를 통합하여 현재 근로자13,22를위한 음식으로 사용됩니다. 곰팡이 배양에 첨가되기 전에, 작업자에 의해 운반 된 식물 재료는 작은 조각으로 절단되고 배설물액체 13로 적셔진다. 개미는 곰팡이 접종 물을 조작하여 성장을 증가시키고 제어하며, 이는 정원 13,22,25를 조절하는 데 특화된 큰 토양 굴착 챔버를 분할하는 역할을합니다.
결혼식 비행 후 약 6 개월 후, A. sexdens 둥지에는 곰팡이 챔버와 몇 개의 채널이 있습니다. 잎 절단 개미 둥지 건설의 위대한 전문화는 천적과 불리한 환경 요인에 대한 방어 메커니즘으로 작동합니다22. 잎 절단 개미는 곰팡이 정원을 조각화하고 챔버가 마르기 시작할 때 습도가 높은 챔버로 옮기는 것으로 알려져 있습니다13. 따라서, 상당한 에너지 비용을 갖는 둥지의 굴착에도 불구하고, 투자된 에너지는 식민지 자체에 대한 이익에서 역전된다(22). 몇 가지 예외를 제외하고 Atta 종은 대부분 고갈 된 곰팡이 기질과 죽은 개미의 시체로 만들어진 식민지의 폐기물을위한 특수 챔버를 만들어 나머지 둥지와 격리하고 중요한 사회적 면역 전략을 수립합니다30. 또한 별개의 작업자 그룹이 다른 개인의 오염을 피하기 위해 쓰레기를 직접 조작합니다. 노동자들은 식민지의 주요 영양 자원 인 곰팡이를 키우기 위해 끊임없이 먹이를 찾습니다. 그러나 그들은 파편을 자르는 동안 식물 수액을 먹을 수 있습니다. 식물 재료는 곰팡이 정원 유지를 위해 신중하게 선택되며 잎 특성 및 생태계의 특성과 같은 많은 요인의 영향을받습니다13.
신선한 재료를 얻기 위해 개미를 자르는 채집 전략은 매우 복잡하며 기존 식민지의 높은 수확 수요와 결합되어 농업 생산자에게 상당한 경제적 손실을 초래하고 산림 복원 지역을 위태롭게합니다22,31. 따라서이 개미는 미국 남부에서 아르헨티나 북동부 11,13,22,32에 이르기까지 발생할 수있는 대부분의 지역에서 해충으로 분류 될 수 있습니다. 문제가있는 식민지의 멸종은 이러한 곤충의 생물학에 내재 된 일련의 적응 (즉, 사회 조직, 채집, 곰팡이 재배, 위생 및 복잡한 둥지 구조)으로 인해 어렵습니다 33. 따라서 개체군 통제 전략은 다른 해충에 일반적으로 적용되는 전략과 구별되며 주로 매력적인 오염 된 미끼 제물33,34에 의존합니다. 그러나 이러한 개미는 곰팡이와 식민지 개체 모두에 유해한 물질을 거부하고 경작지를 손상시킬 수 있기 때문에 33, 새로운 천연 화합물 및 방제 대안이 지속적으로 테스트되고 있습니다33,35,36. 현장 테스트를 거친 콜로니에서는 실험 결과를 거의 모니터링 할 수 없기 때문에 예비 에세이는 통제 된 환경에서 수행됩니다.
따라서, 실험 프로토콜은 개미의 이질적인 생활 방식을 고려하고, 종 수준에 대한 연구를 지원하고, 하나의 개미가 복잡한 초유기체(11)의 요소인 운영 단위로서 콜로니를 설명하는 관심 그룹에 적응되어야 한다. 지금까지 Atta 속에 관해 수집 된 보고서는 실험실 조건에서 식민지를 성공적으로 수집 및 유지하고 기본 요구와 일반적인 기능을 인정할 수있게했습니다. 번식, 식민지 설립 및 먹이 행동과 같은 자연적 과정을 기반으로 다양한 유형의 둥지에 식민지를 장기간 설립 할 수있는 일상적인 관행이 개발되었습니다. 여기에서는 실험실에서 잎사귀 개미를 유지하기 위한 절차적 프로토콜이 설명되고 뚜렷한 실험 목적과 과학 지원을 통해 가능한 일반 연구를 강조합니다.
프로토콜
1. 여왕의 컬렉션
- 관심 지역의 Atta 생식 시즌 기간에 대한 문헌을 검색하십시오. 결혼식 비행의 번식기 발생, 빈도 및 주간 시간은 지역 기후 조건에 따라 다릅니다 (표 1). 일반적으로 봄에 발생하지만이 정보는 수집이 발생할 위치 37,38,39,40,41,42,43,44,45,46에 대해 수집되어야합니다.
- 여왕과 어린 식민지를 수집 할 수있는 가능한 지역으로 간주되는 Atta 둥지가있는 위치를 식별하고 표시하십시오. 결혼식 비행 중에 여왕은 둥지 주변에 흩어져 있습니다. 따라서 식민지 수가 많은 지역은 새로운 둥지 발굴을 시작하는 여왕 착륙 지점을 가질 가능성이 더 높습니다.
- Atta 개미의 번식기 동안 결혼식 비행의 징후가 있는지 이전에 선택한 영역을 확인하십시오. 덥고 강우 날씨와 같은 결혼식 비행 일의 환경 조건을 추적하십시오.
- 이전에 선택한 지역에서 잎 절단 개미 둥지를 확인하고 날개 달린 생식 개미의 다가오는 출발을 나타내는 외부 특징을 찾으십시오. 둥지 특징에는 터널 입구가 넓어지고(그림 1), 가능한 포식자에 대해 더 공격적인 행동을 보이는 작업자의 흐름 증가, 터널 입구에 나타나는 날개 달린 생식 개미(그림 1)가 포함됩니다. 습도가 높은 날은 일반적으로 결혼식 비행에 앞서 강우가 계속되므로 주의하십시오.
- 여왕을 개별적으로 유지하기 위해 바닥 석고 층이있는 플라스틱 뚜껑이 달린 용기를 준비하십시오. 용기 부피가 약 200mL이고 바닥의 석고 층 높이가 약 1cm이고 습도 조절을 위해 흡수성이 높은지 확인하십시오.
알림: 석고베이스를 준비하려면 제조업체의 지침을 따르십시오. - 23 ± 1 ° C의 일정한 온도와 약 70 % ± 10 %의 상대 습도로 환경을 준비하십시오. 진동과 방해를 피하기 위해 격렬한 활동과 사람들의 흐름이 많지 않은 위치를 선택하십시오. 개미 행동에 방해가되지 않도록 중성 향의 세제를 사용하십시오.
알림: 지정된 환경 조건의 변동은 수분 응결 또는 수분 손실을 유발하고 곰팡이 정원을 손상시킬 수 있습니다. - 결혼식 비행 후, 둥지 발굴을 시작한 날개없는 여왕을 모아서 석고 층으로 준비된 플라스틱 용기에 조심스럽게 넣으십시오. 맨손으로 여왕을 만지지 말고 라텍스 장갑이나 곤충 핀셋을 사용하십시오.
참고 : 날개 제거 및 토양 굴착 행동은 이미 교미 한 생식 암컷을 나타내므로 새로운 식민지를 시작할 수 있습니다. 퀸즈 컬렉션은 또한이 작품의 첫 번째 컬렉션으로 취급됩니다. - 여왕이 있는 컨테이너를 이전에 선택한 통제된 환경이 있는 위치로 이동합니다. 여왕의 운송은 최대한주의를 기울여 너무 많은 방해를 피하고 최소 온도 일정성을 유지하십시오.
- 스트레스를 피하기 위해 수집 후 약 3 일 동안 여왕을 조작하거나 움직이지 마십시오.

그림 1. 둥지 입구는 날개 달린 개미 번식자와 노동자로 넓어졌습니다. 넓어진 터널 입구는 Atta 결혼식 비행 발생을 나타내는 둥지 기능 중 하나입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 퀸즈의 유지 보수
- 처음에는 바늘 주사기를 사용하여 2 일마다 수령인의 석고 층에 2.5mL의 물을 첨가하십시오.
- 수신자를 여는 대신 조작으로 인한 방해를 피하기 위해 바늘로 용기 뚜껑을 조심스럽게 뚫습니다. 이 기간 동안 동일한 구멍을 사용할 수 있습니다. 첨가 된 물이 석고 층을 흡수하지 않도록하십시오. 여왕, 초기 곰팡이 스폰지 및 미성숙 한 사람에게 직접 물을주지 마십시오. 곰팡이 정원이 물 부재로 건조한 측면을 나타내는 한 석고 층을 관개하십시오.
- 수집 2 주 후, 곰팡이가 여왕에 의해 역류되었는지 확인하십시오. 곰팡이가 없으면 확립 된 식민지에서 얻은 약 2g의 곰팡이를 옮깁니다. 또한 곰팡이가 발생하지 않으면이 단계를 수행하십시오.
참고 : 곰팡이 이동을 위해서는 확립 된 식민지에서 건강한 곰팡이를 수집하고 그 위에있을 수있는 모든 개미를 제거해야합니다. 큰 스푼, 곤충학 핀셋 및 라텍스 장갑을 사용하여 곰팡이를 조작하십시오. - 첫 번째 노동자가 출현 한 후, 식민지의 절단 활동에 따라 젊고 얇은 잎 조각을 정기적으로 제공하기 시작하십시오. 제공된 잎이 건강하고 식물이 살충제 또는 기타 화학 물질로 처리되지 않았는지 확인하십시오. 초기 단계에서 잎 조각이 4cm를 넘지 않도록하십시오.
알림: 첫 번째 작업자가 잎 채집을 시작할 때 출현 후 식물 재료를 제공해야합니다. 제공 빈도는 작업자가 곰팡이에 식물 재료를 통합하는 민첩성에 따라 다르지만 일주일에 2-3 일까지 다양합니다. 귀리 플레이크와 콘플레이크도 제공 될 수 있지만 곰팡이 건조를 피하기 위해 잎과 번갈아 가며 제공해야합니다. - 새 잎을 제공 할 때는 식민지 폐기물과 마른 잎 조각을 제거하십시오. 여왕을 조작 할 때 향수, 보습제, 크림 또는 강한 냄새가 나는 물질의 사용을 피하십시오. 또한 모든 과정에서 라텍스 장갑을 사용하십시오.
- 식민지의 발달을 따르고 곰팡이 정원이 용기 부피의 절반 이상에 도달하면 식민지를 인공 내구성있는 둥지로 옮깁니다.
참고: 개발 속도는 각 식민지에 내재되어 있으므로 식민지 이동에 대한 예상 시간은 없습니다. 일반적으로 첫 번째 컬렉션의 식민지는 작은 곰팡이 정원으로 인해 최대 1L 부피의 곰팡이 정원 챔버가있는 둥지로 옮겨집니다.
3. 젊은 식민지 수집
- 약 500mL 부피의 플라스틱 용기를 구입하십시오.
- 결혼식 비행 후 약 6 개월 후, 이전에 표시된 잎 절단 개미 발생이있는 위치에서 초기 Atta 둥지 (그림 1)의 과립 토양 입자 (그림 2)가있는 표시 타워 모양의 마운드를 식별합니다.
참고 : 결혼식 비행 후 6 개월 후, 어린 식민지의 둥지는 토양에서 최대 1m 깊이로 추정됩니다. 이 기간에 새로운 컬렉션이 표시되어 대량으로 성공적이고 지속적인 식민지의 더 높은 기회를 얻습니다. - 정원 괭이로 어린 식민지를 지키고있는 방에 도달 할 때까지 둥지 입구를 굴착하십시오. 여왕, 곰팡이 정원, 미성숙 및 젊은 노동자를 모아 플라스틱 용기에 넣으십시오. 수집 프로세스를 가능한 한 부드럽게 수행하십시오.
알림: 당연히 많은 양의 토양도 수집되며 실험실의 향후 유지 관리 절차에서 점진적으로 제거해야 합니다. - 식민지를 담고있는 플라스틱 뚜껑이있는 용기를 지정된 통제 된 환경으로 옮깁니다. 너무 많은 교란을 피하고 최소 온도 일정성을 유지하면서 궁극적 인주의를 기울여 어린 식민지의 운송을 수행하십시오. 스트레스를 피하기 위해 약 3 일 동안 식민지를 조작하거나 이동하는 것을 자제하십시오. 방에 활동적인 루틴이 있으면 식민지 위에 어두운 천을 놓을 수 있습니다.

그림 2. 탑 모양의 토양 마운드. 특징적인 탑 모양의 마운드는 Atta sexdens 와 Atta laevigata의 초기 식민지의 존재를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 젊은 식민지의 유지
- 얇은 어린 잎을 일주일에 3 번 제공하십시오.
- 제공된 잎이 건강하고 식물이 살충제 또는 기타 화학 물질로 처리되지 않았는지 확인하십시오. 이 단계에서 잎 조각의 길이가 7cm 이상인지 확인하십시오.
알림: 귀리 플레이크와 콘플레이크도 제공 될 수 있지만 곰팡이 건조를 피하기 위해 잎과 번갈아 가며 제공해야합니다. - 제공 빈도는 작업자가 곰팡이에 식물 재료를 통합하는 민첩성에 따라 다릅니다. 컷 활동이 강렬 해지면 하루에 두 번 일주일에 세 번 또는 일주일에 5 일 헌금을 늘리십시오.
- 제공된 잎이 건강하고 식물이 살충제 또는 기타 화학 물질로 처리되지 않았는지 확인하십시오. 이 단계에서 잎 조각의 길이가 7cm 이상인지 확인하십시오.
- 새 잎을 제공 할 때 숟가락을 사용하여 토양 잔재물을 포함한 식민지 폐기물을 제거하십시오. 모든 과정에서 라텍스 장갑을 사용하십시오. 젊은 식민지를 조작 할 때 향수, 보습제, 크림 또는 강한 냄새가 나는 물질의 사용을 피하십시오.
알림: 작업자 자신이 토양과 폐기물을 곰팡이에서 분리합니다. - 식민지의 발달을 따르고 곰팡이 정원이 용기 부피의 절반 이상에 도달하면 식민지를 인공 내구성있는 둥지로 옮깁니다.
참고: 개발 속도는 각 식민지에 내재되어 있으므로 식민지 이동에 대한 예상 시간은 없습니다.
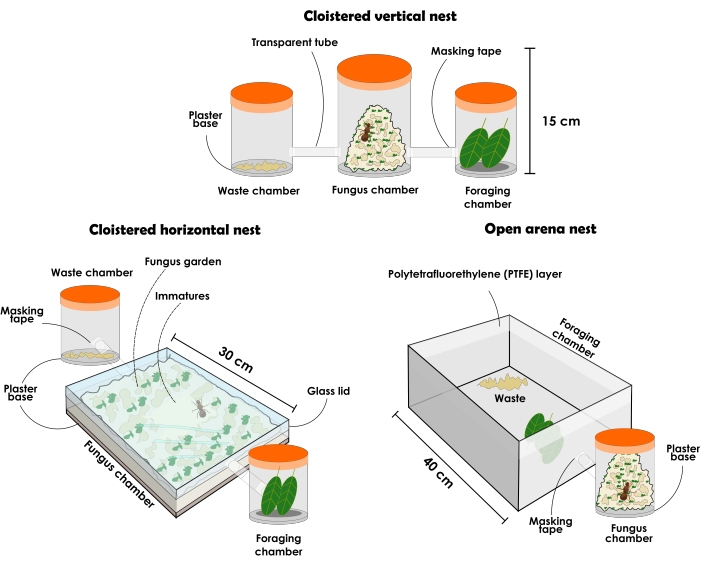
그림 3 : Atta sexdens와 Atta laevigata 식민지를 보유하기위한 인공 둥지의 유형. 잎사귀 개미의 내구성 있는 인공 둥지의 그림: 회랑 수직 둥지 설정, 회랑 수평 둥지 설정 및 개방형 경기장 둥지 설정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 튼튼한 인공 둥지
- 아래 설명된 대로 회랑 수직 둥지 설정을 준비합니다(그림 3 및 그림 4).
알림: 회랑 둥지 구성에는 항상 (1) 곰팡이 정원 챔버, (2) 폐기물 처리 챔버 및 (3) 채집 챔버로 별도로 포즈를 취할 다른 수신자가 있어야 합니다. 처음에는 3 개의 컨테이너로 시작해야하지만 곰팡이 정원을 늘리기 위해 더 많은 수신자를 추가 할 수 있습니다. 둥지는 실험 목적에 따라 크기와 재료가 다를 수 있지만 여기서는 투명 재료의 사용을 설명하고 권장합니다. 용기는 구멍이 없어야하며, 그렇지 않으면 개미가 탈출합니다. 아래에 설명 된 둥지의 유형은 일반적인 연구에 사용할 수 있지만 뚜껑을 제거 할 때 발생하는 방해로 인해 독단적 인 개미 수집에는 권장되지 않아 개인간에 큰 동요가 발생합니다. 그럼에도 불구하고 물질적 투명성으로 인해 곰팡이 정원이 전체 용기를 채운 경우에도 여왕과 다른 개미 카스트를 찾을 수 있습니다. 그것이 경향이기 때문에, 미성숙은 수직 컨테이너에서 사용할 수있는 대부분의 공간을 차지했을 때 항상 곰팡이 정원의 중앙에 있다고 가정합니다.- 약 1L의 투명한 뚜껑이 있는 용기를 선택하고 1cm의 고흡수성 석고 베이스를 추가합니다. 이것은 곰팡이 정원 챔버가 될 것입니다. 각각 약 500mL의 뚜껑이 있는 투명 용기 2개를 폐기물 처리 및 채집 챔버로 선택하십시오. 개미는 각각 어떤 챔버가 될지 선택하고 그 후에 서로 바꿔서 사용하지 않도록합니다.
알림: 석고베이스를 준비하려면 제조업체의 지침을 따르십시오. - 세 개의 용기를 구멍을 뚫고 투명한 튜브 또는 호스로 연결하십시오. 필요한 경우 튜브 테두리에 마스킹 테이프를 적용하여 용기와의 허벅지 연결을 보장하고 개미가 탈출하지 않도록하십시오. 석고 베이스 용기를 가운데에 놓고 다른 용기를 반대쪽에 놓습니다.
- 선택한 식민지의 곰팡이 스폰지 (2.5 단계 및 4.3 단계 참조)를 여왕, 작업자 및 미성숙과 함께 석고 기본 용기로 조심스럽게 옮깁니다. 옮기기 전에 석고 바닥에 물을 주는지 확인하십시오. 라텍스 장갑을 사용하십시오.
- 약 1L의 투명한 뚜껑이 있는 용기를 선택하고 1cm의 고흡수성 석고 베이스를 추가합니다. 이것은 곰팡이 정원 챔버가 될 것입니다. 각각 약 500mL의 뚜껑이 있는 투명 용기 2개를 폐기물 처리 및 채집 챔버로 선택하십시오. 개미는 각각 어떤 챔버가 될지 선택하고 그 후에 서로 바꿔서 사용하지 않도록합니다.
- 아래 설명된 대로 회랑 수평 둥지 설정을 준비합니다(그림 3 및 그림 4).
알림: 수평 구성의 둥지를 통해 곰팡이 정원과 그에 대한 작업자의 활동을 면밀히 관찰 할 수 있습니다. 곰팡이 정원의 젊은 부분이 맨 위에 있기 때문에 최근에 제공된 기질이 작업자에 의해 통합되는 것을 관찰 할 수 있습니다. 곰팡이의 새로운 부분은 그 색으로 발견 될 수 있는데, 이는 마지막으로 제공된 자원의 색과 비슷하지만 오래된 부분은 일반적으로 베이지 색을 띠게됩니다. 자손과 여왕은 또한 수평 컨테이너에서와 같이 대부분의 공간을 차지한 경우에도 일반적으로 곰팡이 정원의 최상위에 있기 때문에 쉽게 찾을 수 있습니다. 이 구성은 둥지 내부의 조직에 대한 인식을 제공하므로 행동 중심 연구, 초점 샘플링 및 과학 지원 목적으로 사용할 수 있습니다.- 약 31cm x 21cm x 4.5cm 크기의 투명한 뚜껑이 있는 용기를 얻고 1cm의 고흡수성 석고 베이스를 추가합니다. 이것은 곰팡이 정원 챔버가 될 것입니다. 각각 약 500mL의 뚜껑이 있는 투명 용기 2개를 폐기물 처리 및 채집 챔버로 선택하십시오. 개미는 각각 어떤 챔버가 될지 선택하고 그 후에 서로 바꿔서 사용하지 않도록합니다.
알림: 석고베이스를 준비하려면 제조업체의 지침을 따르십시오. 필요한 경우 개미가 빠져 나가지 않도록 마스킹 테이프로 뚜껑과 용기 사이의 작은 공간을 닫으십시오. - 용기를 천공하고 투명한 튜브 또는 호스로 연결하십시오. 필요한 경우 튜브 테두리에 마스킹 테이프를 적용하여 용기와의 허벅지 연결을 보장하고 개미가 탈출하지 않도록하십시오. 석고 베이스 용기를 가운데에 놓고 다른 용기를 반대쪽에 놓습니다.
- 선택한 식민지의 곰팡이 스폰지 (2.5 단계 및 4.3 단계 참조)를 여왕, 작업자 및 미성숙과 함께 석고 기본 용기로 조심스럽게 옮깁니다. 옮기기 전에 석고 바닥에 물을 주는지 확인하십시오. 라텍스 장갑을 사용하십시오.
- 약 31cm x 21cm x 4.5cm 크기의 투명한 뚜껑이 있는 용기를 얻고 1cm의 고흡수성 석고 베이스를 추가합니다. 이것은 곰팡이 정원 챔버가 될 것입니다. 각각 약 500mL의 뚜껑이 있는 투명 용기 2개를 폐기물 처리 및 채집 챔버로 선택하십시오. 개미는 각각 어떤 챔버가 될지 선택하고 그 후에 서로 바꿔서 사용하지 않도록합니다.
- 아래 설명된 대로 개방형 경기장 둥지 설정을 준비합니다(그림 3 및 그림 5).
알림: 개방형 경기장 둥지는 큰 방해 및 채집 행동 분석 없이 개미를 수집할 수 있습니다. 그들은 또한 과학 봉사 목적으로 자연에서 발견되는 식민지의 신뢰할 수있는 표현을 제공 할 수 있습니다.- 약 1L의 투명한 뚜껑이 있는 용기를 선택하고 고흡수성 석고층 베이스의 1cm 층을 추가합니다. 이것은 곰팡이 정원 챔버가 될 것입니다.
알림: 1L 용기로 시작하여 더 큰 곰팡이 정원을 위해 점차적으로 더 많은 양의 용기로 전달하는 것이 좋습니다. 그러나 용기는 5L 부피를 초과해서는 안됩니다. 필요한 만큼 컨테이너를 추가합니다. - 열려 있는 경기장을 선택합니다. 경기장의 크기는 연구 목적에 따라 다를 수 있습니다. 큰 경기장을 선택한 경우 곰팡이 정원을 담고있는 용기를 내부에 놓습니다 (그림 5). 작은 경기장의 경우 투명한 호스 또는 튜브로 곰팡이 정원 용기에 연결하십시오 (그림 3). 경기장은 채집 및 폐기물 처리실 역할을 하므로 너무 작지 않도록 하십시오.
- 한 번의 움직임으로 폴리 테트라 플루오로 에틸렌 액체의 한 층을 개미를 담기 위해 경기장 경계에 바르십시오. 액체와 니트릴 장갑에 적신면을 사용하십시오.
주의 : 폴리 테트라 플루오로 에틸렌 액체를 사용하는 동안 흡입 및 피부 접촉을 피하십시오. - 선택한 식민지의 곰팡이 스폰지 (2.5 단계 및 4.3 단계 참조)를 여왕, 작업자 및 미성숙과 함께 석고 기본 용기로 조심스럽게 옮깁니다. 옮기기 전에 석고 바닥에 물을 주는지 확인하십시오. 라텍스 장갑을 사용하십시오.
- 약 1L의 투명한 뚜껑이 있는 용기를 선택하고 고흡수성 석고층 베이스의 1cm 층을 추가합니다. 이것은 곰팡이 정원 챔버가 될 것입니다.

그림 4 : 잎을 자르는 개미 Atta sexdens와 Atta laevigata의 인공 회랑 둥지. 회랑 수직 둥지 셋업 탑 (A) 및 측면도 (B); 회랑 수평 둥지 설정 상단(C) 및 측면도(D). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 잎을 자르는 개미 Atta sexdens 와 Atta laevigata의 인공 개방형 경기장 둥지. Atta 섹스덴스 상단(A) 및 측면도(B)의 개방형 경기장 둥지 설정. 1) 곰팡이 정원 챔버; 2) 폐기물; 3) 오렌지 슬라이스; 4) 폴리 테트라 플루오로 에틸렌 (PTFE) 층이있는 유리. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 개발 된 식민지의 유지
- 매일 1L의 곰팡이 정원이있는 식민지 당 적어도 하나의 큰 잎을 채집 실에 제공하십시오. 개미의 절단 활동이 강하면 잎의 수를 늘리십시오. 곰팡이가 건조한 경우 잎을 미리 적셔 습도를 높입니다. 회랑 둥지에서는 개미가 먹이를 찾는 방에서 탈출하지 않도록 신속하게 제물을 바칩니다.
참고: 여기에서 잎은 뽕나무(Morus nigra), 망고(Mangifera indica), 유칼립투스(유칼립투스 sp.), 잠볼란(Syzygium cumini), 히비스커스(히비스커스 종), 아카리파(Acalypha wilkesiana) 및 리구스트룸(Ligustrum lucidum).- 오렌지와 사과, 귀리와 콘플레이크와 같은 과일을 제공하여 식단을 다양 화하고 보완하십시오. 강렬한 채집 활동을하는 큰 식민지에는 매일 귀리 플레이크와 콘플레이크를 제공하고 일주일에 한 번 과일을 제공하십시오. 그렇지 않은 경우 잎과 번갈아 가며 플레이크를 제공하지만 일주일에 세 번 이상, 한 달에 한두 번 과일을 제공하십시오. 개미의 채집 활동에 따라 각 음식의 양과 빈도를 조정하십시오.
- 위에서 설명한 옵션을 사용할 수없는 경우 지역 나무와 관목의 잎, 꽃, 열매 또는 상업화 된 야채, 곡물 및 기타 플레이크 중에서 개미의 채집 선호도를 확인하십시오. 방어 화합물과 살충제로 자원을 제공하지 마십시오.
- 모든 식민지에서 2 주마다 폐기물 챔버의 모든 내용물을 제거하십시오. 인구 통제 목적으로 근로자도 제거하십시오. 작업자가 건강한 곰팡이를 폐기물 챔버로 옮기면 여왕이 그 위에 있지 않은지 확인하고 제거하십시오. 폐기되는 폐기물의 양이 많거나 너무 습한 경우 일주일에 한 번 제거하십시오.
- 새 재료를 제공 할 때마다 개미가 먹이 집에서 가져 가지 않은 재료를 제거하고 항상 깨끗한 지 확인하십시오.
- 작업자가 건강한 곰팡이를 채집 실로 옮기면 방해하고 용기 뚜껑을 열어두고 중성 활석 가루를 챔버 가장자리 표면에 바르십시오. 곰팡이 챔버에 아직 공간이있는 경우에만이 절차를 수행하면 작업자가 곰팡이를 잃어 버리거나 미성숙하지 않고 곰팡이를 용기로 다시 옮길 수 있습니다.
- 더 많은 곰팡이 정원이 필요하면 다른 회 반죽 용기를 추가하고 곰팡이 스폰지의 일부를 그 안으로 옮깁니다. 곰팡이가 용기의 절반에 도달 할 때까지 곰팡이 챔버에 잎을 넣으십시오. 곰팡이 정원의 성장은 식민지 균형을 손상시키지 않기 위해 점차적으로 일어나야합니다. 더 큰 용기를 원한다면 옮기기 전에 곰팡이가 가장 작은 용기의 전체 공간을 차지하도록하십시오. 식민지 폐기물과 마른 잎은 곰팡이 정원 챔버에 축적되어서는 안됩니다.
- 시간이 지남에 따라 짙은 갈색을 띠고 개미 배설, 폐기물 운송 및 높은 습도 농도로 인해 효과가 없을 수 있으므로 용기에서 석고 바닥을 확인하십시오. 또한 일부 식민지는 층을 자르고 처분 할 수 있습니다. 이 경우 곰팡이 정원을 새로운 회 반죽 용기로 옮깁니다.
결과
개미 수집 과정을 보여주는 순서도는 그림 6에 나와 있습니다. 여기서, 위에서 설명한 수집, 유지 관리 및 둥지 설정의 프로토콜을 사용하여 얻은 일부 결과가 표시됩니다.
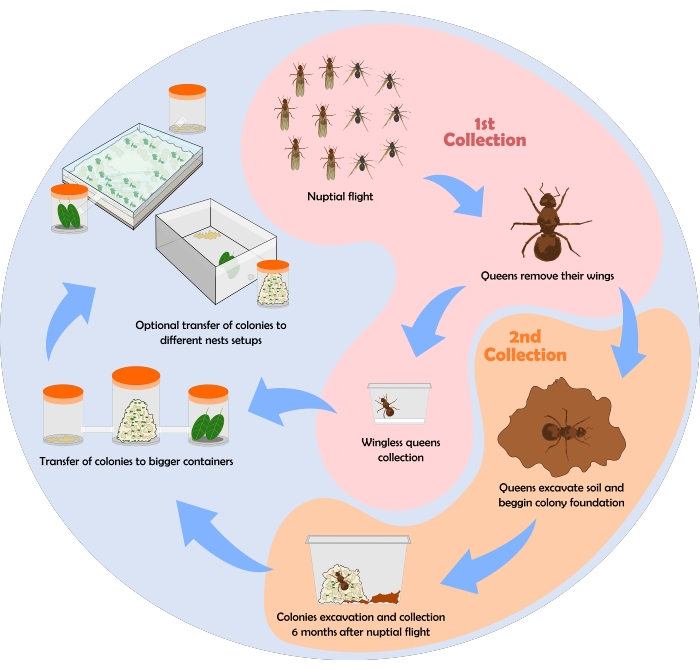
그림 6: 잎사귀 개미의 군락 수집을 위한 순서도. ...
토론
잎을 자르는 개미 식민지를 유지하기 위해 여기에 설명 된 프로토콜은 단호하고 복제 가능한 방식으로 3 년 이상 개발 및 적용되었습니다. 그것은 현장 조건에 의해 제한 될 연구의 개발을 허용했습니다. 이로써 건강한 개미와 식민지는 개인 및 식민지 수준에서 비교 형태학, 독성학 51,52, 조직학53 및 미생물학54,55,56
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
마리오 오투오리(추모) 와 월터 휴고 드 안드라데 쿠냐 잎사귀 연구에 크게 기여한 사람. 우리는 상파울루 주립 대학과 생명 과학 연구소의 지원을 인정합니다. 이 연구는 부분적으로 Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES) - Finance Code 001, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) 및 Fundação para o Desenvolvimento da UNESP (Fundunesp)에 의해 재정 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| Entomologic forceps | N/A | N/A | N/A |
| Glass tank | N/A | N/A | Tempered glass, custom made |
| Hose | N/A | N/A | Transparent, PVC 1/2 Inch x 2,0 mm |
| Latex gloves | Descarpack | 550301 | N/A |
| Nitrile gloves | Descarpack | 433301 | N/A |
| Open arena | N/A | N/A | Polypropylene crate |
| Plaster pouder | N/A | N/A | Plaster pouder used in construction, must be absorbant |
| Plastic Containers for collection | Prafesta | Natural Cód.: 8231/Natural Cód.: 8262 | Lidded, transparent , polypropylene |
| Plastic containers for nests | Prafesta | Discontinued | Polystyrene, hermetic |
| Teflon | Dupont | N/A | Polytetrafluoroethylene liquid (PTFE Dispertion 30) |
참고문헌
- Wilson, E. O. . The Insect Societies. , (1971).
- Ortiz, D. P., Elizalde, L., Pirk, G. I. Role of ants as dispersers of native and exotic seeds in an understudied dryland. Ecological Entomology. 46 (3), 626-636 (2021).
- Christianini, A. V., Oliveira, P. S. Birds and ants provide complementary seed dispersal in a neotropical savanna. Journal of Ecology. 98 (3), 573-582 (2010).
- Camargo, P. H. S. A., Martins, M. M., Feitosa, R. M., Christianini, A. V. Bird and ant synergy increases the seed dispersal effectiveness of an ornithochoric shrub. Oecologia. 181 (2), 507-518 (2016).
- Sanders, D., van Veen, F. J. F. Ecosystem engineering and predation: the multi-trophic impact of two ant species. Journal of Animal Ecology. 80 (3), 569-576 (2011).
- Swanson, A. C., et al. Welcome to the Atta world: A framework for understanding the effects of leaf-cutter ants on ecosystem functions. Functional Ecology. 33 (8), 1386-1399 (2019).
- Meyer, S. T., et al. Leaf-cutting ants as ecosystem engineers: topsoil and perturbations around Atta cephalotes nests reduce nutrient availability. Ecological Entomology. 38 (5), 497-504 (2013).
- Sosa, B., Brazeiro, A. Positive ecosystem engineering effects of the ant Atta vollenweideri on the shrub Grabowskia duplicata. Journal of Vegetation Science. 21 (3), 597-605 (2010).
- De Almeida, T., et al. Above- and below-ground effects of an ecosystem engineer ant in Mediterranean dry grasslands. Proceedings of the Royal Society B: Biological Sciences. 287 (1935), 20201840 (2020).
- Folgarait, P. J. Ant biodiversity and its relationship to ecosystem functioning: a review. Biodiversity & Conservation. 7 (9), 1221-1244 (1998).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Barrera, C. A., Sosa-Calvo, J., Schultz, T. R., Rabeling, C., Bacci, M. Phylogenomic reconstruction reveals new insights into the evolution and biogeography of Atta leaf-cutting ants (Hymenoptera: Formicidae). Systematic Entomology. 47 (1), 13-35 (2021).
- Hölldobler, B., Wilson, E. O. . The Leafcutter Ants: Civilization By Instinct. , (2011).
- Branstetter, M. G., et al. Dry habitats were crucibles of domestication in the evolution of agriculture in ants. Proceedings of the Royal Society B: Biological Sciences. 284 (1852), 20170095 (2017).
- Solomon, S. E., et al. The molecular phylogenetics of Trachymyrmex Forel ants and their fungal cultivars provide insights into the origin and coevolutionary history of ‘higher-attine’ ant agriculture. Systematic Entomology. 44 (4), 939-956 (2019).
- Cristiano, M. P., Cardoso, D. C., Sandoval-Gómez, V. E., Simões-Gomes, F. C. Amoimyrmex Cristiano, Cardoso & Sandoval, gen. nov. (Hymenoptera: Formicidae): a new genus of leaf-cutting ants revealed by multilocus molecular phylogenetic and morphological analyses. Austral Entomology. 59 (4), 643-676 (2020).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences of the United States of America. 105 (14), 5435-5440 (2008).
- Mueller, U. G., et al. Phylogenetic patterns of ant–fungus associations indicate that farming strategies, not only a superior fungal cultivar, explain the ecological success of leafcutter ants. Molecular Ecology. 27 (10), 2414-2434 (2018).
- Mueller, U. G., et al. Biogeography of mutualistic fungi cultivated by leafcutter ants. Molecular Ecology. 26 (24), 6921-6937 (2017).
- Weber, N. A. The fungus-culturing behavior of ants. American Zoologist. 12 (3), 577-587 (1972).
- Wilson, E. O. Caste and division of labor in leaf-cutter ants (Hymenoptera: Formicidae: Atta). Behavioral Ecology and Sociobiology. 7 (2), 157-165 (1980).
- Della Lucia, T. M. C. Formigas cortadeiras: da bioecologia ao manejo. Viçosa Editora UFV. 421, (2011).
- Autuori, M. Contribuição para o conhecimento da saúva (Atta spp). I. Evolução do sauveiro (Atta sex dens rubolpilosa Forel, 1908). Arquivos do Instituto Biologico Saul Paulo. 12, 197-228 (1941).
- Bueno, O. C., Hebling, M. J. A., Schneider, M. O., Pagnocca, F. C. Ocorrência de formas aladas de Atta sexdens rubropilosa Forel (Hymenoptera: Formicidae) em colônias de laboratório. Neotropical Entomology. 31 (3), 469-473 (2002).
- Mariconi, F. A. M. Biologo. As Saúvas. , (2021).
- Bento, J. M. S. . Condições climáticas para o vôo nupcial e reconhecimento dos indivíduos em Atta sexdens rubropilosa (Hymenoptera: Formicidae). , (1993).
- Little, A. E. F., Murakami, T., Mueller, U. G., Currie, C. R. The infrabuccal pellet piles of fungus-growing ants. Naturwissenschaften. 90 (12), 558-562 (2003).
- Kerr, W. E. Acasalamento de rainhas com vários machos em duas espécies da tribo Attini. Revista Brasileira de Biologia. 21, 45-48 (1961).
- Kerr, W. E. Tendências evolutivas na reprodução dos himenópteros sociais. Arquivos do Museu Nacional. 52, (1962).
- Cremer, S., Armitage, S. A. O., Schmid-Hempel, P. Social immunity. Current Biology. 17 (16), 693-702 (2007).
- Hernández, J. V., Jaffé, K. Dano econômico causado por populações de formigas Atta laevigata (F. Smith) em plantações de Pinus caribaea (Mor.) e elementos para o manejo da praga. Anais da Sociedade Entomológica do Brasil. 24 (2), 287-298 (1995).
- Kempf, W. W. Catálogo abreviado das formigas da Região Neotropical Studia Entomologica. antbase.org. 15, 3 (1972).
- Della Lucia, T. M. C., Gandra, L. C., Guedes, R. N. C. Managing leaf-cutting ants: peculiarities, trends and challenges. Pest Management Science. 70 (1), 14-23 (2013).
- Boaretto, M. A. C., Forti, L. C. Perspectivas no controle de formigas-cortadeiras. Série Técnica IPEF. 11 (30), 31-46 (1997).
- Folgarait, P. J., Goffré, D. Conidiobolus lunulus, a newly discovered entomophthoralean species, pathogenic and specific to leaf-cutter ants. Journal of Invertebrate Pathology. 186, 107685 (2021).
- Cardoso, S. R. S., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Pathogenicity of filamentous fungi towards Atta sexdens rubropilosa (Hymenoptera: Formicidae). International Journal of Tropical Insect Science. 42 (2), 1215-1223 (2022).
- Ichinose, K., Rinaldi, I., Forti, L. C. Winged leaf-cutting ants on nuptial flights used as transport by Attacobius spiders for dispersal. Ecological Entomology. 29 (5), 628-631 (2004).
- Pagnocca, F. C., Rodrigues, A., Nagamoto, N. S., Bacci, M. Yeasts and filamentous fungi carried by the gynes of leaf-cutting ants. Antonie Van Leeuwenhoek. 94 (4), 517-526 (2008).
- Attili-Angelis, D., et al. Novel Phialophora species from leaf-cutting ants (tribe Attini). Fungal Diversity. 65 (1), 65-75 (2014).
- Delabie, J. H. C., do Nascimento, I. C., Mariano, C. S. F. Estratégias de reprodução e dispersão em formigas attines, com exemplos do sul da Bahia. XIX Congresso Brasileiro de Entomologia. , 16-21 (2002).
- Fjerdingstad, E. J., Boomsma, J. J. Variation in size and sperm content of sexuals in the leafcutter ant Atta colombica. Insectes Sociaux. 44 (3), 209-218 (1997).
- Currie, C. R., Mueller, U. G., Malloch, D. The agricultural pathology of ant fungus gardens. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7998-8002 (1999).
- Moser, J. C., et al. Eye size and behaviour of day-and night-flying leafcutting ant alates. Journal of Zoology. 264 (1), 69-75 (2004).
- Moreira, S. M., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Absence of the parasite Escovopsis in fungus garden pellets carried by gynes of Atta sexdens. Sociobiology. 62 (1), 34-38 (2015).
- Arcuri, S. L., et al. Yeasts found on an ephemeral reproductive caste of the leaf-cutting ant Atta sexdens rubropilosa. Antonie Van Leeuwenhoek. 106 (3), 475-487 (2014).
- Staab, M., Kleineidam, C. J. Initiation of swarming behavior and synchronization of mating flights in the leaf-cutting ant Atta vollenweideri FOREL, 1893 (Hymenoptera: Formicidae). Myrmecol. News. 19, 93-102 (2014).
- Gálvez, D., Chapuisat, M. Immune priming and pathogen resistance in ant queens. Ecology and Evolution. 4 (10), 1761-1767 (2014).
- Baer, B., Armitage, S. A. O., Boomsma, J. J. Sperm storage induces an immunity cost in ants. Nature. 441 (7095), 872-875 (2006).
- Carlos, A. A. . Semioquímicos e comunicação sonora em formigas cortadeiras (Hymenoptera: Formicidae). , (2013).
- Veja um FORMIGUEIRO por DENTRO. Boravê Available from: https://youtu.be/sN99x_Rjf90 (2021)
- Ortiz, G., Vieira, A. S., Bueno, O. C. Toxicological and morphological comparative studies of insecticides action in leaf-cutting ants. International Journal of Agriculture Innovations and Research. 6 (3), 516-522 (2017).
- Decio, P., Silva-Zacarin, E. C. M., Bueno, F. C., Bueno, O. C. Toxicological and histopathological effects of hydramethylnon on Atta sexdens rubropilosa (Hymenoptera: Formicidae) workers. Micron. 45, 22-31 (2013).
- Vieira, A. S., Morgan, E. D., Drijfhout, F. P., Camargo-Mathias, M. I. Chemical composition of metapleural gland secretions of fungus-growing and non-fungus-growing ants. Journal of Chemical Ecology. 38 (10), 1289-1297 (2012).
- Vieira, A. S., Ramalho, M. O., Martins, C., Martins, V. G., Bueno, O. C. Microbial communities in different tissues of Atta sexdens rubropilosa leaf-cutting ants. Current Microbiology. 74 (10), 1216-1225 (2017).
- Ramalho, M. d. e. O., Martins, C., Morini, M. S. C., Bueno, O. C. What can the bacterial community of Atta sexdens (Linnaeus, 1758) tell us about the habitats in which this ant species evolves. Insects. 11 (6), 332 (2020).
- Machado, L. M., et al. Attractivity or repellence: relation between the endophytic fungi of Acalypha, Colocasia and the leaf-cutting ants—Atta sexdens. Advances in Entomology. 9 (2), 85-99 (2021).
- Moreira, A., Forti, L. C., Andrade, A. P., Boaretto, M. A., Lopes, J. Nest architecture of Atta laevigata (F. Smith, 1858) (Hymenoptera: Formicidae). Studies on Neotropical Fauna and Environment. 39 (2), 109-116 (2004).
- Della Lucia, T. M. C., Moreira, D. D. O., Oliveira, M. A., Araújo, M. S. Perda de peso de rainhas de Atta durante a fundação e o estabelecimento das colônias. Revista Brasileira de Biologia. 55 (4), 533-536 (1995).
- Fujihara, R. T., Camargo, R. d. a. S., Forti, L. C. Lipid and energy contents in the bodies of queens of Atta sexdens rubropilosa Forel (Hymenoptera, Formicidae): pre-and post-nuptial flight. Revista Brasileira de Entomologia. 56 (1), 73-75 (2012).
- da Silva Camargo, R., Forti, L. C. Queen lipid content and nest growth in the leaf cutting ant (Atta sexdens rubropilosa) (Hymenoptera: Formicidae). Journal of Natural History. 47, 65-73 (2013).
- Camargo, R. S., Forti, L. C., Fujihara, R. T., Roces, F. Digging effort in leaf-cutting ant queens (Atta sexdens rubropilosa) and its effects on survival and colony growth during the claustral phase. Insectes Sociaux. 58 (1), 17-22 (2011).
- Mota Filho, T. M. M., Garcia, R. D. M., Camargo, R. S., Stefanelli, L. E. P., Forti, L. C. Observations about founding queens (Atta sexdens) and their unusual behavior. International Journal of Agriculture Innovations and Research. 9, 352-357 (2021).
- Barcoto, M. O., Pedrosa, F., Bueno, O. C., Rodrigues, A. Pathogenic nature of Syncephalastrum in Atta sexdens rubropilosa fungus gardens. Pest Management Science. 73 (5), 999-1009 (2017).
- Silva, A., Bacci, M., Pagnocca, F. C., Bueno, O. C., Hebling, M. J. A. Production of polysaccharidases in different carbon sources by Leucoagaricus gongylophorus Möller (Singer), the symbiotic fungus of the leaf-cutting ant Atta sexdens Linnaeus. Curr. Microbiology. 53 (1), 68-71 (2006).
- Majoe, M., Libbrecht, R., Foitzik, S., Nehring, V. Queen loss increases worker survival in leaf-cutting ants under paraquat-induced oxidative stress. Philosophical Transactions of the Royal Society B. 376 (1823), 20190735 (2021).
- Della Lucia, T. M. C., Peternelli, E. F. O., Lacerda, F. G., Peternelli, L. A., Moreira, D. D. O. Colony behavior of Atta sexdens rubropilosa (Hymenoptera: Formicidae) in the absence of the queen under laboratory conditions. Behavioural Processes. 64 (1), 49-55 (2003).
- Sales, T. A., Toledo, A. M. O., Zimerer, A., Lopes, J. F. S. Foraging for the fungus: why do Acromyrmex subterraneus (Formicidae) queens need to forage during the nest foundation phase. Ecological Entomology. 46 (6), 1364-1372 (2021).
- Forti, L. C., et al. Do workers from subspecies Acromyrmex subterraneus prepare leaves and toxic baits in similar ways for their fungus garden. Neotropical Entomology. 49 (1), 12-23 (2020).
- Dorigo, A. S., et al. Projeto Primeiros Passos na Ciência: rompendo barreiras sociais e estreitando laços entre a comunidade acadêmica e o ensino médio público. Revista Brasileira de Extensão Universitária. 11 (1), 47-59 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유