Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Сбор и длительное содержание муравьев-листорезов (Atta) в лабораторных условиях
В этой статье
Резюме
Здесь описан протокол успешного сбора и поддержания здоровых колоний муравьев Atta (Hymenoptera: Formicidae) в лабораторных условиях. Кроме того, различные типы и конфигурации гнезд детализируются вместе с возможными экспериментальными процедурами.
Аннотация
Муравьи являются одной из самых биоразнообразных групп животных на планете и населяют различные среды. Содержание колоний муравьев в контролируемых средах позволяет обогатить понимание их биологии, что может способствовать прикладным исследованиям. Эта практика обычно используется в исследованиях контроля популяции видов, которые вызывают экономические потери, таких как муравьи Атта . Чтобы культивировать свой взаимный грибок, эти муравьи-листорезы собирают листья и для этого считаются сельскохозяйственными вредителями, широко распространенными по всему американскому континенту. Они высоко социально организованы и населяют сложные подземные гнезда, состоящие из различных камер. Их поддержание в контролируемой среде зависит от распорядка дня, состоящего из нескольких процедур и частого ухода, которые описаны здесь. Он начинается со сбора маток во время репродуктивного сезона (то есть брачного полета), которые затем индивидуально переносятся в пластиковые контейнеры. Из-за высокой смертности маток второй сбор может быть проведен примерно через 6 месяцев после брачного полета, когда зарождающиеся гнезда с развитым грибком выкапывают, вручную собирают и помещают в пластиковые контейнеры. В лаборатории листья ежедневно подают в установленные колонии, а отходы, произведенные муравьями, еженедельно удаляют вместе с оставшимся сухим растительным материалом. По мере того, как грибовой сад продолжает расти, колонии переносятся в различные типы контейнеров в соответствии с экспериментальным назначением. Колонии муравьев-листорезов помещаются во взаимосвязанные контейнеры, представляющие собой организационную систему с функциональными камерами, построенными этими насекомыми в природе. Эта установка идеально подходит для мониторинга таких факторов, как количество отходов, здоровье сада грибка и поведение рабочих и королевы. Облегченный сбор данных и более подробные наблюдения считаются наибольшим преимуществом содержания колоний муравьев в контролируемых условиях.
Введение
Муравьи составляют разнообразную группу особей, которые оказывают влияние на большинство наземных сред1. Они действуют как эффективные диспергаторы 2,3,4, хищники5 и экосистемные инженеры 6,7,8,9,10, подчеркивая их важность и экологический успех в природных экосистемах. Все виды муравьев классифицируются как эусоциальные насекомые; однако их социальная организация сильно варьируется между различными видовыми группами, т. е. системы разделения труда, функциональные группы, общение между индивидуумами, организация кормов, основание колонии и процесс воспроизводства11. Как высоко диверсифицированная группа, они прибегают к нескольким пищевым ресурсам и специализированному пищевому поведению. По сути, сельское хозяйство было не только огромным шагом для человеческой цивилизации, но и для видов муравьев. Примерно от 55 до 65 млн лет назад12 лет муравьи начали культивировать грибы и включать их в почти эксклюзивную диету. Они стали настолько специализированными, что развили строгие, зависимые и обязательные взаимодействия, классифицируемые как симбиоз, когда один человек не выживает без другого.
Низшие грибообразующие муравьи собирают и обрабатывают мертвое органическое вещество, такое как фрагменты гниющего листа, чтобы вырастить свой мутуалистический гриб; в то время как более высокогрибковые муравьи собирают свежий растительный материал, составляя одну из самых успешных симбиотических природных систем13. Эта узкоспециализированная сельскохозяйственная техника позволила им занять новую нишу. Муравьи с более высоким аттином включают муравьев-листорезов, монофилетическую группу, которая пробуждается между 19 Ма (15-24 Ма) и 18 Ма (14-22 Ма)14,15,16, состоящая из четырех действительных родов: Atta Fabricius, Acromyrmex Mayr, Amoimyrmex Cristiano и Pseudoatta Gallardo. Система земледелия листорезов, выполняемая муравьями-листорезами, развилась из производных систем земледелия17. Большинство из этих видов исключительно эксплуатируют вид мутуалистического гриба Leucoagaricus gongylophorus Singer18 (также называемый Leucocoprinus gongylophorus Heim19), отмечая значительный эволюционный переход11. Грибковые сорта передаются вертикально, от первоначальных гнезд к потомству, предполагая, что они размножаются клонально20.
Примечательно, что общества Атты разработали сложную организационную структуру, имеющую огромное значение в их среде и представляющую большой интерес для мирмекологов. Их популяция может состоять из миллионов особей, большинство из которых являются стерильными работницами, которые демонстрируют подчеркнутый полиморфизм, то есть различный размер и анатомическую морфологию. Популяция отличается кастами по возрасту, физиологическому состоянию, морфологическому типу, поведению и специализированной деятельности в колонии21. Рабочие могут быть дискриминированы на садовников и медсестер, универсалов внутри гнезда, собирателей и экскаваторов, а также защитников или солдат21. Эта организация позволяет выполнять задачи в сотрудничестве и самоорганизующейся системе, которая может производить высокоструктурированное коллективное поведение, позволяя им эффективно реагировать на нарушения окружающей среды22.
Роль обновления популяции играет одна королева (т. е. моногинная), до тех пор, пока она жива, составляя постоянную репродуктивную касту22. Известно, что королевы атты живут более 20 лет, откладывая яйца на протяжении всей своей жизни23. Поскольку королева незаменима, ее выносливость имеет решающее значение для выживания колонии 13,20,23,24. Тем не менее, тысячи крылатых репродуктивных самок и самцов могут быть найдены в гнезде во время сезонов размножения, но ни один из них не остается в первоначальном гнезде, образуя временную касту22. В колониях atta sexdens производится около 3000 репродуктивных самок и 14 000 репродуктивных самцов. Это происходит, когда колония достигает половой зрелости, примерно через 38 месяцев после ее реализации, и повторяется ежегодно с тех пор, пока она не исчезнет23,25. Новые колонии атты создаются путем гаплометроза, когда одна королева начинает новое гнездо.
Когда условия окружающей среды благоприятны, размножатели покидают подземное гнездо, чтобы начать брачный полет. Период его возникновения различается по регионам, начиная по годам по всей территории Бразилии в зависимости от вида. Однако этому событию, по-видимому, предшествуют осадки и высота влажности26, что может быть связано с облегчением раскопок из-за влажности почвы22. Часто, за 1-5 недель до брачного полета, входы и каналы гнезда расширяются, чтобы облегчить уход репродуктивных особей. Прежде чем покинуть свои материнские колонии, крылатые самки собирают и хранят в инфрабуккальной полости часть мутуалистического гриба20,27. Множественные совокупления выполняются в середине полета, и подсчитано, что одна матка может быть осеменена тремя-восемью самцами (т. е. полиандриями) у некоторых видов28, обеспечивая генетическую изменчивость29. После этого матки переходят в почву, отдавая предпочтение местам с отсутствием или небольшим количеством растительности25, где они удаляют свои крылья и выкапывают свою первую гнездовую камеру. Это единственный период, когда маток можно увидеть за пределами гнезда. Хотя особи временной касты были замечены в искусственных гнездах, неизвестно, было ли выполнено какое-либо успешное совокупление (т.е. брачный полет) в лабораторных условиях24.
Первоначальное строительство гнезда соответствует наиболее критическому периоду колонии, который может длиться от 6 ч до 8 ч23,25. В этот момент королева обитает в начальной камере, и в считанные дни начинается яйцекладка. Первые яйца скармливаются мицелиалу, который отрыгивает королева, отмечая начало грибкового сада колонии. Первые личинки появляются примерно через 25дней 22, и почти в конце первого месяца колония состоит из мата размножающегося гриба, где гнездятся незрелые (яйца, личинки и куколки), и королевы, которая воспитывает свое первоначальное потомство в изоляции23. Яйца также являются пищевым ресурсом первых личинок и сильно потребляются маткой13. Кроме того, королева поддерживает себя жировыми запасами тела и катаболизирует мышцы крыльев, которые больше не используются13. Первоначальная культура гриба не потребляется, так как выживание колонии зависит от ее развития, и в этот период матка оплодотворяет ее фекальной жидкостью13. Через несколько дней после появления первые рабочие открывают вход в гнездо и начинают кормовую деятельность в непосредственной близости от гнезда13. Они включают в себя материал, собранный в качестве субстрата грибного сада, который в настоящее время служит пищей длярабочих 13,22. Перед добавлением в культуру гриба растительный материал, переносимый рабочими, разрезается на крошечные кусочки и смачивается фекальной жидкостью13. Муравьи манипулируют грибком inoculum для увеличения и контроля его роста, который будет служить для разделения больших почвенных выкопанных камер, специализирующихся на кондиционировании сада 13,22,25.
Примерно через 6 месяцев после брачного перелета гнезда A. sexdens содержат грибковую камеру и несколько каналов. Большая специализация в строительстве муравьиных гнезд листорезов работает как защитный механизм от естественных врагов и неблагоприятных факторов окружающей среды22. Известно, что муравьи-листорезы фрагментируют грибной сад и переносят его в камеры с высокой влажностью, когда камеры начинают высыхать13. Таким образом, несмотря на то, что раскопки гнезда имеют значительные энергетические затраты, вложенная энергия обращена вспять в пользу самой колонии22. За некоторыми исключениями, виды Atta также делают специализированные камеры для отходов колонии, сделанные в основном из истощенного грибного субстрата и тел мертвых муравьев, изолируя его от остальной части гнезда и устанавливая важную стратегию социального иммунитета30. Кроме того, отдельная группа рабочих манипулирует мусором напрямую, чтобы избежать заражения другими людьми. Рабочие постоянно кормятся, чтобы вырастить грибок, который является основным питательным ресурсом колонии. Тем не менее, они могут питаться соком растений, а также при обрезке фрагментов. Растительный материал тщательно отбирается для ухода за грибом сада и под влиянием многих факторов, таких как черты листьев и свойства экосистемы13.
Стратегия кормления муравьев-листоносцев для получения свежего материала является весьма сложной и в сочетании с высоким спросом на урожай в устоявшихся колониях приводит к значительным экономическим потерям для сельскохозяйственных производителей и ставит под угрозу лесные восстановительные районы22,31. Таким образом, эти муравьи могут быть классифицированы как вредители в большинстве районов, где они могут встречаться, начиная от юга Соединенных Штатов до северо-восточной Аргентины 11,13,22,32. Уничтожение проблемных колоний является сложной задачей из-за ряда адаптаций, присущих биологии этих насекомых (т.е. социальная организация, кормление, выращивание грибов, гигиена и сложные структуры гнезд)33. Таким образом, стратегии борьбы с популяцией отличаются от тех, которые обычно применяются к другим насекомым-вредителям, и в основном прибегают к привлекательным предложениям загрязненных приманок33,34. Однако, поскольку эти муравьи могут отторгать вредные вещества как для гриба, так и для особей колонии и компрометировать обрабатываемые поля33, новые природные соединения и альтернативы контроля постоянно тестируются 33,35,36. Поскольку результаты эксперимента вряд ли можно контролировать на проверенных в полевых условиях колониях, предварительные эссе проводятся в контролируемой среде.
Таким образом, экспериментальные протоколы должны быть адаптированы к группам интересов, учитывающим неоднородный образ жизни муравьев, поддерживающий исследования на видовом уровне и учитывающий колонии как операционные единицы, где один муравей является элементом сложного суперорганизма11. Собранные до сих пор отчеты о роде Atta позволили успешно собирать и поддерживать колонии в лабораторных условиях и признавать их основные потребности и общее функционирование. Основываясь на их естественных процессах, таких как размножение, создание колоний и пищевое поведение, была разработана рутина практик, которая позволяет долгосрочно создавать колонии в различных типах гнезд. Здесь описан процедурный протокол для поддержания муравьев-листорезов в лаборатории и освещает возможные общие исследования с четкими экспериментальными целями и научной пропагандой.
протокол
1. Коллекция маток
- Поиск в литературе по периоду репродуктивного сезона Атты в интересующем регионе. Возникновение репродуктивного сезона, частота и время суток брачных перелетов варьируются в зависимости от региональных климатических условий (табл. 1). Хотя обычно это происходит весной, эта информация должна быть собрана для места, где сбор должен происходить 37,38,39,40,41,42,43,44,45,46.
- Определите и обозначьте места с гнездами атта , рассматриваемыми как возможные районы для сбора маток и молодых колоний. Во время брачных полетов матки рассредоточиваются по местам гнездования; поэтому районы с большим количеством колоний имеют более высокие шансы иметь места посадки королевы, где они инициируют новые раскопки гнезд.
- Проверьте районы, выбранные ранее, на наличие признаков брачного полета во время репродуктивного сезона муравьев Атта . Следите за условиями окружающей среды брачных полетов, такими как жаркая и дождливая погода.
- Определите муравьиные гнезда листоносцев на выбранных ранее участках и ищите внешние признаки, указывающие на предстоящий уход крылато-репродуктивных муравьев. Особенности гнезда включают расширенные входы в туннель (рисунок 1), увеличение потока рабочих, демонстрирующих более агрессивное поведение по отношению к возможным хищникам, и крылатых репродуктивных муравьев, появляющихся на входах в туннель (рисунок 1). Остерегайтесь дней с высокой влажностью, сменяющихся осадками, так как они, как правило, предшествуют брачным полетам.
- Подготовьте пластиковые контейнеры с крышкой с нижним гипсовым слоем для удержания маток по отдельности. Убедитесь, что объем контейнера составляет примерно 200 мл, а слой штукатурки на дне составляет около 1 см в высоту и обладает высокой абсорбирующей способностью для контроля влажности.
ПРИМЕЧАНИЕ: Чтобы подготовить гипсовое основание, следуйте инструкциям производителя. - Подготовьте среду с постоянной температурой 23 ± 1 °C и приблизительно 70% ± 10% относительной влажности. Выберите место без интенсивной деятельности и высокого потока людей, чтобы избежать вибраций и помех. Используйте чистящие средства нейтрального аромата, чтобы предотвратить любое вмешательство в поведение муравьев.
ПРИМЕЧАНИЕ: Колебания в определенных условиях окружающей среды могут вызвать конденсацию воды или потерю влаги и поставить под угрозу грибной сад. - После брачного полета соберите бескрылых маток, которые начали раскопки гнезда, и аккуратно поместите их в пластиковые контейнеры, подготовленные с гипсовым слоем, по отдельности. Избегайте прикосновения к королевам голыми руками и используйте латексные перчатки или энтомологический пинцет.
ПРИМЕЧАНИЕ: Удаление крыльев и поведение при раскопках почвы указывают на репродуктивных самок, которые уже совокупились и, следовательно, способны начать новую колонию. Коллекция Queens также рассматривается как первая коллекция в этой работе. - Переместите контейнеры с матками в место с ранее выбранной контролируемой средой. Выполняйте перевозку маток с особой осторожностью, избегая слишком больших помех и поддерживая минимальное температурное постоянство.
- Не манипулируйте и не двигайте матками в течение примерно 3 дней после сбора, чтобы избежать стресса.

Рисунок 1. Вход в гнездо расширен крылатыми муравьиными размножателями и рабочими. Расширенные входы в туннель являются одной из особенностей гнезд, которая указывает на возникновение брачных полетов Атты . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Обслуживание Квинса
- Первоначально добавляйте 2,5 мл воды в гипсовый слой реципиента каждые 2 дня с помощью игольчатого шприца.
- Вместо того, чтобы открывать реципиента, осторожно проколите крышки контейнера иглой, чтобы избежать беспокойства из-за манипуляций. В этот период можно использовать такое же отверстие. Убедитесь, что добавленная вода не впитывает слой штукатурки. Избегайте непосредственного полива матки, первоначальной грибковой губки и любых незрелых. До тех пор, пока грибной сад проявляет сухой вид с отсутствием воды, орошайте слой штукатурки.
- Через две недели после сбора проверьте, не был ли грибок отрыгнут матками. Если грибка нет, перенесите примерно 2 г гриба, полученного из установленной колонии. Также выполните этот этап, если грибок не развивается.
ПРИМЕЧАНИЕ: Для переноса грибка необходимо собрать здоровый гриб из установленной колонии и удалить всех муравьев, которые могут быть на ней. Используйте столовую ложку, энтомологический пинцет и латексные перчатки для манипулирования грибком. - После появления первых рабочих начинают регулярно предлагать фрагменты молодых и тонких листьев, в зависимости от срезанной активности колонии. Следите за тем, чтобы предлагаемые листья были здоровыми, а растения не были обработаны инсектицидами или другими химическими веществами. На ранних стадиях следите за тем, чтобы фрагменты листьев не превышали 4 см.
ПРИМЕЧАНИЕ: Поскольку первые рабочие инициируют кормление листьев, растительный материал должен быть предложен после их появления. Частота предложения зависит от ловкости, с которой рабочие включают растительный материал на грибок, но может варьироваться до 2-3 дней в неделю. Овсяные хлопья и кукурузные хлопья также могут быть предложены, но их следует чередовать с листьями, чтобы избежать грибковой сухости. - При предложении новых листьев удалите отходы колонии и сухие фрагменты листьев. Избегайте использования духов, увлажняющих средств, кремов или любого вещества с сильным запахом при манипулировании матками. Кроме того, используйте латексные перчатки во время всех процессов.
- Следите за развитием колонии, и когда грибовой сад достигнет хотя бы половины объема контейнера, перенесите колонию в искусственное долговечное гнездо.
ПРИМЕЧАНИЕ: Поскольку темпы развития присущи каждой колонии, расчетного времени для переноса колонии не существует. Обычно колонии из первой коллекции переносят в гнезда с грибной садовой камерой объемом не более 1л, из-за небольшого гриба садового.
3. Коллекция молодых колоний
- Приобретайте пластиковые контейнеры объемом около 500 мл.
- Примерно через 6 месяцев после брачного полета определите ориентировочные башнеобразные курганы с гранулированными частицами почвы (рисунок 1) зарождающихся гнезд атта (рисунок 2) на местах с ранее отмеченным появлением муравьев-листоносителей.
ПРИМЕЧАНИЕ: Через шесть месяцев после брачного полета гнезда молодых колоний, по оценкам, находятся на глубине до 1 м в почве. Новая коллекция показана в этот период для достижения более высоких шансов на успех и долговечность колоний в больших количествах. - С помощью садовой мотыги выкапывайте вход в гнездо, пока не достигнете камеры, в которой находится молодая колония. Соберите матку, грибного сада, незрелых и молодых рабочих и поместите их в пластиковый контейнер. Выполните процесс сбора как можно более мягко.
ПРИМЕЧАНИЕ: Естественно, большое количество почвы также будет собрано и должно быть удалено постепенно в будущих процедурах обслуживания в лаборатории. - Переместите пластиковые контейнеры с крышкой, удерживающие колонии, в назначенную контролируемую среду. Выполняйте транспортировку молодых колоний с предельной осторожностью, избегая слишком большого беспокойства и поддерживая минимальное температурное постоянство. Воздержитесь от манипулирования или перемещения колоний в течение примерно 3 дней, чтобы избежать стресса. Если в комнате есть активный распорядок дня, на колонии можно надеть темную ткань.

Рисунок 2. Башневидный почвенный насыпь. Характерный башневидный курган указывает на наличие зарождающихся колоний Atta sexdens и Atta laevigata. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Содержание молодняков
- Обеспечивают тонкие молодые листья 3 раза в неделю.
- Убедитесь, что предлагаемые листья здоровы, а растения не были обработаны инсектицидами или другими химическими веществами. На этом этапе убедитесь, что фрагменты листьев не менее 7 см в длину.
ПРИМЕЧАНИЕ: Овсяные хлопья и кукурузные хлопья также могут быть предложены, но их следует чередовать с листьями, чтобы избежать грибковой сухости. - Частота предложения зависит от ловкости, с которой рабочие включают растительный материал в гриб. Когда активность сокращения является интенсивной, увеличьте предложение два раза в день три раза в неделю или 5 дней в неделю.
- Убедитесь, что предлагаемые листья здоровы, а растения не были обработаны инсектицидами или другими химическими веществами. На этом этапе убедитесь, что фрагменты листьев не менее 7 см в длину.
- При предложении новых листьев удаляйте колониальные отходы, в том числе остатки почвы, с помощью ложки. Используйте латексные перчатки во время всех процессов. При манипулировании молодыми колониями избегайте использования духов, увлажняющих средств, кремов или любого вещества с сильным запахом.
ПРИМЕЧАНИЕ: Рабочие сами отделят почву и отходы от грибка. - Следите за развитием колонии, и когда грибовой сад достигнет хотя бы половины объема контейнера, перенесите колонию в искусственное долговечное гнездо.
ПРИМЕЧАНИЕ: Поскольку темпы развития присущи каждой колонии, расчетного времени для переноса колонии не существует.
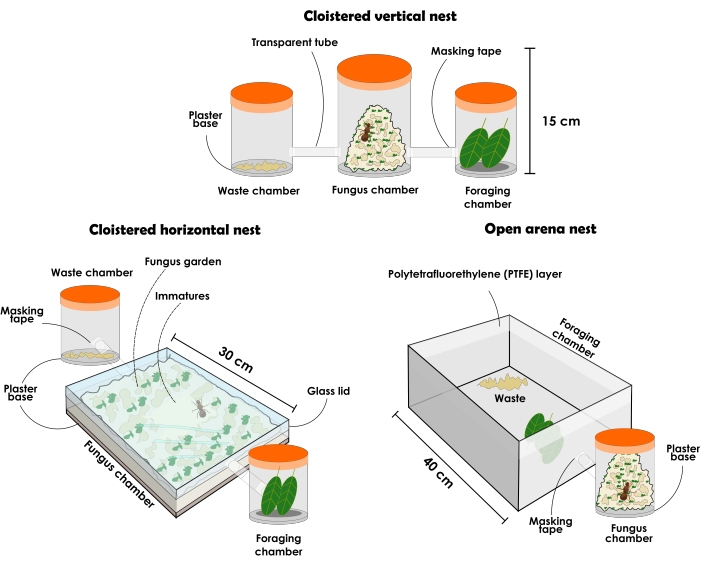
Рисунок 3: Типы искусственных гнезд для содержания колоний Atta sexdens и Atta laevigata . Иллюстрация долговечных искусственных гнезд муравьев-листорезов: закрытая вертикальная установка гнезда, закрытая горизонтальная установка гнезда и открытая установка гнезда арены. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Долговечные искусственные гнезда
- Подготовьте закрытую вертикальную установку гнезда, как описано ниже (рисунок 3 и рисунок 4).
ПРИМЕЧАНИЕ: Конфигурации закрытых гнезд всегда должны иметь разных получателей, чтобы отдельно представлять себя как (1) садовая камера гриба, (2) камера для удаления отходов и (3) кормовая камера. Изначально он должен начинаться с трех контейнеров, но для увеличения грибкового сада можно добавить больше получателей. Гнезда могут различаться по размеру и материалу в зависимости от их экспериментального назначения, хотя здесь описано и рекомендовано использование прозрачных материалов. Контейнеры должны быть без отверстий, иначе муравьи сбегут. Тип гнезда, описанный ниже, может быть использован для общих исследований, но он не рекомендуется для ассертивного сбора муравьев из-за беспокойства, вызванного при снятии крышки, что приводит к большому возбуждению среди особей. Тем не менее, благодаря прозрачности материала, можно найти королеву и различные касты муравьев, даже если грибной сад заполнил весь контейнер. Поскольку это тенденция, всегда предполагается, что незрелые находятся в центре грибкового сада, когда он занял большую часть пространства, доступного в вертикальных контейнерах.- Выберите прозрачный контейнер с крышкой объемом около 1 л и добавьте слой 1 см высокоабсорбирующей гипсовой основы. Это будет грибковая садовая камера. Выберите два прозрачных контейнера с крышкой объемом около 500 мл каждый, которые будут камерами для удаления отходов и кормления. Муравьи будут выбирать, в какой камере будет каждая, и после этого следить за тем, чтобы они не были взаимозаменяемыми.
ПРИМЕЧАНИЕ: Чтобы подготовить гипсовое основание, следуйте инструкциям производителя. - Перфорируйте и соедините три контейнера прозрачной трубкой или шлангом. При необходимости нанесите маскировочную ленту на границу трубок, чтобы гарантировать соединение бедра с контейнерами и избежать выхода муравьев. Поместите контейнер для гипсового основания в середину, а другие контейнеры с противоположных сторон.
- Осторожно перенесите грибковую губку выбранных колоний (см. шаг 2.5 и шаг 4.3) вместе с маткой, рабочими и незрелыми в контейнер для гипсового основания. Перед переносом убедитесь, что гипсовая основа полита. Используйте латексные перчатки.
- Выберите прозрачный контейнер с крышкой объемом около 1 л и добавьте слой 1 см высокоабсорбирующей гипсовой основы. Это будет грибковая садовая камера. Выберите два прозрачных контейнера с крышкой объемом около 500 мл каждый, которые будут камерами для удаления отходов и кормления. Муравьи будут выбирать, в какой камере будет каждая, и после этого следить за тем, чтобы они не были взаимозаменяемыми.
- Подготовьте закрытую горизонтальную установку гнезда, как описано ниже (рисунок 3 и рисунок 4).
ПРИМЕЧАНИЕ: Гнезда с горизонтальной конфигурацией позволяют внимательно наблюдать за грибным садом и деятельностью рабочих по отношению к нему. Поскольку более молодые части грибкового сада находятся наверху, можно наблюдать, как недавно предложенные субстраты включаются рабочими. Новые части гриба могут быть замечены по его цвету, который будет похож на цвет последнего предлагаемого ресурса, тогда как старые порции обычно имеют бежевый цвет. Потомство и матка также могут быть легко расположены, так как в горизонтальных контейнерах они обычно находятся в верхней части грибкового сада, даже когда он занял большую часть пространства. Эта конфигурация может быть использована для поведенческих исследований, фокусной выборки и научных целей, поскольку она дает представление об организации внутри гнезда.- Приобретите прозрачный контейнер с крышкой размером примерно 31 см х 21 см х 4,5 см и добавьте слой 1 см высокоабсорбирующей гипсовой основы. Это будет грибковая садовая камера. Выберите два прозрачных контейнера с крышкой объемом около 500 мл каждый, которые будут камерами для удаления отходов и кормления. Муравьи будут выбирать, в какой камере будет каждая, и после этого следить за тем, чтобы они не были взаимозаменяемыми.
ПРИМЕЧАНИЕ: Чтобы подготовить гипсовое основание, следуйте инструкциям производителя. При необходимости закройте небольшое пространство между крышкой и контейнером маскировочной лентой, чтобы муравьи не вырвались. - Перфорировать и соединить контейнеры прозрачной трубкой или шлангом. При необходимости нанесите маскировочную ленту на границу трубок, чтобы гарантировать соединение бедра с контейнерами и избежать выхода муравьев. Поместите контейнер для гипсового основания в середину, а другие контейнеры с противоположных сторон.
- Осторожно перенесите грибковую губку выбранных колоний (см. шаг 2.5 и шаг 4.3) вместе с маткой, рабочими и незрелыми в контейнер для гипсового основания. Перед переносом убедитесь, что гипсовая основа полита. Используйте латексные перчатки.
- Приобретите прозрачный контейнер с крышкой размером примерно 31 см х 21 см х 4,5 см и добавьте слой 1 см высокоабсорбирующей гипсовой основы. Это будет грибковая садовая камера. Выберите два прозрачных контейнера с крышкой объемом около 500 мл каждый, которые будут камерами для удаления отходов и кормления. Муравьи будут выбирать, в какой камере будет каждая, и после этого следить за тем, чтобы они не были взаимозаменяемыми.
- Подготовьте открытую настройку гнезда арены, как описано ниже (рисунок 3 и рисунок 5).
ПРИМЕЧАНИЕ: Открытые гнезда арены позволяют собирать муравьев без большого беспокойства и анализировать поведение корма. Они также могут обеспечить надежное представление о колонии, найденной в природе, для научных целей.- Выберите прозрачный контейнер с крышкой объемом около 1 л и добавьте слой 1 см высокоабсорбирующего гипсового слоя основания. Это будет грибковая садовая камера.
ПРИМЕЧАНИЕ: Рекомендуется начинать с контейнеров по 1 л и постепенно переходить к контейнерам с большими объемами для большего грибного сада. Однако контейнеры не должны превышать объем 5 л. Добавьте столько контейнеров, сколько необходимо. - Выберите открытую арену. Размер арены может варьироваться в зависимости от целей исследования. Если выбрана большая арена, поместите контейнеры, удерживающие грибной сад, в ее интерьер (рисунок 5). В случае небольшой арены подключите его к грибковому садовому контейнеру прозрачным шлангом или трубкой (рисунок 3). Арена будет служить камерой для кормления и утилизации отходов, поэтому следите за тем, чтобы она не была слишком маленькой.
- Нанесите один слой политетрафторэтиленовой жидкости одним движением к границе арены, чтобы сдержать муравьев. Используйте хлопок, пропитанный жидкостью, и нитриловую перчатку.
ВНИМАНИЕ: Избегайте вдыхания и прикосновений к коже при использовании политетрафторэтиленовой жидкости. - Осторожно перенесите грибковую губку выбранных колоний (см. шаг 2.5 и шаг 4.3) вместе с маткой, рабочими и незрелыми в контейнер для гипсового основания. Перед переносом убедитесь, что гипсовая основа полита. Используйте латексные перчатки.
- Выберите прозрачный контейнер с крышкой объемом около 1 л и добавьте слой 1 см высокоабсорбирующего гипсового слоя основания. Это будет грибковая садовая камера.

Рисунок 4: Искусственные закрытые гнезда муравьев-листорезов Atta sexdens и Atta laevigata. Закрытая вертикальная установка гнезда сверху (А) и сбоку (В); закрытая горизонтальная установка гнезда сверху (C) и вид сбоку (D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Искусственное открытое гнездо муравьев-листорезов Atta sexdens и Atta laevigata. Открытая установка гнезда арены atta sexdens сверху (A) и бокового вида (B). 1) Грибковые садовые камеры; 2) отходы; 3) Дольки апельсина; 4) Стекло со слоем политетрафторэтилена (PTFE). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Содержание развитых колоний
- Ежедневно предлагайте по крайней мере один большой лист в кормовую камеру на колонию с 1 л грибного сада. Если срезанная активность муравьев интенсивна, увеличьте количество листьев. Если гриб сухой, предварительно смочите листья, чтобы обеспечить дополнительную влажность. В закрытых гнездах выполняйте подношение быстро, чтобы муравьи не сбежали из кормовой камеры.
ПРИМЕЧАНИЕ: Здесь листья собраны из таких видов растений, как шелковица (Morus nigra), манго (Mangifera indica), эвкалипт (Eucalyptus sp.), джамболан (Syzygium cumini), гибискус (Hibiscus sp.), акалифа (Acalypha wilkesiana) и лигуструм (Ligustrum lucidum).- Предложите фрукты, такие как апельсин и яблоко, а также овсяные и кукурузные хлопья, чтобы разнообразить и дополнить рацион. Большим колониям с интенсивной кормовой активностью предлагают овсяные хлопья и кукурузные хлопья ежедневно, а фрукты раз в неделю. Если это не так, предлагают хлопья поочередно с листьями, но не чаще трех раз в неделю, а плоды один-два раза в месяц. Отрегулируйте количество и частоту каждой пищи в соответствии с кормовой активностью муравьев.
- Если варианты, описанные выше, недоступны, определите предпочтения муравьев в корме среди листьев, цветов и плодов региональных деревьев и кустарников или даже коммерческих овощей, зерновых и других хлопьев. Избегайте предложения ресурсов с защитными химическими соединениями и пестицидами.
- Удаляйте все содержимое мусорной камеры каждые 2 недели из всех колоний. Увольнять работников также в целях контроля численности населения. Если рабочие переносят здоровый грибок в камеру отходов, убедитесь, что матка не находится на ней и удалите ее. Если количество утилизируемых отходов велико или оно слишком влажное, удаляйте его один раз в неделю.
- Удаляйте материал, не взятый муравьями, из кормовой камеры всякий раз, когда предлагаете новые, и убедитесь, что он всегда чист.
- Если рабочие переносят здоровый грибок в кормовую камеру, потревожите его, оставьте крышку контейнера открытой и нанесите нейтральный порошок талька на поверхность края камеры. Выполняйте эту процедуру только в том случае, если в грибковой камере еще есть место, таким образом, работники перенесут грибок обратно в контейнер, не потеряв его или незрелые.
- Если требуется больше грибкового сада, добавьте еще один оштукатуренный контейнер и переместите в него часть грибковой губки. Пока гриб не достигнет половины контейнера, добавьте листья в грибковую камеру. Рост гриба сада должен происходить постепенно, чтобы не нарушить баланс колонии. Если требуется контейнер большего размера, убедитесь, что гриб занимает все пространство самых маленьких контейнеров, прежде чем переносить его. Колониальные отходы и сухие листья не должны скапливаться в грибковой садовой камере.
- Проверьте гипсовое основание из контейнеров, так как со временем оно может приобрести темно-коричневый цвет и стать неэффективным из-за выделения муравьев, транспортировки отходов и высокой концентрации влажности. Также некоторые колонии могут разрезать слой и утилизировать его. В этих случаях перенесите грибной сад в новую оштукатуренную емкость.
Результаты
Блок-схема, изображающая процесс сбора муравьев, показана на рисунке 6. Здесь показаны некоторые результаты, полученные с использованием протокола сбора, обслуживания и установки гнезда, описанного выше.
Обсуждение
Протокол, описанный здесь для поддержания колоний муравьев-листоносцев, был разработан и применяется более трех десятилетий напористым и воспроизводимым способом. Это позволило развивать исследования, которые были бы ограничены полевыми условиями. Таким образом, здоровые муравьи и к...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Посвящается Марио Аутуори (памяти) и Вальтеру Уго де Андраде Кунья, которые внесли большой вклад в исследования муравьев-листоносцев. Мы признаем поддержку Государственного университета Сан-Паулу и Института биологических наук. Это исследование было частично профинансировано Координационным советом по вопросам образования и развития (CNPq), Фондом ампаро в песке Сан-Паулу (FAPESP) и Фондом по развитию образования и развития ООН (Fundunesp).
Материалы
| Name | Company | Catalog Number | Comments |
| Entomologic forceps | N/A | N/A | N/A |
| Glass tank | N/A | N/A | Tempered glass, custom made |
| Hose | N/A | N/A | Transparent, PVC 1/2 Inch x 2,0 mm |
| Latex gloves | Descarpack | 550301 | N/A |
| Nitrile gloves | Descarpack | 433301 | N/A |
| Open arena | N/A | N/A | Polypropylene crate |
| Plaster pouder | N/A | N/A | Plaster pouder used in construction, must be absorbant |
| Plastic Containers for collection | Prafesta | Natural Cód.: 8231/Natural Cód.: 8262 | Lidded, transparent , polypropylene |
| Plastic containers for nests | Prafesta | Discontinued | Polystyrene, hermetic |
| Teflon | Dupont | N/A | Polytetrafluoroethylene liquid (PTFE Dispertion 30) |
Ссылки
- Wilson, E. O. . The Insect Societies. , (1971).
- Ortiz, D. P., Elizalde, L., Pirk, G. I. Role of ants as dispersers of native and exotic seeds in an understudied dryland. Ecological Entomology. 46 (3), 626-636 (2021).
- Christianini, A. V., Oliveira, P. S. Birds and ants provide complementary seed dispersal in a neotropical savanna. Journal of Ecology. 98 (3), 573-582 (2010).
- Camargo, P. H. S. A., Martins, M. M., Feitosa, R. M., Christianini, A. V. Bird and ant synergy increases the seed dispersal effectiveness of an ornithochoric shrub. Oecologia. 181 (2), 507-518 (2016).
- Sanders, D., van Veen, F. J. F. Ecosystem engineering and predation: the multi-trophic impact of two ant species. Journal of Animal Ecology. 80 (3), 569-576 (2011).
- Swanson, A. C., et al. Welcome to the Atta world: A framework for understanding the effects of leaf-cutter ants on ecosystem functions. Functional Ecology. 33 (8), 1386-1399 (2019).
- Meyer, S. T., et al. Leaf-cutting ants as ecosystem engineers: topsoil and perturbations around Atta cephalotes nests reduce nutrient availability. Ecological Entomology. 38 (5), 497-504 (2013).
- Sosa, B., Brazeiro, A. Positive ecosystem engineering effects of the ant Atta vollenweideri on the shrub Grabowskia duplicata. Journal of Vegetation Science. 21 (3), 597-605 (2010).
- De Almeida, T., et al. Above- and below-ground effects of an ecosystem engineer ant in Mediterranean dry grasslands. Proceedings of the Royal Society B: Biological Sciences. 287 (1935), 20201840 (2020).
- Folgarait, P. J. Ant biodiversity and its relationship to ecosystem functioning: a review. Biodiversity & Conservation. 7 (9), 1221-1244 (1998).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Barrera, C. A., Sosa-Calvo, J., Schultz, T. R., Rabeling, C., Bacci, M. Phylogenomic reconstruction reveals new insights into the evolution and biogeography of Atta leaf-cutting ants (Hymenoptera: Formicidae). Systematic Entomology. 47 (1), 13-35 (2021).
- Hölldobler, B., Wilson, E. O. . The Leafcutter Ants: Civilization By Instinct. , (2011).
- Branstetter, M. G., et al. Dry habitats were crucibles of domestication in the evolution of agriculture in ants. Proceedings of the Royal Society B: Biological Sciences. 284 (1852), 20170095 (2017).
- Solomon, S. E., et al. The molecular phylogenetics of Trachymyrmex Forel ants and their fungal cultivars provide insights into the origin and coevolutionary history of ‘higher-attine’ ant agriculture. Systematic Entomology. 44 (4), 939-956 (2019).
- Cristiano, M. P., Cardoso, D. C., Sandoval-Gómez, V. E., Simões-Gomes, F. C. Amoimyrmex Cristiano, Cardoso & Sandoval, gen. nov. (Hymenoptera: Formicidae): a new genus of leaf-cutting ants revealed by multilocus molecular phylogenetic and morphological analyses. Austral Entomology. 59 (4), 643-676 (2020).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences of the United States of America. 105 (14), 5435-5440 (2008).
- Mueller, U. G., et al. Phylogenetic patterns of ant–fungus associations indicate that farming strategies, not only a superior fungal cultivar, explain the ecological success of leafcutter ants. Molecular Ecology. 27 (10), 2414-2434 (2018).
- Mueller, U. G., et al. Biogeography of mutualistic fungi cultivated by leafcutter ants. Molecular Ecology. 26 (24), 6921-6937 (2017).
- Weber, N. A. The fungus-culturing behavior of ants. American Zoologist. 12 (3), 577-587 (1972).
- Wilson, E. O. Caste and division of labor in leaf-cutter ants (Hymenoptera: Formicidae: Atta). Behavioral Ecology and Sociobiology. 7 (2), 157-165 (1980).
- Della Lucia, T. M. C. Formigas cortadeiras: da bioecologia ao manejo. Viçosa Editora UFV. 421, (2011).
- Autuori, M. Contribuição para o conhecimento da saúva (Atta spp). I. Evolução do sauveiro (Atta sex dens rubolpilosa Forel, 1908). Arquivos do Instituto Biologico Saul Paulo. 12, 197-228 (1941).
- Bueno, O. C., Hebling, M. J. A., Schneider, M. O., Pagnocca, F. C. Ocorrência de formas aladas de Atta sexdens rubropilosa Forel (Hymenoptera: Formicidae) em colônias de laboratório. Neotropical Entomology. 31 (3), 469-473 (2002).
- Mariconi, F. A. M. Biologo. As Saúvas. , (2021).
- Bento, J. M. S. . Condições climáticas para o vôo nupcial e reconhecimento dos indivíduos em Atta sexdens rubropilosa (Hymenoptera: Formicidae). , (1993).
- Little, A. E. F., Murakami, T., Mueller, U. G., Currie, C. R. The infrabuccal pellet piles of fungus-growing ants. Naturwissenschaften. 90 (12), 558-562 (2003).
- Kerr, W. E. Acasalamento de rainhas com vários machos em duas espécies da tribo Attini. Revista Brasileira de Biologia. 21, 45-48 (1961).
- Kerr, W. E. Tendências evolutivas na reprodução dos himenópteros sociais. Arquivos do Museu Nacional. 52, (1962).
- Cremer, S., Armitage, S. A. O., Schmid-Hempel, P. Social immunity. Current Biology. 17 (16), 693-702 (2007).
- Hernández, J. V., Jaffé, K. Dano econômico causado por populações de formigas Atta laevigata (F. Smith) em plantações de Pinus caribaea (Mor.) e elementos para o manejo da praga. Anais da Sociedade Entomológica do Brasil. 24 (2), 287-298 (1995).
- Kempf, W. W. Catálogo abreviado das formigas da Região Neotropical Studia Entomologica. antbase.org. 15, 3 (1972).
- Della Lucia, T. M. C., Gandra, L. C., Guedes, R. N. C. Managing leaf-cutting ants: peculiarities, trends and challenges. Pest Management Science. 70 (1), 14-23 (2013).
- Boaretto, M. A. C., Forti, L. C. Perspectivas no controle de formigas-cortadeiras. Série Técnica IPEF. 11 (30), 31-46 (1997).
- Folgarait, P. J., Goffré, D. Conidiobolus lunulus, a newly discovered entomophthoralean species, pathogenic and specific to leaf-cutter ants. Journal of Invertebrate Pathology. 186, 107685 (2021).
- Cardoso, S. R. S., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Pathogenicity of filamentous fungi towards Atta sexdens rubropilosa (Hymenoptera: Formicidae). International Journal of Tropical Insect Science. 42 (2), 1215-1223 (2022).
- Ichinose, K., Rinaldi, I., Forti, L. C. Winged leaf-cutting ants on nuptial flights used as transport by Attacobius spiders for dispersal. Ecological Entomology. 29 (5), 628-631 (2004).
- Pagnocca, F. C., Rodrigues, A., Nagamoto, N. S., Bacci, M. Yeasts and filamentous fungi carried by the gynes of leaf-cutting ants. Antonie Van Leeuwenhoek. 94 (4), 517-526 (2008).
- Attili-Angelis, D., et al. Novel Phialophora species from leaf-cutting ants (tribe Attini). Fungal Diversity. 65 (1), 65-75 (2014).
- Delabie, J. H. C., do Nascimento, I. C., Mariano, C. S. F. Estratégias de reprodução e dispersão em formigas attines, com exemplos do sul da Bahia. XIX Congresso Brasileiro de Entomologia. , 16-21 (2002).
- Fjerdingstad, E. J., Boomsma, J. J. Variation in size and sperm content of sexuals in the leafcutter ant Atta colombica. Insectes Sociaux. 44 (3), 209-218 (1997).
- Currie, C. R., Mueller, U. G., Malloch, D. The agricultural pathology of ant fungus gardens. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7998-8002 (1999).
- Moser, J. C., et al. Eye size and behaviour of day-and night-flying leafcutting ant alates. Journal of Zoology. 264 (1), 69-75 (2004).
- Moreira, S. M., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Absence of the parasite Escovopsis in fungus garden pellets carried by gynes of Atta sexdens. Sociobiology. 62 (1), 34-38 (2015).
- Arcuri, S. L., et al. Yeasts found on an ephemeral reproductive caste of the leaf-cutting ant Atta sexdens rubropilosa. Antonie Van Leeuwenhoek. 106 (3), 475-487 (2014).
- Staab, M., Kleineidam, C. J. Initiation of swarming behavior and synchronization of mating flights in the leaf-cutting ant Atta vollenweideri FOREL, 1893 (Hymenoptera: Formicidae). Myrmecol. News. 19, 93-102 (2014).
- Gálvez, D., Chapuisat, M. Immune priming and pathogen resistance in ant queens. Ecology and Evolution. 4 (10), 1761-1767 (2014).
- Baer, B., Armitage, S. A. O., Boomsma, J. J. Sperm storage induces an immunity cost in ants. Nature. 441 (7095), 872-875 (2006).
- Carlos, A. A. . Semioquímicos e comunicação sonora em formigas cortadeiras (Hymenoptera: Formicidae). , (2013).
- Veja um FORMIGUEIRO por DENTRO. Boravê Available from: https://youtu.be/sN99x_Rjf90 (2021)
- Ortiz, G., Vieira, A. S., Bueno, O. C. Toxicological and morphological comparative studies of insecticides action in leaf-cutting ants. International Journal of Agriculture Innovations and Research. 6 (3), 516-522 (2017).
- Decio, P., Silva-Zacarin, E. C. M., Bueno, F. C., Bueno, O. C. Toxicological and histopathological effects of hydramethylnon on Atta sexdens rubropilosa (Hymenoptera: Formicidae) workers. Micron. 45, 22-31 (2013).
- Vieira, A. S., Morgan, E. D., Drijfhout, F. P., Camargo-Mathias, M. I. Chemical composition of metapleural gland secretions of fungus-growing and non-fungus-growing ants. Journal of Chemical Ecology. 38 (10), 1289-1297 (2012).
- Vieira, A. S., Ramalho, M. O., Martins, C., Martins, V. G., Bueno, O. C. Microbial communities in different tissues of Atta sexdens rubropilosa leaf-cutting ants. Current Microbiology. 74 (10), 1216-1225 (2017).
- Ramalho, M. d. e. O., Martins, C., Morini, M. S. C., Bueno, O. C. What can the bacterial community of Atta sexdens (Linnaeus, 1758) tell us about the habitats in which this ant species evolves. Insects. 11 (6), 332 (2020).
- Machado, L. M., et al. Attractivity or repellence: relation between the endophytic fungi of Acalypha, Colocasia and the leaf-cutting ants—Atta sexdens. Advances in Entomology. 9 (2), 85-99 (2021).
- Moreira, A., Forti, L. C., Andrade, A. P., Boaretto, M. A., Lopes, J. Nest architecture of Atta laevigata (F. Smith, 1858) (Hymenoptera: Formicidae). Studies on Neotropical Fauna and Environment. 39 (2), 109-116 (2004).
- Della Lucia, T. M. C., Moreira, D. D. O., Oliveira, M. A., Araújo, M. S. Perda de peso de rainhas de Atta durante a fundação e o estabelecimento das colônias. Revista Brasileira de Biologia. 55 (4), 533-536 (1995).
- Fujihara, R. T., Camargo, R. d. a. S., Forti, L. C. Lipid and energy contents in the bodies of queens of Atta sexdens rubropilosa Forel (Hymenoptera, Formicidae): pre-and post-nuptial flight. Revista Brasileira de Entomologia. 56 (1), 73-75 (2012).
- da Silva Camargo, R., Forti, L. C. Queen lipid content and nest growth in the leaf cutting ant (Atta sexdens rubropilosa) (Hymenoptera: Formicidae). Journal of Natural History. 47, 65-73 (2013).
- Camargo, R. S., Forti, L. C., Fujihara, R. T., Roces, F. Digging effort in leaf-cutting ant queens (Atta sexdens rubropilosa) and its effects on survival and colony growth during the claustral phase. Insectes Sociaux. 58 (1), 17-22 (2011).
- Mota Filho, T. M. M., Garcia, R. D. M., Camargo, R. S., Stefanelli, L. E. P., Forti, L. C. Observations about founding queens (Atta sexdens) and their unusual behavior. International Journal of Agriculture Innovations and Research. 9, 352-357 (2021).
- Barcoto, M. O., Pedrosa, F., Bueno, O. C., Rodrigues, A. Pathogenic nature of Syncephalastrum in Atta sexdens rubropilosa fungus gardens. Pest Management Science. 73 (5), 999-1009 (2017).
- Silva, A., Bacci, M., Pagnocca, F. C., Bueno, O. C., Hebling, M. J. A. Production of polysaccharidases in different carbon sources by Leucoagaricus gongylophorus Möller (Singer), the symbiotic fungus of the leaf-cutting ant Atta sexdens Linnaeus. Curr. Microbiology. 53 (1), 68-71 (2006).
- Majoe, M., Libbrecht, R., Foitzik, S., Nehring, V. Queen loss increases worker survival in leaf-cutting ants under paraquat-induced oxidative stress. Philosophical Transactions of the Royal Society B. 376 (1823), 20190735 (2021).
- Della Lucia, T. M. C., Peternelli, E. F. O., Lacerda, F. G., Peternelli, L. A., Moreira, D. D. O. Colony behavior of Atta sexdens rubropilosa (Hymenoptera: Formicidae) in the absence of the queen under laboratory conditions. Behavioural Processes. 64 (1), 49-55 (2003).
- Sales, T. A., Toledo, A. M. O., Zimerer, A., Lopes, J. F. S. Foraging for the fungus: why do Acromyrmex subterraneus (Formicidae) queens need to forage during the nest foundation phase. Ecological Entomology. 46 (6), 1364-1372 (2021).
- Forti, L. C., et al. Do workers from subspecies Acromyrmex subterraneus prepare leaves and toxic baits in similar ways for their fungus garden. Neotropical Entomology. 49 (1), 12-23 (2020).
- Dorigo, A. S., et al. Projeto Primeiros Passos na Ciência: rompendo barreiras sociais e estreitando laços entre a comunidade acadêmica e o ensino médio público. Revista Brasileira de Extensão Universitária. 11 (1), 47-59 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены