このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
実験室条件における葉切りアリ(atta)の収集と長期維持
要約
ここでは、実験室条件で健康な アッタ (膜翅目:Formicidae)アリのコロニーを首尾よく収集して維持するためのプロトコルについて説明します。さらに、さまざまなネストタイプと構成が、可能な実験手順とともに詳細に説明されています。
要約
アリは地球上で最も生物多様性の高い動物のグループの1つであり、さまざまな環境に生息しています。制御された環境でアリのコロニーを維持することで、その生物学の理解を深めることができ、応用研究に貢献することができます。この慣行は通常、 アッタ アリなどの経済的損失を引き起こす種の個体群管理研究で採用されています。彼らの相利共生菌を栽培するために、これらの葉を切るアリは葉を集めます、そしてこれのためにアメリカ大陸中に広く分布している農業害虫と考えられています。彼らは高度に社会的に組織化されており、さまざまな部屋で構成される精巧な地下の巣に生息しています。管理された環境でのそれらのメンテナンスは、ここで説明されているいくつかの手順と頻繁なケアの日常業務に依存します。それは、生殖期(すなわち、婚姻飛行)の間に女王の収集から始まり、その後、プラスチック容器に個別に移されます。女王の死亡率が高いため、婚姻飛行の約6か月後に、発達した真菌の塊を持つ初期の巣が発掘され、手で摘み取られ、プラスチック容器に入れられるときに、2回目の収集を行うことができます。実験室では、葉は確立されたコロニーに毎日提供され、アリが生産した廃棄物は残りの乾燥植物材料とともに毎週除去されます。菌園が成長し続けるにつれて、コロニーは実験目的に応じてさまざまな種類の容器に移されます。葉を切るアリのコロニーは相互接続された容器に入れられ、自然界の昆虫によって構築された機能的な部屋を備えた組織システムを表しています。この設定は、廃棄物の量、菌類の庭の健康状態、労働者と女王の行動などの要因を監視するのに理想的です。データ収集の促進とより詳細な観察は、アリのコロニーを制御された状態に保つことの最大の利点と考えられています。
概要
アリは、ほとんどの陸生環境に影響を与える多様な個体群を構成しています1。それらは効率的な分散者2,3,4、捕食者5、生態系エンジニア6,7,8,9,10として機能し、自然生態系におけるそれらの重要性と生態学的成功を強調しています。すべてのアリ種は真社会性昆虫として分類されます。しかし、それらの社会組織は、分業システム、機能グループ、個体間のコミュニケーション、飼料組織、コロニー基盤、および繁殖プロセスなど、異なる種グループ間で大きく異なります11。非常に多様なグループとして、彼らはいくつかの食料資源と専門的な摂食行動に頼っています。実際のところ、農業は人間の文明にとってだけでなく、アリの種にとっても大きな一歩でした。約55〜65 Ma12年前、アチンアリは真菌を培養し、ほぼ独占的な食事に取り入れ始めました。彼らは非常に専門的になり、共生として分類される厳格で依存的で義務的な相互作用を発達させ、一方の個人が他方なしでは生き残れません。
低次真菌成長アリは、腐った葉の破片などの死んだ有機物を集めて処理し、相利共生菌を成長させます。高等真菌成長アリは新鮮な植物材料を収穫し、最も成功した共生自然システムの1つを構成します13。この高度に専門化された農業技術は、彼らが新しいニッチをつかむことを可能にしました。高等アチンアリは、19 Ma(15-24 Ma)から18 Ma(14-22 Ma)14,15,16の間に喚起する単系統群である葉を切るアリで構成され、アッタファブリキウス、アクロミルメクスマイヤー、アモイルメックスクリスティアーノ、シュードアッタガヤルドの4つの有効な属で構成されています。 葉切りアリによって行われるハキリアリ農業システムは、派生農業システム17から進化した。これらの種のほとんどは、相利共生菌種ロイコアガリクス・ゴンギロフォラス・シンガー18(ロイココプリヌス・ゴンギロフォラス・ハイム19とも呼ばれる)を独占的に利用しており、重要な進化的移行を示しています11。真菌栽培品種は、元の巣から子孫へと垂直に伝染し、クローン繁殖していることを示唆しています20。
驚くべきことに、 アッタ 社会は、その環境において非常に重要であり、ミルエコロジストにとって非常に興味深い複雑な組織構造を開発しました。彼らの人口は何百万人もの個人で構成される可能性があり、そのほとんどは強調された多型、すなわち明確なサイズと解剖学的形態を示す不妊の女性労働者です。人口は、コロニー21の年齢、生理学的状態、形態学的タイプ、行動、および専門的な活動に応じてカーストによって区別されます。労働者は、庭師と看護師、巣内のジェネラリスト、採餌者と掘削機、そして擁護者または兵士に差別される可能性があります21。この組織は、協力してタスクの実行と、高度に構造化された集団行動を生み出すことができる自己組織化システムを可能にし、環境障害に効率的に対応できるようにします22。
人口再生の役割は、彼女が生きている限り、単一の女王(すなわち、一夫一婦制)によって演じられ、恒久的な生殖カースト22を構成します。アッタの女王は20年以上生き、生涯を通じて卵を産むことが知られています23。女王はかけがえのないものであるため、その耐久性はコロニー13,20,23,24の生存にとって非常に重要です。それでも、繁殖期には何千もの翼のある生殖雌と雄が巣に見られますが、元の巣にとどまるものはなく、一時的なカーストを形成しています22。アッタセクデンスのコロニーでは、約3,000の生殖雌と14,000の生殖雄が生産されています25。コロニーが性的成熟に達したときに発生し、その実施から約38か月で発生し、それ以来、消滅するまで毎年繰り返されます23,25。新しいアッタコロニーは、1人の女王が新しい巣を始めるハプロメトロシスによって確立されます。
環境条件が良好になると、再生者は地下の巣を離れて婚姻飛行を開始します。その発生期間は地域によって異なり、種に応じてブラジルの領土全体で年間を通じて異なります。しかし、イベントの前に降雨と湿度の上昇26があり、土壌水分による掘削の促進に関連している可能性があります22。多くの場合、婚姻便の1〜5週間前に、巣の入り口と水路を広げて、生殖個体の出発を容易にします。母親のコロニーを離れる前に、翼のある雌は頬下腔に相利共生菌の一部を集めて保管します20,27。飛行中に複数の交尾が行われ、一部の種では1人の女王が3〜8人のオス(つまり一夫多妻制)に授精できると計算されており28、遺伝的多様性を確保しています29。その後、女王は土壌に進み、植生25がないかほとんどない場所を優先し、そこで翼を取り除き、最初の巣室を発掘します。これは女王が巣の外で見ることができる唯一の期間です。一時的なカーストの個体は人工巣で見られましたが、実験室条件で交尾(つまり、婚姻飛行)が成功したかどうかは不明です24。
最初の巣の建設はコロニーの最も重要な期間に対応し、6時間から8時間23,25まで続くことがあります。この瞬間、女王は最初の部屋に身を置き、数日のうちに産卵が始まります。最初の卵は、女王が逆流する菌糸体に与えられ、コロニーの菌園の始まりを示します。最初の幼虫は約25日で出現し22、最初の月の終わり近くに、コロニーは未熟な(卵、幼虫、蛹)が巣を作る増殖する真菌のマットと、最初の子孫を孤立して育てる女王で構成されています23。卵は最初の幼虫の食料資源でもあり、女王13によって非常に消費されます。さらに、女王はもはや役に立たない脂肪体の蓄えと異化翼の筋肉で自分自身を支えています13。コロニーの生存はその発達に依存するため、最初の真菌培養は消費されず、この期間中、女王は糞便でそれを受精させます13。出現から数日後、最初の労働者は巣の入り口を開き、巣のすぐ近くで採餌活動を開始します13。彼らは、現在労働者の食物として機能している菌類園の基質として集められた材料を組み込んでいます13,22。真菌培養物に添加される前に、労働者によって運ばれた植物材料は小片に切断され、糞便液13で湿らされる。アリは真菌の接種材料を操作してその成長を増加させ制御し、それは庭のコンディショニングに特化した大きな土壌掘削チャンバーを分割するのに役立ちます13,22,25。
婚姻飛行の約6か月後、 A.セクデンの 巣には真菌室といくつかのチャネルが含まれています。葉を切るアリの巣の建設における大きな専門化は、天敵や不利な環境要因に対する防御メカニズムとして機能します22。葉を切るアリは、菌類の庭を断片化し、チャンバーが乾燥し始めると湿度の高いチャンバーに移すことが知られています13。したがって、かなりのエネルギーコストを有する巣の掘削にもかかわらず、投資されたエネルギーは、コロニー自体にとっての利益において逆転される22。いくつかの例外を除いて、 アッタ 種はまた、コロニーの廃棄物のための特殊なチャンバーを作り、主に枯渇した真菌基質と死んだアリの体でできており、巣の残りの部分から隔離し、重要な社会的免疫戦略を確立しています30。さらに、別の労働者グループがごみを直接操作して、他の人の汚染を回避します。労働者は、コロニーの主要な栄養資源である真菌を育てるために絶えず採餌します。しかし、彼らは断片を切断しながら植物の樹液も食べることができます。植物材料は、菌園の維持のために慎重に選択され、葉の形質や生態系の特性などの多くの要因の影響を受けます13。
新鮮な材料を得るための葉切りアリの採餌戦略は非常に複雑であり、確立されたコロニーの高い収穫需要と相まって、農業生産者にかなりの経済的損失をもたらし、森林回復地域を危険にさらします22,31。したがって、これらのアリは、米国南部からアルゼンチン北東部に至るまで、遭遇する可能性のあるほとんどの地域で害虫として分類できます11,13,22,32。問題のあるコロニーの消滅は、これらの昆虫の生物学に固有の一連の適応(すなわち、社会組織、採餌、真菌栽培、衛生、および複雑な巣構造)のために困難です33。したがって、個体数管理戦略は、他の害虫に一般的に適用される戦略とは異なり、主に魅力的な汚染された餌の提供に頼っています33,34。しかし、これらのアリは真菌とコロニー個体の両方に有害物質を拒絶し、耕作地を危険にさらす可能性があるため33、新しい天然化合物と防除の代替案が絶えずテストされています33,35,36。実験結果は野外試験されたコロニーではほとんど監視できないため、予備エッセイは管理された環境で行われます。
したがって、実験プロトコルは、アリの不均一なライフスタイルを考慮し、種レベルでの研究をサポートし、1つのアリが複雑な超生物の要素である操作単位としてのコロニーを説明する関心のあるグループに適合させる必要があります11。 Atta 属に関してこれまでに収集された報告により、実験室条件でコロニーを首尾よく収集および維持し、それらの基本的なニーズと一般的な機能を認識することができました。繁殖、コロニーの設立、摂食行動などの自然なプロセスに基づいて、さまざまな種類の巣にコロニーを長期間確立することを可能にするルーチンの実践が開発されました。ここでは、実験室で葉を切るアリを維持するための手順プロトコルについて説明し、明確な実験目的と科学的アウトリーチを備えた可能な一般的な研究を強調しています。
プロトコル
1.女王のコレクション
- 関心のある地域のアッタ生殖期の期間を文献で検索します。婚姻便の繁殖期の発生、頻度、日中の時刻は、地域の気候条件によって異なります(表1)。通常は春に行われますが、この情報は、収集が行われる予定の場所について収集する必要があります37、38、39、40、41、42、43、44、45、46。
- 女王や若いコロニーを集めるための可能なエリアと見なされる アッタ の巣がある場所を特定してマークします。婚姻飛行中、女王は巣の場所の周りに分散します。したがって、コロニーの数が多い地域は、新しい巣の発掘を開始するクイーンランディングスポットを持つ可能性が高くなります。
- アッタアリの繁殖期に婚姻飛行の兆候がないか以前に選択した領域を確認してください。暑さや降雨の天候など、結婚式の飛行日の環境条件を追跡します。
- 以前に選択したエリアで葉を切るアリの巣を特定し、翼のある生殖アリの今後の出発を示す外部の特徴を探します。巣の特徴には、トンネルの入り口が広くなったこと(図1)、捕食者の可能性に対してより攻撃的な行動を示す労働者の流れの増加、トンネルの入り口に現れる翼のある生殖アリ(図1)が含まれます。降雨後の湿度の高い日は、一般的に婚姻便に先行するため、注意してください。
- 女王を個別に保持するために、底の石膏層を備えたプラスチック製の蓋付き容器を準備します。容器容量が約200mLで、底部の石膏層の高さが約1cmで、湿度管理のために吸収性が高いことを確認してください。
注意: 石膏ベースを準備するには、製造元の指示に従ってください。 - 23±1°Cの一定温度、相対湿度の約70%±10%の環境を整えます。振動や妨害を避けるために、激しい活動や人の流れの多い場所を選択してください。アリの行動への干渉を防ぐために、中性香料の洗浄剤を使用してください。
注意: 指定された環境条件の変動は、水の結露や水分の損失を引き起こし、菌類の庭を損なう可能性があります。 - 結婚式の飛行の後、巣の発掘を開始した翼のない女王を集めて、石膏層で準備されたプラスチック容器にそれらを個々に慎重に入れてください。素手で女王に触れることは避け、ラテックス手袋または昆虫学的ピンセットを使用してください。
注:翼の除去と土壌掘削の行動は、すでに交尾した生殖雌を示し、したがって、新しいコロニーを開始することができます。クイーンズコレクションも本作では最初のコレクションとして扱われている。 - クイーンを乗せたコンテナを、以前に選択した制御された環境の場所に移動します。クイーンズ輸送は細心の注意を払って行い、過度の妨害を避け、最低温度の一定性を維持します。
- ストレスを避けるために、収集後約3日間は女王を操作したり動かしたりしないでください。

図 1.巣の入り口は翼のあるアリの繁殖者と労働者で広がりました。拡幅されたトンネルの入り口は、アッタ婚姻便の発生を示す巣の特徴の1つです。 この図の拡大版を表示するには、ここをクリックしてください。
2.クイーンズのメンテナンス
- 最初に、針注射器の助けを借りて2日ごとにレシピエントの石膏層に2.5 mLの水を加えます。
- 受取人を開く代わりに、操作による妨害を避けるために、針で容器の蓋を慎重に穿刺します。この期間中も同じ穴を使用できます。追加された水が石膏層を浸さないようにしてください。女王、最初の真菌スポンジ、および未熟なものに直接水をやることは避けてください。菌類の庭が水の欠如を伴う乾燥した側面を示す限り、石膏層を灌漑します。
- 収集の2週間後、真菌が女王によって逆流したかどうかを確認します。真菌がない場合は、確立されたコロニーから得られた約2 gの真菌を移します。また、真菌が発生しない場合は、この手順を実行してください。
注:真菌の移動のためには、確立されたコロニーから健康な真菌を収集し、その上にある可能性のあるすべてのアリを除去する必要があります。大さじ、昆虫学のピンセット、ラテックス手袋を使用して真菌を操作します。 - 最初の労働者の出現後、コロニーのカット活動に応じて、若くて薄い葉の断片を定期的に提供し始めます。提供された葉が健康であり、植物が殺虫剤や他の化学物質で処理されていないことを確認してください。初期段階では、葉の破片が4 cmを超えていないことを確認してください。
注:最初の労働者が葉の採餌を開始するので、植物材料は出現後に提供されなければなりません。提供頻度は、労働者が真菌に植物材料を組み込む敏捷性に依存しますが、週に2〜3日の範囲である可能性があります。オーツ麦フレークとコーンフレークも提供できますが、真菌の乾燥を避けるために葉と交互にする必要があります。 - 新しい葉を提供するときは、コロニーの廃棄物と乾燥した葉の破片を取り除きます。女王を操作するときは、香水、保湿剤、クリーム、または臭いの強い物質の使用は避けてください。さらに、すべてのプロセスでラテックス手袋を使用してください。
- コロニーの発達を追跡し、菌類の庭がコンテナ容量の少なくとも半分に達したら、コロニーを人工の耐久性のある巣に移します。
注:発生速度は各コロニーに固有のものであるため、コロニーの移動の推定時間はありません。通常、最初のコレクションからのコロニーは、小さな真菌ガーデンのために、最大1Lの容積の真菌ガーデンチャンバーを持つ巣に移されます。
3.若いコロニーの収集
- 約500mL容量のプラスチック容器を入手してください。
- 婚姻飛行から約6か月後、以前にマークされた葉切りアリの発生がある場所に、初期のアッタの巣(図2)の粒状土壌粒子(図1)を持つ指標となる塔状の塚を特定します。
注:婚姻飛行から6か月後、若いコロニーの巣は土壌の深さ1 mまでと推定されています。この時期には、コロニーが大量に成功し、永続的になる可能性が高くなります。 - 庭の鍬で、若いコロニーを保持している部屋に到達するまで巣の入り口を掘削します。女王、菌類の庭、未熟な、若い労働者を集めて、プラスチック容器に入れます。収集プロセスはできるだけ穏やかに実行します。
注:当然のことながら、大量の土壌も収集されるため、実験室での将来のメンテナンス手順で徐々に除去する必要があります。 - コロニーを保持しているプラスチック製の蓋付き容器を指定された制御された環境に移動します。若いコロニーの輸送は、過度の妨害を避け、最低温度の恒常性を維持しながら、究極の注意を払って実行してください。ストレスを避けるために、コロニーの操作や移動を約3日間控えてください。部屋にアクティブなルーチンがある場合は、コロニーの上に暗い布を置くことができます。

図 2.塔型の土塚。 特徴的な塔型の塚は、アッタセクデンとアッタラエビガタの初期コロニーの存在を示しています。この図の拡大版を表示するには、ここをクリックしてください。
4.若いコロニーの維持
- 週に3回、薄い若い葉を用意してください。
- 提供された葉が健康であり、植物が殺虫剤または他の化学物質で処理されていないことを確認してください。この段階で、葉の破片の長さが少なくとも7 cmであることを確認してください。
注:オーツ麦フレークとコーンフレークも提供できますが、真菌の乾燥を避けるために葉と交互にする必要があります。 - 提供頻度は、労働者が真菌に植物材料を組み込む敏捷性に依存します。カット活動が激しいので、週に3回、または週に5日、1日2回提供を増やします。
- 提供された葉が健康であり、植物が殺虫剤または他の化学物質で処理されていないことを確認してください。この段階で、葉の破片の長さが少なくとも7 cmであることを確認してください。
- 新しい葉を提供するときは、スプーンを使って土壌の残骸を含むコロニーの廃棄物を取り除きます。すべてのプロセスでラテックス手袋を使用してください。若いコロニーを操作するときは、香水、保湿剤、クリーム、または強い臭いのある物質の使用を避けてください。
注:労働者自身が土壌と廃棄物を真菌から分離します。 - コロニーの発達を追跡し、菌類の庭がコンテナ容量の少なくとも半分に達したら、コロニーを人工の耐久性のある巣に移します。
注:発生速度は各コロニーに固有のものであるため、コロニーの移動の推定時間はありません。
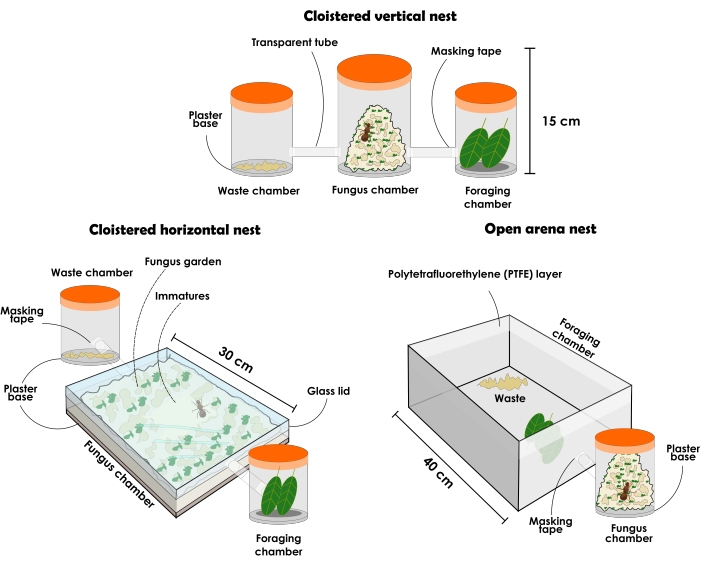
図3:アッタセクデンとアッタラエビガタのコロニーを保持する人工巣の種類。 葉を切るアリの耐久性のある人工巣の図:回廊の垂直巣のセットアップ、回廊の水平の巣のセットアップ、およびオープンアリーナの巣のセットアップ。この図の拡大版を表示するには、ここをクリックしてください。
5.耐久性のある人工巣
- 以下に説明するように、回廊の垂直ネストセットアップを準備します(図3および 図4)。
注:回廊の巣の構成には、(1)菌類の庭室、(2)廃棄物処理室、および(3)採餌室を別々に装うために、常に異なる受信者が必要です。最初は3つのコンテナから始める必要がありますが、菌類の庭を増やすために受信者を追加することもできます。巣は実験目的に応じてサイズと材料が異なる場合がありますが、ここではシースルー材料の使用について説明し、推奨しています。容器は開口部がないものでなければなりません、さもなければアリは逃げます。後述のような巣の種類は一般的な研究にも使用できますが、蓋を外す際に生じる乱れ、個体間の大きな動揺が生じるため、断定的なアリの収集にはあまりお勧めできません。それにもかかわらず、材料の透明性のために、菌類の庭が容器全体を満たしているときでさえ、女王と異なるアリのカーストを見つけることが可能です。それは傾向であるため、垂直コンテナで利用可能なスペースの大部分を占めている場合、未熟児は菌類の庭の中央にいると常に想定されます。- 約1Lの透明な蓋付き容器を選択し、吸収性の高い石膏ベースの1cmの層を追加します。これは真菌の庭の部屋になります。廃棄物処理室と採餌室として、それぞれ約500mLの蓋付きシースルー容器を2つ選択します。アリはどのチャンバーがそれぞれになるかを選択し、その後、それらが交換されないようにします。
注意: 石膏ベースを準備するには、製造元の指示に従ってください。 - 3つの容器に穴を開け、透明なチューブまたはホースで接続します。必要に応じて、チューブの境界にマスキングテープを貼って、容器との太ももの接続を保証し、アリが逃げないようにします。石膏ベースコンテナを中央に配置し、他のコンテナを反対側に置きます。
- 選択したコロニーの真菌スポンジ(ステップ2.5およびステップ4.3を参照)を、女王、労働者、および未熟なものとともに石膏ベースコンテナに注意深く移します。移植する前に、石膏ベースに水をやるようにしてください。ラテックス手袋を使用してください。
- 約1Lの透明な蓋付き容器を選択し、吸収性の高い石膏ベースの1cmの層を追加します。これは真菌の庭の部屋になります。廃棄物処理室と採餌室として、それぞれ約500mLの蓋付きシースルー容器を2つ選択します。アリはどのチャンバーがそれぞれになるかを選択し、その後、それらが交換されないようにします。
- 以下に説明するように、回廊の水平ネストセットアップを準備します(図3および 図4)。
注:水平構成の巣は、菌類の庭とそれに対する労働者の活動を綿密に観察することを可能にします。菌類園の若い部分が一番上にあるので、最近提供された基質が労働者によって組み込まれているのを観察することができます。真菌の新しい部分は、最後に提供されたリソースの色に似た色で見つけることができますが、古い部分は通常ベージュ色になります。子孫と女王はまた、それがスペースの大部分を占めていたとしても、水平容器のように、それらは通常菌類の庭の一番上にあるので、簡単に見つけることができます。この構成は、巣の中の組織の認識を与えるため、行動に焦点を当てた研究、焦点サンプリング、科学アウトリーチの目的で使用できます。- 約31 cm x 21 cm x 4.5 cmの透明な蓋付き容器を入手し、吸収性の高い石膏ベースの1cmの層を追加します。これは真菌の庭の部屋になります。廃棄物処理室と採餌室として、それぞれ約500mLの蓋付きシースルー容器を2つ選択します。アリはどのチャンバーがそれぞれになるかを選択し、その後、それらが交換されないようにします。
注意: 石膏ベースを準備するには、製造元の指示に従ってください。必要に応じて、アリが逃げないようにマスキングテープで蓋と容器の間の小さなスペースを閉じます。 - 容器に穴を開けて透明なチューブまたはホースで接続します。必要に応じて、チューブの境界にマスキングテープを貼って、容器との太ももの接続を保証し、アリが逃げないようにします。石膏ベースコンテナを中央に配置し、他のコンテナを反対側に置きます。
- 選択したコロニーの真菌スポンジ(ステップ2.5およびステップ4.3を参照)を、女王、労働者、および未熟なものとともに石膏ベースコンテナに注意深く移します。移植する前に、石膏ベースに水をやるようにしてください。ラテックス手袋を使用してください。
- 約31 cm x 21 cm x 4.5 cmの透明な蓋付き容器を入手し、吸収性の高い石膏ベースの1cmの層を追加します。これは真菌の庭の部屋になります。廃棄物処理室と採餌室として、それぞれ約500mLの蓋付きシースルー容器を2つ選択します。アリはどのチャンバーがそれぞれになるかを選択し、その後、それらが交換されないようにします。
- 以下に説明するように、オープンアリーナネストのセットアップを準備します(図3および 図5)。
注:オープンアリーナの巣は、大きな妨害や採餌行動分析なしにアリの収集を可能にします。彼らはまた、科学アウトリーチの目的で自然界に見られるコロニーの信頼できる表現を提供することができます。- 約1Lの透明な蓋付き容器を選択し、吸収性の高い石膏層ベースの1cmの層を追加します。これは真菌の庭の部屋になります。
注:1 Lの容器から始めて、より大きな菌類の庭のために、徐々に大容量の容器に渡すことをお勧めします。ただし、容器は5 Lの容量を超えてはなりません。必要な数のコンテナーを追加します。 - オープンアリーナを選択します。アリーナのサイズは、研究目的によって異なります。大きなアリーナを選択した場合は、菌類の庭を保持しているコンテナを内部に配置します(図5)。小さなアリーナの場合は、透明なホースまたはチューブで菌類の庭の容器に接続します(図3)。アリーナは採餌および廃棄物処理室として機能するため、小さすぎないようにしてください。
- アリを封じ込めるために、1回の動きで1つのポリテトラフルオロエチレン液体をアリーナの境界に適用します。液体とニトリル手袋を染み込ませた綿を使用してください。
注意: ポリテトラフルオロエチレン液を使用している間は、吸入や皮膚に触れないでください。 - 選択したコロニーの真菌スポンジ(ステップ2.5およびステップ4.3を参照)を、女王、労働者、および未熟なものとともに石膏ベースコンテナに注意深く移します。移植する前に、石膏ベースに水をやるようにしてください。ラテックス手袋を使用してください。
- 約1Lの透明な蓋付き容器を選択し、吸収性の高い石膏層ベースの1cmの層を追加します。これは真菌の庭の部屋になります。

図4:葉を切るアリのアッタセクデンとアッタラエビガタの人工回廊巣。回廊垂直ネストセットアップトップ(A)と側面図(B)。回廊水平ネストセットアップトップ(C)と側面図(D)。この図の拡大版を表示するには、ここをクリックしてください。

図5:葉を切るアリのアッタセクデンとアッタラエビガタの人工オープンアリーナの巣。 アッタセクデンの上部(A)と側面図(B)のオープンアリーナネストのセットアップ。1)菌類の庭の部屋;2)廃棄物;3)オレンジスライス;4)ポリテトラフルオロエチレン(PTFE)層を有するガラス。この図の拡大版を表示するには、ここをクリックしてください。
6.開発されたコロニーの維持
- 毎日、1リットルの菌類の庭でコロニーごとに少なくとも1つの大きな葉を採餌室に提供します。アリのカット活動が激しい場合は、葉の数を増やします。真菌が乾燥している場合は、葉を事前に湿らせて湿度を高めます。回廊の巣では、アリが採餌室から逃げるのを防ぐために、供物をすばやく実行します。
注:ここでは、葉は桑(Morus nigra)、マンゴー(Mangifera indica)、ユーカリ(Eucalyptus sp)、ジャンボラン(Syzygium cumini)、ハイビスカス(Hibiscus sp)、アカリファ(Acalypha wilkesiana)、およびLigustrum (Ligustrum lucidum)などの植物種から収集されます。- オレンジやリンゴなどの果物、オーツ麦やコーンフレークを提供して、食事を多様化し補完します。激しい採餌活動のある大きなコロニーには、毎日オート麦フレークとコーンフレークを提供し、週に一度果物を提供します。そうでない場合は、フレークを葉と交互に提供しますが、週に3回以下、果物を月に1〜2回提供してください。アリの採餌活動に応じて、各食物の量と頻度を調整します。
- 上記のオプションが利用できない場合は、地域の樹木や低木の葉、花、果物、さらには商品化された野菜、穀物、その他のフレークの間でアリの採餌の好みを特定します。防御的な化合物や農薬を含むリソースを提供することは避けてください。
- すべてのコロニーから2週間ごとに廃棄物室のすべての内容物を取り除きます。人口管理の目的で労働者も削除します。労働者が健康な真菌を廃棄物室に移す場合は、女王がその上にいないことを確認し、それを取り除きます。廃棄される廃棄物の量が多い場合や湿度が高すぎる場合は、週に1回除去してください。
- 新しいものを提供するときはいつでも、アリが採餌室から取っていない材料を取り除き、常に清潔であることを確認してください。
- 労働者が健康な真菌を採餌室に移す場合は、それを邪魔し、容器の蓋を開いたままにして、中性のタルカムパウダーをチャンバーの縁の表面に塗布します。真菌室にまだいくらかのスペースがある場合にのみこの手順を実行してください、このようにして労働者はそれを失うことなくまたは未熟なものを容器に戻します。
- より多くの菌類の庭が必要な場合は、別の漆喰の容器を追加し、菌類スポンジの一部をその中に移動します。真菌が容器の半分に達するまで、真菌室に葉を追加します。菌類園の成長は、コロニーのバランスを損なわないように徐々に起こるべきです。より大きな容器が必要な場合は、真菌を移す前に、真菌が最小の容器の全スペースを占めるようにしてください。コロニーの廃棄物や乾燥した葉は、真菌の庭の部屋に蓄積させないでください。
- 容器から石膏ベースを確認すると、時間の経過とともに暗褐色になり、アリの排泄、廃棄物の輸送、高湿度濃度のために効果がなくなる可能性があります。また、一部のコロニーは層を切断して処分する場合があります。このような場合は、菌類の庭を新しい漆喰の容器に移します。
結果
アリの収集プロセスを示すフローチャートを 図6に示します。ここでは、上記の収集、保守、およびネスト設定のプロトコルを使用して得られたいくつかの結果が示されています。
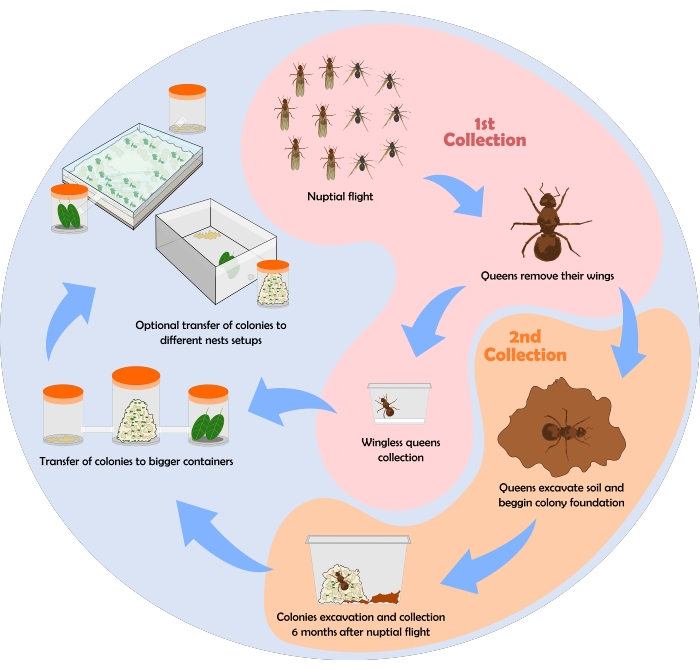
図6:葉切りアリのコロニーの収集のフロー?...
ディスカッション
葉を切るアリのコロニーを維持するためにここで説明するプロトコルは、断定的かつ複製可能な方法で30年以上にわたって開発および適用されてきました。それは野外条件によって制限されるであろう研究の発展を可能にしました。これにより、健康なアリとコロニーは、個体およびコロニーレベルでの比較形態学、毒物学51,52、組織学53、微生物学54,55,56
開示事項
著者は開示する利益相反を持っていません。
謝辞
マリオ・アウトゥオリ(追悼中) と、葉切りアリの研究に大きく貢献したウォルター・ヒューゴ・デ・アンドラーデ・クーニャに捧げられています。我々は、サンパウロ州立大学及び生物科学研究所の支援に感謝する。本研究の一部は、ブラジル・ブラジル国立技術研究所(CAPES) - Finance Code 001、CNPq、サンパウロ・エスタード・ペスキサ(FAPESP)、UNESPの資金提供を受けた。
資料
| Name | Company | Catalog Number | Comments |
| Entomologic forceps | N/A | N/A | N/A |
| Glass tank | N/A | N/A | Tempered glass, custom made |
| Hose | N/A | N/A | Transparent, PVC 1/2 Inch x 2,0 mm |
| Latex gloves | Descarpack | 550301 | N/A |
| Nitrile gloves | Descarpack | 433301 | N/A |
| Open arena | N/A | N/A | Polypropylene crate |
| Plaster pouder | N/A | N/A | Plaster pouder used in construction, must be absorbant |
| Plastic Containers for collection | Prafesta | Natural Cód.: 8231/Natural Cód.: 8262 | Lidded, transparent , polypropylene |
| Plastic containers for nests | Prafesta | Discontinued | Polystyrene, hermetic |
| Teflon | Dupont | N/A | Polytetrafluoroethylene liquid (PTFE Dispertion 30) |
参考文献
- Wilson, E. O. . The Insect Societies. , (1971).
- Ortiz, D. P., Elizalde, L., Pirk, G. I. Role of ants as dispersers of native and exotic seeds in an understudied dryland. Ecological Entomology. 46 (3), 626-636 (2021).
- Christianini, A. V., Oliveira, P. S. Birds and ants provide complementary seed dispersal in a neotropical savanna. Journal of Ecology. 98 (3), 573-582 (2010).
- Camargo, P. H. S. A., Martins, M. M., Feitosa, R. M., Christianini, A. V. Bird and ant synergy increases the seed dispersal effectiveness of an ornithochoric shrub. Oecologia. 181 (2), 507-518 (2016).
- Sanders, D., van Veen, F. J. F. Ecosystem engineering and predation: the multi-trophic impact of two ant species. Journal of Animal Ecology. 80 (3), 569-576 (2011).
- Swanson, A. C., et al. Welcome to the Atta world: A framework for understanding the effects of leaf-cutter ants on ecosystem functions. Functional Ecology. 33 (8), 1386-1399 (2019).
- Meyer, S. T., et al. Leaf-cutting ants as ecosystem engineers: topsoil and perturbations around Atta cephalotes nests reduce nutrient availability. Ecological Entomology. 38 (5), 497-504 (2013).
- Sosa, B., Brazeiro, A. Positive ecosystem engineering effects of the ant Atta vollenweideri on the shrub Grabowskia duplicata. Journal of Vegetation Science. 21 (3), 597-605 (2010).
- De Almeida, T., et al. Above- and below-ground effects of an ecosystem engineer ant in Mediterranean dry grasslands. Proceedings of the Royal Society B: Biological Sciences. 287 (1935), 20201840 (2020).
- Folgarait, P. J. Ant biodiversity and its relationship to ecosystem functioning: a review. Biodiversity & Conservation. 7 (9), 1221-1244 (1998).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Barrera, C. A., Sosa-Calvo, J., Schultz, T. R., Rabeling, C., Bacci, M. Phylogenomic reconstruction reveals new insights into the evolution and biogeography of Atta leaf-cutting ants (Hymenoptera: Formicidae). Systematic Entomology. 47 (1), 13-35 (2021).
- Hölldobler, B., Wilson, E. O. . The Leafcutter Ants: Civilization By Instinct. , (2011).
- Branstetter, M. G., et al. Dry habitats were crucibles of domestication in the evolution of agriculture in ants. Proceedings of the Royal Society B: Biological Sciences. 284 (1852), 20170095 (2017).
- Solomon, S. E., et al. The molecular phylogenetics of Trachymyrmex Forel ants and their fungal cultivars provide insights into the origin and coevolutionary history of ‘higher-attine’ ant agriculture. Systematic Entomology. 44 (4), 939-956 (2019).
- Cristiano, M. P., Cardoso, D. C., Sandoval-Gómez, V. E., Simões-Gomes, F. C. Amoimyrmex Cristiano, Cardoso & Sandoval, gen. nov. (Hymenoptera: Formicidae): a new genus of leaf-cutting ants revealed by multilocus molecular phylogenetic and morphological analyses. Austral Entomology. 59 (4), 643-676 (2020).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences of the United States of America. 105 (14), 5435-5440 (2008).
- Mueller, U. G., et al. Phylogenetic patterns of ant–fungus associations indicate that farming strategies, not only a superior fungal cultivar, explain the ecological success of leafcutter ants. Molecular Ecology. 27 (10), 2414-2434 (2018).
- Mueller, U. G., et al. Biogeography of mutualistic fungi cultivated by leafcutter ants. Molecular Ecology. 26 (24), 6921-6937 (2017).
- Weber, N. A. The fungus-culturing behavior of ants. American Zoologist. 12 (3), 577-587 (1972).
- Wilson, E. O. Caste and division of labor in leaf-cutter ants (Hymenoptera: Formicidae: Atta). Behavioral Ecology and Sociobiology. 7 (2), 157-165 (1980).
- Della Lucia, T. M. C. Formigas cortadeiras: da bioecologia ao manejo. Viçosa Editora UFV. 421, (2011).
- Autuori, M. Contribuição para o conhecimento da saúva (Atta spp). I. Evolução do sauveiro (Atta sex dens rubolpilosa Forel, 1908). Arquivos do Instituto Biologico Saul Paulo. 12, 197-228 (1941).
- Bueno, O. C., Hebling, M. J. A., Schneider, M. O., Pagnocca, F. C. Ocorrência de formas aladas de Atta sexdens rubropilosa Forel (Hymenoptera: Formicidae) em colônias de laboratório. Neotropical Entomology. 31 (3), 469-473 (2002).
- Mariconi, F. A. M. Biologo. As Saúvas. , (2021).
- Bento, J. M. S. . Condições climáticas para o vôo nupcial e reconhecimento dos indivíduos em Atta sexdens rubropilosa (Hymenoptera: Formicidae). , (1993).
- Little, A. E. F., Murakami, T., Mueller, U. G., Currie, C. R. The infrabuccal pellet piles of fungus-growing ants. Naturwissenschaften. 90 (12), 558-562 (2003).
- Kerr, W. E. Acasalamento de rainhas com vários machos em duas espécies da tribo Attini. Revista Brasileira de Biologia. 21, 45-48 (1961).
- Kerr, W. E. Tendências evolutivas na reprodução dos himenópteros sociais. Arquivos do Museu Nacional. 52, (1962).
- Cremer, S., Armitage, S. A. O., Schmid-Hempel, P. Social immunity. Current Biology. 17 (16), 693-702 (2007).
- Hernández, J. V., Jaffé, K. Dano econômico causado por populações de formigas Atta laevigata (F. Smith) em plantações de Pinus caribaea (Mor.) e elementos para o manejo da praga. Anais da Sociedade Entomológica do Brasil. 24 (2), 287-298 (1995).
- Kempf, W. W. Catálogo abreviado das formigas da Região Neotropical Studia Entomologica. antbase.org. 15, 3 (1972).
- Della Lucia, T. M. C., Gandra, L. C., Guedes, R. N. C. Managing leaf-cutting ants: peculiarities, trends and challenges. Pest Management Science. 70 (1), 14-23 (2013).
- Boaretto, M. A. C., Forti, L. C. Perspectivas no controle de formigas-cortadeiras. Série Técnica IPEF. 11 (30), 31-46 (1997).
- Folgarait, P. J., Goffré, D. Conidiobolus lunulus, a newly discovered entomophthoralean species, pathogenic and specific to leaf-cutter ants. Journal of Invertebrate Pathology. 186, 107685 (2021).
- Cardoso, S. R. S., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Pathogenicity of filamentous fungi towards Atta sexdens rubropilosa (Hymenoptera: Formicidae). International Journal of Tropical Insect Science. 42 (2), 1215-1223 (2022).
- Ichinose, K., Rinaldi, I., Forti, L. C. Winged leaf-cutting ants on nuptial flights used as transport by Attacobius spiders for dispersal. Ecological Entomology. 29 (5), 628-631 (2004).
- Pagnocca, F. C., Rodrigues, A., Nagamoto, N. S., Bacci, M. Yeasts and filamentous fungi carried by the gynes of leaf-cutting ants. Antonie Van Leeuwenhoek. 94 (4), 517-526 (2008).
- Attili-Angelis, D., et al. Novel Phialophora species from leaf-cutting ants (tribe Attini). Fungal Diversity. 65 (1), 65-75 (2014).
- Delabie, J. H. C., do Nascimento, I. C., Mariano, C. S. F. Estratégias de reprodução e dispersão em formigas attines, com exemplos do sul da Bahia. XIX Congresso Brasileiro de Entomologia. , 16-21 (2002).
- Fjerdingstad, E. J., Boomsma, J. J. Variation in size and sperm content of sexuals in the leafcutter ant Atta colombica. Insectes Sociaux. 44 (3), 209-218 (1997).
- Currie, C. R., Mueller, U. G., Malloch, D. The agricultural pathology of ant fungus gardens. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7998-8002 (1999).
- Moser, J. C., et al. Eye size and behaviour of day-and night-flying leafcutting ant alates. Journal of Zoology. 264 (1), 69-75 (2004).
- Moreira, S. M., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Absence of the parasite Escovopsis in fungus garden pellets carried by gynes of Atta sexdens. Sociobiology. 62 (1), 34-38 (2015).
- Arcuri, S. L., et al. Yeasts found on an ephemeral reproductive caste of the leaf-cutting ant Atta sexdens rubropilosa. Antonie Van Leeuwenhoek. 106 (3), 475-487 (2014).
- Staab, M., Kleineidam, C. J. Initiation of swarming behavior and synchronization of mating flights in the leaf-cutting ant Atta vollenweideri FOREL, 1893 (Hymenoptera: Formicidae). Myrmecol. News. 19, 93-102 (2014).
- Gálvez, D., Chapuisat, M. Immune priming and pathogen resistance in ant queens. Ecology and Evolution. 4 (10), 1761-1767 (2014).
- Baer, B., Armitage, S. A. O., Boomsma, J. J. Sperm storage induces an immunity cost in ants. Nature. 441 (7095), 872-875 (2006).
- Carlos, A. A. . Semioquímicos e comunicação sonora em formigas cortadeiras (Hymenoptera: Formicidae). , (2013).
- Veja um FORMIGUEIRO por DENTRO. Boravê Available from: https://youtu.be/sN99x_Rjf90 (2021)
- Ortiz, G., Vieira, A. S., Bueno, O. C. Toxicological and morphological comparative studies of insecticides action in leaf-cutting ants. International Journal of Agriculture Innovations and Research. 6 (3), 516-522 (2017).
- Decio, P., Silva-Zacarin, E. C. M., Bueno, F. C., Bueno, O. C. Toxicological and histopathological effects of hydramethylnon on Atta sexdens rubropilosa (Hymenoptera: Formicidae) workers. Micron. 45, 22-31 (2013).
- Vieira, A. S., Morgan, E. D., Drijfhout, F. P., Camargo-Mathias, M. I. Chemical composition of metapleural gland secretions of fungus-growing and non-fungus-growing ants. Journal of Chemical Ecology. 38 (10), 1289-1297 (2012).
- Vieira, A. S., Ramalho, M. O., Martins, C., Martins, V. G., Bueno, O. C. Microbial communities in different tissues of Atta sexdens rubropilosa leaf-cutting ants. Current Microbiology. 74 (10), 1216-1225 (2017).
- Ramalho, M. d. e. O., Martins, C., Morini, M. S. C., Bueno, O. C. What can the bacterial community of Atta sexdens (Linnaeus, 1758) tell us about the habitats in which this ant species evolves. Insects. 11 (6), 332 (2020).
- Machado, L. M., et al. Attractivity or repellence: relation between the endophytic fungi of Acalypha, Colocasia and the leaf-cutting ants—Atta sexdens. Advances in Entomology. 9 (2), 85-99 (2021).
- Moreira, A., Forti, L. C., Andrade, A. P., Boaretto, M. A., Lopes, J. Nest architecture of Atta laevigata (F. Smith, 1858) (Hymenoptera: Formicidae). Studies on Neotropical Fauna and Environment. 39 (2), 109-116 (2004).
- Della Lucia, T. M. C., Moreira, D. D. O., Oliveira, M. A., Araújo, M. S. Perda de peso de rainhas de Atta durante a fundação e o estabelecimento das colônias. Revista Brasileira de Biologia. 55 (4), 533-536 (1995).
- Fujihara, R. T., Camargo, R. d. a. S., Forti, L. C. Lipid and energy contents in the bodies of queens of Atta sexdens rubropilosa Forel (Hymenoptera, Formicidae): pre-and post-nuptial flight. Revista Brasileira de Entomologia. 56 (1), 73-75 (2012).
- da Silva Camargo, R., Forti, L. C. Queen lipid content and nest growth in the leaf cutting ant (Atta sexdens rubropilosa) (Hymenoptera: Formicidae). Journal of Natural History. 47, 65-73 (2013).
- Camargo, R. S., Forti, L. C., Fujihara, R. T., Roces, F. Digging effort in leaf-cutting ant queens (Atta sexdens rubropilosa) and its effects on survival and colony growth during the claustral phase. Insectes Sociaux. 58 (1), 17-22 (2011).
- Mota Filho, T. M. M., Garcia, R. D. M., Camargo, R. S., Stefanelli, L. E. P., Forti, L. C. Observations about founding queens (Atta sexdens) and their unusual behavior. International Journal of Agriculture Innovations and Research. 9, 352-357 (2021).
- Barcoto, M. O., Pedrosa, F., Bueno, O. C., Rodrigues, A. Pathogenic nature of Syncephalastrum in Atta sexdens rubropilosa fungus gardens. Pest Management Science. 73 (5), 999-1009 (2017).
- Silva, A., Bacci, M., Pagnocca, F. C., Bueno, O. C., Hebling, M. J. A. Production of polysaccharidases in different carbon sources by Leucoagaricus gongylophorus Möller (Singer), the symbiotic fungus of the leaf-cutting ant Atta sexdens Linnaeus. Curr. Microbiology. 53 (1), 68-71 (2006).
- Majoe, M., Libbrecht, R., Foitzik, S., Nehring, V. Queen loss increases worker survival in leaf-cutting ants under paraquat-induced oxidative stress. Philosophical Transactions of the Royal Society B. 376 (1823), 20190735 (2021).
- Della Lucia, T. M. C., Peternelli, E. F. O., Lacerda, F. G., Peternelli, L. A., Moreira, D. D. O. Colony behavior of Atta sexdens rubropilosa (Hymenoptera: Formicidae) in the absence of the queen under laboratory conditions. Behavioural Processes. 64 (1), 49-55 (2003).
- Sales, T. A., Toledo, A. M. O., Zimerer, A., Lopes, J. F. S. Foraging for the fungus: why do Acromyrmex subterraneus (Formicidae) queens need to forage during the nest foundation phase. Ecological Entomology. 46 (6), 1364-1372 (2021).
- Forti, L. C., et al. Do workers from subspecies Acromyrmex subterraneus prepare leaves and toxic baits in similar ways for their fungus garden. Neotropical Entomology. 49 (1), 12-23 (2020).
- Dorigo, A. S., et al. Projeto Primeiros Passos na Ciência: rompendo barreiras sociais e estreitando laços entre a comunidade acadêmica e o ensino médio público. Revista Brasileira de Extensão Universitária. 11 (1), 47-59 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved