É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Coleta e Manutenção a Longo Prazo de Formigas Cortadeiras (Atta) em Condições de Laboratório
Neste Artigo
Resumo
Aqui, um protocolo é descrito para coletar e manter com sucesso colônias de formigas Atta (Hymenoptera: Formicidae) saudáveis em condições de laboratório. Além disso, diferentes tipos e configurações de ninho são detalhados juntamente com possíveis procedimentos experimentais.
Resumo
As formigas são um dos grupos de animais mais biodiversos do planeta e habitam diferentes ambientes. A manutenção de colônias de formigas em ambientes controlados possibilita uma compreensão enriquecida de sua biologia que pode contribuir para a pesquisa aplicada. Essa prática é geralmente empregada em estudos de controle populacional de espécies que causam perdas econômicas, como as formigas Atta . Para cultivar seu fungo mutualístico, essas formigas cortadeiras coletam folhas e para isso são consideradas pragas agrícolas amplamente distribuídas por todo o continente americano. Eles são altamente organizados socialmente e habitam ninhos subterrâneos elaborados compostos por uma variedade de câmaras. Sua manutenção em um ambiente controlado depende de uma rotina diária de vários procedimentos e cuidados frequentes que são descritos aqui. Começa com a coleta de rainhas durante a estação reprodutiva (ou seja, voo nupcial), que são então transferidas individualmente para recipientes de plástico. Devido à alta taxa de mortalidade das rainhas, uma segunda coleta pode ser realizada cerca de 6 meses após o voo nupcial, quando ninhos incipientes com fungos desenvolvidos são escavados, escolhidos a dedo e colocados em recipientes plásticos. No laboratório, as folhas são fornecidas diariamente às colônias estabelecidas, e os resíduos produzidos por formigas são removidos semanalmente, juntamente com o material vegetal seco restante. À medida que o jardim de fungos continua crescendo, as colônias são transferidas para diferentes tipos de recipientes de acordo com o propósito experimental. As colônias de formigas cortadeiras são colocadas em recipientes interconectados, representando o sistema organizacional com câmaras funcionais construídas por esses insetos na natureza. Essa configuração é ideal para monitorar fatores como a quantidade de resíduos, a saúde do jardim de fungos e o comportamento das operárias e da rainha. A coleta de dados facilitada e observações mais detalhadas são consideradas a maior vantagem de manter as colônias de formigas em condições controladas.
Introdução
As formigas compõem um grupo diversificado de indivíduos que exercem influência na maioria dos ambientes terrestres1. Eles atuam como dispersores eficientes 2,3,4, predadores5 e engenheiros de ecossistemas 6,7,8,9,10, destacando sua importância e sucesso ecológico nos ecossistemas naturais. Todas as espécies de formigas são classificadas como insetos eussociais; no entanto, sua organização social varia muito entre os diferentes grupos de espécies, ou seja, sistemas de divisão do trabalho, grupos funcionais, comunicação entre indivíduos, organização da forragem, fundação da colônia e processo de reprodução11. Como um grupo altamente diversificado, eles recorrem a vários recursos alimentares e comportamentos alimentares especializados. De fato, a agricultura não foi apenas um grande passo para a civilização humana, mas também para as espécies de formigas. Aproximadamente 55 a 65 Ma atrás12, as formigas atinas começaram a cultivar fungos e incorporá-los em uma dieta quase exclusiva. Eles se tornaram tão especializados que desenvolveram interações estritas, dependentes e obrigatórias classificadas como simbiose, onde um indivíduo não sobrevive sem o outro.
Formigas de crescimento de fungos inferiores coletam e processam matéria orgânica morta, como fragmentos de folhas podres, para cultivar seu fungo mutualista; enquanto as formigas produtoras de fungos colhem material vegetal fresco, compondo um dos sistemas naturais simbióticos mais bem-sucedidos13. Esta técnica agrícola altamente especializada permitiu-lhes agarrar um novo nicho. As formigas attine superiores compreendem as formigas cortadeiras, um grupo monofilético que desperta entre 19 Ma (15-24 Ma) e 18 Ma (14-22 Ma)14,15,16 consistindo de quatro gêneros válidos: Atta Fabricius, Acromyrmex Mayr, Amoimyrmex Cristiano e Pseudoatta Gallardo. O sistema de agricultura cortadeiras realizado pelas formigas cortadeiras evoluiu a partir de sistemas agrícolas derivados17. A maioria dessas espécies explora exclusivamente a espécie de fungo mutualístico Leucoagaricus gongylophorus Singer 18 (também chamada de Leucocoprinus gongylophorus Heim19), marcando uma transição evolutiva significativa11. As cultivares fúngicas são transmitidas verticalmente, de ninhos originais para descendentes, sugerindo que são propagadas clonalmente20.
Notavelmente, as sociedades Atta desenvolveram uma estrutura organizacional complexa de enorme importância em seu ambiente e de grande interesse para os mirmecologistas. Sua população pode ser composta por milhões de indivíduos, a maioria deles operárias estéreis que apresentam um polimorfismo acentuado, ou seja, tamanho distinto e morfologia anatômica. A população é distinguida por castas de acordo com a idade, estado fisiológico, tipo morfológico, comportamentos e atividades especializadas na colônia21. Os trabalhadores podem ser discriminados em jardineiros e enfermeiros, generalistas dentro do ninho, coletores e escavadeiras, e defensores ou soldados21. Essa organização permite a realização de tarefas em cooperação e um sistema auto-organizado que pode produzir comportamentos coletivos altamente estruturados, permitindo-lhes responder de forma eficiente a distúrbios ambientais22.
O papel de renovação populacional é desempenhado por uma única rainha (ou seja, monógina), enquanto viver, constituindo a casta reprodutiva permanente22. Sabe-se que as rainhas Atta vivem há mais de 20 anos, colocando ovos ao longo de sua vida útil23. Como a rainha é insubstituível, sua resistência é crucial para a sobrevivência da colônia 13,20,23,24. No entanto, milhares de fêmeas e machos reprodutivos alados podem ser encontrados no ninho durante as estações de reprodução, mas nenhum permanece no ninho original, formando uma casta temporária22. Nas colônias de Atta sexdens, cerca de 3.000 fêmeas reprodutivas e 14.000 machos reprodutivos são produzidos25. Ocorre quando uma colônia atinge a maturidade sexual, aproximadamente 38 meses após sua implantação, e se repete anualmente desde então até ser extinta23,25. Novas colônias de Atta são estabelecidas através da haplometrose, onde uma rainha inicia um novo ninho.
Quando as condições ambientais são favoráveis, os reprodutores deixam o ninho subterrâneo para iniciar o voo nupcial. O período de sua ocorrência difere de acordo com a região, variando ao longo do ano em todo o território brasileiro, dependendo da espécie. No entanto, o evento parece ser precedido por chuvas e elevação da umidade26, o que pode estar relacionado à facilitação da escavação devido à umidade do solo22. Frequentemente, 1-5 semanas antes do voo nupcial, as entradas e canais do ninho são ampliados para facilitar a partida dos indivíduos reprodutivos. Antes de deixarem suas colônias-mães, as fêmeas aladas coletam e armazenam, em uma cavidade infrabucal, uma porção do fungo mutualístico20,27. Cópulas múltiplas são realizadas em pleno voo, e calcula-se que uma rainha pode ser inseminada por três a oito machos (ou seja, poliandria) em algumas espécies28, garantindo variabilidade genética29. Posteriormente, as rainhas seguem para o solo, dando preferência a locais com pouca ou nenhuma vegetação25, onde retiram suas asas e escavam sua primeira câmara de ninho. Este é o único período em que as rainhas podem ser vistas fora do ninho. Embora indivíduos da casta temporária tenham sido vistos em ninhos artificiais, não se sabe se alguma cópula bem-sucedida (ou seja, voo nupcial) foi realizada em condições de laboratório24.
A construção inicial do ninho corresponde ao período mais crucial da colônia, que pode durar de 6 h a 8 h23,25. Neste momento, a rainha enclausura-se na câmara inicial e, em questão de dias, começa a oviposição. Os primeiros ovos são alimentados ao micelial que a rainha regurgita, marcando o início do jardim de fungos da colônia. As primeiras larvas aparecem em aproximadamente 25 dias22 e, quase ao final do primeiro mês, a colônia consiste em um tapete de fungos em proliferação, onde nidificam imaturos (ovos, larvas e pupas), e a rainha, que cria sua prole inicial isoladamente23. Os ovos também são o recurso alimentar das primeiras larvas e altamente consumidos pela rainha13. Além disso, a rainha se sustenta com reservas de gordura corporal e catabolizando os músculos das asas que não são mais úteis13. A cultura inicial do fungo não é consumida, pois a sobrevivência da colônia depende de seu desenvolvimento e, durante esse período, a rainha a fertiliza com líquido fecal13. Dias após emergirem, as primeiras operárias abrem a entrada do ninho e iniciam uma atividade de forrageamento na área imediata do ninho13. Incorporam o material coletado como substrato da horta de fungos, que agora serve de alimento para os trabalhadores13,22. Antes de ser adicionado à cultura do fungo, o material vegetal transportado pelos trabalhadores é cortado em pequenos pedaços e umedecido com líquido fecal13. As formigas manipulam o inóculo do fungo para aumentar e controlar seu crescimento, que servirá para a partição de grandes câmaras escavadas no solo, especializadas em condicionar o jardim 13,22,25.
Cerca de 6 meses após o voo nupcial, os ninhos de A. sexdens contêm uma câmara de fungos e alguns canais. A grande especialização na construção de ninhos de formigas cortadeiras funciona como um mecanismo de defesa contra inimigos naturais e fatores ambientais desfavoráveis22. Sabe-se que as formigas cortadeiras fragmentam o jardim de fungos e o transpõem para câmaras com alta umidade quando as câmaras começam a secar13. Assim, apesar da escavação do ninho ter um custo energético considerável, a energia investida é revertida em benefícios para a própria colônia22. Com algumas exceções, as espécies de Atta também formam câmaras especializadas para os resíduos da colônia, feitas principalmente de substrato de fungos esgotados e corpos de formigas mortas, isolando-as do resto do ninho e estabelecendo uma importante estratégia de imunidade social30. Além disso, um grupo distinto de trabalhadores manipula o lixo diretamente, para evitar a contaminação de outros indivíduos. Os trabalhadores constantemente se alimentam para nutrir o fungo, que é o principal recurso nutricional da colônia. No entanto, eles também podem se alimentar de seiva de plantas enquanto cortam fragmentos. O material vegetal é cuidadosamente selecionado para a manutenção do jardim de fungos e influenciado por muitos fatores, como características foliares e propriedades do ecossistema13.
A estratégia de forrageamento de formigas cortadeiras para obtenção de material fresco é altamente complexa e, aliada à alta demanda de colheita das colônias estabelecidas, resulta em considerável perda econômica para os produtores agrícolas e compromete as áreas de restauração florestal22,31. Portanto, essas formigas podem ser categorizadas como pragas na maioria das áreas onde podem ser encontradas, desde o sul dos Estados Unidos até o nordeste da Argentina 11,13,22,32. A extinção de colônias problemáticas é desafiadora devido à série de adaptações inerentes à biologia desses insetos (ou seja, organização social, forrageamento, cultivo de fungos, higiene e estruturas complexas de ninhos)33. Assim, as estratégias de controle populacional são distintas daquelas geralmente aplicadas a outras insetos-praga, recorrendo principalmente a atraentes ofertas de iscas contaminadas33,34. No entanto, como essas formigas podem rejeitar substâncias nocivas tanto para o fungo quanto para os indivíduos da colônia, e comprometer os campos cultivados33, novos compostos naturais e alternativas de controle estão sendo constantemente testados 33,35,36. Como os resultados dos experimentos dificilmente podem ser monitorados em colônias testadas em campo, os ensaios preliminares são conduzidos em um ambiente controlado.
Assim, protocolos experimentais devem ser adaptados a grupos de interesse considerando o estilo de vida heterogêneo das formigas, subsidiando estudos em nível de espécie e contabilizando colônias como unidades operacionais, onde uma formiga é um elemento de um superorganismo complexo11. Os relatórios reunidos até agora sobre o gênero Atta tornaram possível coletar e manter com sucesso colônias em condições de laboratório e reconhecer suas necessidades básicas e funcionamento geral. Com base em seus processos naturais, como reprodução, fundação de colônias e comportamentos alimentares, foi desenvolvida uma rotina de práticas que permite o estabelecimento a longo prazo de colônias em diferentes tipos de ninhos. Aqui, um protocolo processual para manter formigas cortadeiras em laboratório é descrito e destaca possíveis pesquisas gerais com propósitos distintos de experimentação e divulgação científica.
Protocolo
1. Coleção de rainhas
- Pesquisa na literatura para o período da estação reprodutiva de Atta na região de interesse. A ocorrência da estação reprodutiva, a frequência e o horário diurno dos voos nupciais variam de acordo com as condições climáticas regionais (Tabela 1). Embora geralmente ocorra na primavera, essas informações devem ser coletadas para o local onde a coleta se destina a ocorrer 37,38,39,40,41,42,43,44,45,46.
- Identificar e marcar locais com ninhos de Atta considerados como possíveis áreas para coleta de rainhas e colônias jovens. Durante os voos nupciais, as rainhas são dispersas em torno dos locais dos ninhos; portanto, áreas com um maior número de colônias têm maiores chances de ter pontos de pouso de rainhas onde iniciam novas escavações de ninhos.
- Verifique as áreas selecionadas anteriormente para sinais de voo nupcial durante a estação reprodutiva das formigas Atta . Acompanhe as condições ambientais dos dias de voo nupcial, como o clima quente e chuvoso.
- Identifique ninhos de formigas cortadeiras nas áreas selecionadas anteriormente e procure características externas que indiquem a próxima partida de formigas reprodutivas aladas. As características do ninho incluem entradas de túneis alargadas (Figura 1), aumento do fluxo de trabalhadores mostrando comportamento mais agressivo em relação a possíveis predadores e formigas reprodutivas aladas aparecendo nas entradas do túnel (Figura 1). Cuidado com os dias de alta umidade que sucedem às chuvas, pois geralmente precedem os voos nupciais.
- Prepare recipientes com tampa de plástico com uma camada de gesso inferior para reter as rainhas individualmente. Certifique-se de que o volume do recipiente é de aproximadamente 200 mL, e a camada de gesso no fundo tem cerca de 1 cm de altura e é altamente absorvente para o controle da umidade.
NOTA: Para preparar a base de gesso, siga as instruções do fabricante. - Preparar um ambiente com temperatura constante de 23 ± 1 °C e aproximadamente 70% ± 10% de umidade relativa. Escolha um local sem atividades intensas e alto fluxo de pessoas para evitar vibrações e perturbações. Use produtos de limpeza de fragrância neutra para evitar qualquer interferência no comportamento das formigas.
NOTA: Flutuações nas condições ambientais especificadas podem causar condensação de água ou perda de umidade e comprometer o jardim de fungos. - Após o voo nupcial, colete rainhas sem asas que iniciaram a escavação do ninho e coloque-as cuidadosamente nos recipientes de plástico preparados com uma camada de gesso, individualmente. Evite tocar as rainhas com as mãos nuas e use luvas de látex ou pinças entomológicas.
NOTA: A remoção das asas e o comportamento de escavação do solo indicam fêmeas reprodutivas que já copularam e, portanto, são capazes de iniciar uma nova colônia. A coleção Queens também é tratada como a primeira coleção desta obra. - Mova os recipientes com as rainhas para o local com um ambiente controlado previamente selecionado. Realize o transporte das rainhas com a máxima cautela, evitando muita perturbação e mantendo uma temperatura mínima de constância.
- Não manipule ou mova as rainhas por aproximadamente 3 dias após a coleta para evitar o estresse.

Figura 1. Entrada do ninho alargada com reprodutores de formigas aladas e trabalhadores. As entradas alargadas do túnel são uma das características dos ninhos que indica a ocorrência de voos nupciais de Atta . Por favor, clique aqui para ver uma versão maior desta figura.
2. Manutenção das rainhas
- Inicialmente, adicione 2,5 mL de água à camada de gesso do receptor a cada 2 dias com a ajuda de uma seringa de agulha.
- Em vez de abrir o recipiente, perfure cuidadosamente as tampas do recipiente com a agulha para evitar distúrbios devido à manipulação. O mesmo orifício pode ser usado durante este período. Certifique-se de que a água adicionada não mergulhe a camada de gesso. Evite regar diretamente a rainha, a esponja inicial do fungo e quaisquer imaturos. Enquanto o jardim de fungos exibir um aspecto seco com ausência de água, irrigue a camada de gesso.
- Duas semanas após a coleta, verifique se o fungo foi regurgitado pelas rainhas. Se não houver fungo, transfira aproximadamente 2 g de fungo obtido de uma colônia estabelecida. Além disso, execute esta etapa se o fungo não se desenvolver.
NOTA: Para a transferência de fungos, é necessário coletar fungos saudáveis de uma colônia estabelecida e remover todas as formigas que possam estar nela. Use uma colher de sopa, pinça entomológica e luvas de látex para manipular o fungo. - Após o aparecimento dos primeiros trabalhadores, comece a oferecer fragmentos de folhas jovens e finas regularmente, de acordo com a atividade de corte da colônia. Certifique-se de que as folhas oferecidas são saudáveis e as plantas não foram tratadas com inseticidas ou outras substâncias químicas. Nos estágios iniciais, certifique-se de que os fragmentos de folhas não tenham mais de 4 cm.
NOTA: À medida que os primeiros trabalhadores iniciam o forrageamento foliar, o material vegetal deve ser oferecido após o seu aparecimento. A frequência de oferta depende da agilidade com que os trabalhadores incorporam o material vegetal no fungo, mas pode variar para 2-3 dias por semana. Flocos de aveia e flocos de milho também podem ser oferecidos, mas devem ser alternados com folhas para evitar a secura do fungo. - Ao oferecer novas folhas, remova os resíduos da colônia e os fragmentos de folhas secas. Evite o uso de perfumes, hidratantes, cremes ou qualquer substância com odor forte ao manipular as rainhas. Além disso, use luvas de látex durante todos os processos.
- Siga o desenvolvimento da colônia e, quando o jardim de fungos atingir pelo menos metade do volume do recipiente, transfira a colônia para um ninho artificial perdurável.
NOTA: Como a taxa de desenvolvimento é inerente a cada colônia, não há um tempo estimado para a transferência da colônia. Normalmente, as colônias da primeira coleção são transferidas para ninhos com câmara de jardim de fungos de 1L de volume máximo, devido ao pequeno jardim de fungos.
3. Coleção de colônias jovens
- Adquira recipientes plásticos de aproximadamente 500 mL de volume.
- Cerca de 6 meses após o voo nupcial, identificar montículos indicativos em forma de torre com partículas granuladas do solo (Figura 1) de ninhos incipientes de Atta (Figura 2) nos locais com ocorrência de formigas cortadeiras previamente marcadas.
NOTA: Seis meses após o voo nupcial, estima-se que os ninhos de colônias jovens tenham até 1 m de profundidade no solo. Uma nova coleção é indicada neste período para alcançar maiores chances de colônias bem-sucedidas e duradouras em grandes quantidades. - Com uma enxada de jardim, escava a entrada do ninho até chegar à câmara que contém a jovem colônia. Colete a rainha, o jardim de fungos, os imaturos e os jovens trabalhadores e coloque-os no recipiente de plástico. Execute o processo de coleta da forma mais suave possível.
NOTA: Naturalmente, uma grande quantidade de solo também será coletada e deve ser removida gradualmente em futuros procedimentos de manutenção no laboratório. - Mova os recipientes com tampa de plástico que seguram as colônias para o ambiente controlado designado. Realize o transporte de colônias jovens com a máxima cautela, evitando muita perturbação e mantendo uma constância de temperatura mínima. Abster-se de manipular ou mover as colônias por aproximadamente 3 dias para evitar o estresse. Se a sala tiver uma rotina ativa, um pano escuro pode ser colocado sobre as colônias.

Figura 2. Monte de solo em forma de torre. O monte característico em forma de torre indica a presença de colônias incipientes de Atta sexdens e Atta laevigata. Por favor, clique aqui para ver uma versão maior desta figura.
4. Manutenção de colónias jovens
- Forneça folhas jovens e finas 3 vezes por semana.
- Certifique-se de que as folhas oferecidas são saudáveis e as plantas não foram tratadas com inseticidas ou outras substâncias químicas. Nesta fase, certifique-se de que os fragmentos foliares tenham pelo menos 7 cm de comprimento.
NOTA: Flocos de aveia e flocos de milho também podem ser oferecidos, mas devem ser alternados com folhas para evitar a secura de fungos. - A frequência de oferta depende da agilidade com que os trabalhadores incorporam o material vegetal no fungo. Com a atividade de corte sendo intensa, aumente a oferta duas vezes ao dia, três vezes por semana ou 5 dias por semana.
- Certifique-se de que as folhas oferecidas são saudáveis e as plantas não foram tratadas com inseticidas ou outras substâncias químicas. Nesta fase, certifique-se de que os fragmentos foliares tenham pelo menos 7 cm de comprimento.
- Ao oferecer novas folhas, remova os resíduos da colônia, incluindo restos de solo, com a ajuda de uma colher. Use luvas de látex durante todos os processos. Ao manipular as colônias jovens, evite o uso de perfumes, hidratantes, cremes ou qualquer substância com odor forte.
NOTA: Os próprios trabalhadores separarão o solo e os resíduos do fungo. - Siga o desenvolvimento da colônia e, quando o jardim de fungos atingir pelo menos metade do volume do recipiente, transfira a colônia para um ninho artificial perdurável.
NOTA: Como a taxa de desenvolvimento é inerente a cada colônia, não há um tempo estimado para a transferência da colônia.
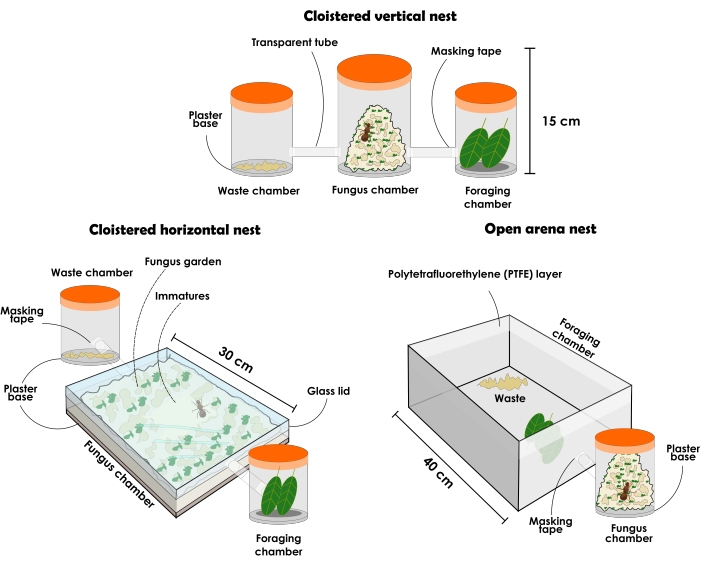
Figura 3: Tipos de ninhos artificiais para abrigar colônias de Atta sexdens e Atta laevigata . Ilustração de ninhos artificiais perduráveis de formigas cortadeiras: configuração de ninho vertical de clausura, configuração de ninho horizontal de clausura e configuração de ninho de arena aberta. Por favor, clique aqui para ver uma versão maior desta figura.
5. Ninhos artificiais perduráveis
- Prepare uma configuração de ninho vertical de clausura, conforme descrito abaixo (Figura 3 e Figura 4).
NOTA: As configurações de ninho de clausura devem sempre ter recipientes diferentes para posar separadamente como (1) câmara de jardim de fungos, (2) câmara de eliminação de resíduos e (3) câmara de forrageamento. Inicialmente, deve começar com três recipientes, mas mais recipientes podem ser adicionados para aumentar o jardim de fungos. Os ninhos podem variar em tamanho e material de acordo com sua finalidade experimental, embora aqui seja descrito e recomendado o uso de materiais transparentes. Os recipientes devem estar sem aberturas, ou então as formigas escaparão. O tipo de ninho descrito abaixo pode ser utilizado para pesquisas gerais, mas não é bem recomendado para a coleta assertiva de formigas devido ao distúrbio causado ao retirar a tampa, resultando em grande agitação entre os indivíduos. No entanto, devido à transparência do material, é possível localizar a rainha e diferentes castas de formigas, mesmo quando o jardim de fungos encheu todo o recipiente. Por se tratar de uma tendência, assume-se sempre que os imaturos estão no centro do jardim de fungos quando este ocupa a maior parte do espaço disponível em recipientes verticais.- Selecione um recipiente com tampa transparente de aproximadamente 1 L e adicione uma camada de 1 cm de base de gesso altamente absorvente. Esta será a câmara do jardim de fungos. Selecione dois recipientes transparentes com tampa de aproximadamente 500 mL cada para serem câmaras de eliminação de resíduos e forrageamento. As formigas escolherão qual câmara será cada uma e, depois disso, garantirão que elas não sejam trocadas.
NOTA: Para preparar a base de gesso, siga as instruções do fabricante. - Perfure e conecte os três recipientes com um tubo transparente ou uma mangueira. Se necessário, aplique fita adesiva na borda dos tubos para garantir uma conexão da coxa com os recipientes e evitar que as formigas escapem. Coloque o recipiente de base de gesso no meio e os outros recipientes em lados opostos.
- Transfira cuidadosamente a esponja de fungos de colônias selecionadas (ver etapa 2.5 e etapa 4.3) junto com a rainha, operárias e imaturas para o recipiente de base de gesso. Antes da transferência, certifique-se de que a base de gesso esteja regada. Use luvas de látex.
- Selecione um recipiente com tampa transparente de aproximadamente 1 L e adicione uma camada de 1 cm de base de gesso altamente absorvente. Esta será a câmara do jardim de fungos. Selecione dois recipientes transparentes com tampa de aproximadamente 500 mL cada para serem câmaras de eliminação de resíduos e forrageamento. As formigas escolherão qual câmara será cada uma e, depois disso, garantirão que elas não sejam trocadas.
- Prepare uma configuração de ninho horizontal de clausura, conforme descrito abaixo (Figura 3 e Figura 4).
NOTA: Ninhos com configuração horizontal permitem observar de perto o jardim de fungos e as atividades dos trabalhadores em direção a ele. Como porções mais jovens do jardim de fungos estão no topo, é possível observar substratos recentemente oferecidos sendo incorporados pelos trabalhadores. Novas porções do fungo podem ser manchadas por sua cor, que será semelhante à cor do último recurso oferecido, enquanto as porções mais antigas geralmente têm uma cor bege. Os filhotes e a rainha também podem ser facilmente localizados, pois em recipientes horizontais eles geralmente estão no topo do jardim de fungos, mesmo quando ocupou a maior parte do espaço. Essa configuração pode ser usada para fins de pesquisa focada no comportamento, amostragem focal e divulgação científica, pois dá percepção da organização dentro do ninho.- Adquira um recipiente com tampa transparente com dimensões aproximadas de 31 cm x 21 cm x 4,5 cm e adicione uma camada de 1 cm de base de gesso altamente absorvente. Esta será a câmara do jardim de fungos. Selecione dois recipientes transparentes com tampa de aproximadamente 500 mL cada para serem câmaras de eliminação de resíduos e forrageamento. As formigas escolherão qual câmara será cada uma e, depois disso, garantirão que elas não sejam trocadas.
NOTA: Para preparar a base de gesso, siga as instruções do fabricante. Se necessário, feche o pouco espaço entre a tampa e o recipiente com fita adesiva para evitar que as formigas escapem. - Perfure e conecte os recipientes com um tubo transparente ou uma mangueira. Se necessário, aplique fita adesiva na borda dos tubos para garantir uma conexão da coxa com os recipientes e evitar que as formigas escapem. Coloque o recipiente de base de gesso no meio e os outros recipientes em lados opostos.
- Transfira cuidadosamente a esponja de fungos de colônias selecionadas (ver etapa 2.5 e etapa 4.3) junto com a rainha, operárias e imaturas para o recipiente de base de gesso. Antes da transferência, certifique-se de que a base de gesso esteja regada. Use luvas de látex.
- Adquira um recipiente com tampa transparente com dimensões aproximadas de 31 cm x 21 cm x 4,5 cm e adicione uma camada de 1 cm de base de gesso altamente absorvente. Esta será a câmara do jardim de fungos. Selecione dois recipientes transparentes com tampa de aproximadamente 500 mL cada para serem câmaras de eliminação de resíduos e forrageamento. As formigas escolherão qual câmara será cada uma e, depois disso, garantirão que elas não sejam trocadas.
- Prepare uma configuração de ninho de arena aberta, conforme descrito abaixo (Figura 3 e Figura 5).
NOTA: Os ninhos de arena aberta permitem a coleta de formigas sem grande perturbação e análise do comportamento de forrageamento. Eles também podem fornecer uma representação confiável de uma colônia encontrada na natureza para fins de divulgação científica.- Selecione um recipiente com tampa transparente de aproximadamente 1 L e adicione uma camada de 1 cm de base de camada de gesso altamente absorvente. Esta será a câmara do jardim de fungos.
NOTA: Recomenda-se começar com recipientes de 1 L e gradualmente passar para recipientes com volumes mais altos para um jardim de fungos maior. No entanto, os recipientes não devem superar um volume de 5 L. Adicione quantos contêineres forem necessários. - Selecione uma arena aberta. O tamanho da arena pode variar de acordo com os propósitos do estudo. Se uma grande arena for selecionada, coloque os recipientes que seguram o jardim de fungos em seu interior (Figura 5). No caso de uma pequena arena, conecte-a ao recipiente do jardim de fungos com uma mangueira ou tubo transparente (Figura 3). A arena servirá como uma câmara de forrageamento e eliminação de resíduos, portanto, certifique-se de que não seja muito pequena.
- Aplique uma camada de líquido de politetrafluoroetileno em um único movimento até a borda da arena para conter as formigas. Use um algodão embebido com o líquido e uma luva nitrílica.
CUIDADO: Evite inalação e toque na pele ao usar líquido de politetrafluoroetileno. - Transfira cuidadosamente a esponja de fungos de colônias selecionadas (ver etapa 2.5 e etapa 4.3) junto com a rainha, operárias e imaturas para o recipiente de base de gesso. Antes da transferência, certifique-se de que a base de gesso esteja regada. Use luvas de látex.
- Selecione um recipiente com tampa transparente de aproximadamente 1 L e adicione uma camada de 1 cm de base de camada de gesso altamente absorvente. Esta será a câmara do jardim de fungos.

Figura 4: Ninhos artificiais de clausura das formigas cortadeiras Atta sexdens e Atta laevigata. Configuração vertical de clausura do ninho superior (A) e vista lateral (B); configuração do ninho horizontal de clausura superior (C) e vista lateral (D). Por favor, clique aqui para ver uma versão maior desta figura.

Figura 5: Ninho artificial aberto das formigas cortadeiras Atta sexdens e Atta laevigata. Configuração de ninho de arena aberta de Atta sexdens superior (A) e vista lateral (B). 1) Câmaras de jardim de fungos; 2) Resíduos; 3) Fatias de laranja; 4) Vidro com camada de politetrafluoretileno (PTFE). Por favor, clique aqui para ver uma versão maior desta figura.
6. Manutenção de colônias desenvolvidas
- Ofereça diariamente pelo menos uma folha grande na câmara de forrageamento por colônia com 1 L de jardim de fungos. Se a atividade de corte das formigas for intensa, aumente o número de folhas. Se o fungo estiver seco, pré-umedeça as folhas para fornecer umidade extra. Em ninhos de clausura, realize a oferenda rapidamente para evitar que as formigas escapem da câmara de forrageamento.
NOTA: Aqui, as folhas são coletadas de espécies vegetais como amoreira (Morus nigra), manga (Mangifera indica), eucalipto (Eucalyptus sp.), jambolão (Syzygium cumini), hibisco (Hibiscus sp.), acalypha (Acalypha wilkesiana) e ligustrum (Ligustrum lucidum).- Ofereça frutas como laranja e maçã, e flocos de aveia e milho para diversificar e complementar a dieta. Para grandes colônias com intensa atividade de forrageamento, ofereça flocos de aveia e flocos de milho diariamente, e frutas uma vez por semana. Se não for o caso, ofereça flocos alternadamente com folhas, mas não mais de três vezes por semana, e frutas uma ou duas vezes por mês. Ajuste a quantidade e a frequência de cada alimento de acordo com a atividade de forrageamento das formigas.
- Se as opções descritas acima não estiverem disponíveis, identifique a preferência de forrageamento das formigas entre folhas, flores e frutos de árvores e arbustos regionais, ou mesmo vegetais comercializados, grãos e outros flocos. Evite oferecer recursos com compostos químicos defensivos e pesticidas.
- Remova todo o conteúdo da câmara de resíduos a cada 2 semanas de todas as colônias. Remover trabalhadores também para fins de controle populacional. Se as operárias transferirem fungos saudáveis para a câmara de resíduos, certifique-se de que a rainha não esteja nela e remova-a. Se a quantidade de resíduos descartados for alta ou estiver muito úmida, remova-a uma vez por semana.
- Remova o material não retirado pelas formigas da câmara de forrageamento sempre que oferecer novas e certifique-se de que está sempre limpo.
- Se os trabalhadores transferirem fungos saudáveis para a câmara de forrageamento, perturbe-a, deixe a tampa do recipiente aberta e aplique pó de talco neutro na superfície da margem da câmara. Execute este procedimento apenas se ainda houver algum espaço na câmara do fungo, desta forma os trabalhadores transferirão o fungo de volta ao recipiente sem perdê-lo ou quaisquer imaturos.
- Se mais jardim de fungos for desejado, adicione outro recipiente rebocado e mova uma parte da esponja do fungo para ele. Até que o fungo atinja metade do recipiente, adicione folhas na câmara do fungo. O crescimento do jardim de fungos deve acontecer gradualmente para não comprometer o equilíbrio da colônia. Se um recipiente maior for desejado, certifique-se de deixar o fungo ocupar todo o espaço dos menores recipientes antes de transferi-lo. Resíduos de colônia e folhas secas não devem ser deixados se acumular na câmara do jardim de fungos.
- Verifique a base de gesso dos recipientes, pois com o tempo, ela pode adquirir uma cor marrom escura e se tornar ineficaz devido à excreção de formigas, transporte de resíduos e alta concentração de umidade. Além disso, algumas colônias podem cortar a camada e descartá-la. Nestes casos, transfira o jardim de fungos para um novo recipiente rebocado.
Resultados
Um fluxograma representando o processo de coleta de formigas é mostrado na Figura 6. Aqui, alguns resultados obtidos empregando o protocolo de coleta, manutenção e configurações de ninho descritos acima são mostrados.
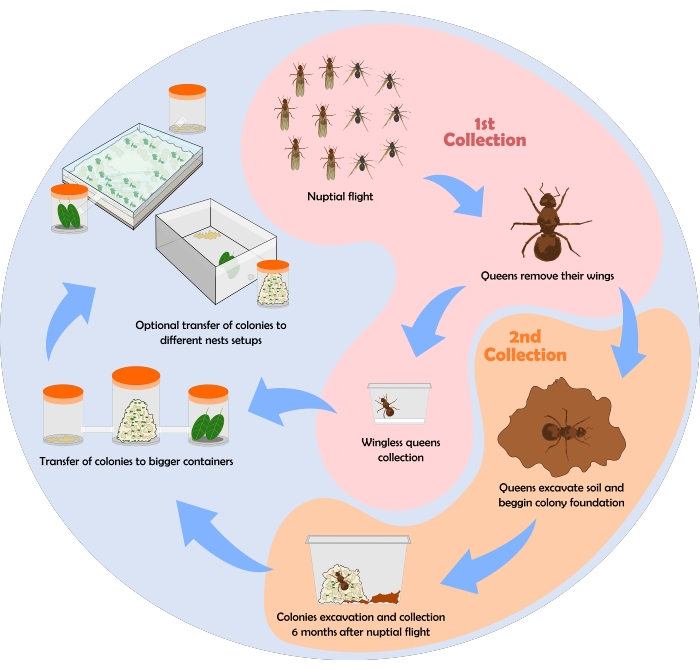
Figura 6: Fluxograma para coleta de colônias de formigas cortadeiras.
Discussão
O protocolo aqui descrito para manter colônias de formigas cortadeiras vem sendo desenvolvido e aplicado há mais de três décadas de forma assertiva e replicável. Permitiu o desenvolvimento de pesquisas que seriam limitadas pelas condições de campo. Com isso, formigas e colônias saudáveis tornaram-se disponíveis para pesquisas em diversas áreas, como morfologia comparativa, toxicologia 51,52, histologia 53 e microbiologia54,55,56
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Dedicado a Mario Autuori (in memoriam) e Walter Hugo de Andrade Cunha que muito contribuíram para os estudos de formigas cortadeiras. Reconhecemos o apoio da Universidade Estadual Paulista e do Instituto de Biociências. Este estudo foi parcialmente financiado pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES) - Código Financeiro 001, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) e Fundação para o Desenvolvimento da UNESP (Fundunesp).
Materiais
| Name | Company | Catalog Number | Comments |
| Entomologic forceps | N/A | N/A | N/A |
| Glass tank | N/A | N/A | Tempered glass, custom made |
| Hose | N/A | N/A | Transparent, PVC 1/2 Inch x 2,0 mm |
| Latex gloves | Descarpack | 550301 | N/A |
| Nitrile gloves | Descarpack | 433301 | N/A |
| Open arena | N/A | N/A | Polypropylene crate |
| Plaster pouder | N/A | N/A | Plaster pouder used in construction, must be absorbant |
| Plastic Containers for collection | Prafesta | Natural Cód.: 8231/Natural Cód.: 8262 | Lidded, transparent , polypropylene |
| Plastic containers for nests | Prafesta | Discontinued | Polystyrene, hermetic |
| Teflon | Dupont | N/A | Polytetrafluoroethylene liquid (PTFE Dispertion 30) |
Referências
- Wilson, E. O. . The Insect Societies. , (1971).
- Ortiz, D. P., Elizalde, L., Pirk, G. I. Role of ants as dispersers of native and exotic seeds in an understudied dryland. Ecological Entomology. 46 (3), 626-636 (2021).
- Christianini, A. V., Oliveira, P. S. Birds and ants provide complementary seed dispersal in a neotropical savanna. Journal of Ecology. 98 (3), 573-582 (2010).
- Camargo, P. H. S. A., Martins, M. M., Feitosa, R. M., Christianini, A. V. Bird and ant synergy increases the seed dispersal effectiveness of an ornithochoric shrub. Oecologia. 181 (2), 507-518 (2016).
- Sanders, D., van Veen, F. J. F. Ecosystem engineering and predation: the multi-trophic impact of two ant species. Journal of Animal Ecology. 80 (3), 569-576 (2011).
- Swanson, A. C., et al. Welcome to the Atta world: A framework for understanding the effects of leaf-cutter ants on ecosystem functions. Functional Ecology. 33 (8), 1386-1399 (2019).
- Meyer, S. T., et al. Leaf-cutting ants as ecosystem engineers: topsoil and perturbations around Atta cephalotes nests reduce nutrient availability. Ecological Entomology. 38 (5), 497-504 (2013).
- Sosa, B., Brazeiro, A. Positive ecosystem engineering effects of the ant Atta vollenweideri on the shrub Grabowskia duplicata. Journal of Vegetation Science. 21 (3), 597-605 (2010).
- De Almeida, T., et al. Above- and below-ground effects of an ecosystem engineer ant in Mediterranean dry grasslands. Proceedings of the Royal Society B: Biological Sciences. 287 (1935), 20201840 (2020).
- Folgarait, P. J. Ant biodiversity and its relationship to ecosystem functioning: a review. Biodiversity & Conservation. 7 (9), 1221-1244 (1998).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Barrera, C. A., Sosa-Calvo, J., Schultz, T. R., Rabeling, C., Bacci, M. Phylogenomic reconstruction reveals new insights into the evolution and biogeography of Atta leaf-cutting ants (Hymenoptera: Formicidae). Systematic Entomology. 47 (1), 13-35 (2021).
- Hölldobler, B., Wilson, E. O. . The Leafcutter Ants: Civilization By Instinct. , (2011).
- Branstetter, M. G., et al. Dry habitats were crucibles of domestication in the evolution of agriculture in ants. Proceedings of the Royal Society B: Biological Sciences. 284 (1852), 20170095 (2017).
- Solomon, S. E., et al. The molecular phylogenetics of Trachymyrmex Forel ants and their fungal cultivars provide insights into the origin and coevolutionary history of ‘higher-attine’ ant agriculture. Systematic Entomology. 44 (4), 939-956 (2019).
- Cristiano, M. P., Cardoso, D. C., Sandoval-Gómez, V. E., Simões-Gomes, F. C. Amoimyrmex Cristiano, Cardoso & Sandoval, gen. nov. (Hymenoptera: Formicidae): a new genus of leaf-cutting ants revealed by multilocus molecular phylogenetic and morphological analyses. Austral Entomology. 59 (4), 643-676 (2020).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences of the United States of America. 105 (14), 5435-5440 (2008).
- Mueller, U. G., et al. Phylogenetic patterns of ant–fungus associations indicate that farming strategies, not only a superior fungal cultivar, explain the ecological success of leafcutter ants. Molecular Ecology. 27 (10), 2414-2434 (2018).
- Mueller, U. G., et al. Biogeography of mutualistic fungi cultivated by leafcutter ants. Molecular Ecology. 26 (24), 6921-6937 (2017).
- Weber, N. A. The fungus-culturing behavior of ants. American Zoologist. 12 (3), 577-587 (1972).
- Wilson, E. O. Caste and division of labor in leaf-cutter ants (Hymenoptera: Formicidae: Atta). Behavioral Ecology and Sociobiology. 7 (2), 157-165 (1980).
- Della Lucia, T. M. C. Formigas cortadeiras: da bioecologia ao manejo. Viçosa Editora UFV. 421, (2011).
- Autuori, M. Contribuição para o conhecimento da saúva (Atta spp). I. Evolução do sauveiro (Atta sex dens rubolpilosa Forel, 1908). Arquivos do Instituto Biologico Saul Paulo. 12, 197-228 (1941).
- Bueno, O. C., Hebling, M. J. A., Schneider, M. O., Pagnocca, F. C. Ocorrência de formas aladas de Atta sexdens rubropilosa Forel (Hymenoptera: Formicidae) em colônias de laboratório. Neotropical Entomology. 31 (3), 469-473 (2002).
- Mariconi, F. A. M. Biologo. As Saúvas. , (2021).
- Bento, J. M. S. . Condições climáticas para o vôo nupcial e reconhecimento dos indivíduos em Atta sexdens rubropilosa (Hymenoptera: Formicidae). , (1993).
- Little, A. E. F., Murakami, T., Mueller, U. G., Currie, C. R. The infrabuccal pellet piles of fungus-growing ants. Naturwissenschaften. 90 (12), 558-562 (2003).
- Kerr, W. E. Acasalamento de rainhas com vários machos em duas espécies da tribo Attini. Revista Brasileira de Biologia. 21, 45-48 (1961).
- Kerr, W. E. Tendências evolutivas na reprodução dos himenópteros sociais. Arquivos do Museu Nacional. 52, (1962).
- Cremer, S., Armitage, S. A. O., Schmid-Hempel, P. Social immunity. Current Biology. 17 (16), 693-702 (2007).
- Hernández, J. V., Jaffé, K. Dano econômico causado por populações de formigas Atta laevigata (F. Smith) em plantações de Pinus caribaea (Mor.) e elementos para o manejo da praga. Anais da Sociedade Entomológica do Brasil. 24 (2), 287-298 (1995).
- Kempf, W. W. Catálogo abreviado das formigas da Região Neotropical Studia Entomologica. antbase.org. 15, 3 (1972).
- Della Lucia, T. M. C., Gandra, L. C., Guedes, R. N. C. Managing leaf-cutting ants: peculiarities, trends and challenges. Pest Management Science. 70 (1), 14-23 (2013).
- Boaretto, M. A. C., Forti, L. C. Perspectivas no controle de formigas-cortadeiras. Série Técnica IPEF. 11 (30), 31-46 (1997).
- Folgarait, P. J., Goffré, D. Conidiobolus lunulus, a newly discovered entomophthoralean species, pathogenic and specific to leaf-cutter ants. Journal of Invertebrate Pathology. 186, 107685 (2021).
- Cardoso, S. R. S., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Pathogenicity of filamentous fungi towards Atta sexdens rubropilosa (Hymenoptera: Formicidae). International Journal of Tropical Insect Science. 42 (2), 1215-1223 (2022).
- Ichinose, K., Rinaldi, I., Forti, L. C. Winged leaf-cutting ants on nuptial flights used as transport by Attacobius spiders for dispersal. Ecological Entomology. 29 (5), 628-631 (2004).
- Pagnocca, F. C., Rodrigues, A., Nagamoto, N. S., Bacci, M. Yeasts and filamentous fungi carried by the gynes of leaf-cutting ants. Antonie Van Leeuwenhoek. 94 (4), 517-526 (2008).
- Attili-Angelis, D., et al. Novel Phialophora species from leaf-cutting ants (tribe Attini). Fungal Diversity. 65 (1), 65-75 (2014).
- Delabie, J. H. C., do Nascimento, I. C., Mariano, C. S. F. Estratégias de reprodução e dispersão em formigas attines, com exemplos do sul da Bahia. XIX Congresso Brasileiro de Entomologia. , 16-21 (2002).
- Fjerdingstad, E. J., Boomsma, J. J. Variation in size and sperm content of sexuals in the leafcutter ant Atta colombica. Insectes Sociaux. 44 (3), 209-218 (1997).
- Currie, C. R., Mueller, U. G., Malloch, D. The agricultural pathology of ant fungus gardens. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7998-8002 (1999).
- Moser, J. C., et al. Eye size and behaviour of day-and night-flying leafcutting ant alates. Journal of Zoology. 264 (1), 69-75 (2004).
- Moreira, S. M., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Absence of the parasite Escovopsis in fungus garden pellets carried by gynes of Atta sexdens. Sociobiology. 62 (1), 34-38 (2015).
- Arcuri, S. L., et al. Yeasts found on an ephemeral reproductive caste of the leaf-cutting ant Atta sexdens rubropilosa. Antonie Van Leeuwenhoek. 106 (3), 475-487 (2014).
- Staab, M., Kleineidam, C. J. Initiation of swarming behavior and synchronization of mating flights in the leaf-cutting ant Atta vollenweideri FOREL, 1893 (Hymenoptera: Formicidae). Myrmecol. News. 19, 93-102 (2014).
- Gálvez, D., Chapuisat, M. Immune priming and pathogen resistance in ant queens. Ecology and Evolution. 4 (10), 1761-1767 (2014).
- Baer, B., Armitage, S. A. O., Boomsma, J. J. Sperm storage induces an immunity cost in ants. Nature. 441 (7095), 872-875 (2006).
- Carlos, A. A. . Semioquímicos e comunicação sonora em formigas cortadeiras (Hymenoptera: Formicidae). , (2013).
- Veja um FORMIGUEIRO por DENTRO. Boravê Available from: https://youtu.be/sN99x_Rjf90 (2021)
- Ortiz, G., Vieira, A. S., Bueno, O. C. Toxicological and morphological comparative studies of insecticides action in leaf-cutting ants. International Journal of Agriculture Innovations and Research. 6 (3), 516-522 (2017).
- Decio, P., Silva-Zacarin, E. C. M., Bueno, F. C., Bueno, O. C. Toxicological and histopathological effects of hydramethylnon on Atta sexdens rubropilosa (Hymenoptera: Formicidae) workers. Micron. 45, 22-31 (2013).
- Vieira, A. S., Morgan, E. D., Drijfhout, F. P., Camargo-Mathias, M. I. Chemical composition of metapleural gland secretions of fungus-growing and non-fungus-growing ants. Journal of Chemical Ecology. 38 (10), 1289-1297 (2012).
- Vieira, A. S., Ramalho, M. O., Martins, C., Martins, V. G., Bueno, O. C. Microbial communities in different tissues of Atta sexdens rubropilosa leaf-cutting ants. Current Microbiology. 74 (10), 1216-1225 (2017).
- Ramalho, M. d. e. O., Martins, C., Morini, M. S. C., Bueno, O. C. What can the bacterial community of Atta sexdens (Linnaeus, 1758) tell us about the habitats in which this ant species evolves. Insects. 11 (6), 332 (2020).
- Machado, L. M., et al. Attractivity or repellence: relation between the endophytic fungi of Acalypha, Colocasia and the leaf-cutting ants—Atta sexdens. Advances in Entomology. 9 (2), 85-99 (2021).
- Moreira, A., Forti, L. C., Andrade, A. P., Boaretto, M. A., Lopes, J. Nest architecture of Atta laevigata (F. Smith, 1858) (Hymenoptera: Formicidae). Studies on Neotropical Fauna and Environment. 39 (2), 109-116 (2004).
- Della Lucia, T. M. C., Moreira, D. D. O., Oliveira, M. A., Araújo, M. S. Perda de peso de rainhas de Atta durante a fundação e o estabelecimento das colônias. Revista Brasileira de Biologia. 55 (4), 533-536 (1995).
- Fujihara, R. T., Camargo, R. d. a. S., Forti, L. C. Lipid and energy contents in the bodies of queens of Atta sexdens rubropilosa Forel (Hymenoptera, Formicidae): pre-and post-nuptial flight. Revista Brasileira de Entomologia. 56 (1), 73-75 (2012).
- da Silva Camargo, R., Forti, L. C. Queen lipid content and nest growth in the leaf cutting ant (Atta sexdens rubropilosa) (Hymenoptera: Formicidae). Journal of Natural History. 47, 65-73 (2013).
- Camargo, R. S., Forti, L. C., Fujihara, R. T., Roces, F. Digging effort in leaf-cutting ant queens (Atta sexdens rubropilosa) and its effects on survival and colony growth during the claustral phase. Insectes Sociaux. 58 (1), 17-22 (2011).
- Mota Filho, T. M. M., Garcia, R. D. M., Camargo, R. S., Stefanelli, L. E. P., Forti, L. C. Observations about founding queens (Atta sexdens) and their unusual behavior. International Journal of Agriculture Innovations and Research. 9, 352-357 (2021).
- Barcoto, M. O., Pedrosa, F., Bueno, O. C., Rodrigues, A. Pathogenic nature of Syncephalastrum in Atta sexdens rubropilosa fungus gardens. Pest Management Science. 73 (5), 999-1009 (2017).
- Silva, A., Bacci, M., Pagnocca, F. C., Bueno, O. C., Hebling, M. J. A. Production of polysaccharidases in different carbon sources by Leucoagaricus gongylophorus Möller (Singer), the symbiotic fungus of the leaf-cutting ant Atta sexdens Linnaeus. Curr. Microbiology. 53 (1), 68-71 (2006).
- Majoe, M., Libbrecht, R., Foitzik, S., Nehring, V. Queen loss increases worker survival in leaf-cutting ants under paraquat-induced oxidative stress. Philosophical Transactions of the Royal Society B. 376 (1823), 20190735 (2021).
- Della Lucia, T. M. C., Peternelli, E. F. O., Lacerda, F. G., Peternelli, L. A., Moreira, D. D. O. Colony behavior of Atta sexdens rubropilosa (Hymenoptera: Formicidae) in the absence of the queen under laboratory conditions. Behavioural Processes. 64 (1), 49-55 (2003).
- Sales, T. A., Toledo, A. M. O., Zimerer, A., Lopes, J. F. S. Foraging for the fungus: why do Acromyrmex subterraneus (Formicidae) queens need to forage during the nest foundation phase. Ecological Entomology. 46 (6), 1364-1372 (2021).
- Forti, L. C., et al. Do workers from subspecies Acromyrmex subterraneus prepare leaves and toxic baits in similar ways for their fungus garden. Neotropical Entomology. 49 (1), 12-23 (2020).
- Dorigo, A. S., et al. Projeto Primeiros Passos na Ciência: rompendo barreiras sociais e estreitando laços entre a comunidade acadêmica e o ensino médio público. Revista Brasileira de Extensão Universitária. 11 (1), 47-59 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados