Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Recolección y mantenimiento a largo plazo de hormigas cortadoras de hojas (Atta) en condiciones de laboratorio
En este artículo
Resumen
Aquí, se describe un protocolo para recolectar y mantener con éxito colonias sanas de hormigas Atta (Hymenoptera: Formicidae) en condiciones de laboratorio. Además, se detallan diferentes tipos y configuraciones de nidos junto con posibles procedimientos experimentales.
Resumen
Las hormigas son uno de los grupos de animales con mayor biodiversidad del planeta y habitan en diferentes entornos. El mantenimiento de colonias de hormigas en ambientes controlados permite una comprensión enriquecida de su biología que puede contribuir a la investigación aplicada. Esta práctica se emplea generalmente en estudios de control de poblaciones de especies que causan pérdidas económicas, como las hormigas Atta . Para cultivar su hongo mutualista, estas hormigas cortadoras de hojas recolectan hojas y para ello se consideran plagas agrícolas ampliamente distribuidas por todo el continente americano. Están altamente organizados socialmente y habitan nidos subterráneos elaborados compuestos por una variedad de cámaras. Su mantenimiento en un ambiente controlado depende de una rutina diaria de varios procedimientos y cuidados frecuentes que se describen aquí. Comienza con la recolección de reinas durante la temporada reproductiva (es decir, el vuelo nupcial), que luego se transfieren individualmente a recipientes de plástico. Debido a la alta tasa de mortalidad de las reinas, se puede realizar una segunda recolección unos 6 meses después del vuelo nupcial, cuando los nidos incipientes con fajo de hongos desarrollados se excavan, se recogen a mano y se colocan en recipientes de plástico. En el laboratorio, las hojas se proporcionan diariamente a las colonias establecidas, y los desechos producidos por hormigas se eliminan semanalmente junto con el material vegetal seco restante. A medida que el jardín de hongos sigue creciendo, las colonias se transfieren a diferentes tipos de contenedores de acuerdo con el propósito experimental. Las colonias de hormigas cortadoras de hojas se colocan en contenedores interconectados, que representan el sistema organizativo con cámaras funcionales construidas por esos insectos en la naturaleza. Esta configuración es ideal para monitorear factores como la cantidad de desechos, la salud del jardín de hongos y el comportamiento de las obreras y la reina. La recopilación de datos facilitada y las observaciones más detalladas se consideran la mayor ventaja de mantener las colonias de hormigas en condiciones controladas.
Introducción
Las hormigas componen un grupo diverso de individuos que ejercen una influencia en la mayoría de los ambientes terrestres1. Actúan como dispersores eficientes 2,3,4, depredadores5 e ingenieros de ecosistemas 6,7,8,9,10, destacando su importancia y éxito ecológico en los ecosistemas naturales. Todas las especies de hormigas se clasifican como insectos eusociales; Sin embargo, su organización social varía mucho entre los diferentes grupos de especies, es decir, los sistemas de división del trabajo, los grupos funcionales, la comunicación entre individuos, la organización del forraje, la fundación de colonias y el proceso de reproducción11. Como grupo altamente diversificado, recurren a varios recursos alimenticios y comportamientos de alimentación especializados. De hecho, la agricultura no solo fue un gran paso para la civilización humana, sino también para las especies de hormigas. Hace aproximadamente 55 a 65 Ma12, las hormigas attine comenzaron a cultivar hongos e incorporarlos a una dieta casi exclusiva. Se especializaron tanto que desarrollaron interacciones estrictas, dependientes y obligatorias clasificadas como simbiosis, donde un individuo no sobrevive sin el otro.
Las hormigas productoras de hongos inferiores recolectan y procesan materia orgánica muerta, como fragmentos de hojas podridas, para cultivar su hongo mutualista; mientras que las hormigas productoras de hongos más altas cosechan material vegetal fresco, componiendo uno de los sistemas naturales simbióticos más exitosos13. Esta técnica agrícola altamente especializada les permitió aprovechar un nuevo nicho. Las hormigas attine más altas comprenden las hormigas cortadoras de hojas, un grupo monofilético que despierta entre 19 Ma (15-24 Ma) y 18 Ma (14-22 Ma)14,15,16 que consiste en cuatro géneros válidos: Atta Fabricius, Acromyrmex Mayr, Amoimyrmex Cristiano y Pseudoatta Gallardo. El sistema de agricultura cortadora de hojas realizado por las hormigas cortadoras de hojas, evolucionó a partir de sistemas agrícolas derivados17. La mayoría de estas especies explotan exclusivamente la especie de hongo mutualista Leucoagaricus gongylophorus Singer 18 (también llamada Leucocoprinus gongylophorus Heim19), marcando una transición evolutiva significativa11. Los cultivares fúngicos se transmiten verticalmente, desde los nidos originales hasta las crías, lo que sugiere que se propagan clonalmente20.
Sorprendentemente, las sociedades Atta desarrollaron una estructura organizativa compleja de enorme importancia en su entorno y de gran interés para los mirmecólogos. Su población puede estar compuesta por millones de individuos, la mayoría de ellos trabajadoras estériles que muestran un polimorfismo acentuado, es decir, tamaño y morfología anatómica distintos. La población se distingue por castas según edad, estado fisiológico, tipo morfológico, comportamientos y actividades especializadas en la colonia21. Los trabajadores pueden ser discriminados en jardineros y enfermeras, generalistas dentro del nido, recolectores y excavadores, y defensores o soldados21. Esta organización permite la realización de tareas en cooperación y un sistema de autoorganización que puede producir comportamientos colectivos altamente estructurados, permitiéndoles responder eficientemente a las perturbaciones ambientales22.
El papel de renovación de la población es desempeñado por una sola reina (es decir, monógina), mientras viva, constituyendo la casta reproductiva permanente22. Se sabe que las reinas Atta viven más de 20 años, poniendo huevos a lo largo de su vida23. Como la reina es insustituible, su resistencia es crucial para la supervivencia de la colonia 13,20,23,24. Sin embargo, miles de hembras y machos reproductores alados se pueden encontrar en el nido durante las temporadas de reproducción, pero ninguno permanece en el nido original, formando una casta temporal22. En las colonias de Atta sexdens, se producen cerca de 3.000 hembras reproductoras y 14.000 machos reproductivos25. Ocurre cuando una colonia alcanza la madurez sexual, aproximadamente 38 meses desde su implementación, y se repite anualmente desde entonces hasta que se extingue23,25. Las nuevas colonias de Atta se establecen a través de la haplometrosis, donde una reina comienza un nuevo nido.
Cuando las condiciones ambientales son favorables, los reproductores abandonan el nido subterráneo para comenzar el vuelo nupcial. El período de su ocurrencia difiere según la región, variando a lo largo del año en todo el territorio brasileño dependiendo de la especie. Sin embargo, el evento parece estar precedido por lluvias y humedad elevación26, que puede estar relacionada con la facilitación de la excavación debido a la humedad del suelo22. Con frecuencia, 1-5 semanas antes del vuelo nupcial, las entradas y los canales de los nidos se ensanchan para facilitar la salida de los individuos reproductivos. Antes de abandonar sus colonias madre, las hembras aladas recogen y almacenan, en una cavidad infrabucal, una porción del hongo mutualista20,27. Se realizan cópulas múltiples en pleno vuelo, y se calcula que una reina puede ser inseminada por tres a ocho machos (es decir, poliandria) en algunas especies28, asegurando la variabilidad genética29. Después, las reinas proceden al suelo, dando preferencia a lugares con poca o ninguna vegetación25, donde quitan sus alas y excavan su primera cámara de anidación. Este es el único período en el que se pueden ver reinas fuera del nido. A pesar de que individuos de la casta temporal fueron vistos en nidos artificiales, se desconoce si alguna cópula exitosa (es decir, vuelo nupcial) fue realizada en condiciones de laboratorio24.
La construcción inicial del nido corresponde al período más crucial de la colonia, que puede durar de 6 h a 8 h23,25. En este momento, la reina se enclaustra en la cámara inicial, y en cuestión de días, comienza la oviposición. Los primeros huevos se alimentan al micelio que la reina regurgita, marcando el inicio del jardín de hongos de la colonia. Las primeras larvas aparecen en aproximadamente 25 días22, y casi al final del primer mes, la colonia consiste en una estera de hongos proliferantes, donde se anidan los inmaduros (huevos, larvas y pupas), y la reina, que cría a su descendencia inicial en aislamiento23. Los huevos también son el recurso alimenticio de las primeras larvas y muy consumidos por la reina13. Además, la reina se sostiene con reservas corporales grasas y catabolizando los músculos de las alas que ya no son útiles13. El cultivo inicial de hongos no se consume ya que la supervivencia de la colonia depende de su desarrollo, y durante este período, la reina la fertiliza con líquido fecal13. Días después de emerger, las primeras obreras abren la entrada del nido y comienzan una actividad de forrajeo en el área inmediata del nido13. Incorporan el material recolectado como sustrato del jardín de hongos, que ahora está sirviendo como alimento para los trabajadores 13,22. Antes de ser agregado al cultivo de hongos, el material vegetal transportado por los trabajadores se corta en trozos pequeños y se humedece con líquido fecal13. Las hormigas manipulan el inóculo del hongo para aumentar y controlar su crecimiento, lo que servirá para dividir grandes cámaras excavadas de tierra, especializadas en acondicionar el jardín 13,22,25.
Aproximadamente 6 meses después del vuelo nupcial, los nidos de A. sexdens contienen una cámara de hongos y algunos canales. La gran especialización en la construcción de nidos de hormigas cortadoras de hojas funciona como un mecanismo de defensa contra enemigos naturales y factores ambientales desfavorables22. Se sabe que las hormigas cortadoras de hojas fragmentan el jardín de hongos y lo transponen a cámaras con alta humedad cuando las cámaras comienzan a secarse13. Así, a pesar de que la excavación del nido tiene un costo energético considerable, la energía invertida se invierte en beneficios para la propia colonia22. Con algunas excepciones, las especies de Atta también hacen cámaras especializadas para los desechos de la colonia, hechas principalmente de sustrato de hongo agotado y cuerpos de hormigas muertas, aislándola del resto del nido y estableciendo una importante estrategia de inmunidad social30. Además, un grupo distinto de trabajadores manipula la basura directamente, para evitar la contaminación de otros individuos. Las obreras se alimentan constantemente para nutrir el hongo, que es el principal recurso nutricional de la colonia. Sin embargo, también pueden alimentarse de la savia de la planta mientras cortan fragmentos. El material vegetal es cuidadosamente seleccionado para el mantenimiento del jardín de hongos e influenciado por muchos factores, como los rasgos de las hojas y las propiedades del ecosistema13.
La estrategia de forrajeo de las hormigas cortadoras de hojas para obtener material fresco es altamente compleja, y combinada con la alta demanda de cosecha de las colonias establecidas, resulta en una pérdida económica considerable para los productores agrícolas y pone en peligro las áreas de restauración forestal22,31. Por lo tanto, estas hormigas pueden clasificarse como plagas en la mayoría de las áreas donde se pueden encontrar, desde el sur de los Estados Unidos hasta el noreste de Argentina 11,13,22,32. La extinción de colonias problemáticas es un desafío debido a la serie de adaptaciones inherentes a la biología de estos insectos (es decir, organización social, búsqueda de alimento, cultivo de hongos, higiene y estructuras complejas de nidos)33. Así, las estrategias de control poblacional son distintas de las generalmente aplicadas a otras plagas de insectos, y recurren principalmente a atractivas ofertas de cebo contaminado33,34. Sin embargo, como estas hormigas pueden rechazar sustancias nocivas tanto para el hongo como para los individuos de la colonia, y comprometer los campos cultivados 33, constantemente se prueban nuevos compuestos naturales y alternativas de control33,35,36. Como los resultados de los experimentos difícilmente pueden ser monitoreados en colonias probadas en el campo, los ensayos preliminares se llevan a cabo en un ambiente controlado.
Por lo tanto, los protocolos experimentales deben adaptarse a los grupos de interés considerando el estilo de vida heterogéneo de las hormigas, apoyando estudios a nivel de especie y teniendo en cuenta las colonias como unidades operativas, donde una hormiga es un elemento de un superorganismo complejo11. Los informes recopilados hasta ahora sobre el género Atta permitieron recolectar y mantener con éxito colonias en condiciones de laboratorio y reconocer sus necesidades básicas y su funcionamiento general. A partir de sus procesos naturales como la reproducción, la fundación de colonias y los comportamientos de alimentación, se ha desarrollado una rutina de prácticas que permite el establecimiento a largo plazo de colonias en diferentes tipos de nidos. Aquí, se describe un protocolo de procedimiento para mantener a las hormigas cortadoras de hojas en el laboratorio y destaca la posible investigación general con distintos propósitos de experimentación y divulgación científica.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Colección de reinas
- Buscar en la literatura el período de la temporada reproductiva de Atta en la región de interés. La ocurrencia de la temporada reproductiva, la frecuencia y el horario diurno de los vuelos nupciales, varía de acuerdo con las condiciones climáticas regionales (Tabla 1). Aunque generalmente se lleva a cabo en primavera, esta información debe recopilarse para el lugar donde se pretende que ocurra la recolección 37,38,39,40,41,42,43,44,45,46.
- Identificar y marcar lugares con nidos de Atta considerados como posibles áreas para recolectar reinas y colonias jóvenes. Durante los vuelos nupciales, las reinas se dispersan alrededor de las ubicaciones de los nidos; Por lo tanto, las áreas con un mayor número de colonias tienen mayores posibilidades de tener lugares de desembarco de reinas donde inician nuevas excavaciones de nidos.
- Verifique las áreas seleccionadas previamente para detectar signos de vuelo nupcial durante la temporada reproductiva de las hormigas Atta . Lleve un registro de las condiciones ambientales de los días de vuelo nupcial, como el clima cálido y lluvioso.
- Identifique nidos de hormigas cortadoras de hojas en las áreas seleccionadas previamente y busque características externas que indiquen la próxima partida de las hormigas reproductivas aladas. Las características del nido incluyen entradas de túneles ensanchadas (Figura 1), aumento del flujo de obreras que muestran un comportamiento más agresivo hacia posibles depredadores y hormigas aladas reproductivas que aparecen en las entradas del túnel (Figura 1). Tenga cuidado con los días de alta humedad que siguen a la lluvia, ya que generalmente preceden a los vuelos nupciales.
- Prepare recipientes con tapa de plástico con una capa inferior de yeso para retener a las reinas individualmente. Asegúrese de que el volumen del contenedor sea de aproximadamente 200 ml, y que la capa de yeso en la parte inferior tenga alrededor de 1 cm de altura y sea altamente absorbente para el control de la humedad.
NOTA: Para preparar la base de yeso, siga las instrucciones del fabricante. - Prepare un ambiente con una temperatura constante de 23 ± 1 °C y aproximadamente 70% ± 10% de humedad relativa. Elija un lugar sin actividades intensas y alto flujo de personas para evitar vibraciones y molestias. Use productos de limpieza de fragancia neutra para evitar cualquier interferencia en el comportamiento de las hormigas.
NOTA: Las fluctuaciones en las condiciones ambientales especificadas pueden causar condensación de agua o pérdida de humedad, y comprometer el jardín de hongos. - Después del vuelo nupcial, recoja las reinas sin alas que hayan iniciado la excavación del nido y colóquelas cuidadosamente en los recipientes de plástico preparados con una capa de yeso, individualmente. Evite tocar a las reinas con las manos desnudas y use guantes de látex o pinzas entomológicas.
NOTA: La eliminación de alas y el comportamiento de excavación del suelo indican hembras reproductivas que ya han copulado y, por lo tanto, pueden comenzar una nueva colonia. La colección Queens también se trata como la primera colección de este trabajo. - Mueva los contenedores que llevan las reinas a la ubicación con un entorno controlado previamente seleccionado. Realice el transporte de las reinas con la máxima precaución, evitando demasiadas molestias y manteniendo una temperatura mínima constante.
- No manipule ni mueva a las reinas durante aproximadamente 3 días después de la recolección para evitar el estrés.

Figura 1. La entrada del nido se ensanchaba con reproductores y obreras de hormigas aladas. Las entradas ensanchadas del túnel son una de las características de los nidos que indica la ocurrencia de vuelos nupciales de Atta . Haga clic aquí para ver una versión más grande de esta figura.
2. Mantenimiento de las reinas
- Inicialmente, agregue 2.5 ml de agua a la capa de yeso del recipiente cada 2 días con la ayuda de una jeringa de aguja.
- En lugar de abrir el recipiente, perfore cuidadosamente las tapas del recipiente con la aguja para evitar molestias debido a la manipulación. El mismo orificio se puede utilizar durante este período. Asegúrese de que el agua añadida no empape la capa de yeso. Evite regar directamente a la reina, la esponja de hongo inicial y cualquier inmaduro. Mientras el jardín de hongos exhiba un aspecto seco con ausencia de agua, riegue la capa de yeso.
- Dos semanas después de la recolección, verifique si el hongo ha sido regurgitado por las reinas. Si no hay hongo, transfiera aproximadamente 2 g de hongo obtenido de una colonia establecida. Además, realice este paso si el hongo no se desarrolla.
NOTA: Para la transferencia de hongos, es necesario recolectar hongos sanos de una colonia establecida y eliminar todas las hormigas que puedan estar en ella. Use una cucharada, pinzas entomológicas y guantes de látex para manipular el hongo. - Después de la aparición de las primeras obreras, comience a ofrecer fragmentos de hojas jóvenes y delgadas regularmente, de acuerdo con la actividad de corte de la colonia. Asegúrese de que las hojas ofrecidas estén sanas y que las plantas no hayan sido tratadas con insecticidas u otras sustancias químicas. En las primeras etapas, asegúrese de que los fragmentos de hojas no superen los 4 cm.
NOTA: Como las primeras obreras inician el forrajeo de hojas, se debe ofrecer material vegetal después de su aparición. La frecuencia de la oferta depende de la agilidad con la que los trabajadores incorporan el material vegetal en el hongo, pero puede variar de 2 a 3 días a la semana. También se pueden ofrecer copos de avena y copos de maíz, pero deben alternarse con hojas para evitar la sequedad de hongos. - Al ofrecer hojas nuevas, elimine los desechos de la colonia y los fragmentos de hojas secas. Evita el uso de perfumes, cremas hidratantes, cremas o cualquier sustancia con un olor fuerte al manipular a las reinas. Además, use guantes de látex durante todos los procesos.
- Siga el desarrollo de la colonia, y cuando el jardín de hongos alcance al menos la mitad del volumen del contenedor, transfiera la colonia a un nido perdurable artificial.
NOTA: Como la tasa de desarrollo es inherente a cada colonia, no hay un tiempo estimado para la transferencia de colonias. Por lo general, las colonias de la primera colección se transfieren a nidos con cámara de jardín de hongos de volumen máximo de 1L, debido al pequeño jardín de hongos.
3. Colección de colonias jóvenes
- Adquiera envases de plástico de aproximadamente 500 mL de volumen.
- Aproximadamente 6 meses después del vuelo nupcial, identifique montículos indicativos en forma de torre con partículas de suelo granuladas (Figura 1) de nidos incipientes de Atta (Figura 2) en los lugares con la aparición de hormigas cortadoras de hojas previamente marcadas.
NOTA: Seis meses después del vuelo nupcial, se estima que los nidos de colonias jóvenes tienen hasta 1 m de profundidad en el suelo. Se indica una nueva colección en este período para lograr mayores posibilidades de colonias exitosas y duraderas en grandes cantidades. - Con una azada de jardín, excava la entrada del nido hasta llegar a la cámara que sostiene la colonia joven. Recoja la reina, el jardín de hongos, los inmaduros y los trabajadores jóvenes, y colóquelos en el recipiente de plástico. Realice el proceso de recolección con la mayor delicadeza posible.
NOTA: Naturalmente, también se recolectará una gran cantidad de tierra y debe eliminarse gradualmente en futuros procedimientos de mantenimiento en el laboratorio. - Mueva los recipientes con tapa de plástico que contienen las colonias al entorno controlado designado. Realizar el transporte de colonias jóvenes con la máxima precaución, evitando demasiadas perturbaciones y manteniendo una temperatura mínima constante. Abstenerse de manipular o mover las colonias durante aproximadamente 3 días para evitar el estrés. Si la habitación tiene una rutina activa, se puede poner un paño oscuro sobre las colonias.

Figura 2. Montículo de tierra en forma de torre. El característico montículo en forma de torre indica la presencia de colonias incipientes de Atta sexdens y Atta laevigata. Haga clic aquí para ver una versión más grande de esta figura.
4. Mantenimiento de colonias jóvenes
- Proporcione hojas jóvenes delgadas 3 veces a la semana.
- Asegúrese de que las hojas ofrecidas estén sanas y que las plantas no hayan sido tratadas con insecticidas u otras sustancias químicas. En esta etapa, asegúrese de que los fragmentos de hojas tengan al menos 7 cm de longitud.
NOTA: También se pueden ofrecer copos de avena y copos de maíz, pero deben alternarse con hojas para evitar la sequedad de hongos. - La frecuencia de la oferta depende de la agilidad con la que los trabajadores incorporan el material vegetal sobre el hongo. Con la actividad de corte intensa, aumente la oferta dos veces al día tres veces a la semana o 5 días a la semana.
- Asegúrese de que las hojas ofrecidas estén sanas y que las plantas no hayan sido tratadas con insecticidas u otras sustancias químicas. En esta etapa, asegúrese de que los fragmentos de hojas tengan al menos 7 cm de longitud.
- Cuando ofrezca hojas nuevas, elimine los desechos de la colonia, incluidos los restos de tierra, con la ayuda de una cuchara. Use guantes de látex durante todos los procesos. Al manipular las colonias jóvenes evite el uso de perfumes, cremas hidratantes, cremas o cualquier sustancia con un olor fuerte.
NOTA: Los propios trabajadores separarán el suelo y los desechos del hongo. - Siga el desarrollo de la colonia, y cuando el jardín de hongos alcance al menos la mitad del volumen del contenedor, transfiera la colonia a un nido perdurable artificial.
NOTA: Como la tasa de desarrollo es inherente a cada colonia, no hay un tiempo estimado para la transferencia de colonias.
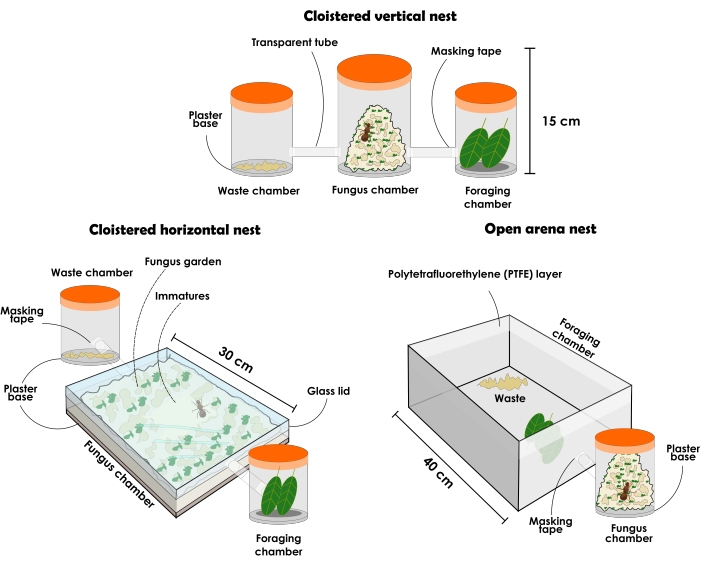
Figura 3: Tipos de nidos artificiales para contener colonias de Atta sexdens y Atta laevigata . Ilustración de nidos artificiales perdurable de hormigas cortadoras de hojas: configuración de nido vertical enclaustrado, configuración de nido horizontal enclaustrado y configuración de nido de arena abierta. Haga clic aquí para ver una versión más grande de esta figura.
5. Nidos artificiales perdurables
- Prepare una configuración de nido vertical enclaustrado como se describe a continuación (Figura 3 y Figura 4).
NOTA: Las configuraciones de nidos enclaustrados siempre deben tener diferentes recipientes para posar por separado como (1) cámara de jardín de hongos, (2) cámara de eliminación de desechos y (3) cámara de forrajeo. Inicialmente, debe comenzar con tres contenedores, pero se pueden agregar más recipientes para aumentar el jardín de hongos. Los nidos pueden variar en tamaño y material según su propósito experimental, aunque aquí se describe y recomienda el uso de materiales transparentes. Los contenedores deben estar sin aberturas, o de lo contrario las hormigas escaparán. El tipo de nido como se describe a continuación se puede utilizar para la investigación general, pero no está bien recomendado para la recolección asertiva de hormigas debido a la perturbación causada al quitar la tapa, lo que resulta en una gran agitación entre los individuos. Sin embargo, debido a la transparencia del material, es posible localizar a la reina y diferentes castas de hormigas incluso cuando el jardín de hongos ha llenado todo el contenedor. Como es una tendencia, siempre se asume que los inmaduros están en el centro del jardín de hongos cuando ha ocupado la mayor parte del espacio disponible en contenedores verticales.- Seleccione un recipiente con tapa transparente de aproximadamente 1 L y agregue una capa de 1 cm de base de yeso altamente absorbente. Esta será la cámara de jardín de hongos. Seleccione dos contenedores transparentes con tapa de aproximadamente 500 ml cada uno para que sean cámaras de eliminación de desechos y forrajeo. Las hormigas elegirán qué cámara será cada una, y después de eso, se asegurarán de que no se intercambien.
NOTA: Para preparar la base de yeso, siga las instrucciones del fabricante. - Perfore y conecte los tres recipientes con un tubo transparente o una manguera. Si es necesario, aplique cinta adhesiva en el borde de los tubos para garantizar una conexión del muslo con los contenedores y evitar que las hormigas se escapen. Coloque el recipiente de base de yeso en el medio y los otros recipientes en lados opuestos.
- Transfiera cuidadosamente la esponja de hongos de las colonias seleccionadas (ver paso 2.5 y paso 4.3) junto con la reina, las obreras y los inmaduros al recipiente de la base de yeso. Antes de la transferencia, asegúrese de que la base de yeso esté regada. Use guantes de látex.
- Seleccione un recipiente con tapa transparente de aproximadamente 1 L y agregue una capa de 1 cm de base de yeso altamente absorbente. Esta será la cámara de jardín de hongos. Seleccione dos contenedores transparentes con tapa de aproximadamente 500 ml cada uno para que sean cámaras de eliminación de desechos y forrajeo. Las hormigas elegirán qué cámara será cada una, y después de eso, se asegurarán de que no se intercambien.
- Prepare una configuración de nido horizontal enclaustrado como se describe a continuación (Figura 3 y Figura 4).
NOTA: Los nidos con configuración horizontal permiten observar de cerca el jardín de hongos y las actividades de los trabajadores hacia él. Como las porciones más jóvenes del jardín de hongos están en la parte superior, es posible observar sustratos recientemente ofrecidos incorporados por los trabajadores. Las nuevas porciones del hongo pueden ser detectadas por su color, que será similar al color del último recurso ofrecido, mientras que las porciones más antiguas generalmente tienen un color beige. Las crías y la reina también se pueden localizar fácilmente, ya que en contenedores horizontales suelen estar en la parte superior del jardín de hongos, incluso cuando ha ocupado la mayor parte del espacio. Esta configuración se puede utilizar para la investigación centrada en el comportamiento, el muestreo focal y la divulgación científica, ya que da una percepción de la organización dentro del nido.- Adquiera un recipiente con tapa transparente con dimensiones aproximadas de 31 cm x 21 cm x 4,5 cm, y agregue una capa de 1 cm de base de yeso altamente absorbente. Esta será la cámara de jardín de hongos. Seleccione dos contenedores transparentes con tapa de aproximadamente 500 ml cada uno para que sean cámaras de eliminación de desechos y forrajeo. Las hormigas elegirán qué cámara será cada una, y después de eso, se asegurarán de que no se intercambien.
NOTA: Para preparar la base de yeso, siga las instrucciones del fabricante. Si es necesario, cierre el poco espacio entre la tapa y el recipiente con cinta adhesiva para evitar que las hormigas se escapen. - Perforar y conectar los recipientes con un tubo transparente o una manguera. Si es necesario, aplique cinta adhesiva en el borde de los tubos para garantizar una conexión del muslo con los contenedores y evitar que las hormigas se escapen. Coloque el recipiente de base de yeso en el medio y los otros recipientes en lados opuestos.
- Transfiera cuidadosamente la esponja de hongos de las colonias seleccionadas (ver paso 2.5 y paso 4.3) junto con la reina, las obreras y los inmaduros al recipiente de la base de yeso. Antes de la transferencia, asegúrese de que la base de yeso esté regada. Use guantes de látex.
- Adquiera un recipiente con tapa transparente con dimensiones aproximadas de 31 cm x 21 cm x 4,5 cm, y agregue una capa de 1 cm de base de yeso altamente absorbente. Esta será la cámara de jardín de hongos. Seleccione dos contenedores transparentes con tapa de aproximadamente 500 ml cada uno para que sean cámaras de eliminación de desechos y forrajeo. Las hormigas elegirán qué cámara será cada una, y después de eso, se asegurarán de que no se intercambien.
- Prepare una configuración de nido de arena abierta como se describe a continuación (Figura 3 y Figura 5).
NOTA: Los nidos de arena abierta permiten la recolección de hormigas sin grandes perturbaciones y análisis de comportamiento de alimentación. También pueden proporcionar una representación confiable de una colonia que se encuentra en la naturaleza con fines de divulgación científica.- Seleccione un recipiente con tapa transparente de aproximadamente 1 L y agregue una capa de 1 cm de base de capa de yeso altamente absorbente. Esta será la cámara de jardín de hongos.
NOTA: Se recomienda comenzar con recipientes de 1 L y pasar gradualmente a contenedores con volúmenes más altos para un jardín de hongos más grande. Sin embargo, los recipientes no deben superar un volumen de 5 L. Agregue tantos contenedores como sea necesario. - Seleccione una arena abierta. El tamaño de la arena puede variar según los propósitos del estudio. Si se selecciona una arena grande, coloque los recipientes que contienen el jardín de hongos en su interior (Figura 5). En el caso de una arena pequeña, conéctela al recipiente del jardín de hongos con una manguera o tubo transparente (Figura 3). La arena servirá como una cámara de forrajeo y eliminación de desechos, por lo tanto, asegúrese de que no sea demasiado pequeña.
- Aplique una capa de politetrafluoroetileno líquido en un solo movimiento al borde de la arena para contener las hormigas. Use un algodón empapado con el líquido y un guante de nitrilo.
PRECAUCIÓN: Evite la inhalación y el contacto con la piel mientras usa el líquido de politetrafluoroetileno. - Transfiera cuidadosamente la esponja de hongos de las colonias seleccionadas (ver paso 2.5 y paso 4.3) junto con la reina, las obreras y los inmaduros al recipiente de la base de yeso. Antes de la transferencia, asegúrese de que la base de yeso esté regada. Use guantes de látex.
- Seleccione un recipiente con tapa transparente de aproximadamente 1 L y agregue una capa de 1 cm de base de capa de yeso altamente absorbente. Esta será la cámara de jardín de hongos.

Figura 4: Nidos artificiales de clausura de las hormigas cortadoras de hojas Atta sexdens y Atta laevigata. Configuración de nido vertical enclaustrado superior (A) y vista lateral (B); enclaustrado horizontal de configuración de nido superior (C) y vista lateral (D). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Nido artificial de arena abierta de las hormigas cortadoras de hojas Atta sexdens y Atta laevigata. Configuración de nido de arena abierta de Atta sexdens superior (A) y vista lateral (B). 1) Cámaras de jardín de hongos; 2) Residuos; 3) rodajas de naranja; 4) Vidrio con capa de politetrafluoretileno (PTFE). Haga clic aquí para ver una versión más grande de esta figura.
6. Mantenimiento de colonias desarrolladas
- Ofrezca diariamente al menos una hoja grande en la cámara de forrajeo por colonia con 1 L de jardín de hongos. Si la actividad de corte de las hormigas es intensa, aumente el número de hojas. Si el hongo está seco, humedezca previamente las hojas para proporcionar humedad adicional. En los nidos de clausura, realice la ofrenda rápidamente para evitar que las hormigas escapen de la cámara de alimentación.
NOTA: Aquí, las hojas se recolectan de especies de plantas como morera (Morus nigra), mango (Mangifera indica), eucalipto (Eucalyptus sp.), jambolan (Syzygium cumini), hibisco (Hibiscus sp.), acalypha (Acalypha wilkesiana) y ligustrum (Ligustrum lucidum).- Ofrezca frutas como naranja y manzana, y copos de avena y maíz para diversificar y complementar la dieta. A las colonias grandes con intensa actividad de forrajeo, ofrezca copos de avena y copos de maíz diariamente, y frutas una vez a la semana. Si no es el caso, ofrezca copos alternativamente con hojas, pero no más de tres veces a la semana, y frutas una o dos veces al mes. Ajuste la cantidad y frecuencia de cada alimento de acuerdo con la actividad de forrajeo de las hormigas.
- Si las opciones descritas anteriormente no están disponibles, identifique la preferencia de alimentación de las hormigas entre hojas, flores y frutos de árboles y arbustos regionales, o incluso vegetales, granos y otros copos comercializados. Evite ofrecer recursos con compuestos químicos defensivos y pesticidas.
- Retire todo el contenido de la cámara de residuos cada 2 semanas de todas las colonias. Eliminar a los trabajadores también con fines de control de la población. Si las obreras transfieren hongos sanos a la cámara de desechos, asegúrese de que la reina no esté sobre ella y retírela. Si la cantidad de residuos desechados es alta o está demasiado húmeda, retírelos una vez por semana.
- Retire el material no tomado por las hormigas de la cámara de forrajeo cada vez que ofrezca otros nuevos y asegúrese de que siempre esté limpio.
- Si las obreras transfieren hongos sanos a la cámara de forrajeo, la perturban, dejan la tapa del recipiente abierta y aplican talco neutro a la superficie del margen de la cámara. Realice este procedimiento solo si todavía hay algo de espacio en la cámara de hongos, de esta manera los trabajadores transferirán el hongo nuevamente al recipiente sin perderlo ni inmaduros.
- Si se desea más jardín de hongos, agregue otro recipiente enlucido y mueva una porción de la esponja de hongos en él. Hasta que el hongo llegue a la mitad del recipiente, agregue hojas en la cámara del hongo. El crecimiento del jardín de hongos debe ocurrir gradualmente para no comprometer el equilibrio de la colonia. Si se desea un recipiente más grande, asegúrese de dejar que el hongo ocupe todo el espacio de los contenedores más pequeños antes de transferirlo. Los desechos de colonias y las hojas secas no deben acumularse en la cámara del jardín de hongos.
- Verifique la base de yeso de los contenedores, ya que con el tiempo, puede adquirir un color marrón oscuro y volverse ineficaz debido a la excreción de hormigas, el transporte de desechos y la alta concentración de humedad. Además, algunas colonias pueden cortar la capa y deshacerse de ella. En estos casos, transfiera el jardín de hongos a un nuevo recipiente enlucido.
Access restricted. Please log in or start a trial to view this content.
Resultados
En la Figura 6 se muestra un diagrama de flujo que representa el proceso de recolección de hormigas. Aquí se muestran algunos resultados obtenidos empleando el protocolo de recolección, mantenimiento y configuraciones de anidación descritas anteriormente.
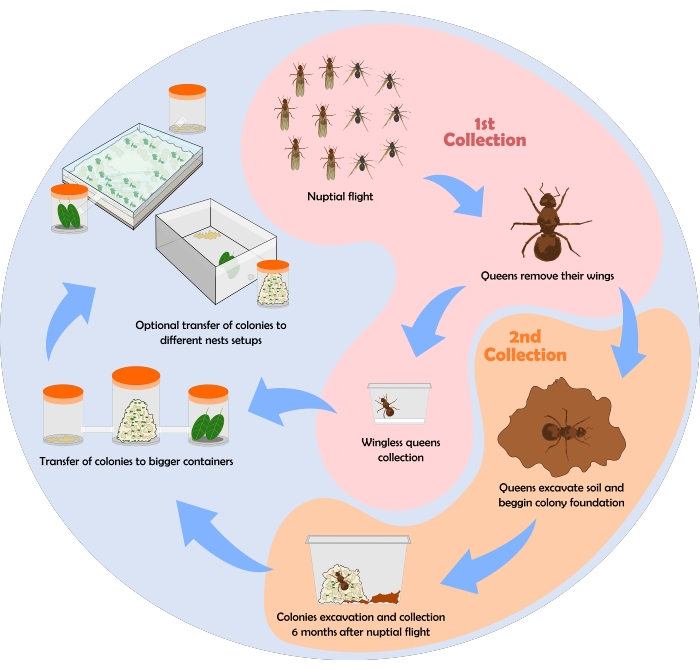
Figura 6: Diagrama de flujo para la recol...
Access restricted. Please log in or start a trial to view this content.
Discusión
El protocolo descrito aquí para mantener colonias de hormigas cortadoras de hojas se ha desarrollado y aplicado durante más de tres décadas de manera asertiva y replicable. Permitió el desarrollo de investigaciones que estarían limitadas por las condiciones del campo. De este modo, las hormigas sanas y las colonias estuvieron disponibles para la investigación en varias áreas, como la morfología comparada, la toxicología 51,52, la histología53 y la microbiología54,55,56...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Dedicado a Mario Autuori (in memoriam) y Walter Hugo de Andrade Cunha que contribuyeron en gran medida a los estudios de hormigas cortadoras de hojas. Reconocemos el apoyo de la Universidad Estadual Paulista y del Instituto de Biociencias. Este estudio fue financiado en parte por la Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES) - Código de Finanzas 001, el Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), la Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) y la Fundação para o Desenvolvimento da UNESP (Fundunesp).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Entomologic forceps | N/A | N/A | N/A |
| Glass tank | N/A | N/A | Tempered glass, custom made |
| Hose | N/A | N/A | Transparent, PVC 1/2 Inch x 2,0 mm |
| Latex gloves | Descarpack | 550301 | N/A |
| Nitrile gloves | Descarpack | 433301 | N/A |
| Open arena | N/A | N/A | Polypropylene crate |
| Plaster pouder | N/A | N/A | Plaster pouder used in construction, must be absorbant |
| Plastic Containers for collection | Prafesta | Natural Cód.: 8231/Natural Cód.: 8262 | Lidded, transparent , polypropylene |
| Plastic containers for nests | Prafesta | Discontinued | Polystyrene, hermetic |
| Teflon | Dupont | N/A | Polytetrafluoroethylene liquid (PTFE Dispertion 30) |
Referencias
- Wilson, E. O. The Insect Societies. , Harvard University Press. Cambridge, Massachusetts, USA. (1971).
- Ortiz, D. P., Elizalde, L., Pirk, G. I. Role of ants as dispersers of native and exotic seeds in an understudied dryland. Ecological Entomology. 46 (3), 626-636 (2021).
- Christianini, A. V., Oliveira, P. S. Birds and ants provide complementary seed dispersal in a neotropical savanna. Journal of Ecology. 98 (3), 573-582 (2010).
- Camargo, P. H. S. A., Martins, M. M., Feitosa, R. M., Christianini, A. V. Bird and ant synergy increases the seed dispersal effectiveness of an ornithochoric shrub. Oecologia. 181 (2), 507-518 (2016).
- Sanders, D., van Veen, F. J. F. Ecosystem engineering and predation: the multi-trophic impact of two ant species. Journal of Animal Ecology. 80 (3), 569-576 (2011).
- Swanson, A. C., et al. Welcome to the Atta world: A framework for understanding the effects of leaf-cutter ants on ecosystem functions. Functional Ecology. 33 (8), 1386-1399 (2019).
- Meyer, S. T., et al. Leaf-cutting ants as ecosystem engineers: topsoil and perturbations around Atta cephalotes nests reduce nutrient availability. Ecological Entomology. 38 (5), 497-504 (2013).
- Sosa, B., Brazeiro, A. Positive ecosystem engineering effects of the ant Atta vollenweideri on the shrub Grabowskia duplicata. Journal of Vegetation Science. 21 (3), 597-605 (2010).
- De Almeida, T., et al. Above- and below-ground effects of an ecosystem engineer ant in Mediterranean dry grasslands. Proceedings of the Royal Society B: Biological Sciences. 287 (1935), 20201840(2020).
- Folgarait, P. J. Ant biodiversity and its relationship to ecosystem functioning: a review. Biodiversity & Conservation. 7 (9), 1221-1244 (1998).
- Hölldobler, B., Wilson, E. O. The Ants. , Harvard University Press. (1990).
- Barrera, C. A., Sosa-Calvo, J., Schultz, T. R., Rabeling, C., Bacci, M. Phylogenomic reconstruction reveals new insights into the evolution and biogeography of Atta leaf-cutting ants (Hymenoptera: Formicidae). Systematic Entomology. 47 (1), 13-35 (2021).
- Hölldobler, B., Wilson, E. O. The Leafcutter Ants: Civilization By Instinct. , WW Norton & Company. (2011).
- Branstetter, M. G., et al. Dry habitats were crucibles of domestication in the evolution of agriculture in ants. Proceedings of the Royal Society B: Biological Sciences. 284 (1852), 20170095(2017).
- Solomon, S. E., et al. The molecular phylogenetics of Trachymyrmex Forel ants and their fungal cultivars provide insights into the origin and coevolutionary history of ‘higher-attine’ ant agriculture. Systematic Entomology. 44 (4), 939-956 (2019).
- Cristiano, M. P., Cardoso, D. C., Sandoval-Gómez, V. E., Simões-Gomes, F. C. Amoimyrmex Cristiano, Cardoso & Sandoval, gen. nov. (Hymenoptera: Formicidae): a new genus of leaf-cutting ants revealed by multilocus molecular phylogenetic and morphological analyses. Austral Entomology. 59 (4), 643-676 (2020).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences of the United States of America. 105 (14), 5435-5440 (2008).
- Mueller, U. G., et al. Phylogenetic patterns of ant–fungus associations indicate that farming strategies, not only a superior fungal cultivar, explain the ecological success of leafcutter ants. Molecular Ecology. 27 (10), 2414-2434 (2018).
- Mueller, U. G., et al. Biogeography of mutualistic fungi cultivated by leafcutter ants. Molecular Ecology. 26 (24), 6921-6937 (2017).
- Weber, N. A. The fungus-culturing behavior of ants. American Zoologist. 12 (3), 577-587 (1972).
- Wilson, E. O. Caste and division of labor in leaf-cutter ants (Hymenoptera: Formicidae: Atta). Behavioral Ecology and Sociobiology. 7 (2), 157-165 (1980).
- Della Lucia, T. M. C. Formigas cortadeiras: da bioecologia ao manejo. Viçosa Editora UFV. 421, University of Viçosa Press. Viçosa, Minas Gerais, Brazil. (2011).
- Autuori, M. Contribuição para o conhecimento da saúva (Atta spp). I. Evolução do sauveiro (Atta sex dens rubolpilosa Forel, 1908). Arquivos do Instituto Biologico Saul Paulo. 12, 197-228 (1941).
- Bueno, O. C., Hebling, M. J. A., Schneider, M. O., Pagnocca, F. C. Ocorrência de formas aladas de Atta sexdens rubropilosa Forel (Hymenoptera: Formicidae) em colônias de laboratório. Neotropical Entomology. 31 (3), 469-473 (2002).
- Mariconi, F. A. M. Biologo. As Saúvas. , Ceres Press. Piracicaba, São Paulo, Agronômica. (2021).
- Bento, J. M. S. Condições climáticas para o vôo nupcial e reconhecimento dos indivíduos em Atta sexdens rubropilosa (Hymenoptera: Formicidae). , Viçosa. Minas Gerais, Brazil. Master's dissertation (1993).
- Little, A. E. F., Murakami, T., Mueller, U. G., Currie, C. R. The infrabuccal pellet piles of fungus-growing ants. Naturwissenschaften. 90 (12), 558-562 (2003).
- Kerr, W. E. Acasalamento de rainhas com vários machos em duas espécies da tribo Attini. Revista Brasileira de Biologia. 21, 45-48 (1961).
- Kerr, W. E. Tendências evolutivas na reprodução dos himenópteros sociais. Arquivos do Museu Nacional. 52, (1962).
- Cremer, S., Armitage, S. A. O., Schmid-Hempel, P. Social immunity. Current Biology. 17 (16), 693-702 (2007).
- Hernández, J. V., Jaffé, K. Dano econômico causado por populações de formigas Atta laevigata (F. Smith) em plantações de Pinus caribaea (Mor.) e elementos para o manejo da praga. Anais da Sociedade Entomológica do Brasil. 24 (2), 287-298 (1995).
- Kempf, W. W. Catálogo abreviado das formigas da Região Neotropical Studia Entomologica. antbase.org. 15, 3(1972).
- Della Lucia, T. M. C., Gandra, L. C., Guedes, R. N. C. Managing leaf-cutting ants: peculiarities, trends and challenges. Pest Management Science. 70 (1), 14-23 (2013).
- Boaretto, M. A. C., Forti, L. C. Perspectivas no controle de formigas-cortadeiras. Série Técnica IPEF. 11 (30), 31-46 (1997).
- Folgarait, P. J., Goffré, D. Conidiobolus lunulus, a newly discovered entomophthoralean species, pathogenic and specific to leaf-cutter ants. Journal of Invertebrate Pathology. 186, 107685(2021).
- Cardoso, S. R. S., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Pathogenicity of filamentous fungi towards Atta sexdens rubropilosa (Hymenoptera: Formicidae). International Journal of Tropical Insect Science. 42 (2), 1215-1223 (2022).
- Ichinose, K., Rinaldi, I., Forti, L. C. Winged leaf-cutting ants on nuptial flights used as transport by Attacobius spiders for dispersal. Ecological Entomology. 29 (5), 628-631 (2004).
- Pagnocca, F. C., Rodrigues, A., Nagamoto, N. S., Bacci, M. Yeasts and filamentous fungi carried by the gynes of leaf-cutting ants. Antonie Van Leeuwenhoek. 94 (4), 517-526 (2008).
- Attili-Angelis, D., et al. Novel Phialophora species from leaf-cutting ants (tribe Attini). Fungal Diversity. 65 (1), 65-75 (2014).
- Delabie, J. H. C., do Nascimento, I. C., Mariano, C. S. F. Estratégias de reprodução e dispersão em formigas attines, com exemplos do sul da Bahia. XIX Congresso Brasileiro de Entomologia. , 16-21 (2002).
- Fjerdingstad, E. J., Boomsma, J. J. Variation in size and sperm content of sexuals in the leafcutter ant Atta colombica. Insectes Sociaux. 44 (3), 209-218 (1997).
- Currie, C. R., Mueller, U. G., Malloch, D. The agricultural pathology of ant fungus gardens. Proceedings of the National Academy of Sciences of the United States of America. 96 (14), 7998-8002 (1999).
- Moser, J. C., et al. Eye size and behaviour of day-and night-flying leafcutting ant alates. Journal of Zoology. 264 (1), 69-75 (2004).
- Moreira, S. M., Rodrigues, A., Forti, L. C., Nagamoto, N. S. Absence of the parasite Escovopsis in fungus garden pellets carried by gynes of Atta sexdens. Sociobiology. 62 (1), 34-38 (2015).
- Arcuri, S. L., et al. Yeasts found on an ephemeral reproductive caste of the leaf-cutting ant Atta sexdens rubropilosa. Antonie Van Leeuwenhoek. 106 (3), 475-487 (2014).
- Staab, M., Kleineidam, C. J. Initiation of swarming behavior and synchronization of mating flights in the leaf-cutting ant Atta vollenweideri FOREL, 1893 (Hymenoptera: Formicidae). Myrmecol. News. 19, 93-102 (2014).
- Gálvez, D., Chapuisat, M. Immune priming and pathogen resistance in ant queens. Ecology and Evolution. 4 (10), 1761-1767 (2014).
- Baer, B., Armitage, S. A. O., Boomsma, J. J. Sperm storage induces an immunity cost in ants. Nature. 441 (7095), 872-875 (2006).
- Carlos, A. A. Semioquímicos e comunicação sonora em formigas cortadeiras (Hymenoptera: Formicidae). , Rio Claro, São Paulo, Brazil. Doctoral's thesis (2013).
- do Mundo, M. Veja um FORMIGUEIRO por DENTRO. Boravê. , Available from: https://youtu.be/sN99x_Rjf90 (2021).
- Ortiz, G., Vieira, A. S., Bueno, O. C. Toxicological and morphological comparative studies of insecticides action in leaf-cutting ants. International Journal of Agriculture Innovations and Research. 6 (3), 516-522 (2017).
- Decio, P., Silva-Zacarin, E. C. M., Bueno, F. C., Bueno, O. C. Toxicological and histopathological effects of hydramethylnon on Atta sexdens rubropilosa (Hymenoptera: Formicidae) workers. Micron. 45, 22-31 (2013).
- Vieira, A. S., Morgan, E. D., Drijfhout, F. P., Camargo-Mathias, M. I. Chemical composition of metapleural gland secretions of fungus-growing and non-fungus-growing ants. Journal of Chemical Ecology. 38 (10), 1289-1297 (2012).
- Vieira, A. S., Ramalho, M. O., Martins, C., Martins, V. G., Bueno, O. C. Microbial communities in different tissues of Atta sexdens rubropilosa leaf-cutting ants. Current Microbiology. 74 (10), 1216-1225 (2017).
- Ramalho, M. deO., Martins, C., Morini, M. S. C., Bueno, O. C. What can the bacterial community of Atta sexdens (Linnaeus, 1758) tell us about the habitats in which this ant species evolves. Insects. 11 (6), 332(2020).
- Machado, L. M., et al. Attractivity or repellence: relation between the endophytic fungi of Acalypha, Colocasia and the leaf-cutting ants—Atta sexdens. Advances in Entomology. 9 (2), 85-99 (2021).
- Moreira, A., Forti, L. C., Andrade, A. P., Boaretto, M. A., Lopes, J. Nest architecture of Atta laevigata (F. Smith, 1858) (Hymenoptera: Formicidae). Studies on Neotropical Fauna and Environment. 39 (2), 109-116 (2004).
- Della Lucia, T. M. C., Moreira, D. D. O., Oliveira, M. A., Araújo, M. S. Perda de peso de rainhas de Atta durante a fundação e o estabelecimento das colônias. Revista Brasileira de Biologia. 55 (4), 533-536 (1995).
- Fujihara, R. T., Camargo, R. daS., Forti, L. C. Lipid and energy contents in the bodies of queens of Atta sexdens rubropilosa Forel (Hymenoptera, Formicidae): pre-and post-nuptial flight. Revista Brasileira de Entomologia. 56 (1), 73-75 (2012).
- da Silva Camargo, R., Forti, L. C. Queen lipid content and nest growth in the leaf cutting ant (Atta sexdens rubropilosa) (Hymenoptera: Formicidae). Journal of Natural History. 47, 65-73 (2013).
- Camargo, R. S., Forti, L. C., Fujihara, R. T., Roces, F. Digging effort in leaf-cutting ant queens (Atta sexdens rubropilosa) and its effects on survival and colony growth during the claustral phase. Insectes Sociaux. 58 (1), 17-22 (2011).
- Mota Filho, T. M. M., Garcia, R. D. M., Camargo, R. S., Stefanelli, L. E. P., Forti, L. C. Observations about founding queens (Atta sexdens) and their unusual behavior. International Journal of Agriculture Innovations and Research. 9, 352-357 (2021).
- Barcoto, M. O., Pedrosa, F., Bueno, O. C., Rodrigues, A. Pathogenic nature of Syncephalastrum in Atta sexdens rubropilosa fungus gardens. Pest Management Science. 73 (5), 999-1009 (2017).
- Silva, A., Bacci, M., Pagnocca, F. C., Bueno, O. C., Hebling, M. J. A. Production of polysaccharidases in different carbon sources by Leucoagaricus gongylophorus Möller (Singer), the symbiotic fungus of the leaf-cutting ant Atta sexdens Linnaeus. Curr. Microbiology. 53 (1), 68-71 (2006).
- Majoe, M., Libbrecht, R., Foitzik, S., Nehring, V. Queen loss increases worker survival in leaf-cutting ants under paraquat-induced oxidative stress. Philosophical Transactions of the Royal Society B. 376 (1823), 20190735(2021).
- Della Lucia, T. M. C., Peternelli, E. F. O., Lacerda, F. G., Peternelli, L. A., Moreira, D. D. O. Colony behavior of Atta sexdens rubropilosa (Hymenoptera: Formicidae) in the absence of the queen under laboratory conditions. Behavioural Processes. 64 (1), 49-55 (2003).
- Sales, T. A., Toledo, A. M. O., Zimerer, A., Lopes, J. F. S. Foraging for the fungus: why do Acromyrmex subterraneus (Formicidae) queens need to forage during the nest foundation phase. Ecological Entomology. 46 (6), 1364-1372 (2021).
- Forti, L. C., et al. Do workers from subspecies Acromyrmex subterraneus prepare leaves and toxic baits in similar ways for their fungus garden. Neotropical Entomology. 49 (1), 12-23 (2020).
- Dorigo, A. S., et al. Projeto Primeiros Passos na Ciência: rompendo barreiras sociais e estreitando laços entre a comunidade acadêmica e o ensino médio público. Revista Brasileira de Extensão Universitária. 11 (1), 47-59 (2020).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados