A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقايسة الترسيب القائمة على Concanavalin A لقياس ارتباط الركيزة لفوسفاتاز الجلوكان
* These authors contributed equally
In This Article
Summary
تصف هذه الطريقة مقايسة الترسيب في المختبر القائمة على الليكتين لتحديد تقارب الارتباط بين فوسفاتيز الجلوكان والأميلوبكتين. يمكن الاعتماد على اختبار الترسيب المشترك هذا لقياس ارتباط ركيزة الجلوكان الفوسفاتيز ويمكن تطبيقه على ركائز الجلوكان المختلفة القابلة للذوبان.
Abstract
تنتمي فوسفاتاز الجلوكان إلى عائلة أكبر من الفوسفاتاز ثنائية الخصوصية (DSP) التي تزيل الفسفور ركائز الجلوكان ، مثل الجليكوجين في الحيوانات والنشا في النباتات. تكشف الهياكل البلورية لفوسفاتيز الجلوكان مع ركائز الجلوكان النموذجية عن واجهات ربط جلوكان مميزة مصنوعة من DSP ومجالات ربط الكربوهيدرات. ومع ذلك ، فإن القياسات الكمية لتفاعلات الفوسفاتيز الجلوكان - الجلوكان مع الركائز ذات الصلة من الناحية الفسيولوجية أساسية للفهم البيولوجي لعائلة إنزيمات الفوسفاتيز الجلوكان وتنظيم استقلاب الطاقة. تشير هذه المخطوطة إلى اختبار ترسيب في المختبر قائم على Concanavalin A (ConA) مصمم للكشف عن تقارب ربط الركيزة لفوسفاتاز الجلوكان ضد ركائز الجلوكان المختلفة. كدليل على المفهوم ، تم تحديد ثابت التفكك (KD) لفوسفاتيز الجلوكان أرابيدوبسيس ثاليانا النشا الزائد 4 (SEX4) والأميلوبكتين. يوضح توصيف طفرات SEX4 والأعضاء الآخرين في عائلة إنزيمات الفوسفاتيز الجلوكان فائدة هذا الفحص لتقييم الارتباط التفاضلي للتفاعلات بين البروتين والكربوهيدرات. توضح هذه البيانات مدى ملاءمة هذا الفحص لتوصيف مجموعة واسعة من البروتينات المتفاعلة مع النشا والجليكوجين.
Introduction
فوسفاتاز الجلوكان هي أعضاء في فصيلة فرعية متنوعة وظيفيا من الفوسفاتاز ثنائي الخصوصية (DSPs) داخل عائلة بروتين التيروزين الفوسفاتيز (PTP)1. تم العثور عليها في معظم أشكال الحياة ، بما في ذلك الكائنات الحية الضوئية المتباينة على نطاق واسع ، والبشر ، والفقاريات ، وبعض اللافقاريات والطلائعيات2،3،4. تحتوي النباتات على ثلاثة فوسفاتاز جلوكان معروفة: النشا الزائد 4 (SEX4) ، مثل الجنس four1 (LSF1) ، ومثل الجنس four2 (LSF2) 5،6،7. تظهر النباتات التي تفتقر إلى فوسفاتاز الجلوكان معدلات منخفضة من تدهور النشا المؤقت وتراكم النشا في الأوراق 8,9. لافورين هو العضو المؤسس لعائلة الفوسفاتيز الجلوكان التي تزيل الفسفوريلات الجليكوجين في الفقاريات والبشر 3,10. تؤدي طفرات اللافورين إلى مرض لافورا التنكسي العصبي ، وهو شكل صبغي جسدي متنحي قاتل من الصرع11. فوسفاتاز الجلوكان ضرورية لعملية التمثيل الغذائي للجليكوجين والنشا وقد ظهرت كإنزيمات مهمة لتعديل محتوى النشا في النباتات وعلاج مرض لافورا التنكسي العصبي12,13. ألقت دراسات علم البلورات بالأشعة السينية الحديثة على فوسفاتاز الجلوكان مع ركائز الجلوكان النموذجية الضوء على ارتباط الركيزة والآلية التحفيزية لإزالة فسفرة الجلوكان14،15،16،17. ومع ذلك ، فإن الفهم الحالي لكيفية ارتباط فوسفاتاز الجلوكان بركائزها الفسيولوجية غير مكتمل.
النشا عبارة عن بوليمر غير قابل للذوبان من الجلوكوز مصنوع من 80٪ -90٪ أميلوبكتين و 10٪ -20٪ أميلوز18. ركائز فوسفاتاز الجلوكان النباتية هي جزيئات الكربوهيدرات المفسفرة ، مثل حبيبات الجليكوجين والنشا. توجد بقايا الجلوكوزيل المفسفرة عند نسبة 1: 600 فوسفات: بقايا الجلوكوزيل. ومن المثير للاهتمام أن الفوسفات موجود فقط على جزيئات الأميلوبكتين19. يعمل النبات الرئيسي جلوكان فوسفاتيز SEX4 على حبيبات النشا لإزالة الفسفرة من جزيئات الأميلوبكتين. أظهرت البنية البلورية للأشعة السينية ل SEX4 جنبا إلى جنب مع دراسات الطفرات الموجهة بالهيكل خصائص الركيزة الفريدة ل SEX4 لمواقع مختلفة داخل بنية جلوكان15. لقد أظهرنا مؤخرا أنه لا يمكن ملاحظة النشاط ذي الصلة بيولوجيا ل SEX4 إلا عند العمل على ركائز الأميلوبكتين القابلة للذوبان20. ومع ذلك ، فقد ثبت أن فهم تفاعلات glucan-SEX4 أمر صعب بسبب التعقيد الهيكلي للركيزة ، وخصائص الربط الأوسع ، والصلات المنخفضة بين البروتين وركائزه. وقد أعاقت هذه القضايا القدرة على استخدام الأساليب المستخدمة بشكل شائع في تفاعلات البروتين والليجند، مثل قياس كالوريمتر المعايرة بالتحليل الحجمي متساوي الحرارة (ITC)، والتحليل الطيفي بالرنين المغناطيسي النووي (NMR)، والمقايسات القائمة على مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA).
ومن المثير للاهتمام أن الكثير من فهمنا للتفاعلات بين الكربوهيدرات والبروتين قد جاء من دراسة المحاضرات. Concanavalin A (ConA) هي عائلة ليكتين من البقوليات من البروتينات المستخرجة أصلا من حبة جاك. يربط ConA الكربوهيدرات بخصوصية عالية ، وهو أمر مفيد لاستخدامه في تطبيقات استهداف الأدوية وتسليمها. تمت دراسة ارتباط ConA بمجموعة متنوعة من الركائز التي تحتوي على α-D-mannosyl غير المختزل و α-D-glucosyl على نطاق واسع19,20. تستخدم حبات السيفاروز المرتبطة ب ConA المتاحة تجاريا بشكل شائع لتنقية البروتينات السكرية والجليكوليبيدات21. يرتبط ConA بهذه الجلوكان عبر مجموعات هيدروكسيل C3 و C4 و C6 من بقايا الجلوكوز. كما تم استخدام حبات ConA-Sepharose بنجاح لقياس ارتباط تفاعلات بروتين الجليكوجين والنشاوالبروتين 22,23. في هذه الدراسة ، استخدمنا حبات ConA-Sepharose لتطوير مقايسة ملزمة لقياس خصائص الارتباط لتفاعلات الجلوكان فوسفاتيز والأميلوبكتين.
في السابق ، تم استخدام مقايسة الترسيب القائمة على ConA لتقييم قدرة ربط ركيزة الفوسفاتيزالجلوكان 14،20،24. في هذه الدراسة ، تم استخدام نفس الاستراتيجية لتطوير طريقة جديدة لتحديد تقارب الارتباط بين الفوسفاتيز الجلوكان وتفاعلات الكربوهيدرات. هذه الطريقة لها أيضا ميزة للتحقيق في مختلف تفاعلات الكربوهيدرات والبروتين القابلة للذوبان.
Protocol
1. إعداد حبات ConA-Sepharose
- اصنع 250 مل من مخزن مؤقت ملزم يحتوي على 67 مللي مول HEPES (درجة الحموضة 7.5) و 10 مللي مول MgCl 2 و 0.2 مللي مول CaCl2. اضبط الأس الهيدروجيني باستخدام محلول 1 M NaOH.
- ماصة 250 ميكرولتر من تعليق حبة ConA-Sepharose في أنبوب طرد مركزي دقيق سعة 1.5 مل. أجهزة الطرد المركزي محتويات في 10000 × غرام لمدة 30 ثانية عند 4 درجات مئوية. تخلص من المادة الطافية.
ملاحظة: هناك حاجة إلى 250 ميكرولتر من حبات ConA-Sepharose في أنبوب طرد مركزي دقيق سعة 1.5 مل لكل تركيز أميلوبكتين يستخدم في الفحص. - أضف 750 ميكرولتر من المخزن المؤقت للربط إلى كل أنبوب يحتوي على 250 ميكرولتر من حبات ConA-Sepharose. أجهزة الطرد المركزي الأنابيب في 10000 × غرام لمدة 1 دقيقة عند 4 درجات مئوية. إزالة الطاف. كرر هذه الخطوة 2x للتأكد من غسل الخرزات بشكل مناسب وتوازنها مع المخزن المؤقت للربط.
2. إعداد حلول الأميلوبكتين
- اصنع محلول مرق من 10 مجم / مل من أميلوبكتين البطاطس. الأميلوبكتين غير قابل للذوبان في الماء ويمكن إذابته بالحرارة. للذوبان ، أضف 0.1 غرام من أميلوبكتين البطاطس إلى 10 مل من الماء المقطر. سخني المعلق في حمام مائي على حرارة 80 درجة مئوية لمدة 1 ساعة أو حتى يختفي المحلول من الغيوم.
- اسمح للمحلول بالعودة إلى درجة حرارة الغرفة (RT) ، مع الدوامة المتكررة لتجنب التكتل.
- العلاج القلوي للكحول هو طريقة بديلة لإذابة ركائز الأميلوبكتين. للذوبان باستخدام هذه الطريقة ، اتبع الخطوات أدناه.
- تعليق 0.5 غرام من الركيزة أميلوبكتين في 5 مل من الإيثانول 20 ٪ و 5 مل من 2 M هيدروكسيد الصوديوم. حرك المحتويات بقوة لمدة 15-20 دقيقة في RT.
- بعد ذلك ، أضف 10 مل من الماء ، واضبط الرقم الهيدروجيني للمحلول إلى 6.5 بإضافة 2 M HCl. ارفع حجم المحلول الناتج إلى 50 مل بالماء المقطر لعمل محلول أميلوبكتين 10 مجم / مل.
- قم بتخفيف محلول الأميلوبكتين المذاب 10 مجم / مل لعمل سلسلة من 2 مل من محاليل الأميلوبكتين المخففة. على سبيل المثال ، قم بإجراء تخفيفات نصف 10 مجم / مل لإعداد سلسلة من تركيزات الأميلوبكتين (5 مجم / مل ، 2.5 مجم / مل ، 1.25 مجم / مل ، 0.625 مجم / مل ، 0.3125 مجم / مل ، 0.156 مجم / مل ، 0.078 مجم / مل ، 0.039 مجم / مل ، 0.019 مجم / مل ، و 0 مجم / مل).
3. إعداد ConA-Sepharose: حبات الأميلوبكتين
- أضف 250 ميكرولتر من كل محلول أميلوبكتين مخفف إلى أنابيب طرد مركزي دقيقة سعة 1.5 مل تحتوي على 250 ميكرولتر من حبات ConA-Sepharose المتوازنة مسبقا في مخزن مؤقت ملزم. خلط المحتويات جيدا. قم بتسمية الأنابيب بتركيز الأميلوبكتين المقابل.
- احتضان المحتويات على عجلة دوارة عند 4 درجات مئوية لمدة 30 دقيقة.
ملاحظة: لا يوجد أي تغيير في ConA-Sepharose: مركب مرتبط بالأميلوبكتين بمرور الوقت بعد 20 دقيقة. تم اختيار وقت الحضانة البالغ 30 دقيقة من خلال أوقات حضانة متفاوتة من 10 دقائق إلى 1 ساعة لضمان الوصول إلى التوازن. - أجهزة الطرد المركزي الأنابيب في 10000 × غرام لمدة 1 دقيقة. اجمع المادة الطافية في أنبوب طرد مركزي صغير سعة 1.5 مل تم تسميته حديثا. احفظ هذه الأجزاء الطافية لإجراء مقايسة الجلوكوزD 12 (التحلل المائي الحمضي للأميلوبكتين متبوعا بتحديد الجلوكوز بالأشعة فوق البنفسجية عن طريق الفحص الأنزيمي). هذه الخطوة ضرورية لضمان ارتباط كل الأميلوبكتين بالخرز.
- أضف 750 ميكرولتر من المخزن المؤقت للربط إلى ConA-Sepharose: حبات الأميلوبكتين. أجهزة الطرد المركزي الأنابيب في 10000 × غرام لمدة 1 دقيقة. تخلص من المادة الطافية لإزالة أي جزيئات أميلوبكتين غير مرتبطة.
- كرر الخطوة 3.4 لضمان الغسيل الكافي. يحتوي كل أنبوب الآن على حبات ConA-Sepharose مرتبطة بكميات متفاوتة من ركائز الأميلوبكتين.
4. احتضان SEX4 مع ConA-Sepharose: حبات الأميلوبكتين
- امزج 250 ميكرولتر من ConA-Sepharose: حبات الأميلوبكتين مع 100 ميكرولتر من المخزن المؤقت المرتبط الذي يتضمن 10 ميكروغرام من بروتين SEX4 ، و 10 مللي مول ديثيوثريتول (DTT) ، و 10 ميكرومتر كوكتيل مثبط الأنزيم البروتيني (PIC). لاحظ أن الحجم الكلي في كل أنبوب هو 350 ميكرولتر.
ملاحظة: يضاف كوكتيل مثبط الأنزيم البروتيني كخطوة احترازية لتجنب أي تدهور غير ضروري ل SEX4. هذه خطوة اختيارية. في هذا الفحص ، يتم استخدام البروتين المؤتلف Arabidopsis thaliana SEX4 (AtSEX4). يحتوي البروتين المنقى على علامة الهستيدين N-terminal اللازمة للكشف عن البروتين عن طريق التلألؤ الكيميائي. تم وصف معلومات مفصلة عن تنقية الفوسفاتيز الجلوكان في المنشورات السابقة14،20،24. - احتضان البروتين و ConA-Sepharose: تعليق حبة الأميلوبكتين عند 4 درجات مئوية لمدة 45 دقيقة مع دوران لطيف.
ملاحظة: يتم اختيار وقت الحضانة البالغ 45 دقيقة لضمان الوصول إلى التوازن للمجمع. - أجهزة الطرد المركزي الأنابيب في 10000 × غرام لمدة 1 دقيقة. ماصة 50 ميكرولتر من المادة الطافية بعناية باستخدام طرف تحميل هلام في أنبوب طرد مركزي دقيق جديد سعة 1.5 مل. أضف 20 ميكرولتر من صبغة SDS-PAGE 4x و 10 ميكرولتر من الماء إلى كل أنبوب يحتوي على 50 ميكرولتر من الكسور الطافية التي تم جمعها. سخني العينات على حرارة 95 درجة مئوية لمدة 10 دقائق. حفظ هذه العينات لتشغيل المواد الهلامية SDS-PAGE. تأكد من أن 10 أنابيب جديدة تحمل علامة "طافية (S)" تحتوي على تركيزات الركيزة المقابلة.
- أضف 750 ميكرولتر من المخزن المؤقت للربط إلى ConA-Sepharose: حبات الأميلوبكتين: SEX4 لإزالة أي بروتين غير منضم من الخرزات. أجهزة الطرد المركزي الأنابيب في 10000 × غرام لمدة 1 دقيقة. كرر هذه الخطوة مرة أخرى لضمان الغسيل المناسب. تخلص من المادة الطافية.
- أضف 20 ميكرولتر من صبغة 4x SDS-PAGE و 80 ميكرولتر من الماء المقطر في الأنابيب التي تحتوي على ConA-Sepharose المغسول: أميلوبكتين: حبات SEX4. تسخين العينات في 95 درجة مئوية لمدة 10 دقائق وأجهزة الطرد المركزي في 10000 × غرام لمدة 1 دقيقة.
- تخلص من الحبيبات واحفظ المادة الطافية لتشغيل المواد الهلامية SDS-PAGE. ماصة 80 ميكرولتر من المادة الطافية في أنابيب جديدة وتسميتها "بيليه (P)".
5. تشغيل المواد الهلامية SDS-PAGE
- قم بتحميل 40 ميكرولتر من عينات البروتين غير المنضمة (المصنوعة في الخطوة 2.3 ، المسمى S) في آبار جل بولي أكريلاميد مسبقة الصب بنسبة 4٪ -12٪ من أدنى تركيز للركيزة إلى أعلى تركيز ، ولكن احتفظ بالممر الأول خاليا لتحميل علامة الوزن الجزيئي للبروتين. استخدم هلاما ثانيا لتحميل 10 عينات بروتين مرتبطة مصنوعة في الخطوة 2.5 (المسمى P).
- أضف مخزن مؤقت تشغيل 1x SDS-PAGE معد حديثا إلى غرفتي الجهاز. قم بتشغيل الجل على حرارة 150 فولت لمدة 35 دقيقة أو حتى تصل مقدمة الصبغة إلى قاع الجل.
- قم بإزالة جل التشغيل من الجهاز وإزالة الفواصل والألواح الزجاجية. استخدم الجل المنفصل لإجراء تحليل اللطخة الغربية.
6. النشاف الغربي للكشف عن التلألؤ الكيميائي14,15
ملاحظة: يمكن تعديل / تكييف هذه الطريقة بسهولة اعتمادا على معدات النشاف الغربية التي يمتلكها المستخدمون في مختبراتهم.
- اصنع 1 لتر من المخزن المؤقت للنقل يحتوي على 5.8 جم من قاعدة Tris ، و 2.9 جم من الجلايسين ، و 0.37 جم من SDS ، و 200 مل من الميثانول.
- نقل البروتينات المفصولة الحجم من هلام بولي أكريلاميد إلى غشاء النيتروسليلوز. قم بتجميع الإسفنج وأوراق الترشيح والهلام وغشاء النيتروسليلوز لفترة وجيزة وفقا لبروتوكول النقل الغربي14،15. تشغيل في 70 فولت لمدة 1 ساعة.
- لمنع ارتباط البروتين غير النوعي ، احتضان غشاء النيتروسليلوز الذي يحتوي على محلول البروتين من 1٪ -5٪ ألبومين مصل البقر (BSA) أو بروتين الحليب في 50 مل من المخزن المؤقت TBST (20 mM Tris [pH 7.5] ، 150 mM NaCl ، 0.1٪ Tween 20) لمدة 1 ساعة. اغسل الغشاء 3x باستخدام المخزن المؤقت TBST لإزالة أي محلول حظر غير منضم.
- احتضان الغشاء بجسم مضاد مرتبط ببيروكسيديز الفجل (HRP) خاص بالبروتين الموسوم به لمدة 1 ساعة. اغسل الغشاء 3x في المخزن المؤقت TBST لإزالة أي أجسام مضادة غير منضمة. استخدم تخفيفا بنسبة 1: 2000 من الجسم المضاد ل TBST للحصول على التكاثر والحساسية المثلى.
- يرتبط الجسم المضاد المرتبط بإنزيم HRP على وجه التحديد بعلامة الهستيدين لبروتين SEX4 ، والتي تنتج شريطا في وجود كواشف التلألؤ الكيميائي. للتصوير الرقمي ، اصنع محلولا لأجزاء متساوية من محاليل الركيزة الكيميائية (750 ميكرولتر لكل منهما) في أنبوب سعة 1.5 مل. احتضان الغشاء لمدة 5 دقائق على الأقل في المحلول.
- ضع جانب البروتين الغشائي لأسفل على ماسح اللطخة وقم بتشغيل برنامج الاستحواذ لتحديد كمية البروتين في كل من الكسور الحبيبية والطافية.
7. تحليل البيانات
- قم بإجراء قياسات الإشارة الكمية باستخدام برنامج الاستحواذ مع ماسح اللطخة. تطبيع جميع القياسات الكمية في الأجزاء الطافية والحبيبات إلى إجمالي البروتين المحمل.
ملاحظة: يسمح البرنامج بتحديد شدة كل شريط بروتين في كسور الطافية والحبيبات. - في تجربة الربط المشبع، ارسم النسبة المئوية لتركيز البروتين المرتبط مقابل تركيز الأميلوبكتين. قم بملاءمة البيانات مع Y = Bmax x X / (K D + X) ، باستخدام برنامج تحليل البيانات لحساب KD.
ملاحظة: Bmax هو الحد الأقصى للربط المحدد ، والمحور Y هو النسبة المئوية للبروتين المرتبط ، والمحور X هو تركيز الأميلوبكتين.
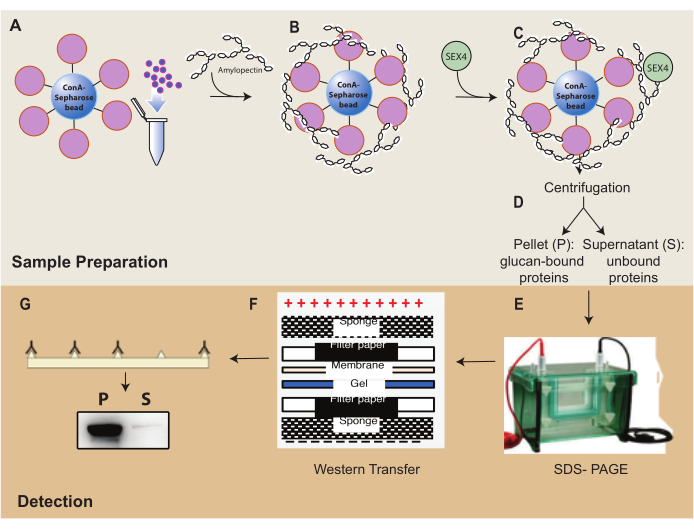
الشكل 1: نظرة عامة على سير عمل مقايسة ترسيب ConA-Sepharose . (أ) تحضير حبات ConA-Sepharose. ب: الحضانة مع ركيزة الأميلوبكتين. ج: الحضانة ببروتين SEX4. د: فصل أجزاء البروتين المربوطة وغير المرتبطة عن طريق الطرد المركزي. (ه) فصل البروتين من خلال SDS-PAGE. (و) تحليل اللطخة الغربية. (ز) الكشف عن التلألؤ الكيميائي لبروتين SEX4 الموسوم به. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
واحدة من السمات الرئيسية لعائلة بروتينات الفوسفاتيز الجلوكان هي قدرتها على الارتباط بركائز الجلوكان. أولا ، تم تحليل قدرة ربط SEX4 ب ConA-Sepharose: حبات الأميلوبكتين باستخدام SDS-PAGE (الشكل 2A). كان ألبومين مصل الأبقار (BSA) بمثابة عنصر تحكم سلبي للكشف عن أي ارتباط غير محدد للبروتينات ب?...
Discussion
توضح هذه الدراسة التطور الناجح لمقايسة ترسيب جديدة في المختبر تسمح بتحديد تقارب الارتباط لتفاعلات الفوسفاتيز الجلوكان والجلوكان. يستفيد تصميم الفحص من الارتباط المحدد لليكتين كونا بالجلوكان عبر بقايا هيدروكسيل الجلوكوز لالتقاط ركائز الكربوهيدرات القابلة للذوبان بشكل غير مب?...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذه الدراسة من قبل جائزة المؤسسة الوطنية للعلوم MCB-2012074. يشكر المؤلفون الدكتور كريج دبليو فاندر كوي من قسم الكيمياء الحيوية والبيولوجيا الجزيئية بجامعة فلوريدا على المناقشات والدعم القيمين. كما يشكر المؤلفون الدكتور ماثيو س. جينتري من قسم الكيمياء الحيوية والبيولوجيا الجزيئية بجامعة فلوريدا على دعمه. نود أن نشكر الدكتورة سارة لاجالوار ، رئيسة برنامج علم الأعصاب في كلية سكيدمور ، على السماح لنا باستخدام ماسح اللطخة LICOR C-digit لتصوير البقع الغربية.
Materials
| Name | Company | Catalog Number | Comments |
| 6x-His Tag monoclonal antibody (HIS.H8), HRP | Therm Fisher Scientific | MA1-21315-HRP | |
| Biorad gel electrophoresis and Western blot kit | Biorad | 1703930 | |
| Calcium chloride | Sigma-Aldrich | 208291 | |
| C-Digit blot scanner | LICOR | 3600-00 | Blot scanner |
| Complete protease inhibitor cocktail | Sigma-Aldrich | 11836170001 | |
| Concanavalin A-sepharose beads | Sigma-Aldrich | C9017 | This product contains in 0.1 M acetate buffer, pH 6, containing 1 M NaCl, 1 mM CaCl2, 1 mM MnCl2, and 1 mM MgCl2 in 20% ethanol |
| Centrifuge | Eppendorf | 5425R | |
| Glycine | Fisher Scientific | BP381-5 | |
| GraphPad Prism 8.0 software | GraphPad | Version 8.0 | Data analysis software |
| HEPES | Sigma-Aldrich | H8651 | |
| Image Studio | LICOR | 3600-501 | Acquisition Software |
| Magnesium chloride | Sigma-Aldrich | M2670 | |
| Methanol | Fisher Scientific | A452SK-4 | |
| Sodium dodecyl sulfate | Fisher Scientific | PI28312 | |
| Potato amylopectin | Sigma-Aldrich | A8515 | |
| Precast SDSPAGE Gels | Genscript | M00653S | |
| Tris base | Fisher Scientific | BP154-1 | |
| Tween 20 | Fisher Scientific | MP1TWEEN201 | |
| Westernsure premium chemiluminescence substrate | LI-COR | 926-95000 |
References
- Meekins, D. A., Vander Kooi, C. W., Gentry, M. S. Structural mechanisms of plant glucan phosphatases in starch metabolism. The FEBS Journal. 283 (13), 2427-2447 (2016).
- Gentry, M. S., et al. The phosphatase laforin crosses evolutionary boundaries and links carbohydrate metabolism to neuronal disease. The Journal of Cell Biology. 178 (3), 477-488 (2007).
- Worby, C. A., Gentry, M. S., Dixon, J. E. Laforin, a dual specificity phosphatase that dephosphorylates complex carbohydrates. The Journal of Biological Chemistry. 281 (41), 30412-30418 (2006).
- Gentry, M. S., Pace, R. M. Conservation of the glucan phosphatase laforin is linked to rates of molecular evolution and the glucan metabolism of the organism. BMC Evolutionary Biology. 9, 138 (2009).
- Niittyla, T., et al. Similar protein phosphatases control starch metabolism in plants and glycogen metabolism in mammals. The Journal of Biological Chemistry. 281 (17), 11815-11818 (2006).
- Kotting, O., et al. STARCH-EXCESS4 is a laforin-like Phosphoglucan phosphatase required for starch degradation in Arabidopsis thaliana. The Plant Cell. 21 (1), 334-346 (2009).
- Comparot-Moss, S., et al. A putative phosphatase, LSF1, is required for normal starch turnover in Arabidopsis leaves. Plant Physiology. 152 (2), 685-697 (2010).
- Zeeman, S. C., Northrop, F., Smith, A. M., Rees, T. A starch-accumulating mutant of Arabidopsis thaliana deficient in a chloroplastic starch-hydrolysing enzyme. The Plant Journal: For Cell and Molecular Biology. 15 (3), 357-365 (1998).
- Kotting, O., et al. Identification of a novel enzyme required for starch metabolism in Arabidopsis leaves. The phosphoglucan, water dikinase. Plant Physiology. 137 (1), 242-252 (2005).
- Tagliabracci, V. S., et al. Laforin is a glycogen phosphatase, deficiency of which leads to elevated phosphorylation of glycogen in vivo. Proceedings of the National Academy of Sciences. 104 (49), 19262-19266 (2007).
- Gentry, M. S., Guinovart, J. J., Minassian, B. A., Roach, P. J., Serratosa, J. M. Lafora disease offers a unique window into neuronal glycogen metabolism. The Journal of Biological Chemistry. 293 (19), 7117-7125 (2018).
- Brewer, M. K., et al. Targeting pathogenic lafora bodies in lafora disease using an antibody-enzyme fusion. Cell Metabolism. 30 (4), 689-705 (2019).
- Santelia, D., Zeeman, S. C. Progress in Arabidopsis starch research and potential biotechnological applications. Current Opinion in Biotechnology. 22 (2), 271-280 (2011).
- Raththagala, M., et al. Structural mechanism of laforin function in glycogen dephosphorylation and lafora disease. Molecular Cell. 57 (2), 261-272 (2015).
- Meekins, D. A., et al. Phosphoglucan-bound structure of starch phosphatase Starch Excess4 reveals the mechanism for C6 specificity. Proceedings of the National Academy of Sciences. 111 (20), 7272-7277 (2014).
- Vander Kooi, C. W., et al. Structural basis for the glucan phosphatase activity of Starch Excess4. Proceedings of the National Academy of Sciences. 107 (35), 15379-15384 (2010).
- Meekins, D. A., et al. Structure of the Arabidopsis glucan phosphatase like sex four2 reveals a unique mechanism for starch dephosphorylation. The Plant Cell. 25 (6), 2302-2314 (2013).
- Smith, A. M., Zeeman, S. C. Starch: A flexible, adaptable carbon store coupled to plant growth. Annual Review of Plant Biology. 71, 217-245 (2020).
- Jane, J., Kasemuwan, T., Chen, J. F., Juliano, B. O. Phosphorus in rice and other starches. Cereal Foods World. 41 (11), 827-832 (1996).
- Mak, C. A., et al. Cooperative kinetics of the glucan phosphatase starch excess4. Biochemistry. 60 (31), 2425-2435 (2021).
- Campbell, K. P., MacLennan, D. H. Purification and characterization of the 53,000-dalton glycoprotein from the sarcoplasmic reticulum. The Journal of Biological Chemistry. 256 (9), 4626-4632 (1981).
- Campbell, K. P., MacLennan, D. H., Jorgensen, A. O., Mintzer, M. C. Purification and characterization of calsequestrin from canine cardiac sarcoplasmic reticulum and identification of the 53,000 dalton glycoprotein. The Journal of Biological Chemistry. 258 (2), 1197-1204 (1983).
- Davey, M. W., Sulkowski, E., Carter, W. A. Binding of human fibroblast interferon to concanavalin A-agarose. Involvement of carbohydrate recognition and hydrophobic interaction. Biochemistry. 15 (3), 704-713 (1976).
- Meekins, D. A., et al. Mechanistic insights into glucan phosphatase activity against polyglucan substrates. The Journal of Biological Chemistry. 290 (38), 23361-23370 (2015).
- Wilkens, C., et al. Plant α-glucan phosphatases SEX4 and LSF2 display different affinity for amylopectin and amylose. FEBS Letters. 590 (1), 118-128 (2016).
- Atanasova, M., Bagdonas, H., Agirre, J. Structural glycobiology in the age of electron cryo-microscopy. Current Opinion in Structural Biology. 62, 70-78 (2020).
- Doyle, M. L. Characterization of binding interactions by isothermal titration calorimetry. Current Opinion in Biotechnology. 8 (1), 31-35 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved