A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Concanavalin A מבוסס Sedimentation Assay למדידת קשירת המצע של פוספטאז גלוקני
* These authors contributed equally
In This Article
Summary
שיטה זו מתארת בדיקת שיקוע חוץ גופית מבוססת לקטין כדי לכמת את זיקת הקישור של פוספטאז גלוקן ועמילופקטין. בדיקת שקיעה משותפת זו אמינה למדידת קשירת מצע גלוקן פוספטאז וניתן ליישם אותה על מצעים גלוקניים מסיסים שונים.
Abstract
פוספטזות גלוקניות שייכות למשפחה הגדולה יותר של פוספטזות בעלות סגוליות כפולה (DSP) אשר מנטרלות מצעי גלוקן, כגון גליקוגן בבעלי חיים ועמילן בצמחים. המבנים הגבישיים של פוספטאז גלוקן עם מצעי גלוקן מודל חושפים ממשקים קושרי גלוקן נפרדים העשויים מתחומי DSP וקשירת פחמימות. עם זאת, מדידות כמותיות של אינטראקציות גלוקן-גלוקן פוספטאז עם מצעים רלוונטיים מבחינה פיזיולוגית הן בסיסיות להבנה הביולוגית של משפחת האנזימים גלוקן פוספטאז ולוויסות חילוף החומרים של אנרגיה. כתב יד זה מדווח על בדיקת שיקוע חוץ גופית מבוססת Concanavalin A (ConA) שנועדה לזהות את זיקת קשירת המצע של פוספטזות גלוקניות כנגד מצעים גלוקניים שונים. כהוכחת היתכנות, נקבע קבוע הדיסוציאציה (KD) של גלוקן פוספטאז Arabidopsis thaliana עמילן עודף4 (SEX4) ועמילופקטין נקבע. האפיון של מוטנטים SEX4 וחברים אחרים במשפחת האנזימים גלוקן פוספטאז מדגים עוד יותר את התועלת של בדיקה זו כדי להעריך את הקישור הדיפרנציאלי של אינטראקציות חלבון-פחמימות. נתונים אלה מדגימים את התאמתו של מחקר זה לאפיון מגוון רחב של חלבונים המקיימים אינטראקציה עם עמילן וגליקוגן.
Introduction
פוספטזות גלוקניות שייכות לתת-משפחה מגוונת מבחינה תפקודית של פוספטזות ספציפיות כפולה (DSPs) בתוך משפחת העל של החלבון טירוזין פוספטאז (PTP)1. הם נמצאו ברוב צורות החיים, כולל אורגניזמים פוטוסינתטיים שונים מאוד, בני אדם, בעלי חוליות, וכמה חסרי חוליות ופרוטיסטים 2,3,4. צמחים מכילים שלושה פוספטזים גלוקניים ידועים: עודפי עמילן4 (SEX4), כמו מין ארבע1 (LSF1), וכמו מין ארבע2 (LSF2)5,6,7. צמחים חסרי פוספטאז גלוקני מציגים שיעורים מופחתים של פירוק עמילן חולף והצטברות של עמילן בעלים 8,9. Laforin הוא החבר המייסד של משפחת phosphatase גלוקן כי dephosphorylates גליקוגן בחולייתנים ובני אדם 3,10. המוטציות של לאפורין גורמות למחלת לפורה נוירודגנרטיבית, צורה אוטוזומלית רצסיבית קטלנית של אפילפסיה11. פוספטזות גלוקן נחוצות למטבוליזם של גליקוגן ועמילן, והתגלו כאנזימים חשובים לוויסות תכולת העמילן בצמחים ולטיפול במחלת לפורה ניוונית12,13. מחקרי קריסטלוגרפיה בקרני רנטגן שנערכו לאחרונה על פוספטזות גלוקניות עם מצעי גלוקן מודל שפכו אור על קשירת המצע והמנגנון הקטליטי של זרחן גלוקני14,15,16,17. עם זאת, ההבנה הנוכחית של האופן שבו פוספטזים גלוקניים נקשרים למצעים הפיזיולוגיים שלהם אינה שלמה.
עמילן הוא פולימר בלתי מסיס של גלוקוז העשוי מ-80%-90% עמילופקטין ו-10%-20% עמילוז18. המצע לפוספטזות גלוקן צמחיות הוא מולקולות פחמימות זרחניות, כגון גרגרי גליקוגן ועמילן. שאריות הגלוקוזיל הזרחניות נמצאות ביחס שאריות פוספט:גלוקוזיל של 1:600. מעניין, פוספטים נמצאים רק על מולקולות עמילופקטין19. הצמח העיקרי גלוקן phosphatase SEX4 פועל על גרגיר עמילן כדי dephosphorylate עמילופקטין מולקולות. המבנה הגבישי של קרני רנטגן של SEX4 בשילוב עם מחקרי מוטגנזה מונחי מבנה הדגימו את ייחודיות המצע הייחודי של SEX4 עבור מיקומים שונים בתוך מבנה גלוקן15. לאחרונה הראינו כי ניתן לצפות בפעילות הרלוונטית ביולוגית של SEX4 רק כאשר פועלים על מצעי העמילופקטין המסיסים שלו20. עם זאת, הבנת אינטראקציות גלוקן-SEX4 הוכחה כקשה בשל המורכבות המבנית של המצע, ספציפיות קישור רחבה יותר וזיקות קישור נמוכות בין החלבון למצעים שלו. בעיות אלה פגעו ביכולת להשתמש בשיטות הנפוצות באינטראקציות חלבון-ליגנד, כגון קלורימטריית טיטרציה איזותרמית (ITC), ספקטרוסקופיית תהודה מגנטית גרעינית (NMR) ובדיקות מבוססות אנזימים מקושרים לאימונוסורבנט (ELISA).
באופן מעניין, חלק גדול מההבנה שלנו של אינטראקציות בין פחמימות לחלבונים הגיע ממחקר של לקטינים. Concanavalin A (ConA) היא משפחת קטניות לקטין של חלבונים שהופקו במקור משעועית הג'ק. ConA קושר פחמימות עם ספציפיות גבוהה, וזה יתרון לשימוש בו ביישומי מיקוד סמים ומשלוח. הקישור של ConA למגוון מצעים המכילים α-D-מנוסיל ו-α-D-גלוקוזיל לא מפחיתים נחקר בהרחבה19,20. חרוזי ספרוז הקשורים ל- ConA זמינים באופן מסחרי משמשים בדרך כלל לטיהור גליקופרוטאינים וגליקוליפידים21. ConA נקשר לגלוקנים אלה באמצעות קבוצות הידרוקסיל C3, C4 ו-C6 של שאריות הגלוקוז. חרוזי ConA-Sepharose שימשו בהצלחה גם למדידת הקישור של אינטראקציות גליקוגן-חלבון ועמילן-חלבון22,23. במחקר זה השתמשנו בחרוזי ConA-Sepharose כדי לפתח בדיקת קישור למדידת תכונות הקישור של אינטראקציות גלוקן פוספטאז-עמילופקטין.
בעבר, נעשה שימוש בבדיקת שיקוע מבוססת ConA כדי להעריך את יכולת הקישור של מצע גלוקן פוספטאז 14,20,24. במחקר זה, אותה אסטרטגיה שימשה לפיתוח שיטה חדשנית לקביעת הזיקה הקושרת של אינטראקציות גלוקן-גלוקן פוספטאז ופחמימות. לשיטה זו יש גם יתרון בחקירת אינטראקציות שונות של פחמימות-חלבונים מסיסים.
Protocol
1. הכנת חרוזי ConA-Sepharose
- צור 250 מ"ל של מאגר מחייב המכיל 67 mM HEPES (pH 7.5), 10 mM MgCl 2 ו- 0.2 mM CaCl2. כוונן את רמת החומציות באמצעות תמיסת 1 M NaOH.
- פיפטה 250 μL של תרחיף חרוזי ConA-Sepharose לתוך צינור מיקרוצנטריפוגה 1.5 מ"ל. צנטריפוגה את התוכן ב 10,000 x גרם במשך 30 שניות ב 4 ° C. השליכו את הסופרנטנט.
הערה: 250 μL של חרוזי ConA-Sepharose בצינור מיקרוצנטריפוגה של 1.5 מ"ל נדרש עבור כל ריכוז עמילופקטין המשמש לבדיקה. - הוסף 750 μL של חיץ הקישור לכל צינור המכיל 250 μL של חרוזי ConA-Sepharose. צנטריפוגה את הצינורות ב 10,000 x גרם במשך 1 דקות ב 4 ° C. הסר את supernatant. חזור על שלב זה 2x כדי לוודא שהחרוזים נשטפים כראוי ומאוזנים עם מאגר הקשירה.
2. הכנת פתרונות עמילופקטין
- הפוך פתרון מלאי של 10 מ"ג / מ"ל עמילופקטין תפוחי אדמה. עמילופקטין אינו מסיס במים וניתן להמיס אותו בחום. כדי להמיס, להוסיף 0.1 גרם של עמילופקטין תפוחי אדמה ל 10 מ"ל של מים מזוקקים. מחממים את התרחיף באמבט מים ב 80 מעלות צלזיוס למשך שעה או עד שהפתרון כבר לא מעונן.
- אפשרו לתמיסה לחזור לטמפרטורת החדר (RT), עם מערבולות חוזרות ונשנות כדי למנוע היווצרות גושים.
- טיפול אלכוהול-אלקליין הוא שיטה חלופית למסיסים מצעי עמילופקטין. כדי להמיס בשיטה זו, בצע את השלבים הבאים.
- להשהות 0.5 גרם של מצע עמילופקטין ב 5 מ"ל של 20% אתנול ו 5 מ"ל של 2 M NaOH. ערבבו את התוכן במרץ במשך 15-20 דקות ב-RT.
- לאחר מכן, הוסף 10 מ"ל מים, והתאם את ה- pH של התמיסה ל -6.5 על ידי הוספת 2 M HCl. העלה את נפח התמיסה המתקבלת ל -50 מ"ל עם מים מזוקקים כדי ליצור תמיסת עמילופקטין 10 מ"ג / מ"ל.
- לדלל את תמיסת עמילופקטין מסיס 10 מ"ג / מ"ל כדי ליצור סדרה של 2 מ"ל של תמיסות עמילופקטין מדולל. לדוגמה, בצע חצי דילול של 10 מ"ג/מ"ל להכנת סדרה של ריכוזי עמילופקטין (5 מ"ג/מ"ל, 2.5 מ"ג/מ"ל, 1.25 מ"ג/מ"ל, 0.625 מ"ג/מ"ל, 0.3125 מ"ג/מ"ל, 0.156 מ"ג/מ"ל, 0.078 מ"ג/מ"ל, 0.039 מ"ג/מ"ל, 0.019 מ"ג/מ"ל ו-0 מ"ג/מ"ל).
3. הכנת ConA-Sepharose: חרוזי עמילופקטין
- הוסף 250 μL של כל תמיסת עמילופקטין מדוללת לצינורות מיקרוצנטריפוגות של 1.5 מ"ל המכילות 250 μL של חרוזי ConA-Sepharose שקולים מראש במאגר קשירה. מערבבים היטב את התכולה. תייגו את הצינורות עם ריכוז העמילופקטין המתאים.
- יש לדגור על התכולה על גלגל מסתובב בטמפרטורה של 4°C למשך 30 דקות.
הערה: אין שינוי בקומפלקס ConA-Sepharose:עמילופקטין לאורך זמן לאחר 20 דקות. זמן הדגירה של 30 דקות נבחר על ידי זמני דגירה משתנים מ-10 דקות עד שעה כדי להבטיח הגעה לשיווי משקל. - צנטריפוגה את הצינורות ב 10,000 x גרם במשך 1 דקה. אספו את הסופרנאטנט בצינור מיקרוצנטריפוגה חדש בנפח 1.5 מ"ל. שמור שברים סופרנטנטיים אלה כדי לבצע בדיקת גלוקוז D12 (הידרוליזה חומצית של עמילופקטין ואחריה קביעת UV של גלוקוז באמצעות בדיקה אנזימטית). שלב זה נחוץ כדי להבטיח שכל העמילופקטין קשור לחרוזים.
- הוסף 750 μL של חיץ קשירה לחרוזי ConA-Sepharose:amylopectin. צנטריפוגה את הצינורות ב 10,000 x גרם במשך 1 דקה. השליכו את הסופרנאטנט כדי להסיר מולקולות עמילופקטין לא קשורות.
- חזור על שלב 3.4 כדי להבטיח שטיפה מספקת. כל צינור מכיל כעת חרוזי ConA-Sepharose הקשורים לכמויות משתנות של מצעי עמילופקטין.
4. דגירה SEX4 עם ConA-Sepharose:חרוזי עמילופקטין
- ערבבו 250 μL של ConA-Sepharose:חרוזי עמילופקטין עם 100 μL של מאגר הקישור הכולל 10 מיקרוגרם של חלבון SEX4, 10 mM dithiothreitol (DTT), וקוקטייל מעכב פרוטאז 10 μM (PIC). שים לב שהנפח הכולל בכל צינור הוא 350 μL.
הערה: קוקטייל מעכב פרוטאז מתווסף כאמצעי זהירות כדי למנוע השפלה מיותרת של SEX4. זהו צעד אופציונלי. בבדיקה זו, חלבון רקומביננטי Arabidopsis thaliana SEX4 (AtSEX4) משמש. החלבון המטוהר מכיל תג היסטידין N-terminal הדרוש לזיהוי החלבון באמצעות כימילומינסנציה. מידע מפורט על טיהור פוספטאז גלוקן מתואר בפרסומים קודמים14,20,24. - לדגור על החלבון ו- ConA-Sepharose:תרחיף חרוזי עמילופקטין ב 4 ° C למשך 45 דקות עם סיבוב עדין.
הערה: זמן הדגירה של 45 דקות נבחר כדי להבטיח הגעה לשיווי משקל עבור המתחם. - צנטריפוגה את הצינורות ב 10,000 x גרם במשך 1 דקה. פיפטה 50 μL של supernatant בזהירות באמצעות קצה העמסת ג'ל לתוך צינור מיקרוצנטריפוגה חדש 1.5 מ"ל. הוסף 20 μL של צבע 4x SDS-PAGE ו 10 μL של מים לכל צינור המכיל 50 μL של שברים supernatant שנאספו. חממו את הדגימות בטמפרטורה של 95°C למשך 10 דקות. שמור דוגמאות אלה להפעלת ג'לים SDS-PAGE. ודא של-10 צינורות חדשים המסומנים כ"סופרנאטנט (S)" יש את ריכוזי המצע המתאימים.
- הוסף 750 μL של חיץ הקישור ל- ConA-Sepharose:amylopectin: SEX4 חרוזים כדי להסיר כל חלבון לא קשור מהחרוזים. צנטריפוגה את הצינורות ב 10,000 x גרם במשך 1 דקה. חזור על שלב זה פעם נוספת כדי להבטיח כביסה נאותה. השליכו את הסופרנטנט.
- הוסף 20 μL של צבע 4x SDS-PAGE ו 80 μL של מים מזוקקים לתוך צינורות המכילים שטף ConA-Sepharose:amylopectin:SEX4 חרוזים. חממו את הדגימות בטמפרטורה של 95°C למשך 10 דקות ואת הצנטריפוגה בטמפרטורה של 10,000 x g למשך דקה אחת.
- השליכו את הגלולה ושמרו את הסופרנאטנט להפעלת ג'ל SDS-PAGE. פיפטה 80 μL של supernatant לתוך צינורות חדשים ולתייג אותם כמו "גלולה (P)".
5. הפעלת ג'לים SDS-PAGE
- טען 40 μL של דגימות חלבון לא קשורות (שנעשו בשלב 2.3, מסומן S) לתוך בארות ג'ל פוליאקרילאמיד precast 4%-12% מריכוז המצע הנמוך ביותר לגבוה ביותר, אך שמור על הנתיב הראשון פנוי כדי לטעון את סמן המשקל המולקולרי של החלבון. השתמש בג'ל שני כדי לטעון 10 דגימות חלבון קשורות שנעשו בשלב 2.5 (מסומן כ- P).
- הוסף מאגר ריצה 1x SDS-PAGE טרי שהוכן לשני תאי המנגנון. יש להפעיל את הג'ל במתח של 150 וולט למשך 35 דקות או עד שחזית הצבע מגיעה לתחתית הג'ל.
- מוציאים את ג'ל הריצה מהמכשיר ומסירים את הספייסרים וצלחות הזכוכית. השתמש בג'ל המופרד כדי לבצע ניתוח כתם מערבי.
6. כתם מערבי לזיהוי כימילומינסנציה14,15
הערה: ניתן לשנות/להתאים שיטה זו בקלות בהתאם לציוד ההדבקה המערבי שיש למשתמשים במעבדות שלהם.
- צור 1 ליטר של מאגר העברה המכיל 5.8 גרם בסיס טריס, 2.9 גרם גליצין, 0.37 גרם SDS ו-200 מ"ל מתנול.
- העבירו את החלבונים המופרדים בגודל מג'ל הפוליאקרילאמיד לקרום ניטרוצלולוז. הרכיבו בקצרה את הספוגים, ניירות הסינון, הג'ל וקרום הניטרוצלולוז על פי פרוטוקול העברה מערבי14,15. הפעל ב 70 V במשך 1 שעות.
- כדי למנוע קשירת חלבונים לא ספציפית, דגרו על קרום הניטרוצלולוז המכיל את תמיסת החלבון של אלבומין בסרום בקר (BSA) 1%-5% או חלבון חלב במאגר TBST של 50 מ"ל (20 mM Tris [pH 7.5], 150 mM NaCl, 0.1% Tween 20) למשך שעה אחת. שטפו את הממברנה 3x באמצעות מאגר TBST כדי להסיר כל פתרון חסימה לא מאוגד.
- יש לדגור על הממברנה עם נוגדן פרוקסידז (HRP) ספציפי לחלבון המתויג על ידי חזרת למשך שעה אחת. שטפו את הממברנה 3x במאגר TBST כדי להסיר נוגדנים לא קשורים. יש להשתמש בדילול נוגדנים ביחס של 1:2,000 ל-TBST לשחזור ורגישות מיטביים.
- הנוגדן המקושר לאנזים HRP נקשר באופן ספציפי לתג ההיסטידין של חלבון SEX4, אשר מניב רצועה בנוכחות ריאגנטים כימילומינסננציים. עבור הדמיה דיגיטלית, לעשות פתרון של חלקים שווים של תמיסות מצע chemiluminescent (750 μL כל אחד) בצינור 1.5 מ"ל. לדגור על הממברנה לפחות 5 דקות בתמיסה.
- הניחו את חלבון הממברנה על סורק הכתם והריצו את תוכנת הרכישה כדי לכמת את החלבון הן בשבר הכדורי והן בשבר הסופרנאטנטי.
7. ניתוח נתונים
- בצע את מדידות האות הכמותיות באמצעות תוכנת הרכישה עם סורק הכתם. נרמלו את כל המדידות הכמותיות בשברי הסופרנאטנט והגלולה לסך החלבון הטעון.
הערה: התוכנה מאפשרת לכמת את העוצמה של כל רצועת חלבון בשברים supernatant ו pellet. - בניסוי הקישור הרווי, שרטט את אחוז ריכוז החלבון לעומת ריכוז העמילופקטין (amylopectin). התאם את הנתונים ל- Y = Bmax x X/(K D + X), באמצעות תוכנת ניתוח נתונים לחישוב KD.
הערה: Bmax הוא הקישור הספציפי המקסימלי, ציר Y הוא אחוז החלבון הקשורים, ציר X הוא ריכוז העמילופקטין .
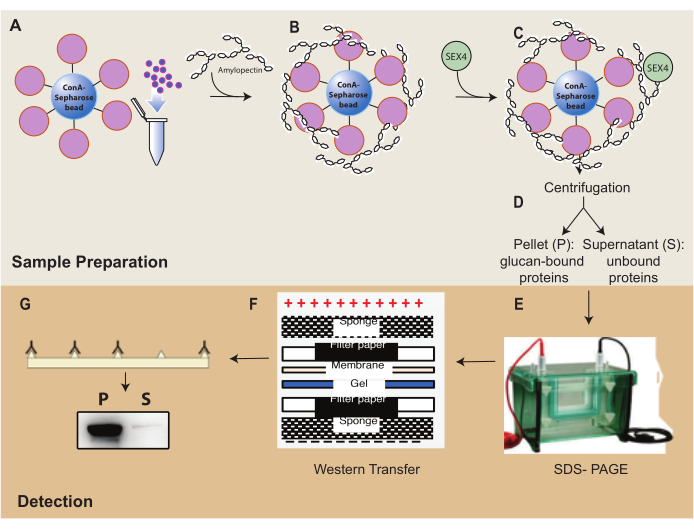
איור 1: סקירה כללית של זרימת העבודה של בדיקת שיקוע ConA-Sepharose. (A) הכנת חרוזי ConA-Sepharose. (B) דגירה עם מצע עמילופקטין. (C) דגירה עם חלבון SEX4. (D) הפרדה של שברי חלבונים קשורים ולא קשורים באמצעות צנטריפוגה. (E) הפרדת חלבון באמצעות SDS-PAGE. (F) ניתוח כתם מערבי. (G) זיהוי כימילומינסנציה של חלבון SEX4 המתויג שלו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
אחד המאפיינים העיקריים של משפחת החלבונים גלוקן פוספטאז הוא יכולתם להיקשר למצעים גלוקניים. ראשית, יכולת הקישור של SEX4 לחרוזי ConA-Sepharose:amylopectin נותחה באמצעות SDS-PAGE (איור 2A). אלבומין בסרום בקר (BSA) שימש כבקרה שלילית לזיהוי כל קשירה לא ספציפית של חלבונים לחרוזי ConA-Sepharose:amylopectin. ניתוח S...
Discussion
מחקר זה מדגים את הפיתוח המוצלח של בדיקת שיקוע חוץ גופית חדשנית המאפשרת לקבוע את הזיקה הקושרת של אינטראקציות פוספטאז גלוקן-גלוקן. תכנון הבדיקה מנצל את הקישור הספציפי של לקטין ConA לגלוקנים באמצעות שאריות הידרוקסיל של גלוקוז כדי ללכוד בעקיפין מצעי פחמימות מסיסים על חרוזי ספארוז. זה...
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
מחקר זה נתמך על ידי פרס הקרן הלאומית למדע MCB-2012074. המחברים מודים לד"ר קרייג וונדר קוי מהמחלקה לביוכימיה וביולוגיה מולקולרית באוניברסיטת פלורידה על דיונים חשובים ותמיכה. המחברים מודים גם לד"ר מתיו ס. ג'נטרי מהמחלקה לביוכימיה וביולוגיה מולקולרית באוניברסיטת פלורידה על תמיכתו. ברצוננו להודות לד"ר שרה לגלוואר, יו"ר התוכנית למדעי המוח במכללת סקידמור, שאפשרה לנו להשתמש בסורק הכתם בן הספרות C של LICOR עבור דימות כתמים מערביים.
Materials
| Name | Company | Catalog Number | Comments |
| 6x-His Tag monoclonal antibody (HIS.H8), HRP | Therm Fisher Scientific | MA1-21315-HRP | |
| Biorad gel electrophoresis and Western blot kit | Biorad | 1703930 | |
| Calcium chloride | Sigma-Aldrich | 208291 | |
| C-Digit blot scanner | LICOR | 3600-00 | Blot scanner |
| Complete protease inhibitor cocktail | Sigma-Aldrich | 11836170001 | |
| Concanavalin A-sepharose beads | Sigma-Aldrich | C9017 | This product contains in 0.1 M acetate buffer, pH 6, containing 1 M NaCl, 1 mM CaCl2, 1 mM MnCl2, and 1 mM MgCl2 in 20% ethanol |
| Centrifuge | Eppendorf | 5425R | |
| Glycine | Fisher Scientific | BP381-5 | |
| GraphPad Prism 8.0 software | GraphPad | Version 8.0 | Data analysis software |
| HEPES | Sigma-Aldrich | H8651 | |
| Image Studio | LICOR | 3600-501 | Acquisition Software |
| Magnesium chloride | Sigma-Aldrich | M2670 | |
| Methanol | Fisher Scientific | A452SK-4 | |
| Sodium dodecyl sulfate | Fisher Scientific | PI28312 | |
| Potato amylopectin | Sigma-Aldrich | A8515 | |
| Precast SDSPAGE Gels | Genscript | M00653S | |
| Tris base | Fisher Scientific | BP154-1 | |
| Tween 20 | Fisher Scientific | MP1TWEEN201 | |
| Westernsure premium chemiluminescence substrate | LI-COR | 926-95000 |
References
- Meekins, D. A., Vander Kooi, C. W., Gentry, M. S. Structural mechanisms of plant glucan phosphatases in starch metabolism. The FEBS Journal. 283 (13), 2427-2447 (2016).
- Gentry, M. S., et al. The phosphatase laforin crosses evolutionary boundaries and links carbohydrate metabolism to neuronal disease. The Journal of Cell Biology. 178 (3), 477-488 (2007).
- Worby, C. A., Gentry, M. S., Dixon, J. E. Laforin, a dual specificity phosphatase that dephosphorylates complex carbohydrates. The Journal of Biological Chemistry. 281 (41), 30412-30418 (2006).
- Gentry, M. S., Pace, R. M. Conservation of the glucan phosphatase laforin is linked to rates of molecular evolution and the glucan metabolism of the organism. BMC Evolutionary Biology. 9, 138 (2009).
- Niittyla, T., et al. Similar protein phosphatases control starch metabolism in plants and glycogen metabolism in mammals. The Journal of Biological Chemistry. 281 (17), 11815-11818 (2006).
- Kotting, O., et al. STARCH-EXCESS4 is a laforin-like Phosphoglucan phosphatase required for starch degradation in Arabidopsis thaliana. The Plant Cell. 21 (1), 334-346 (2009).
- Comparot-Moss, S., et al. A putative phosphatase, LSF1, is required for normal starch turnover in Arabidopsis leaves. Plant Physiology. 152 (2), 685-697 (2010).
- Zeeman, S. C., Northrop, F., Smith, A. M., Rees, T. A starch-accumulating mutant of Arabidopsis thaliana deficient in a chloroplastic starch-hydrolysing enzyme. The Plant Journal: For Cell and Molecular Biology. 15 (3), 357-365 (1998).
- Kotting, O., et al. Identification of a novel enzyme required for starch metabolism in Arabidopsis leaves. The phosphoglucan, water dikinase. Plant Physiology. 137 (1), 242-252 (2005).
- Tagliabracci, V. S., et al. Laforin is a glycogen phosphatase, deficiency of which leads to elevated phosphorylation of glycogen in vivo. Proceedings of the National Academy of Sciences. 104 (49), 19262-19266 (2007).
- Gentry, M. S., Guinovart, J. J., Minassian, B. A., Roach, P. J., Serratosa, J. M. Lafora disease offers a unique window into neuronal glycogen metabolism. The Journal of Biological Chemistry. 293 (19), 7117-7125 (2018).
- Brewer, M. K., et al. Targeting pathogenic lafora bodies in lafora disease using an antibody-enzyme fusion. Cell Metabolism. 30 (4), 689-705 (2019).
- Santelia, D., Zeeman, S. C. Progress in Arabidopsis starch research and potential biotechnological applications. Current Opinion in Biotechnology. 22 (2), 271-280 (2011).
- Raththagala, M., et al. Structural mechanism of laforin function in glycogen dephosphorylation and lafora disease. Molecular Cell. 57 (2), 261-272 (2015).
- Meekins, D. A., et al. Phosphoglucan-bound structure of starch phosphatase Starch Excess4 reveals the mechanism for C6 specificity. Proceedings of the National Academy of Sciences. 111 (20), 7272-7277 (2014).
- Vander Kooi, C. W., et al. Structural basis for the glucan phosphatase activity of Starch Excess4. Proceedings of the National Academy of Sciences. 107 (35), 15379-15384 (2010).
- Meekins, D. A., et al. Structure of the Arabidopsis glucan phosphatase like sex four2 reveals a unique mechanism for starch dephosphorylation. The Plant Cell. 25 (6), 2302-2314 (2013).
- Smith, A. M., Zeeman, S. C. Starch: A flexible, adaptable carbon store coupled to plant growth. Annual Review of Plant Biology. 71, 217-245 (2020).
- Jane, J., Kasemuwan, T., Chen, J. F., Juliano, B. O. Phosphorus in rice and other starches. Cereal Foods World. 41 (11), 827-832 (1996).
- Mak, C. A., et al. Cooperative kinetics of the glucan phosphatase starch excess4. Biochemistry. 60 (31), 2425-2435 (2021).
- Campbell, K. P., MacLennan, D. H. Purification and characterization of the 53,000-dalton glycoprotein from the sarcoplasmic reticulum. The Journal of Biological Chemistry. 256 (9), 4626-4632 (1981).
- Campbell, K. P., MacLennan, D. H., Jorgensen, A. O., Mintzer, M. C. Purification and characterization of calsequestrin from canine cardiac sarcoplasmic reticulum and identification of the 53,000 dalton glycoprotein. The Journal of Biological Chemistry. 258 (2), 1197-1204 (1983).
- Davey, M. W., Sulkowski, E., Carter, W. A. Binding of human fibroblast interferon to concanavalin A-agarose. Involvement of carbohydrate recognition and hydrophobic interaction. Biochemistry. 15 (3), 704-713 (1976).
- Meekins, D. A., et al. Mechanistic insights into glucan phosphatase activity against polyglucan substrates. The Journal of Biological Chemistry. 290 (38), 23361-23370 (2015).
- Wilkens, C., et al. Plant α-glucan phosphatases SEX4 and LSF2 display different affinity for amylopectin and amylose. FEBS Letters. 590 (1), 118-128 (2016).
- Atanasova, M., Bagdonas, H., Agirre, J. Structural glycobiology in the age of electron cryo-microscopy. Current Opinion in Structural Biology. 62, 70-78 (2020).
- Doyle, M. L. Characterization of binding interactions by isothermal titration calorimetry. Current Opinion in Biotechnology. 8 (1), 31-35 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved