Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Седиментационный анализ на основе конканавалина А для измерения связывания субстрата глюканфосфатаз
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот метод описывает анализ седиментации in vitro на основе лектина для количественной оценки сродства связывания глюканфосфатазы и амилопектина. Этот анализ совместного седиментации надежен для измерения связывания субстрата глюканфосфатазы и может применяться к различным солюбилизированным глюкановым субстратам.
Аннотация
Глюканфосфатазы принадлежат к более крупному семейству фосфатаз двойной специфичности (DSP), которые дефосфорилируют субстраты глюканов, такие как гликоген у животных и крахмал у растений. Кристаллические структуры глюканфосфатазы с модельными глюкановыми субстратами показывают отчетливые интерфейсы связывания глюканов, состоящие из DSP и углеводсвязывающих доменов. Однако количественные измерения взаимодействия глюкан-глюканфосфатазы с физиологически значимыми субстратами имеют основополагающее значение для биологического понимания семейства ферментов глюканфосфатазы и регуляции энергетического обмена. В этой рукописи сообщается об анализе седиментации in vitro на основе конканавалина А (ConA), предназначенном для определения аффинности связывания субстрата глюканфосфатаз с различными глюкановыми субстратами. В качестве доказательства концепции была определена константа диссоциации (KD) глюканфосфатазы Arabidopsis thaliana Starch Excess4 (SEX4) и амилопектина. Характеристика мутантов SEX4 и других членов семейства ферментов глюканфосфатазы еще раз демонстрирует полезность этого анализа для оценки дифференциального связывания белок-углеводных взаимодействий. Эти данные демонстрируют пригодность этого анализа для характеристики широкого спектра белков, взаимодействующих с крахмалом и гликогеном.
Введение
Глюканфосфатазы являются членами функционально разнообразного подсемейства фосфатаз двойной специфичности (DSP) в суперсемействе белковой тирозинфосфатазы (PTP)1. Они были обнаружены в большинстве форм жизни, включая широко расходящиеся фотосинтезирующие организмы, людей, позвоночных и некоторых беспозвоночных и простейших 2,3,4. Растения содержат три известные глюканфосфатазы: избыток крахмала4 (SEX4), Like Sex Four1 (LSF1) и Like Sex Four2 (LSF2)5,6,7. Растения, в которых отсутствует глюканфосфатаза, демонстрируют пониженные скорости преходящей деградации крахмала и накопления крахмала в листьях 8,9. Лафорин является членом-основателем семейства глюканфосфатаз, которые дефосфорилируют гликоген у позвоночных и человека 3,10. Мутации лафорина приводят к нейродегенеративной болезни Лафора, фатальной аутосомно-рецессивной форме эпилепсии11. Глюканфосфатазы необходимы для метаболизма гликогена и крахмала и стали важными ферментами для модуляции содержания крахмала в растениях и лечения нейродегенеративной болезни Лафора12,13. Недавние рентгеновские кристаллографические исследования глюканфосфатаз с модельными глюкановыми субстратами пролили свет на связывание субстрата и каталитический механизм дефосфорилирования глюкана14,15,16,17. Однако нынешнее понимание того, как глюканфосфатазы связываются со своими физиологическими субстратами, является неполным.
Крахмал представляет собой нерастворимый полимер глюкозы, состоящий из 80-90% амилопектина и 10-20% амилозы18. Субстратами для растительных глюканфосфатаз являются фосфорилированные молекулы углеводов, такие как гранулы гликогена и крахмала. Фосфорилированные остатки глюкозила присутствуют в соотношении 1:600 фосфат к глюкозильному остатку. Интересно, что фосфаты присутствуют только на молекулах амилопектина19. Основная растительная глюканфосфатаза SEX4 действует на гранулы крахмала, дефосфорилируя молекулы амилопектина. Рентгеновская кристаллическая структура SEX4 в сочетании с структурно-ориентированными исследованиями мутагенеза продемонстрировала уникальную специфичность субстрата SEX4 для различных положений в структуре глюкана15. Недавно мы показали, что биологически значимая активность SEX4 может наблюдаться только при воздействии на его солюбилизированные амилопектиновые субстраты20. Однако понимание взаимодействий глюкан-SEX4 оказалось трудным из-за структурной сложности субстрата, более широкой специфики связывания и низкого сродства связывания между белком и его субстратами. Эти проблемы препятствовали возможности использования методов, обычно используемых в белково-лигандных взаимодействиях, таких как изотермическая титрационная калориметрия (ITC), спектроскопия ядерного магнитного резонанса (ЯМР) и анализы на основе иммуноферментного анализа (ИФА).
Интересно, что большая часть нашего понимания углеводно-белковых взаимодействий пришла из изучения лектинов. Конканавалин А (ConA) представляет собой семейство белков лектина бобовых, первоначально извлеченных из бобов. ConA связывает углеводы с высокой специфичностью, что выгодно для его использования в нацеливании и доставке лекарств. Широко изучено связывание ConA с различными субстратами, содержащими невосстанавливающие α-D-маннозил и α-D-глюкозил19,20. Коммерчески доступные гранулы сефарозы, связанные с ConA, обычно используются для очистки гликопротеинов и гликолипидов21. ConA связывается с этими глюканами через гидроксильные группы C3, C4 и C6 остатков глюкозы. Шарики ConA-сефарозы также успешно использовались для измерения связывания взаимодействия гликоген-белок и крахмал-белок22,23. В этом исследовании мы использовали шарики ConA-сефарозы для разработки анализа связывания для измерения специфичности связывания взаимодействия глюканфосфатазы и амилопектина.
Ранее для оценки способности связывания субстрата глюканфосфатазы использовался седиментационный анализна основе ConA 14,20,24. В этом исследовании та же стратегия была использована для разработки нового метода определения аффинности связывания глюкан-глюканфосфатазы и углеводных взаимодействий. Этот метод также имеет преимущество для исследования различных солюбилизированных углеводно-белковых взаимодействий.
протокол
1. Приготовление шариков ConA-Sepharose
- Сделайте 250 мл связывающего буфера, содержащего 67 мМ HEPES (pH 7,5), 10 мМ MgCl2 и0,2 мМ CaCl2. Отрегулируйте рН с помощью 1 М раствора NaOH.
- Пипетка 250 мкл суспензии шариков ConA-сефарозы в микроцентрифужную пробирку объемом 1,5 мл. Центрифугировать содержимое при 10 000 x g в течение 30 с при 4 °C. Откажитесь от надосадочной жидкости.
ПРИМЕЧАНИЕ: 250 мкл шариков ConA-сефарозы в микроцентрифужной пробирке объемом 1,5 мл необходимо для каждой концентрации амилопектина, используемой для анализа. - Добавьте 750 мкл связывающего буфера в каждую пробирку, содержащую 250 мкл шариков ConA-сефарозы. Центрифугируют пробирки при 10 000 x g в течение 1 мин при 4 °C. Удалите надосадочную жидкость. Повторите этот шаг 2 раза, чтобы убедиться, что шарики должным образом промыты и уравновешены связующим буфером.
2. Приготовление растворов амилопектина
- Сделайте бульон из 10 мг/мл картофельного амилопектина. Амилопектин нерастворим в воде и может растворяться при нагревании. Для растворения добавьте 0,1 г картофельного амилопектина в 10 мл дистиллированной воды. Нагрейте суспензию на водяной бане при температуре 80 °C в течение 1 ч или до тех пор, пока раствор не перестанет мутнеть.
- Дайте раствору вернуться к комнатной температуре (RT) с повторным встряхиванием, чтобы избежать комкования.
- Спиртощелочная обработка является альтернативным методом растворения субстратов амилопектина. Чтобы растворить с помощью этого метода, выполните следующие действия.
- Суспендировать 0,5 г субстрата амилопектина в 5 мл 20% этанола и 5 мл 2 М NaOH. Энергично перемешивайте содержимое в течение 15-20 минут при РТ.
- Затем добавьте 10 мл воды и отрегулируйте рН раствора до 6,5, добавив 2 М HCl. Доведите объем полученного раствора до 50 мл дистиллированной водой, чтобы получить 10 мг/мл раствора амилопектина.
- Разбавьте 10 мг / мл раствора солюбилизированного амилопектина, чтобы получить серию из 2 мл разбавленных растворов амилопектина. Например, выполняют половинные разведения 10 мг / мл для получения ряда концентраций амилопектина (5 мг / мл, 2,5 мг / мл, 1,25 мг / мл, 0,625 мг / мл, 0,3125 мг / мл, 0,156 мг / мл, 0,078 мг / мл, 0,039 мг / мл, 0,019 мг / мл и 0 мг / мл).
3. Получение ConA-сефарозы: шарики амилопектина
- Добавьте 250 мкл каждого разбавленного раствора амилопектина в микроцентрифужные пробирки объемом 1,5 мл, содержащие 250 мкл шариков ConA-сефарозы, предварительно уравновешенных в связывающем буфере. Хорошо перемешайте содержимое. Пометьте пробирки соответствующей концентрацией амилопектина.
- Инкубировать содержимое на вращающемся колесе при температуре 4 °C в течение 30 мин.
ПРИМЕЧАНИЕ: Через 20 минут не происходит никаких изменений в комплексе ConA-сефароза: амилопектин. 30-минутное время инкубации было выбрано путем изменения времени инкубации от 10 минут до 1 часа, чтобы обеспечить достижение равновесия. - Центрифугируют пробирки при 10 000 x g в течение 1 мин. Соберите надосадочную жидкость в микроцентрифужную пробирку объемом 1,5 мл с новой маркировкой. Сохраните эти надосадочные фракции для проведения анализа D-глюкозы12 (кислотный гидролиз амилопектина с последующим УФ-определением глюкозы с помощью ферментативного анализа). Этот шаг необходим для того, чтобы убедиться, что весь амилопектин связан с шариками.
- Добавьте 750 мкл связывающего буфера в шарики ConA-сефарозы: амилопектина. Центрифугируют пробирки при 10 000 x g в течение 1 мин. Откажитесь от надосадочной жидкости, чтобы удалить все несвязанные молекулы амилопектина.
- Повторите шаг 3.4, чтобы обеспечить достаточную стирку. Каждая пробирка теперь содержит шарики ConA-сефарозы, связанные с различными количествами субстратов амилопектина.
4. Инкубация SEX4 с ConA-сефарозой: шариками амилопектина
- Смешайте 250 мкл шариков ConA-сефарозы: амилопектина со 100 мкл связывающего буфера, который включает 10 мкг белка SEX4, 10 мМ дитиотреитол (DTT) и 10 мкМ коктейль ингибитора протеазы (PIC). Обратите внимание, что общий объем в каждой пробирке составляет 350 мкл.
ПРИМЕЧАНИЕ: Коктейль ингибитора протеазы добавляется в качестве меры предосторожности, чтобы избежать ненужной деградации SEX4. Это необязательный шаг. В этом анализе используется рекомбинантный белок Arabidopsis thaliana SEX4 (AtSEX4). Очищенный белок содержит N-концевую гистидиновую метку, необходимую для обнаружения белка посредством хемилюминесценции. Подробная информация об очистке глюканфосфатазы описана в предыдущих публикациях14,20,24. - Инкубируйте белок и суспензию шариков ConA-сефарозы: амилопектина при 4 ° C в течение 45 минут при осторожном вращении.
ПРИМЕЧАНИЕ: 45-минутное время инкубации выбрано для обеспечения равновесия для комплекса. - Центрифугируют пробирки при 10 000 x g в течение 1 мин. Пипеткой 50 мкл надосадочной жидкости осторожно с помощью геля загружают наконечник в новую микроцентрифужную пробирку объемом 1,5 мл. Добавьте 20 мкл 4x красителя SDS-PAGE и 10 мкл воды в каждую пробирку, содержащую 50 мкл собранных надосадочных фракций. Нагрейте образцы до 95 °C в течение 10 минут. Сохраните эти примеры для запуска гелей SDS-PAGE. Убедитесь, что 10 новых пробирок с надписью «надосадочная жидкость (S)» имеют соответствующие концентрации субстрата.
- Добавьте 750 мкл связывающего буфера в шарики ConA-сефарозы: амилопектин: SEX4, чтобы удалить любой несвязанный белок из шариков. Центрифугируют пробирки при 10 000 x g в течение 1 мин. Повторите этот шаг еще раз, чтобы обеспечить правильную стирку. Откажитесь от надосадочной жидкости.
- Добавьте 20 мкл 4-кратного красителя SDS-PAGE и 80 мкл дистиллированной воды в пробирки, содержащие промытые шарики ConA-Sepharose:amilopectin:SEX4. Нагрейте образцы при 95 °C в течение 10 мин и центрифугу при 10 000 x g в течение 1 мин.
- Выбросьте гранулы и сохраните надосадочную жидкость для запуска гелей SDS-PAGE. Пипеткой 80 мкл надосадочной жидкости в новые пробирки и пометьте их как «гранулы (P)».
5. Запуск гелей SDS-PAGE
- Загрузите 40 мкл образцов несвязанного белка (изготовленных на этапе 2.3, помеченных S) в 4%-12% сборные полиакриламидные гелевые лунки от самой низкой концентрации субстрата до самой высокой, но оставьте первую полосу свободной для загрузки маркера молекулярной массы белка. Используйте второй гель для загрузки 10 связанных образцов белка, полученных на шаге 2.5 (помеченных как P).
- Добавьте свежеприготовленный 1x рабочий буфер SDS-PAGE в обе камеры аппарата. Запускайте гель при напряжении 150 В в течение 35 мин или до тех пор, пока передняя часть красителя не достигнет дна геля.
- Извлеките прогонный гель из аппарата и снимите прокладки и стеклянные пластины. Используйте отделенный гель для проведения анализа вестерн-блоттинга.
6. Вестерн-блоттинг для хемилюминесцентного детектирования14,15
ПРИМЕЧАНИЕ: Этот метод может быть легко изменен / адаптирован в зависимости от западного оборудования для блоттинга, которое пользователи имеют в своих лабораториях.
- Сделайте 1 л буфера для переноса, содержащего 5,8 г трис-основания, 2,9 г глицина, 0,37 г SDS и 200 мл метанола.
- Перенесите разделенные по размеру белки из полиакриламидного геля на нитроцеллюлозную мембрану. Кратко соберите губки, фильтровальную бумагу, гель и нитроцеллюлозную мембрану в соответствии с западным протоколом переноса14,15. Работает при напряжении 70 В в течение 1 ч.
- Для предотвращения неспецифического связывания с белками инкубируют нитроцеллюлозную мембрану, содержащую белковый раствор 1%-5% бычьего сывороточного альбумина (BSA) или молочного белка, в 50 мл буфера TBST (20 мМ Tris [pH 7,5], 150 мМ NaCl, 0,1% Tween 20) в течение 1 ч. Промойте мембрану 3 раза, используя буфер TBST, чтобы удалить несвязанный блокирующий раствор.
- Инкубируйте мембрану с антителом, связанным с пероксидазой хрена (HRP), специфичным для белка, меченного His, в течение 1 часа. Промойте мембрану 3 раза в буфере TBST, чтобы удалить все несвязанные антитела. Используйте разведение антител к TBST в соотношении 1:2000 для оптимальной воспроизводимости и чувствительности.
- Антитело, связанное с ферментом HRP, специфически связывается с гистидиновой меткой белка SEX4, что дает полосу в присутствии хемилюминесцентных реагентов. Для цифровой визуализации сделайте раствор из равных частей растворов хемилюминесцентной подложки (по 750 мкл каждый) в пробирке объемом 1,5 мл. Инкубируют мембрану не менее 5 мин в растворе.
- Поместите мембранный белок стороной вниз на сканер блоттинга и запустите программное обеспечение для сбора данных для количественного определения белка как в гранулах, так и в надосадочной фракциях.
7. Анализ данных
- Выполняйте количественные измерения сигнала с помощью программного обеспечения для сбора данных с помощью сканера блоттинга. Нормализуйте все количественные измерения в надосадочной и гранулированной фракциях к общему белковому нагруженному.
ПРИМЕЧАНИЕ: Программное обеспечение позволяет количественно оценить интенсивность каждой белковой полосы в надосадочной и гранулированной фракциях. - В эксперименте по насыщению связывания постройте график процентного соотношения связанного с белком по сравнению с концентрацией амилопектина. Подгоните данные под Y = Bmax x X/(K D + X), используя программное обеспечение для анализа данных для расчета KD.
ПРИМЕЧАНИЕ: Bmax - максимальное специфическое связывание, ось Y - процент связанного белка, а ось X - концентрация амилопектина.
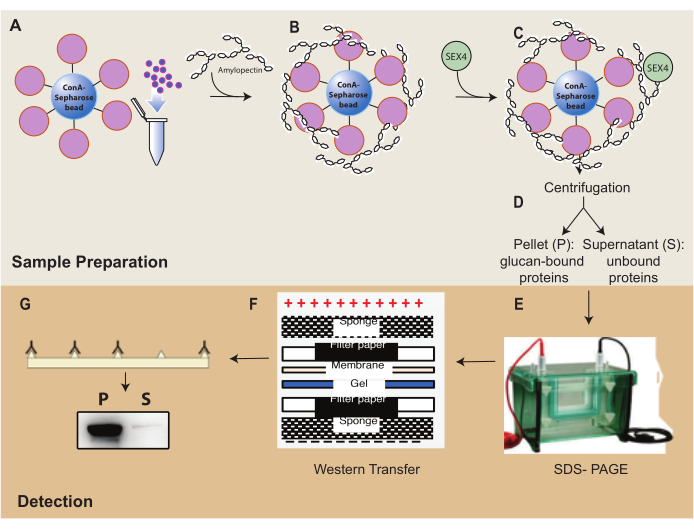
Рисунок 1: Обзор рабочего процесса седиментации ConA-сефарозы . (A) Приготовление шариков ConA-сефарозы. (B) Инкубация с субстратом амилопектина. (C) Инкубация с белком SEX4. (D) Разделение связанных и несвязанных белковых фракций путем центрифугирования. (E) Разделение белка с помощью SDS-PAGE. (F) Вестерн-блоттинг-анализ. (G) Хемилюминесцентное обнаружение белка SEX4 с меткой His. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Одной из ключевых особенностей семейства белков глюканфосфатазы является их способность связываться с глюкановыми субстратами. Во-первых, связывающая способность SEX4 с шариками ConA-сефарозы: амилопектина была проанализирована с использованием SDS-PAGE (рис. 2A). Бычий сывор?...
Обсуждение
Это исследование демонстрирует успешную разработку нового седиментационного анализа in vitro , который позволяет определить аффинность связывания взаимодействий глюкан-глюканфосфатазы. В дизайне анализа используется специфическое связывание лектина ConA с глюканами через гид?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было поддержано премией Национального научного фонда MCB-2012074. Авторы благодарят доктора Крейга В. Вандера Кооя из Университета Флориды за ценные дискуссии и поддержку. Авторы также благодарят доктора Мэтью С. Джентри с факультета биохимии и молекулярной биологии Университета Флориды за его поддержку. Мы хотели бы поблагодарить доктора Сару Лагалвар, председателя программы неврологии колледжа Скидмор, за то, что она позволила нам использовать сканер блоттинга LICOR C-digit для визуализации вестерн-блоттинга.
Материалы
| Name | Company | Catalog Number | Comments |
| 6x-His Tag monoclonal antibody (HIS.H8), HRP | Therm Fisher Scientific | MA1-21315-HRP | |
| Biorad gel electrophoresis and Western blot kit | Biorad | 1703930 | |
| Calcium chloride | Sigma-Aldrich | 208291 | |
| C-Digit blot scanner | LICOR | 3600-00 | Blot scanner |
| Complete protease inhibitor cocktail | Sigma-Aldrich | 11836170001 | |
| Concanavalin A-sepharose beads | Sigma-Aldrich | C9017 | This product contains in 0.1 M acetate buffer, pH 6, containing 1 M NaCl, 1 mM CaCl2, 1 mM MnCl2, and 1 mM MgCl2 in 20% ethanol |
| Centrifuge | Eppendorf | 5425R | |
| Glycine | Fisher Scientific | BP381-5 | |
| GraphPad Prism 8.0 software | GraphPad | Version 8.0 | Data analysis software |
| HEPES | Sigma-Aldrich | H8651 | |
| Image Studio | LICOR | 3600-501 | Acquisition Software |
| Magnesium chloride | Sigma-Aldrich | M2670 | |
| Methanol | Fisher Scientific | A452SK-4 | |
| Sodium dodecyl sulfate | Fisher Scientific | PI28312 | |
| Potato amylopectin | Sigma-Aldrich | A8515 | |
| Precast SDSPAGE Gels | Genscript | M00653S | |
| Tris base | Fisher Scientific | BP154-1 | |
| Tween 20 | Fisher Scientific | MP1TWEEN201 | |
| Westernsure premium chemiluminescence substrate | LI-COR | 926-95000 |
Ссылки
- Meekins, D. A., Vander Kooi, C. W., Gentry, M. S. Structural mechanisms of plant glucan phosphatases in starch metabolism. The FEBS Journal. 283 (13), 2427-2447 (2016).
- Gentry, M. S., et al. The phosphatase laforin crosses evolutionary boundaries and links carbohydrate metabolism to neuronal disease. The Journal of Cell Biology. 178 (3), 477-488 (2007).
- Worby, C. A., Gentry, M. S., Dixon, J. E. Laforin, a dual specificity phosphatase that dephosphorylates complex carbohydrates. The Journal of Biological Chemistry. 281 (41), 30412-30418 (2006).
- Gentry, M. S., Pace, R. M. Conservation of the glucan phosphatase laforin is linked to rates of molecular evolution and the glucan metabolism of the organism. BMC Evolutionary Biology. 9, 138 (2009).
- Niittyla, T., et al. Similar protein phosphatases control starch metabolism in plants and glycogen metabolism in mammals. The Journal of Biological Chemistry. 281 (17), 11815-11818 (2006).
- Kotting, O., et al. STARCH-EXCESS4 is a laforin-like Phosphoglucan phosphatase required for starch degradation in Arabidopsis thaliana. The Plant Cell. 21 (1), 334-346 (2009).
- Comparot-Moss, S., et al. A putative phosphatase, LSF1, is required for normal starch turnover in Arabidopsis leaves. Plant Physiology. 152 (2), 685-697 (2010).
- Zeeman, S. C., Northrop, F., Smith, A. M., Rees, T. A starch-accumulating mutant of Arabidopsis thaliana deficient in a chloroplastic starch-hydrolysing enzyme. The Plant Journal: For Cell and Molecular Biology. 15 (3), 357-365 (1998).
- Kotting, O., et al. Identification of a novel enzyme required for starch metabolism in Arabidopsis leaves. The phosphoglucan, water dikinase. Plant Physiology. 137 (1), 242-252 (2005).
- Tagliabracci, V. S., et al. Laforin is a glycogen phosphatase, deficiency of which leads to elevated phosphorylation of glycogen in vivo. Proceedings of the National Academy of Sciences. 104 (49), 19262-19266 (2007).
- Gentry, M. S., Guinovart, J. J., Minassian, B. A., Roach, P. J., Serratosa, J. M. Lafora disease offers a unique window into neuronal glycogen metabolism. The Journal of Biological Chemistry. 293 (19), 7117-7125 (2018).
- Brewer, M. K., et al. Targeting pathogenic lafora bodies in lafora disease using an antibody-enzyme fusion. Cell Metabolism. 30 (4), 689-705 (2019).
- Santelia, D., Zeeman, S. C. Progress in Arabidopsis starch research and potential biotechnological applications. Current Opinion in Biotechnology. 22 (2), 271-280 (2011).
- Raththagala, M., et al. Structural mechanism of laforin function in glycogen dephosphorylation and lafora disease. Molecular Cell. 57 (2), 261-272 (2015).
- Meekins, D. A., et al. Phosphoglucan-bound structure of starch phosphatase Starch Excess4 reveals the mechanism for C6 specificity. Proceedings of the National Academy of Sciences. 111 (20), 7272-7277 (2014).
- Vander Kooi, C. W., et al. Structural basis for the glucan phosphatase activity of Starch Excess4. Proceedings of the National Academy of Sciences. 107 (35), 15379-15384 (2010).
- Meekins, D. A., et al. Structure of the Arabidopsis glucan phosphatase like sex four2 reveals a unique mechanism for starch dephosphorylation. The Plant Cell. 25 (6), 2302-2314 (2013).
- Smith, A. M., Zeeman, S. C. Starch: A flexible, adaptable carbon store coupled to plant growth. Annual Review of Plant Biology. 71, 217-245 (2020).
- Jane, J., Kasemuwan, T., Chen, J. F., Juliano, B. O. Phosphorus in rice and other starches. Cereal Foods World. 41 (11), 827-832 (1996).
- Mak, C. A., et al. Cooperative kinetics of the glucan phosphatase starch excess4. Biochemistry. 60 (31), 2425-2435 (2021).
- Campbell, K. P., MacLennan, D. H. Purification and characterization of the 53,000-dalton glycoprotein from the sarcoplasmic reticulum. The Journal of Biological Chemistry. 256 (9), 4626-4632 (1981).
- Campbell, K. P., MacLennan, D. H., Jorgensen, A. O., Mintzer, M. C. Purification and characterization of calsequestrin from canine cardiac sarcoplasmic reticulum and identification of the 53,000 dalton glycoprotein. The Journal of Biological Chemistry. 258 (2), 1197-1204 (1983).
- Davey, M. W., Sulkowski, E., Carter, W. A. Binding of human fibroblast interferon to concanavalin A-agarose. Involvement of carbohydrate recognition and hydrophobic interaction. Biochemistry. 15 (3), 704-713 (1976).
- Meekins, D. A., et al. Mechanistic insights into glucan phosphatase activity against polyglucan substrates. The Journal of Biological Chemistry. 290 (38), 23361-23370 (2015).
- Wilkens, C., et al. Plant α-glucan phosphatases SEX4 and LSF2 display different affinity for amylopectin and amylose. FEBS Letters. 590 (1), 118-128 (2016).
- Atanasova, M., Bagdonas, H., Agirre, J. Structural glycobiology in the age of electron cryo-microscopy. Current Opinion in Structural Biology. 62, 70-78 (2020).
- Doyle, M. L. Characterization of binding interactions by isothermal titration calorimetry. Current Opinion in Biotechnology. 8 (1), 31-35 (1997).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены