A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطبيق نظام اختبار حساسية مضادات الميكروبات / فحص العاثيات الذكي عالي الإنتاجية ومؤشر لار لمقاومة مضادات الميكروبات
In This Article
Summary
نقدم هنا مبدأ وهيكل وتعليمات نظام اختبار حساسية مضادات الميكروبات / فحص العاثيات الذكي عالي الإنتاجية. يتضح تطبيقه باستخدام السالمونيلا المعزولة من الدواجن في شاندونغ ، الصين ، كمثال. يتم حساب مؤشر لار ، وتناقش أهميته في تقييم مقاومة مضادات الميكروبات بشكل شامل.
Abstract
لتحسين كفاءة اختبار الحساسية لمضادات الميكروبات (AST) وفحص العاثيات عالية الإنتاجية للبكتيريا المقاومة وتقليل تكلفة الكشف ، تم تطوير نظام ذكي عالي الإنتاجية لفحص AST / phage ، بما في ذلك ملقح مصفوفة 96 نقطة ، ومحول الحصول على الصور ، والبرامج المقابلة ، وفقا لمعايير AST ونقاط توقف المقاومة (R) التي صاغها معهد المعايير السريرية والمخبرية (CLSI). تم إجراء AST وإحصائيات توزيعات الحد الأدنى للتركيز المثبط (MIC) (من R / 8 إلى 8R) ل 1500 سلالة من السالمونيلا المعزولة من الدواجن في شاندونغ ، الصين ، ضد 10 عوامل مضادة للميكروبات بواسطة نظام فحص AST / phage الذكي عالي الإنتاجية. تم الحصول على مؤشر لار ، الذي يعني "مضادات حيوية أقل ، ومقاومة أقل وبقايا حتى القليل من المضادات الحيوية" ، عن طريق حساب المتوسط المرجح لكل MIC والقسمة على R. يحسن هذا النهج الدقة مقارنة باستخدام انتشار المقاومة لتوصيف درجة مقاومة مضادات الميكروبات (AMR) للسلالات عالية المقاومة. بالنسبة لسلالات السالمونيلا ذات مقاومة مضادات الميكروبات العالية ، تم فحص العاثيات المحللة بكفاءة من مكتبة العاثيات بواسطة هذا النظام ، وتم حساب طيف التحلل وتحليله. أظهرت النتائج أن نظام فحص AST / phage الذكي عالي الإنتاجية كان قابلا للتشغيل ودقيقا وعالي الكفاءة وغير مكلف وسهل الصيانة. وإلى جانب نظام شاندونغ لرصد مقاومة مضادات الميكروبات البيطرية، كان النظام مناسبا للبحث العلمي والكشف السريري المتعلق بمقاومة مضادات الميكروبات.
Introduction
نظرا لاستخدام العوامل المضادة للميكروبات على نطاق واسع للوقاية من الأمراض المعدية البكتيرية ، أصبحت مقاومة مضادات الميكروبات (AMR) مشكلة صحية عامة عالمية1. مكافحة مقاومة مضادات الميكروبات هي المهمة الرئيسية الحالية لرصد مقاومة مضادات الميكروبات لمسببات الأمراض الوبائية والعلاج التآزري للعوامل الحساسة المضادة للميكروبات والبكتيريا المحللة2.
اختبار حساسية مضادات الميكروبات في المختبر (AST) هو الدعامة الأساسية لرصد العلاج والكشف عن مستوى مقاومة مضادات الميكروبات. إنه جزء مهم من علم الأدوية المضادة للميكروبات والأساس الحاسم للطب السريري. قام معهد المعايير السريرية والمخبرية (CLSI) التابع للولايات المتحدة واللجنة الأوروبية لاختبار الحساسية لمضادات الميكروبات (EUCAST) بصياغة وتنقيح المعايير الدولية ل AST وتعديل واستكمال طرق AST ونقاط التوقف باستمرار لتحديد MIC لمزيج معين من "العامل المضاد للميكروبات" باعتباره حساسا (S) أو مقاوما (R) أو وسيطا (I) 3 ، 4.
من ثمانينيات القرن العشرين إلى تسعينيات القرن العشرين ، تم تطوير أدوات التخفيف الدقيقة الأوتوماتيكية بسرعة وتطبيقها على الممارسة السريرية ، مع أمثلة تشمل Alfred 60AST و VITEK System و PHOENIXTM و Cobasbact5،6،7. ومع ذلك ، كانت هذه الأدوات باهظة الثمن ، وتتطلب مواد استهلاكية عالية التكلفة ، وتم تصميم نطاقات الكشف الخاصة بها لأدوية المرضى السريرية5،6،7. لهذه الأسباب ، فهي ليست مناسبة للفحص السريري البيطري والكشف عن كميات كبيرة من السلالات شديدة المقاومة. في هذه الدراسة ، تم تطوير نظام فحص AST / phage ذكي عالي الإنتاجية ، بما في ذلك ملقح مصفوفة 96 نقطة (الشكل 1) ، ومحول الحصول على الصور (الشكل 2) ، والبرنامجالمقابل 8 ، لإجراء AST لمجموعة من سلالات البكتيريا ضد عوامل متعددة مضادة للميكروبات في وقت واحد بواسطة طريقة تخفيف أجار. علاوة على ذلك ، تم استخدام النظام أيضا للكشف عن أنماط تحلل العاثيات وتحليلها ضد البكتيريا المقاومة لمضادات الميكروبات9 ، وتم اختيار العاثيات المحللة بكفاءة من مكتبة العاثيات. تم العثور على هذا النظام ليكون فعالا وبأسعار معقولة وسهل التشغيل.
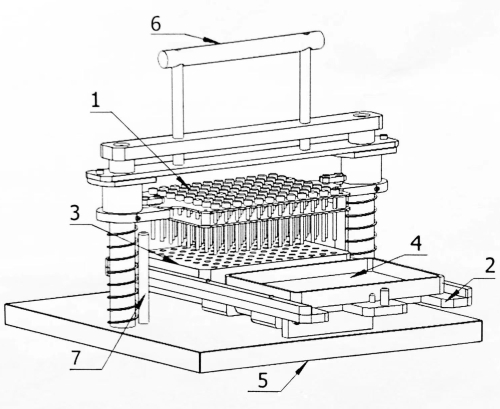
الشكل 1: مخطط إنشائي لملقح المصفوفة المكون من 96 نقطة. 1: لوحة دبوس التلقيح. 2: الناقل المحمول. 3: كتلة البذور. 4: لوحة حضن. 5: قاعدة. 6: مقبض التشغيل. 7: دبوس الحد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
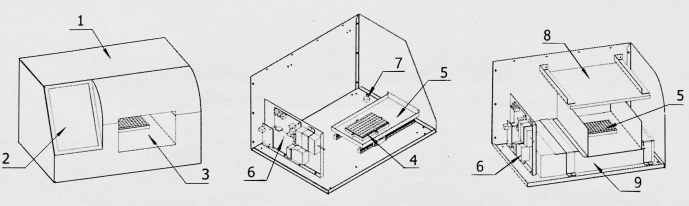
الشكل 2: مخطط هيكلي لمحول الحصول على الصور. 1: قذيفة. 2: شاشة عرض. 3: غرفة الحصول على الصور. 4: قاعدة لوحة الكشف. 5: لوحة الكشف داخل وخارج المستودع. 6: لوحة التحكم. 7: جهاز تحويل الحصول على الصور. 8: مصدر الضوء. 9: ماسح الصور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تم جمع سلالات السالمونيلا المستخدمة في هذه الدراسة من الدواجن في شاندونغ ، الصين ، بعد الحصول على موافقة من لجنة السلامة الحيوية التابعة لمعهد علوم والطب البيطري ، أكاديمية شاندونغ للعلوم الزراعية ، الصين.
1. تطبيق نظام AST الذكي عالي الإنتاجية8
- إعداد اللقاح
- احتضان كائن مراقبة الجودة الإشريكية القولونية و 93 سلالة من السالمونيلا ليتم اختبارها ل AST على ألواح مولر هينتون أجار (MHA) لمدة 16-18 ساعة عند 37 درجة مئوية3.
- قم بإعداد لقاح كل سلالة لمطابقة معيار التعكر 0.5 McFarland بناء على الطريقة المحددة في معيار CLSI3ثم قم بتخفيفه 10 مرات.
- ضع 200 ميكرولتر من المياه المالحة العادية المعقمة فيالبئر الأفقي الأول (A1) للوحة 96 بئرا كعنصر تحكم سلبي ، وتعليقين لكائن مراقبة الجودةفي البئرين الأفقيين 2 و 3 (A2و A3) كتحكم إيجابي ، ومراقبة الجودة ، على التوالي. أضف 200 ميكرولتر من معلقات اللقاح المخففة لكل بقعة تم اختبارها في 93 بئرا المقابلة في كتلة البذور المكونة من 96 بئرا.
- تحضير لوحة أجار مضادات الميكروبات
- اضبط نطاقات تركيز العوامل المضادة للبكتيريا المختلفة التي تم اختبارها وفقا لنطاق حساب مؤشر لار (من 0.125R إلى 8R). تتراوح التركيزات من نطاق مراقبة الجودة أو 0.0625R (يخضع للنطاق الأدنى) إلى 8R.
ملاحظة: إذا لم يتم حساب مؤشر لار ، يمكن تعيين نطاق تركيزات المضادات الحيوية وفقا لاحتياجات AST. - تنفيذ مخطط تخفيف مضاعفة log2 لمحلول المضادات الحيوية بدءا من تركيز مخزون مناسب بناء على طريقة تخفيف الآجار المحددة في معيار CLSI3.
- تعقيم عبوات زجاجية سعة 50 مل تحتوي على 18 مل من وسائط أجار مولر-هينتون. أضف 2 مل من التخفيفات المناسبة للمحلول المضاد للميكروبات إلى 18 مل من الوسائط المنصهرة المبردة إلى 45-50 درجة مئوية ، واخلطها جيدا ، واسكبها في الألواح في خزانة السلامة الأحيائية.
- اسمح للأجار بالتصلب في درجة حرارة الغرفة (RT) ، واترك فجوة تحت غطاء الألواح المحتضنة وانفخ لتجفيف سطح الآجار قبل التلقيح.
- قم بتسمية أنواع العوامل المضادة للميكروبات والتركيزات على الجانب الخلفي من الألواح المحتضنة. رتب الألواح المحتضنة المتعددة لكل عامل مضاد للميكروبات في كومة بترتيب تخفيف مضاعف log2.
- قم بإعداد لوحين أجار خاليين من الأدوية كعناصر تحكم لكل عامل مضاد للميكروبات.
- اضبط نطاقات تركيز العوامل المضادة للبكتيريا المختلفة التي تم اختبارها وفقا لنطاق حساب مؤشر لار (من 0.125R إلى 8R). تتراوح التركيزات من نطاق مراقبة الجودة أو 0.0625R (يخضع للنطاق الأدنى) إلى 8R.
- خطوات التلقيح لملقح المصفوفة 96 نقطة
- قم بتركيب لوحة دبوس التلقيح المعقم على دعم ملقح مصفوفة 96 نقطة في خزانة السلامة البيولوجية.
- ضع كتلة البذور المحضرة مع سلالات مختبرة وصفيحة محتضنة أجار على الناقل المحمول ، بنفس زاوية تحديد المواقع للوحتين.
- ادفع الناقل المحمول بحيث تكون كتلة البذور أسفل لوحة دبوس التلقيح مباشرة.
- اضغط على مقبض التشغيل ، وحرك لوحة دبوس التلقيح لأسفل ، وقم بتوجيه 96 دبابيس إلى اللقاح في 96 بئرا من كتلة البذور.
- حرر مقبض التشغيل مع التحكم ، ثم أعد ضبط لوحة دبوس التلقيح تحت تأثير الزنبرك.
- اضغط على مقبض التشغيل 2-3 مرات لتحريك كل لقاح جيدا وغمسه. ادفع وحرك اللوحة الحاملة بحيث تكون اللوحة المحتضنة أسفل لوحة دبوس التلقيح مباشرة.
- اضغط على مقبض التشغيل ، وحرك لوحة دبوس التلقيح لأسفل ، وتوقف لمدة 1-2 ثانية لجعل دبابيس التلقيح تلامس سطح اللوحة المحتضنة بالكامل.
- حرر مقبض التشغيل. هذا يكمل تلقيح واحد. استبدل صفيحة محتضنة أخرى واستمر في الدورة حتى تنتهي مجموعة واحدة من ألواح أجار مضادات الميكروبات.
- استبدل صفيحة دبوس تلقيح أخرى وكتلة بذور ، وقم بتلقيح مجموعة أخرى من السلالات المختبرة. دورة حتى يتم الانتهاء من جميع التطعيمات.
ملاحظة: قم بتلقيح صفيحة أجار تحكم (بدون عامل مضاد للميكروبات) أولا ، ثم اللوحة بترتيب تركيز الدواء من الأقل إلى الأعلى ، ولوحة أجار التحكم الثانية أخيرا لضمان عدم وجود تلوث أو ترحيل عامل مضاد للميكروبات. يعتمد حجم التلقيح على حجم الترسب الطبيعي لكل دبوس يبلغ حوالي 2 ميكرولتر.
- احتضان ألواح أجار المضادة للميكروبات
- احتضان ألواح الآجار المضادة للميكروبات الملقحة في RT حتى يتم امتصاص الرطوبة الموجودة في بقع اللقاح في الآجار.
- اقلب الألواح واحتضنها لمدة 16-20 ساعة عند 37 درجة مئوية للسلالات المختبرة للتأكد من أن البكتيريا غير المقيدة تشكل مستعمرات.
- الحصول على الصور وإحصاءات البيانات
- انقر نقرا مزدوجا فوق نظام الحصول على صور AST مصفوفة 96 نقطة لفتح البرنامج.
- انقر فوق معلومات الاختبار في شريط المهام. انقر فوق جديد لإنشاء مهمة اختبار جديدة ، واملأ المعلومات وفقا للمطالبات ، بما في ذلك الرمز والاسم والمصدر والبكتيريا وعدد السلالات والمضادات الحيوية والتدرج.
- انقر فوق جمع البيانات > عنصر اختبار > الصورة لتحديد المهمة الجديدة التي تم إنشاؤها. انقر فوق المضادات الحيوية لتحديد اسم المضاد الحيوي ، وانقر فوق التدرج لتحديد التركيز الأولي لهذا المضاد الحيوي.
- انقر فوق اتصال للاتصال بمحول الحصول على الصور.
- ضع الألواح المحتضنة المقابلة على قاعدة لوحة الكشف مع الزاوية المفقودة في المقدمة اليمنى للتوجيه وادفع إلى محول التقاط الصور.
- انقر فوق مجموعة للحصول على الصور. سوف يقفز تدرج المضادات الحيوية تلقائيا إلى التدرج التالي. ضع اللوحة التالية بدورها واستمر في النقر فوق المجموعة حتى يتم جمع لوحات هذا المضاد الحيوي.
- انقر فوق المضادات الحيوية ، وحدد المجموعة التالية من اللوحات المحتضنة. انقر فوق التدرج لتحديد تدرج البداية وانتقل إلى الجولة التالية من مجموعة الصور.
- بعد الانتهاء من جميع المجموعات ، انقر فوق إرسال. سيتعرف البرنامج تلقائيا على عدد وحدات البكسل البيضاء المنسقة في كل نقطة تلقيح في الصور ، ويحدد ما إذا كان هناك تكوين مستعمرة ويحول الصور إلى قيم MIC.
- انقر فوق استعلام للحصول على جميع نتائج MIC للسلالات ضد المضادات الحيوية المختبرة.
ملاحظة: نظام AST الذكي عالي الإنتاجية مناسب لتحديد MICs لدفعات كبيرة من السلالات البكتيرية. تستغرق عملية الاختبار ، بما في ذلك التحضير والتلقيح والحضانة وقراءة النتائج ، 3 أيام. يمكن ضبط أنواع المضادات الحيوية ونطاقات الكشف عن MIC وفقا للاحتياجات الخاصة ، ويمكن إعادة استخدام المواد الاستهلاكية الرئيسية.
- حساب مؤشر لار
- حدد مؤشر لار بدقة باستخدام الصيغة: ، حيث:
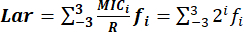
MICi: الحد الأدنى من التركيز المثبط.
يمثل نطاق توزيعات MIC من MIC-3 إلى MIC3 تركيزات تسلسلية مزدوجة تتمحور حول R: 0.125R و 0.25R و 0.5R و R و 2R و 4R و 8R. هو 2 i ، ونطاقi هو -3 إلى 3.
هو 2 i ، ونطاقi هو -3 إلى 3.
R: نقاط توقف مقاومة البكتيريا ضد العوامل المضادة للميكروبات الموحدة بواسطة CLSI.
f: توزيع تردد هيئة التصنيع العسكري.
ملاحظة: مؤشر لار العام هو المتوسط الحسابي لجميع مؤشرات لار. بعد حساب مؤشر لار ، قم بتقريب القيمة النهائية إلى رقمين مهمين بعد الفاصلة العشرية.
- حدد مؤشر لار بدقة باستخدام الصيغة: ، حيث:
2. نظام ذكي عالي الإنتاجية لفحص العاثيات9
- تحضير كتلة بذور العاثية وألواح محتضنة مزدوجة الطبقة تحتوي على بكتيريا.
- استخدم طريقة أجار الطبقةالمزدوجة 10 أو طريقة الاستزراع السائل11 لصنع عاثيات مختلفة. خفف إلى تركيز مواز مناسب مع عيار 1 × 104-5 pfu / mL ، وأضف 200 ميكرولتر من لقاح العاثية إلى كتلة البذور المكونة من 96 بئرا.
- اصنع صفائح مزدوجة الطبقات من البكتيريا (10 مل من وسائط أجار القاع [أجار 12 جم / لتر] و 6 مل من وسائط شبه أجار العلوية [6 جم / لتر] مع 100 ميكرولتر من البكتيريا [0.5 ماكفارلاند]) ليتم اختبارها.
- اصنع صفيحة محتضنة مزدوجة الطبقة لكل سلالة ليتم اختبارها. اترك فجوة تحت غطاء اللوحة ذات الطبقات المزدوجة وانفخ لتجفيف سطح أجار في خزانة السلامة الحيوية.
- اختبار الفحص
- ضع كتلة بذور العاثية المحضرة ولوحة الطبقة المزدوجة على الناقل المتحرك للقاح المصفوفة المكون من 96 نقطة ، وانقل كل لقاح العاثيات إلى سطح شبه أجار. استمر في الدورات حتى تكتمل جميع السلالات المختبرة.
- اترك الألواح ذات الطبقة المزدوجة الملقحة تبقى في RT حتى يتم امتصاص الرطوبة الموجودة في بقع اللقاح بالكامل في شبه أجار.
- اقلب الألواح واحتضانها في ظل ظروف مناسبة للسلالات المختبرة لمدة 4-6 ساعات لضمان تكوين بقع تحلل واضحة.
- تحليل البيانات
- احصل على صورة النتيجة التجريبية لكل لوحة مزدوجة الطبقة واحفظها بواسطة محول الحصول على الصور (الخطوات 1.5.4-1.5.6).
- سجل عدد وأشكال الأشكال المختلفة للبقع في جدول بيانات بناء على الصور التي تم الحصول عليها ، واحسب النسب الخاصة بالأنواع المختلفة من العاثيات.
النتائج
باتباع بروتوكول نظام AST الذكي عالي الإنتاجية ، تم توضيح تطبيقه بواسطة السالمونيلا من الدواجن في شاندونغ ، الصين ، كمثال.
يوضح الشكل 3 نمو سلالات السالمونيلا على ألواح الآجار مع الأمبيسلين (R من 32 ميكروغرام / مل) بتركيزات من 2 إلى 256 ميكروغرام / مل يحدده...
Discussion
تم تأسيس طريقة تخفيف الآجار واستخدامها على نطاق واسع. كان مبدأ نظام AST عالي الإنتاجية هو مبدأ طريقة تخفيف أجار. كانت إحدى الخطوات الحاسمة في البروتوكول هي النقل الدقيق عالي الإنتاجية ل 96 لقاحا في وقت واحد ، والذي تم إجراؤه عدة مرات متتالية. لإكمال هذه الخطوة الحاسمة ، كانت دبابيس ملقح المصف...
Disclosures
Yuqing Liu et al. قدموا براءات اختراع صينية لملقح المصفوفة 96 نقطة ومحول الحصول على الصور وتطبيقاتهم (رقم براءة الاختراع ZL 201610942866.3 ورقم براءة الاختراع ZL 201910968255.X).
Acknowledgements
تم دعم هذا العمل من قبل المشروع الوطني للبحث والتطوير الرئيسي (2019YFA0904003) ؛ النظام الصناعي الزراعي الحديث في مقاطعة شاندونغ (SDAIT-011-09) ؛ مشروع تحسين منصة التعاون الدولي (CXGC2023G15)؛ مهام الابتكار الرئيسية لمشروع ابتكار العلوم والتكنولوجيا الزراعية التابع لأكاديمية العلوم الزراعية شاندونغ ، الصين (CXGC2023G03).
Materials
| Name | Company | Catalog Number | Comments |
| 96 well culture plate | Beijing lanjieke Technology Co., Ltd | 11510 | |
| 96-dot matrix AST image acquisition system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| 96-dot matrix inoculator | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB8274-1 | |
| Amikacin | Shanghai McLean Biochemical Technology Co., Ltd | A857053 | |
| Amoxicillin | Shanghai McLean Biochemical Technology Co., Ltd | A822839 | |
| Ampicillin | Shanghai McLean Biochemical Technology Co., Ltd | A830931 | |
| Analytical balance | Sartorius | BSA224S | |
| Automated calculation software for Lar index of AMR | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Bacteria Salmonella strains | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Animal origin |
| Bacterial resistance Lar index certification management system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Ceftiofur | Shanghai McLean Biochemical Technology Co., Ltd | C873619 | |
| Ciprofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | C824343 | |
| Clavulanic acid | Shanghai McLean Biochemical Technology Co., Ltd | C824181 | |
| Clean worktable | Suzhou purification equipment Co., Ltd | SW-CJ-2D | |
| Colistin sulfate | Shanghai McLean Biochemical Technology Co., Ltd | C805491 | |
| Culture plate | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Doxycycline | Shanghai McLean Biochemical Technology Co., Ltd | D832390 | |
| Enrofloxacin | Shanghai McLean Biochemical Technology Co., Ltd | E809130 | |
| Filter 0.22 μm | Millipore | SLGP033RB | |
| Florfenicol | Shanghai McLean Biochemical Technology Co., Ltd | F809685 | |
| Gentamicin | Shanghai McLean Biochemical Technology Co., Ltd | G810322 | |
| Glass bottle 50 mL | Xuzhou Qianxing Glass Technology Co., Ltd | QX-7 | |
| High-throughput resistance detection system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Image acquisition converter | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | Patented product |
| Meropenem | Shanghai McLean Biochemical Technology Co., Ltd | M861173 | |
| Mueller-Hinton agar | Qingdao hi tech Industrial Park Haibo Biotechnology Co., Ltd | HB6232 | |
| Petri dish 60 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16021-1 | |
| Petri dish 90 mm x 15 mm | Qingdao Jindian biochemical equipment Co., Ltd | 16001-1 | |
| Salmonella phages | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | N/A | |
| Shaker incubator | Shanghai Minquan Instrument Co., Ltd | MQD-S2R | |
| Turbidimeter | Shanghai XingBai Biotechnology Co., Ltd | F-TC2015 | |
| Varms base type library system V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Vertical high-pressure steam sterilizer | Shanghai Shen'an medical instrument factory | LDZX-75L | |
| Veterinary pathogen resistance testing management system | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright | |
| Veterinary resistance cloud monitoring and phage control platform V1.0 | Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences | In-house software copyright |
References
- Ramanan, L., et al. Antimicrobial resistance-the need for global solutions. The Lancet Infectious Diseases. 13 (12), 1057-1098 (2013).
- Xiaonan, Z., Qing, Z., Thomas, S. P., Yuqing, L., Martha, R. J. C. inPhocus: Perspectives of the application of bacteriophages in poultry and aquaculture industries based on Varms in China. PHAGE: Therapy, Applications, and Research. 2 (2), 69-74 (2021).
- CLSI. . Performance Standards for Antimicrobial Disk Susceptibility Tests. CLSI document M100. , (2022).
- Yuqing, L., et al. . Antimicrobial Sensitivity Testing Standard of EUCAST. , (2017).
- Barnini, S., et al. A new rapid method for direct antimicrobial susceptibility testing of bacteria from positive blood cultures. BMC Microbiology. 16 (1), 185-192 (2016).
- Höring, S., Massarani, A. S., Löffler, B., Rödel, J. Rapid antimicrobial susceptibility testing in blood culture diagnostics performed by direct inoculation using the VITEK®-2 and BD PhoenixTM platforms. European Journal of Clinical Microbiology & Infectious Diseases. 38 (3), 471-478 (2019).
- Dupuis, G. Evaluation of the Cobasbact automated antimicrobial susceptibility testing system. European Journal of Clinical Microbiology & Infectious Diseases. 4 (2), 119-122 (1985).
- Liu, Y., et al. A system of bacterial antimicrobial resistance detection and its operation method. China Patent. , (2019).
- Liu, Y. A high throughput test plate for screening bacteriophage of zoonotic pathogens and its application. China Patent. , (2022).
- Adams, M. H. . Bacteriophages. , (1959).
- Nair, A., Ghugare, G. S., Khairnar, K. An appraisal of bacteriophage isolation techniques from environment. Microbial Ecology. 83 (3), 519-535 (2022).
- . . Shandong veterinary antibiotic resistance system. , (2023).
- Ming, H., et al. Comparison of the results of 96-dot agar dilution method and broth microdilution method. Chinese Journal of Antibiotics. 43 (6), 729-733 (2018).
- Laxminarayan, R., Klugman, K. P. Communicating trends in resistance using a drug resistance index. BMJ Open. 1 (2), e000135 (2011).
- Chen, Y., et al. Assessing antibiotic therapy effectiveness against the major bacterial pathogens in a hospital using an integrated index. Future Microbiology. 12, 853-866 (2017).
- Ciccolini, M., Spoorenberg, V., Geerlings, S. E., Prins, J. M., Grundmann, H. Using an index-based approach to assess the population-level appropriateness of empirical antibiotic therapy. Journal of Antimicrobial Chemotherapy. 70 (1), 286-293 (2015).
- Yanbo, L., et al. Preliminary application of inoculation system for high-throughput drug susceptibility test. China Poultry. 42 (6), 52-57 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved